El remodelado patológico de la pared vascular se refiere a los cambios estructurales y funcionales de la pared del vaso que ocurren en respuesta a una lesión que eventualmente conduce a una enfermedad cardiovascular. La pared de los vasos se compone de dos tipos principales de células, las células endoteliales y las células del músculo liso vascular, cuya comunicación es crucial tanto en el desarrollo de la vasculatura como en la homeostasis de los vasos maduros. Cambios en el diálogo entre las células endoteliales y las células del músculo liso vascular se asocian a diversos estados patológicos que conllevan remodelado de la pared vascular. Durante muchos años se han realizado considerables esfuerzos dedicados al desarrollo de pruebas diagnósticas y tratamientos eficaces para estas patologías mediante el estudio de sus mecanismos tanto en modelos in vitro como in vivo. En comparación con los modelos animales, los modelos in vitro pueden brindar grandes oportunidades para obtener datos de manera más homogénea, económica y masiva, aportando una visión general de las rutas de señalización responsables de estas patologías. La implantación de modelos tridimensionales de cocultivo in vitro para el estudio de otras patologías se ha postulado como una metodología potencialmente aplicable, lo que determina la importancia de su aplicación en el studio de las enfermedades cardiovasculares. En este artículo exponemos un método de cultivo de células endoteliales y células de músculo liso vascular humanas, crecidas en condiciones de no adherencia, que generan estructuras tridimensionales esferoidales con una mayor equivalencia fisiológica a las condiciones in vivo. Este modelado in vitro podría utilizarse como herramienta de estudio para identificar mecanismos celulares y moleculares implicados en los procesos patológicos que subyacen al remodelado vascular.
Pathological vascular remodeling of the vessel wall refers to the structural and functional changes of the vessel wall that occur in response to injury that eventually leads to cardiovascular disease. The vessel wall is composed of two main types of cells, endothelial cells and vascular smooth muscle cells, whose communication is crucial in both the development of the vasculature and the homeostasis of mature vessels. Changes in the dialogue between endothelial cells and vascular smooth muscle cells are associated with various pathological states that triggers remodeling of the vascular wall. For many years, considerable efforts have been made to develop effective diagnoses and treatments for these pathologies by studying their mechanisms in both in vitro and in vivo models. Compared to animal models, in vitro models can provide great opportunities to obtain data in a more homogeneous, economical and massive way, providing an overview of the signaling pathways responsible for these pathologies. The implementation of three-dimensional in vitro co-culture models for the study of other pathologies has been postulated as a potentially applicable methodology, which determines the importance of its application in studies of cardiovascular diseases. In this article we present a method for culturing human endothelial cells and vascular smooth muscle cells, grown under non-adherent conditions, that generate three-dimensional spheroidal structures with greater physiological equivalence to in vivo conditions. This in vitro modeling could be used as a study tool to identify cellular and molecular mechanisms involved in the pathological processes underlying vascular remodeling.
Las enfermedades cardiovasculares (ECV) son la principal causa de muerte en los países desarrollados, representando 17,3 millones de muertes por año y con una previsión de aumento para 20301. Esto ilustra la importancia del estudio de estas patologías con el objetivo de desarrollar marcadores diagnósticos, pronósticos, así como nuevos enfoques terapéuticos. La aterotrombosis es la principal causa de ECV y puede permanecer asintomática durante muchos años, siendo a menudo el evento isquémico su primera manifestación clínica. El remodelado de la pared vascular es clave durante la aterotrombosis e implica la actuación multicelular y multifactorial tanto de células residentes en el vaso (células endoteliales [CE] y células del músculo liso vascular [CMLV]), como circulantes en la sangre2.
La pared vascular presenta una naturaleza compleja y multimodal formada por diferentes capas concéntricas de células en comunicación; la capa íntima o endotelial en contacto con la luz del vaso, la capa media, principalmente compuesta por CMLV y fibras de elastina responsables de la identidad contráctil del vaso, y la capa adventicial rica en elastina y colágeno, responsable de mantener la integridad estructural. La comunicación celular se establece principalmente por vía paracrina y por contacto físico directo, siendo bidireccional y controlando tanto los mecanismos organotípicos y fisiológicos de la propia naturaleza vascular como los mecanismos patológicos de remodelado vascular3. En este sentido, en condiciones fisiológicas, las CE y CMLV secretan constitutivamente bajas concentraciones de vesículas extracelulares y moléculas vasoactivas (prostanoides, metabolitos del ácido araquidónico u óxido nítrico), favoreciendo un comportamiento contráctil que mantiene el tono vascular. Sin embargo, estímulos patológicos como estrés mecánico (lesión, cambio en el flujo sanguíneo), o estrés químico (aumento de factores en sangre) llevan a cambios en el diálogo entre CE-CMLV tanto a nivel paracrino; cambios en los niveles de vesículas extracelulares, cambios en la síntesis y secreción del componente de la matriz extracelular, como a nivel estructural del contacto físico entre células4. En concreto, cambios en la activación del endotelio a causa del aumento de lípidos en sangre, conduce al reclutamiento de monocitos al espacio subendotelial que se diferenciarán a macrófagos, capaces de ingerir lipoproteínas oxidadas de baja densidad (ox-LDL). Asimismo, el ambiente proinflamatorio producido por la secreción de citoquinas por parte de las células inflamatorias induce cambios fenotípicos en las CMLV, que pasan de un fenotipo contráctil a uno sintético, proliferativo y migratorio, desencadenando la formación de la denominada neoíntima y el desarrollo de la placa aterosclerótica5.
Los modelos preclínicos de remodelado vascular, suponen una parte imprescindible en el estudio de la patofisiología y, en consecuencia, para el desarrollo de nuevas dianas diagnósticas y terapéuticas. Este tipo de estudios proporcionan conocimientos importantes sobre los mecanismos potenciales implicados en el daño vascular, aportando una visión sistémica6. Sin embargo, en ocasiones en las que se requiere un estudio de rastreo masivo no suponen la primera opción, debido al alto coste económico y a las consideraciones éticas7. En ese sentido, durante mucho tiempo se ha intentado dilucidar las funciones de las CE y las CMLV como entidades independientes en los procesos patológicos de remodelado vascular mediante cultivos de células únicas debido a una interpretación y análisis de resultados más sencilla. Considerando la naturaleza compleja y multimodal de la comunicación entre CE y CMLV, distintos aspectos de esas interacciones se han intentado imitar y estudiar in vitro a través de la exploración de configuraciones en cocultivo artificial. Un ejemplo que nos permite estudiar de manera simultánea y sencilla ambos tipos celulares son los cocultivos 2D directos de CE y CMLV, o separados por una membrana porosa (cocultivos indirectos), como transwells (cultivo estático) o cámaras de flujo (cultivo dinámico)8. Esta membrana permite, dependiendo de sus características como la permeabilidad o el tamaño del poro, estudios de comunicación, permeabilidad, migración o regulación paracrina3. A pesar de sus múltiples ventajas, este tipo de técnicas tienen una limitación a la hora de simular las complejas interacciones y estructura que ocurre in vivo y el contacto célula-célula. La exploración de técnicas de cocultivos 3D son novedosas en otros campos como las enfermedades oncológicas y podrían resultar interesantes para el estudio del diálogo célula-célula en enfermedades vasculares. Una de esas herramientas son los esferoides, agregados celulares tridimensionales en forma de esfera, que crecidos en diferentes condiciones9,10 se están utilizando como herramienta para estudios de la comunicación celular, y de rastreo de diagnóstico masivo. En concreto, el sistema tridimensional o «vasculoides» es un modelo basado en la generación de esferas celulares suspendidas que, dependiendo del nicho vascular de origen de las CE o CMLV, pueden formar espontáneamente esferas con estructura y composición diferente11.
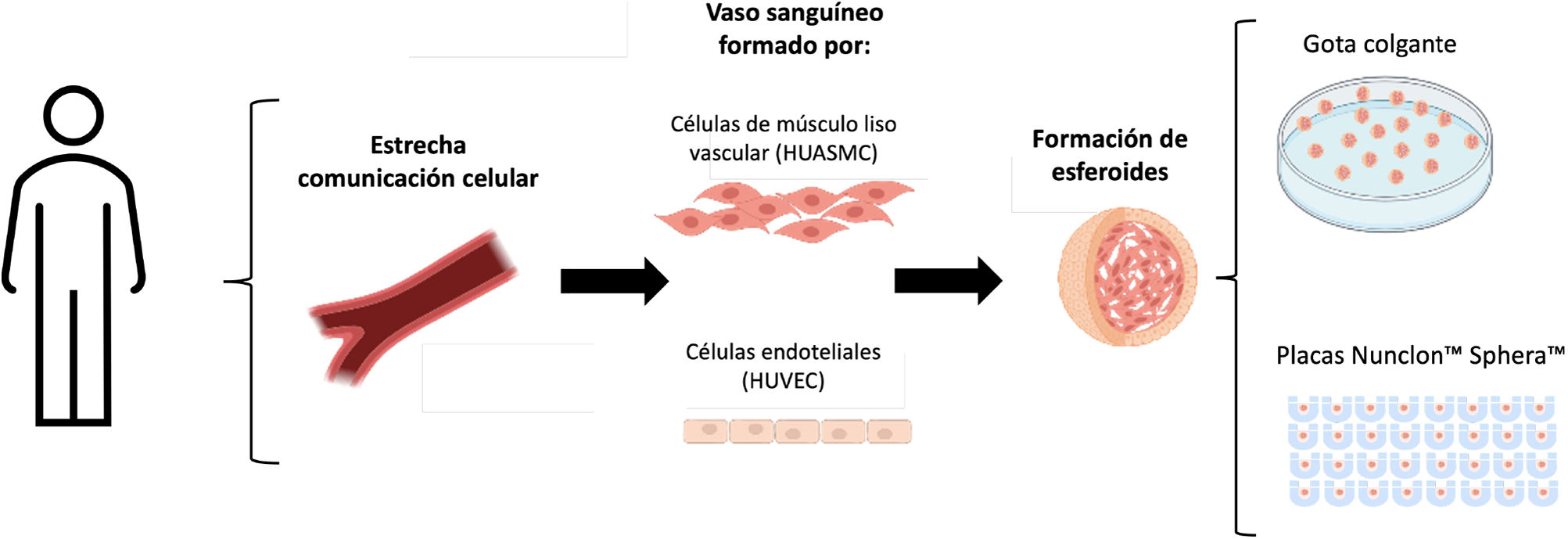
En este trabajo, analizamos el modelo de vasculoides de cocultivo de células endoteliales y células de músculo liso vascular humanas in vitro en diferentes condiciones de crecimiento (gota colgante y placas de baja adherencia).
MétodosCultivo celularSe utilizaron dos tipos celulares: células endoteliales de vena umbilical humana, HUVEC (P10961, Innoprot) y células del músculo liso de arteria umbilical humana, HUASMC (P10964, Innoprot). Tanto las HUVEC como las HUASMC se cultivaron con los medios comerciales de referencia recomendados por la casa comercial. Las células endoteliales se cultivaron en Endothelial Cell Medium (ECM, P60104, Innoprot) suplementado con 20% de suero bovino fetal (FBS, F7524, Sigma-Aldrich), solución de estreptomicina/penicilina (1:100), y factores de crecimiento de endoteliales (1:100). Por otra parte, las células de músculo liso se cultivaron en Smooth Muscle Cell Medium (SMCM, P60125, Innoprot), suplementado con el 10% de FBS, solución de estreptomicina/penicilina (1:100), así como sus respectivos factores de crecimiento (1:100). Ambos medios de cultivo favorecen un entorno nutricional óptimo y equilibrado para la proliferación y el crecimiento de células siguiendo indicaciones de la casa comercial (Innoprot). Ambos tipos celulares se crecieron a temperatura (37°C) y valores de dióxido de carbono (5%) constantes. Se utilizó una solución de tripsina al 0,25%, EDTA 0,5mM, piruvato de sodio 1mM y HEPES 10mM con un pH de 7,4, diluída en DPBS 1:25 para las HUVEC y 1:10 HUASMC con el objetivo de separar las células adherentes de la superficie de cultivo. Se incuban durante 5min en el incubador a 37°C, y esta reacción se neutralizó con una solución neutralizadora o Trypsin Neutralization Solution (TNS) que contiene buffer HEPES y 10% de FBS como inhibidor de tripsina. Tras la neutralización, se procedio a la centrifugación de la suspensión celular durante 5min a 1000rpm siguiendo las instrucciones de la casa comercial.
Formación de esferoides de HUVEC-HUASMCPara la realización de estos complejos tridimensionales esferoidales, se tripsinizaron HUVEC y HUASMC y se suspendieron en una solución mezcla de ambas, en cantidades equitativas (1500 células de cada tipo/esferoide). Se utilizaron dos aproximaciones de cultivo diferentes:
- (a)
Formación de esferoides en gota colgante (hanging drop), para el cual 25μl de volumen de la suspensión celular (3000 células) en medio ECM suplementado con 5% FBS y 0,24% de metilcelulosa (Sigma, M7027) se dispusieron en pequeñas gotas en la superficie estéril de una tapa de placa de cultivo. Posteriormente, se procedió a la inversión de la placa 180° para la generación de la «gota colgante», generando una tensión superficial que favorece la formación del esferoide12.
- (b)
Formación de esferoides en placas de baja adherencia, para el cual 75μl de volumen de la suspensión celular (3000 células) se plaqueó en placas Nunclon™ Sphera™ (174943, Thermo Scientific™) especificadas para evitar la adherencia celular por su superficie con baja fijación. En este caso, el medio de la suspensión celular está libre de metilcelulosa y está compuesto únicamente del medio ECM suplementado con 5% FBS.
En ambos casos se visualizó el desarrollo y generación de las esferas mediante microscopio Leica invertido (Modelo Dmi1) a diferentes tiempos. Se analizó el área de las esferas en el tiempo mediante software ImageJ.
Inmunofluorescencia de esferoidesSe recogieron esferas de HUVEC-HUASMC cuidadosamente con pipeta y se fijaron en paraformaldheido al 4% en PBS durante 20 min en movimiento. Posteriormente, estas esferas se tiñeron con hematoxilina (7211 Epredia) durante 5 min para facilitar su posterior visualización y manejo. Se utilizó agarosa al 2% en PBS como molde de conservación de las esferas. Brevemente, en casete de plástico de 2cm de fondo se añadió la agarosa con las esferas y se dejó solidificar hasta conseguir una estructura manejable. Posteriormente, estos bloques de agarosa con las esferas inmersas en su interior se procesaron en concentraciones crecientes de etanol (70%, 95%, 100%) y se incluyeron en bloques de parafina. Los bloques de parafina se cortaron en secciones de 4 micras, hasta alcanzar los cortes centrales de las esferas. Para la inmunofluorescencia, los cortes de esferas se desparafinaron e hidrataron en concentraciones decrecientes de etanol (100%, 95%, 70%). Las muestras se bloquearon con TBST 0,05% y 5% de suero de caballo (Sigma) durante 45min a temperatura ambiente en cámara húmeda. Posteriormente, las muestras se incubaron durante toda la noche a 4°C en cámara húmeda con los anticuerpos correspondientes, anti alfa actina de músculo liso vascular-Cy3 (C6198, Sigma) 1:1000, y anti-CD31 (AF3628 R&D Systems) 1:100. Se utilizó un anticuerpo anti cabra Alexa 488 (Invitrogen, 1:500) como secundario específico y DAPI (Invitrogen 1:10000) para la tinción nuclear. Las imágenes se tomaron en el microscopio de fluorescencia Zeiss Axioscope 5, cámara Axiocam 208 color, con el objetivo de 20x. La caracterización celular en la parte central del esferoide fue analizado con el software Image J.
Para los ensayos de TUNNEL se siguieron las instrucciones requeridas en el kit de detección de muerte celular in situ, TMR rojo (12156792910, Roche) y se cuantificó el número de células apoptóticas del total de células con el software Image J.
Análisis estadísticoLos datos se presentan como media±error estándar de la media (SEM) y la significación estadística de las diferencias se evaluó con la prueba ANOVA post hoc de Tukey para comparaciones múltiples o t-Student. Se aceptó significación al nivel de p<0,05. El análisis de datos se realizó utilizando el software GraphPad Prism 9.0a (GraphPad, San Diego, CA).
Resultados- 1.
Formación de esferoides mediante la técnica de gota colgante (hanging drop) y en placas de baja adherencia.
Nos planteamos la optimización del método de desarrollo de vasculoides de HUVEC y HUASMC, cultivadas tanto en gota colgante como en otra condición de flotabilidad, en placas específicas de baja adherencia Nunclon Sphera (fig. 1). Realizamos un análisis de su crecimiento y estructura con el objetivo de su consideración como herramienta aplicable al estudio de la comunicación celular en patologías de remodelado vascular.
Esquema del procedimiento a seguir para la formación de vasculoides. A partir de cultivos de HUVEC y HUASMC se realizaron cocultivos para la formación de esferoides mediante gota colgante (hanging drop) y en placas de baja adherencia, como aproximación a la formación de un vaso invertido.
Observamos que la suspensión celular de 25μl de HUVEC-HUASMC en medio ECM suplementado con 5% FBS y 0,24% de metilcelulosa en condiciones de inversión en «gota colgante» a tiempo 0h las células aparecen como células individuales. Pasadas 4h se puede observar una única agrupación celular de contorno inestable. A las 24h esta agrupación celular se hace visiblemente más clara y compacta con morfología esferoidal y su área disminuye significativamente (p<0,0001) con respecto a 4h (0,069mm2). Entre 24h y 48h el área se mantiene (p = 0,6586) y la estructura esferoidal es más opaca, única y compacta, con la presencia de algunas células en su periferia. A 72h se observa una única esfera y de contorno homogéneo, sin embargo, se observa una significativa bajada en su área (0,04mm2) (p<0,0001) (fig. 2 A [paneles superiores] y B).
Dinámica de formación de esferoides 3D de HUVEC-HUASMC en condiciones de gota colgante o en placa de baja adherencia (Nunclon Sphera). A) Imágenes representativas de campo claro de la formación de esferoides en una cinética de tiempo definida (t0 siembra, 4 horas, 24 horas, 48 horas, 72 horas). Las imágenes superiores representan la formación del esferoide en gota colgante. Las imágenes inferiores representan la formación del esferoide en placas de baja adherencia Nunclon™ SpheraTM B). Cuantificación del área del esferoide en el tiempo medido en mm2 en n=24 esferoides en gota colgante, n=22 en placa de baja adherencia. ****p<0,0001. 1,2 indicativo de varios tamaños de esferas. Barras de error 0,25mm. One way-ANOVA, Turkey multiple comparison. Media±SEM. ****p<0,0001.
En el caso de la formación de esferoides en placa de baja adherencia por medio de suspensión celular de 75μl de HUVEC-HUASMC en medio ECM suplementado con 5% FBS libre de metilcelulosa se observa que, a tiempo 0h las células aparecen como células individuales. Pasadas 4h se puede observar agrupación celular inestable, que en muchas ocasiones no es única. A las 24h estas agrupaciones van estructurándose como esferas. Con frecuencia se observan dos grupos de esferas, unas de mayor tamaño (alrededor de 0,1mm2) y otras de menor tamaño (<0,05mm2) cuyas áreas se mantienen durante las 48h (p=0,4295), con tendencia a disminuir de forma no significativa (p=0,8425) a las 72h. (fig. 2 A [paneles inferiores] y C).
3. Caracterización fenotípica de esferoides en gota colgante y en placa de baja adherencia.
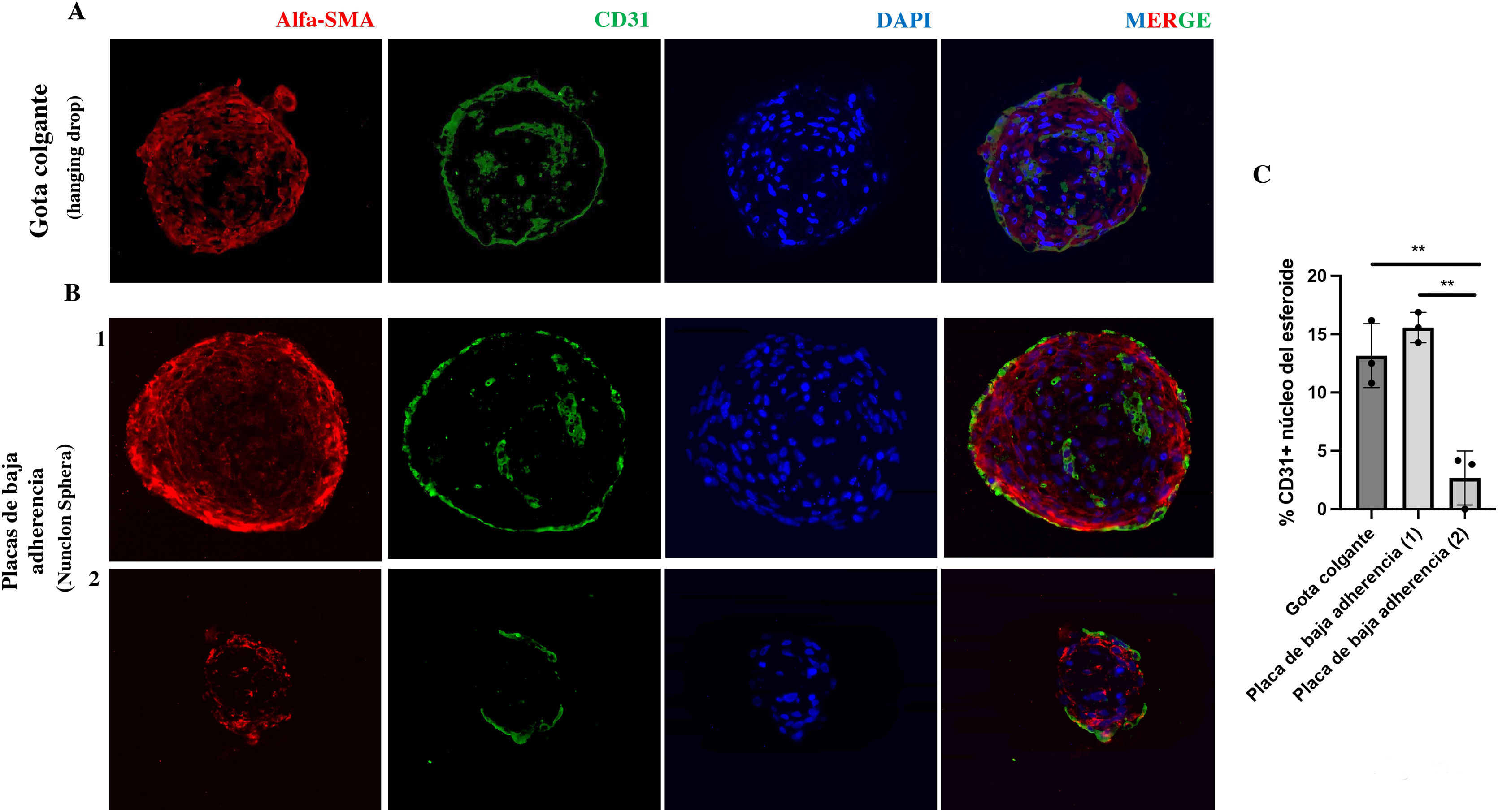
Ambas aproximaciones de cocultivo permiten la formación de estructuras tridimensionales. Sin embargo, en el caso de las esferas desarrolladas por la técnica de gota colgante, existe una mayor homogeneidad en su tamaño y área en el tiempo. Con el objetivo de caracterizar su naturaleza se fijaron esferas desarrolladas en gota colgante y en placa de baja adherencia, y se incluyeron en parafina. Se realizaron inmunofluorescencias del marcador de CE CD31 (PECAM1) así como del marcador de CMLV alfa-actina de músculo liso (a-SMA) en cortes de 4 micras de grosor. Imágenes de microscopía de fluorescencia de un corte central del esferoide nos indican que estos esferoides estarían formados mayoritariamente por células de músculo liso vascular en su zona central, tanto los desarrollados por gota colgante (fig. 3A), como los de placa de baja adherencia de mayor (fig. 3B-1) y menor tamaño (fig. 3B-2). Además, se observa un mínimo porcentaje de células endoteliales en su núcleo medido como células CD31+/células totales que conforman el núcleo del esferoide (fig. 3C). En el caso de los esferoides de menor tamaño desarrollados en las placas de baja adherencia el porcentaje de células CD31+ es significativamente menor (p<0,01) (fig. 3C). En todos los casos se observa una monocapa de células CD31+ en la parte externa (fig. 3A).
Estructura celular de vaso sanguíneo invertido de esferoides en gota colgante y en placa de baja adherencia. A) Imágenes representativas de inmunofluorescencia de esferoides de HUVEC-HUASMC en gota colgante, y en placa de baja adherencia B) ambos tamaños; mayor (1) y menor (2). Se observan los marcadores de endotelio CD31 (verde), de célula de músculo liso vascular α-SMA (rojo), así como de tinción nuclear (DAPI). MERGE, todos los canales juntos. C) Cuantificación del porcentaje de células CD31+ en el total de células del núcleo del esferoide. Barras de escala 50μm. n=3 esferoides por condición. t-Student. **p<0,01. El color de las figuras solo puede apreciarse en la versión electrónica del artículo.
Además, para analizar la viabilidad celular en las esferas crecidas en ambas condiciones de flotabilidad, las esferas se tiñeron con el kit de detección in situ de apoptosis. No se observaron diferencias significativas en el número de células apoptóticas a 72 h entre los esferoides formados en gota colgante (8,34%) y los esferoides formados en placa de baja adherencia (6,73%). Además, estos porcentajes indican la viabilidad a este tiempo de ambos métodos de crecimiento (fig. 4A y B).
Presencia de células apoptóticas en los vasculoides crecidos en gota colgante o placa de baja adherencia. Imágenes representativas de análisis histológico de esferoides 3D de HUVEC-HUASMC crecidos en gota colgante A) o en placa de baja adherencia B) 1,2) teñidas con TUNEL. Barras de escala 50μm. C) Gráfica del porcentaje de células apoptóticas de cada grupo n=3-4 esferoides por condición.
En este trabajo mostramos cómo la herramienta de cocultivo celular en esferas 3D de HUVEC y HUASMC en gota colgante12 podría ser una estrategia de exploración in vitro para el estudio de la comunicación vascular en procesos de remodelado vascular patológico. En este trabajo, describimos que las circunstancias de flotabilidad celular en placa de baja adherencia también generan el desarrollo de estas esferas. Ambos métodos de cultivo generan una representación mimética de estructura de vaso sanguíneo invertido, observándose una capa de HUVEC externa y un núcleo mayoritario de HUASMC. Asimismo, se observa que estas esferas son viables a 72 h de su desarrollo pudiendo utilizarse en experimentos de este determinado rango de tiempo. Por otro lado, el desarrollo de esferoides en gota colgante presenta un mayor riesgo de pérdida por manipulación en comparación a los esferoides desarrollados en placa de baja adherencia. Sin embargo, estos últimos suponen un riesgo en el análisis relacionado con la heterogeneidad en los tamaños de esferoides, además de unos costes económicos añadidos.
El avance en el desarrollo de tecnologías de cultivo organotípico en 3D es en la actualidad una metodología que en las ECV se ha enfocado al diseño de tejidos (cardíaco y muscular), al desarrollo de nanobiomateriales, microfluidos, impresión 3D, etc., y en cualquier caso, supone un gran paso adelante en relación con el tradicional cultivo celular 2D. En este trabajo observamos que los esferoides de HUVEC-HUASMC en condiciones de gota colgante y en placa de baja adherencia forman esferas de estructuras miméticas a un vaso sanguíneo invertido. Además, estas esferas de cocultivo son viables hasta 72h de desarrollo como se observa en el bajo número de células en apoptosis en su núcleo. Sin embargo, el cocultivo celular en condiciones de gota colgante hace que las esferas resultantes de la agregación celular sean más homogéneas en área y celularidad que las que se generan en placa de baja adherencia, donde se observan agrupaciones celulares de varios tamaños lo que podría ser un factor clave en estudios de comunicación celular por la diferencia en el número de células entre esferoides. Estudios llevados a cabo en cultivos 3D esferoidales de células únicas han demostrado que la expresión genética13,14, el metabolismo10, la motilidad celular15 y la polaridad celular16 en el esferoide es diferente al de los cultivos monocapa en 2D, con una naturaleza más cercana al tejido nativo. Se han descrito estudios en las esferas de HUVEC-HUASMC en gota colgante para evaluar el impacto angiogénico de determinadas citoquinas, por medio de su cultivo en matrices de colágeno12 y han aportado información sobre la importancia del cocultivo en contacto de ambas células, observando que favorece un estado de reposo celular similar a lo que ocurre en la vasculatura adulta17. Además, se han utilizado modelos de esferoide 3D de células espumosas18,19 o de CMLV20 con el objetivo de reproducir las circunstancias estructurales y del microambiente para estudio de metabolismo lipídico y el papel de las metaloproteinasas en procesos de aterosclerosis, respectivamente. Estos ejemplos apoyarían la utilidad de estos como herramienta de estudios en patologías de remodelado vascular. La compactación y rigidez de la estructura de estos esferoides podría generar un microambiente hipóxico en su núcleo en el tiempo, lo que puede tener consecuencias en su viabilidad y la regulación de proteínas de muerte celular (p. ej., caspasa-3 en la apoptosis)21. En este trabajo, observamos esferas viables a 72h de desarrollo tanto en gota colgante como en placa de baja adherencia, lo que indicaría viabilidad de estas al menos en este rango de tiempo. Sin embargo, para conseguir configuraciones microambientales similares a la situación in vivo de las células del vaso se debería considerar la implementación del desarrollo de estos esferoides en condiciones dinámicas de flujo. En los últimos años, diferentes grupos han descrito la posibilidad del uso de biorreactores de flujo, tanto para el desarrollo de estructuras 3D, como para su mantenimiento22. Sin embargo, este objetivo metodológico supone un avance por desarrollar en el caso de los esferoides de células vasculares.
En conjunto, estos resultados indican que el cocultivo en esferoides, por su homogeneidad y facilidad de desarrollo, permitiría un alto rendimiento en comparación con otros modelos 3D lo que los convierte en un modelo atractivo para el estudio de los mecanismos que regulan el remodelado vascular. Asimismo, se podrían utilizar para crear modelos específicos de paciente, con fines de exploración farmacológica, como ya ocurre en otras patologías, permitiendo una posible planificación precisa de la terapia.
LimitacionesEl tamaño de estos sistemas de cocultivos (aprox 0,05-0,1mm2) podría representar una de las limitaciones más importantes para su uso. La manipulación y experimentación con ellos necesita de un minucioso pipeteo y de un seguimiento de estos al microscopio, para evitar la pérdida de la muestra. El tamaño celular (definido como el número de células por esferoide) también supondría una limitación a la hora de su análisis, necesitando la optimización de conjuntos de esferoides.
ConclusionesEn este artículo exponemos que el cultivo de células endoteliales (HUVEC) y células de músculo liso vascular (HUASMC) humanas crecidas en condiciones de baja adherencia, reproduce el autoensamblaje de estas en estructuras tridimensionales esferoidales viables con naturaleza vaso sanguíneo invertido, al igual que en gota colgante, con la diferencia que en la placa de baja adherencia no hay una agrupación única. Este modelado in vitro podría utilizarse como herramienta de estudio para identificar mecanismos celulares y moleculares implicados en los procesos patológicos y de comunicación celular que subyacen al remodelado vascular patológico.
FinanciaciónEsta investigación ha contado con el apoyo de BECA FEA 2021 de Investigación Básica en Arteriosclerosis de la Sociedad Española de Arteriosclerosis. Además, ha contado con el apoyo de Fondos de Investigaciones Sanitarias, Instituto de Salud Carlos III (ISCIII/FEDER) PI21/01126, PI19/00128, PI22/00233, Premios Fundación ĹOREAL for Women in Science 2021, y CIBERCV Madrid, España. NM-B tiene un contrato Miguel Servet del ISCIII (MS19/00151), MJ F-G tiene un contrato PFIS de ISCIII (FI22/00140) e I DSS-J un contrato del CIBERCV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.