Investigaciones realizadas en los últimos años han demostrado que la hematopoyesis clonal de potencial indeterminado (CHIP), resultado de mutaciones somáticas en células madre, no es solo un proceso relacionado con la edad y un estado premaligno, sino una condición que predispone al desarrollo de enfermedades cardiovasculares. La presencia de mutaciones DNMT3A, TET-2 y ASXL1 en células hematopoyéticas se ha asociado con un riesgo elevado de cardiopatía e ictus isquémicos, así como con elevada calcificación coronaria. CHIP emerge como un nuevo factor de riesgo de enfermedad aterosclerótica y su detección puede tener importantes implicaciones terapéuticas para modificar la historia natural de la enfermedad.
Recent research has revealed that clonal hematopoyesis of indeterminate potential (CHIP) characterized by the acquisition of somatic mutations in hematopoietic stem cells, is not only a common age-related disorder and a premalignant condition, but it is also associated with the development of atherosclerotic vascular diseases. Mutations in DNMT3A, TET2 and ASXL1 were each individually associated with coronary heart disease, stroke and coronary calcification. Therefore, CHIP emerges as a new risk factor for atherosclerotic vascular pathologies and its detection may be relevant as a new therapeutic target in order to modify the natural course of the disease.
La enfermedad cardiovascular, la principal causa de mortalidad en el mundo, está causada por la oclusión vascular aterotrombótica, responsable de cuadros clínicos tan relevantes como angina inestable, infarto de miocardio, muerte súbita e ictus. La aterotrombosis es una enfermedad caracterizada por acumulación de lípidos e inflamación crónica a nivel de la íntima de arterias de mediano y gran calibre, y comprende 2fases diferenciadas: la primera tiene lugar a lo largo de varias décadas y consiste en el acúmulo de lípidos, macrófagos y otras células inflamatorias y matriz extracelular (MEC) en la íntima y espacio subendotelial de la pared vascular, originando la placa de ateroma, lesión característica en las fases iniciales de la aterosclerosis. Este proceso no suele causar complicaciones cardiovasculares, porque el flujo sanguíneo está preservado a través del denominado remodelado expansivo (excéntrico) de la pared, que preserva la luz vascular. La segunda fase ocurre solo en un pequeño porcentaje de pacientes (menos del 5%) y conlleva la rotura o erosión de la pared vascular y formación de un trombo oclusivo que produce isquemia y necrosis del órgano afectado. Hallazgos de necropsias de pacientes que han fallecido como consecuencia de un evento aterotrombótico agudo han encontrado que la «lesión culpable» no se caracteriza por una estenosis significativa de la luz vascular (como se había indicado en décadas precedentes), sino por alteraciones en la composición de la placa de ateroma que determinan su vulnerabilidad. Las placas de ateroma originan manifestaciones clínicas por rotura y exposición del material procoagulante al contacto con la sangre circulante, desencadenando el proceso trombótico (aterotrombosis). Las placas que se rompen, denominadas vulnerables, se caracterizan por una capa fibrosa fina, amplio núcleo necrótico e infiltrado inflamatorio. La actividad inflamatoria predispone a la rotura de la placa mediada por enzimas proteolíticas, como las metaloproteasas que degradan la MEC. Hoy se considera que la composición de la placa más que el grado de estenosis es el mayor determinante de la aparición de los síndromes clínicos aterotrombóticos1,2.
El componente hematopoyético de la aterosclerosisTeniendo en cuenta el papel de la inflamación en la aterosclerosis, es lógica la participación del componente mieloide en todas las etapas de este proceso, desde las fases iniciales a la progresión y, finalmente, a las consecuencias trombóticas de la enfermedad.
El descubrimiento de linfocitos T en placas de ateroma humanas y la identificación posterior de todos los tipos celulares que participan en la inmunidad innata y adquirida confirman la participación del sistema inmunitario. Avances recientes implican diversas subpoblaciones monocitarias, las células mieloides más abundantes en la placa de ateroma, así como un incremento de la actividad hematopoyética a nivel de las placas de ateroma3-6. Las células mieloides van a contribuir a iniciar la trombosis, elaborando enzimas que degradan la MEC y produciendo factor tisular, el principal iniciador de la coagulación sanguínea. Finalmente, los neutrófilos pueden agravar la trombosis a nivel local elaborando trampas extracelulares de neutrófilos (neutrophil extracelular traps [NET]) que van a promover el crecimiento y la persistencia del trombo al inducir factores procoagulantes y amplificar la inflamación activando el inflamasoma y generando IL-1β. En 2004 se describe un material fibrilar liberado por los neutrófilos en presencia de lipopolisacárido, compuesto mayoritariamente por ADN liberado por decondensación de la cromatina, las histonas y las enzimas proteolíticas (mieloperoxidasa, elastasa, etc.) que atrapaba y destruía bacterias, al que denominaron NET. Estudios posteriores demostraron que las NET están presentes en numerosos procesos patológicos sistémicos con importante componente inflamatorio, como sepsis, enfermedades autoinmunes, cáncer, trauma y diversas enfermedades trombóticas, así como a nivel de lesiones ateroscleróticas7,8. Los mecanismos por los que los NET favorecen la trombosis son múltiples: activación y agregación plaquetaria, activación de las vías intrínseca y extrínseca de la coagulación, con aumento de generación de trombina, y defecto de actividad fibrinolítica7,8.
Es interesante señalar que estudios recientes están analizando el papel de estrategias antiinflamatorias que, modulando la inmunidad innata (p. ej., canakinumab, un antagonista de IL-1β, estudio CANTOS), puedan prevenir el desarrollo de la aterosclerosis9. Además, se ve implicada la inmunidad adquirida, ya que las células T-helper producen citocinas proinflamatorias, como el factor de necrosis tumoral alfa, IL-1β e interferón-γ, con potentes acciones proateroscleróticas10.
Concepto de hematopoyesis clonal y su relevancia en las enfermedades cardiovascularesInvestigaciones realizadas en los últimos años empleando diversas técnicas genómicas han demostrado que la hematopoyesis clonal, resultado de mutaciones somáticas, no es solo un proceso frecuente relacionado con la edad y un estado premaligno, sino una condición que predispone al desarrollo de enfermedades cardiovasculares11.
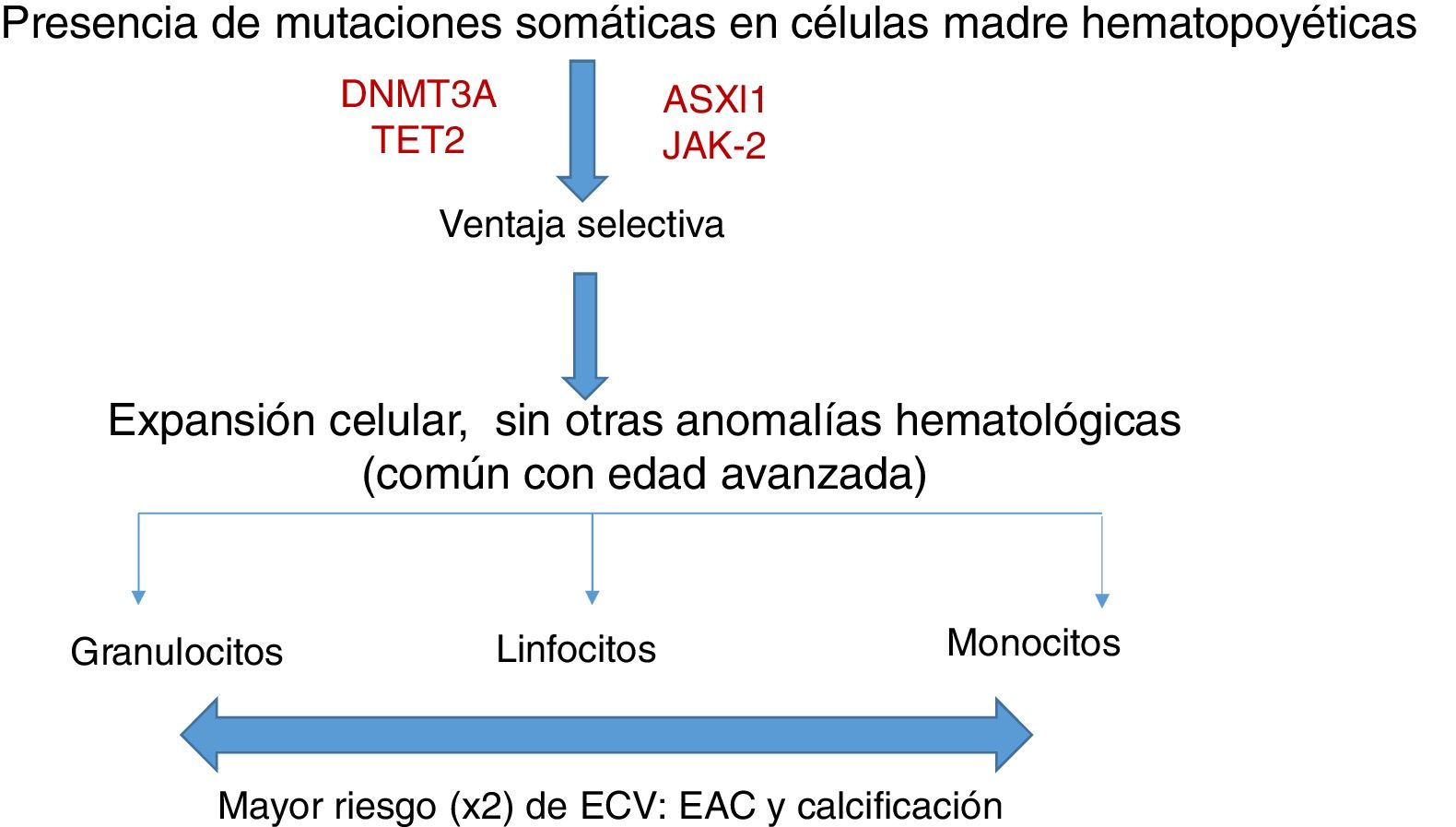
Las mutaciones somáticas son infrecuentes antes de los 40 años de edad, pero están presentes en el 10-20% de sujetos en la 8.ª década de la vida; la mayoría consiste en una mutación única, siendo DNMT3A la más frecuente, seguida de TET2 y ASLX1. Otras mutaciones menos frecuentes son TP53, JAK-2, SF3B1 y BCOR12,13. Las mutaciones somáticas en la hematopoyesis clonal persisten en el tiempo y se consideran un estado premaligno, con similitudes con otros trastornos hematopoyéticos clonales, como la gammapatía monoclonal de significado incierto (GMSI), la linfocitosis B monoclonal, los síndromes mielodisplásicos o la hemoglobinuria paroxística nocturna14. La gran mayoría de las mutaciones en la hematopoyesis clonal afectan a genes involucrados en la regulación epigenética, por ejemplo, DNMT3A y TET2 regulan la metilación del ADN11.
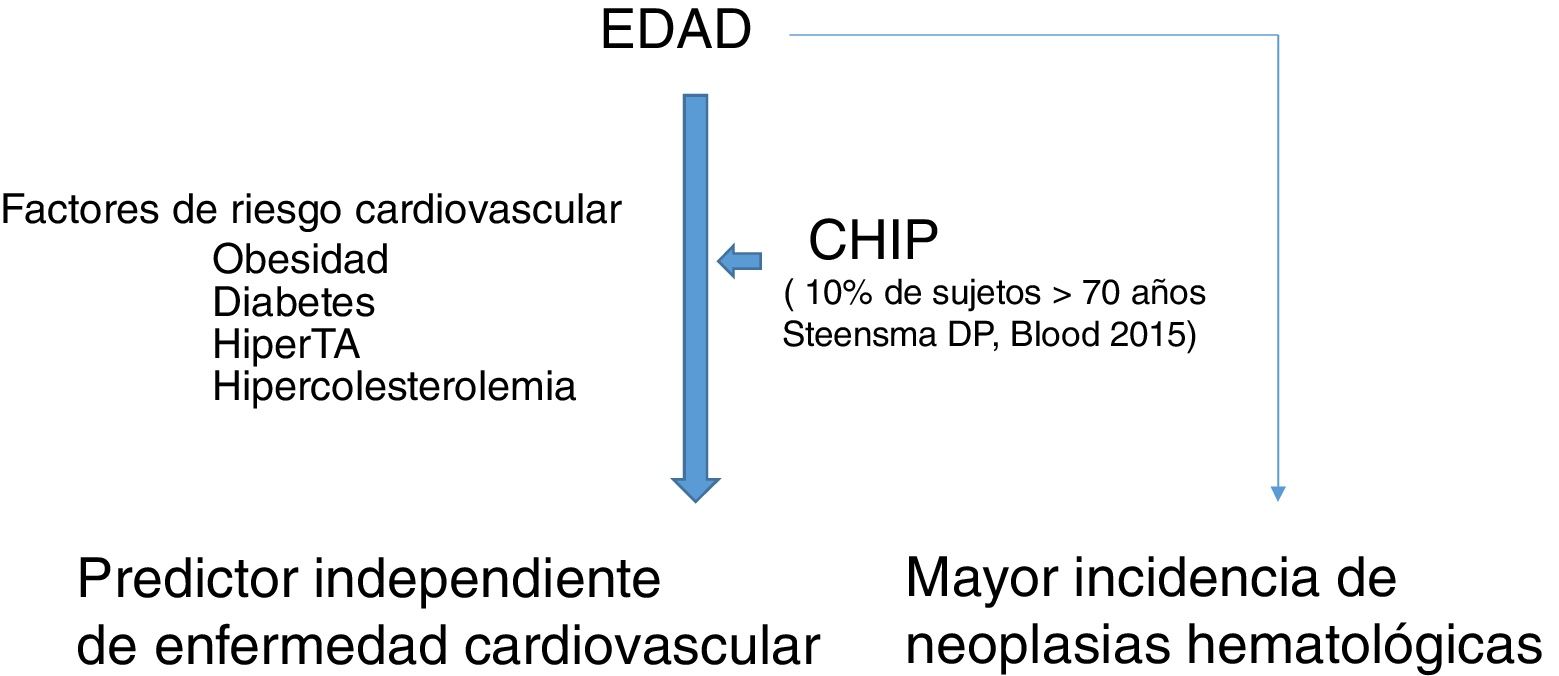
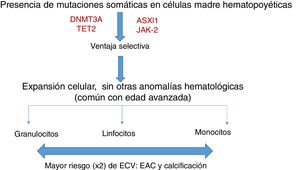
La hematopoyesis clonal de potencial indeterminado (CHIP) se caracteriza, por tanto, por la expansión de clones hematopoyéticos portando mutaciones somáticas, que confieren una ventaja selectiva con expansión clonal de células de estirpe granulocítica, linfocítica y monocítica. Se ha relacionado previamente con la edad avanzada y con un riesgo incrementado de neoplasias hematológicas12,14 (fig. 1). Estudios recientes indican que la presencia de CHIP se asocia a aterosclerosis acelerada en ratones y a elevado riesgo de enfermedad coronaria en humanos15,16. La conexión entre CHIP y enfermedad cardiovascular clínica fue demostrada recientemente por Jaiswal et al.16, en series amplias de pacientes procedentes de estudios prospectivos (BioImage y MDC) y retrospectivos (ATVB y PROMIS) en 4.726 pacientes con enfermedad arterial coronaria y en 3.529 controles sanos. Se observaron mutaciones en ASXL1, TET2, DNMT3A y JAK-2 asociadas con un riesgo elevado de cardiopatía isquémica (HR 2,0), ictus isquémico (HR 2,6) y calcificación coronaria (fig. 2). Es interesante señalar que el riesgo cardiovascular atribuible a CHIP era comparable o superior en magnitud con el de los factores tradicionales de riesgo cardiovascular, como hipertensión arterial, hipercolesterolemia y tabaquismo. La asociación entre CHIP y enfermedades cardiovasculares puede ser debida a variables aún no identificadas o compartir aspectos fisiopatológicos con el proceso de senescencia, como la inflamación vascular. En este sentido, el hecho de que TET2 regule negativamente IL-6 indica que mutaciones somáticas en TET2 pueden favorecer los procesos inflamatorios.
Para estudiar causalidad se realizaron estudios experimentales en ratones LDLr–/– (que desarrollan aterosclerosis espontánea o inducida por dieta), que fueron trasplantados con médula ósea de ratones (TET2–/–). Los animales se sometieron a una dieta rica en grasas durante 10 semanas y se analizó la expresión de genes y proteínas expresadas por macrófagos, así como estudio histológico e inmunohistoquímico de la lesión aterosclerótica. Los resultados mostraron mayor grado de aterosclerosis a nivel del arco aórtico, así como de la producción de citocinas (IL-1β, inflamasoma) en los ratones TET2–/–, estableciendo un mecanismo por el que las mutaciones o la deleción de TET2 pueden contribuir a incrementar el riesgo cardiovascular15,16.
Hematopoyesis clonal de potencial indeterminado: ¿una nueva diana terapéutica en la aterosclerosis?La aterosclerosis, lejos de considerarse un proceso irreversible asociado al envejecimiento, se postula como un cuadro que puede detenerse o incluso regresar1. En este sentido, las estatinas ejercen un efecto beneficioso sobre la composición de la placa, más que sobre el grado de estenosis. Además la acción protectora que ejerce un control estricto de los factores de riesgo cardiovascular y estilos de vida cardiosaludables sobre el proceso aterosclerótico podría estar mediada por su acción sobre la hematopoyesis17. Finalmente, se ha demostrado que la vitamina C restaura la actividad TET2 en algunos tipos de leucemias y regula a la baja la expresión de apoliproteína (a) vía TET2, lo que podría explicar algunas de sus acciones antiaterogénicas18.
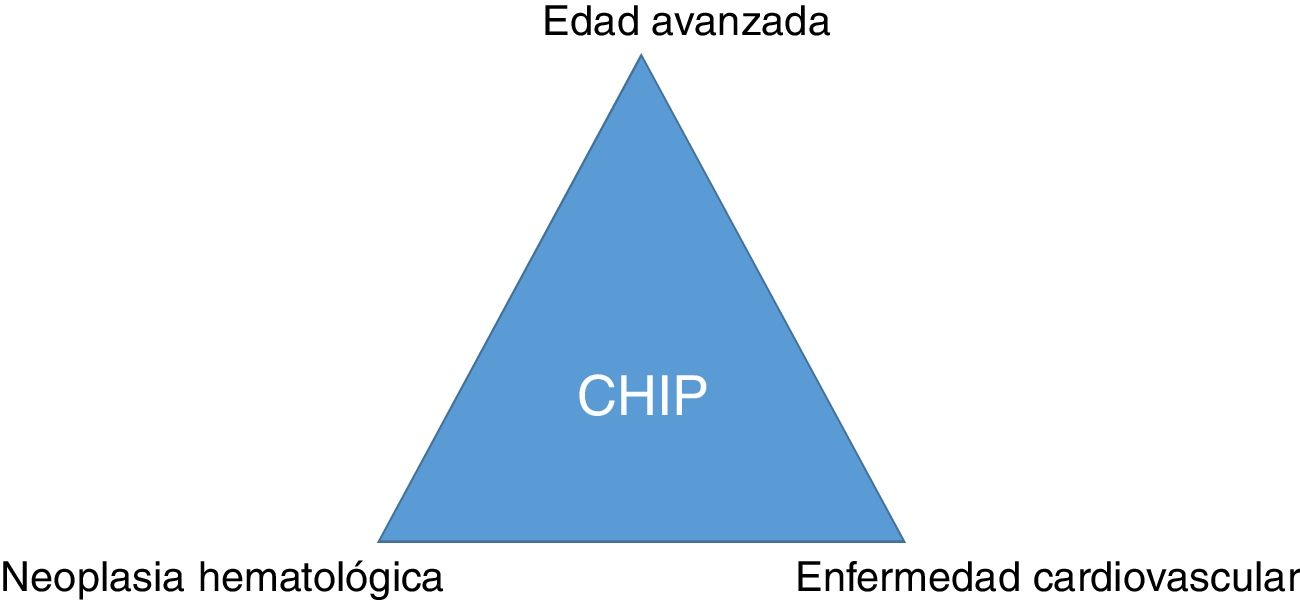
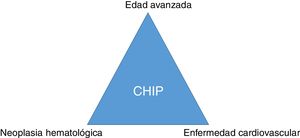
ConclusiónMutaciones somáticas en genes que se describen en pacientes con neoplasias hematológicas pueden ser detectadas con frecuencia en la sangre de sujetos sanos de edad avanzada. La CHIP se asocia a la enfermedad arterial coronaria y al grado de aterosclerosis y puede suponer un nexo entre cáncer y enfermedad cardiovascular (fig. 3). La CHIP emerge como un nuevo factor de riesgo de la enfermedad aterosclerótica y de las enfermedades vasculares isquémicas, por lo que su detección en la práctica clínica puede tener importantes implicaciones terapéuticas para modificar la historia natural de la enfermedad.
Conflicto de interesesNinguno.