El resveratrol tiene propiedades antiinflamatorias y antiaterogénicas; sin embargo, se desconoce su efecto sobre el factor de crecimiento endotelial vascular (VEGF) en la aterosclerosis.
ObjetivoEvaluar el efecto del resveratrol sobre las concentraciones séricas del VEGF durante la progresión y evolución de la aterosclerosis y su evolución en el tiempo en conejos alimentados con dieta enriquecida con colesterol.
Materiales y métodosCuarenta y ocho conejos machos divididos en cuatro grupos de 12 conejos recibieron: grupo1 (control): conejarina; grupo2: conejarina suplementada con 0,5% colesterol; grupo3 (control resveratrol): conejarina y resveratrol (2mg/kg); grupo4: conejarina suplementada con 0,5% colesterol y resveratrol, durante 12 semanas. Se realizaron determinaciones séricas de triglicéridos, colesterol y sus fracciones, VEGF y proteína C reactiva (PCR) al inicio, a la 6.a y a la 12.a semana de experimentación. La mitad de los conejos fueron sacrificados a la 6.a y a la 12.a semana y se realizó estudio histológico de su aorta.
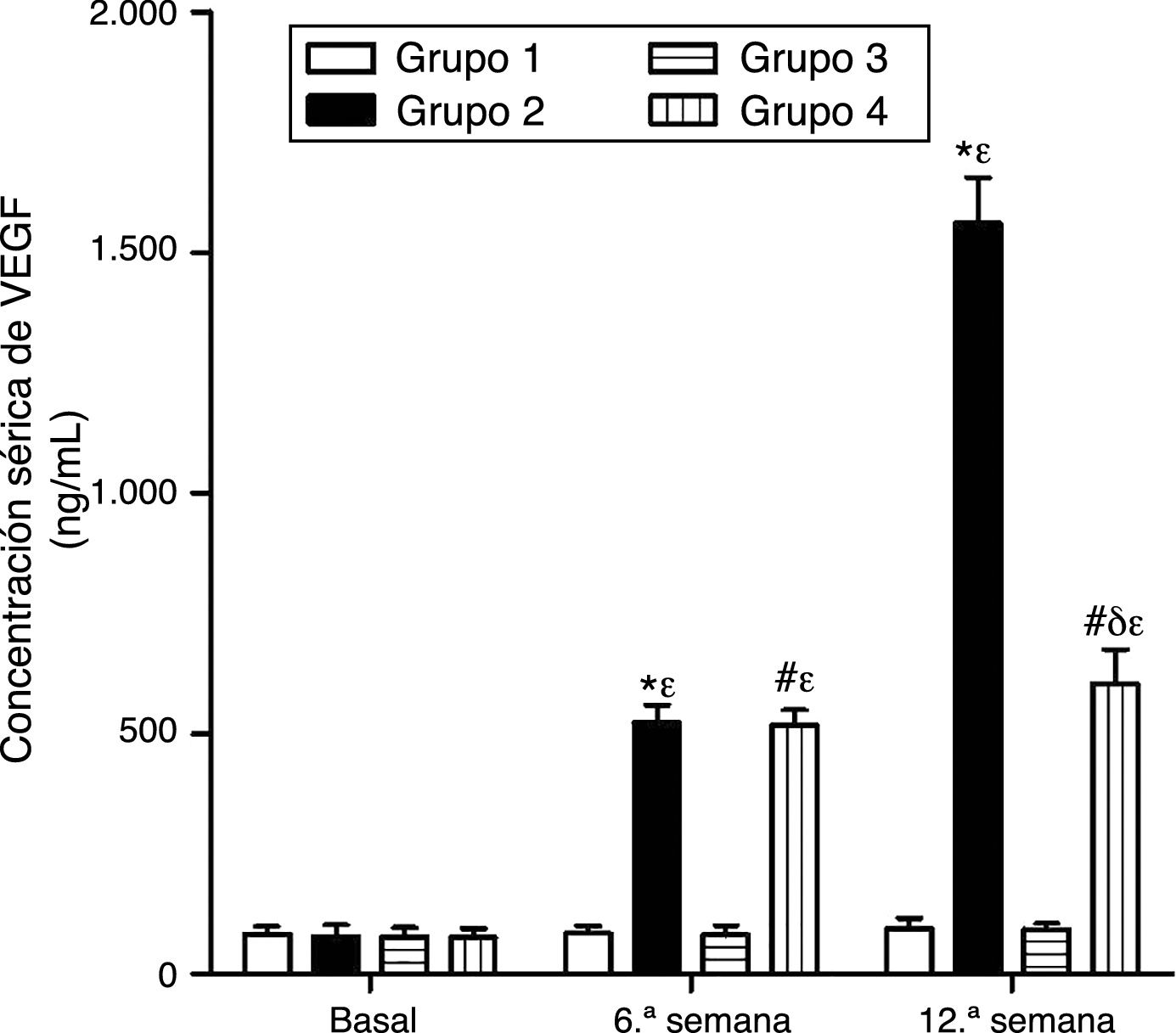
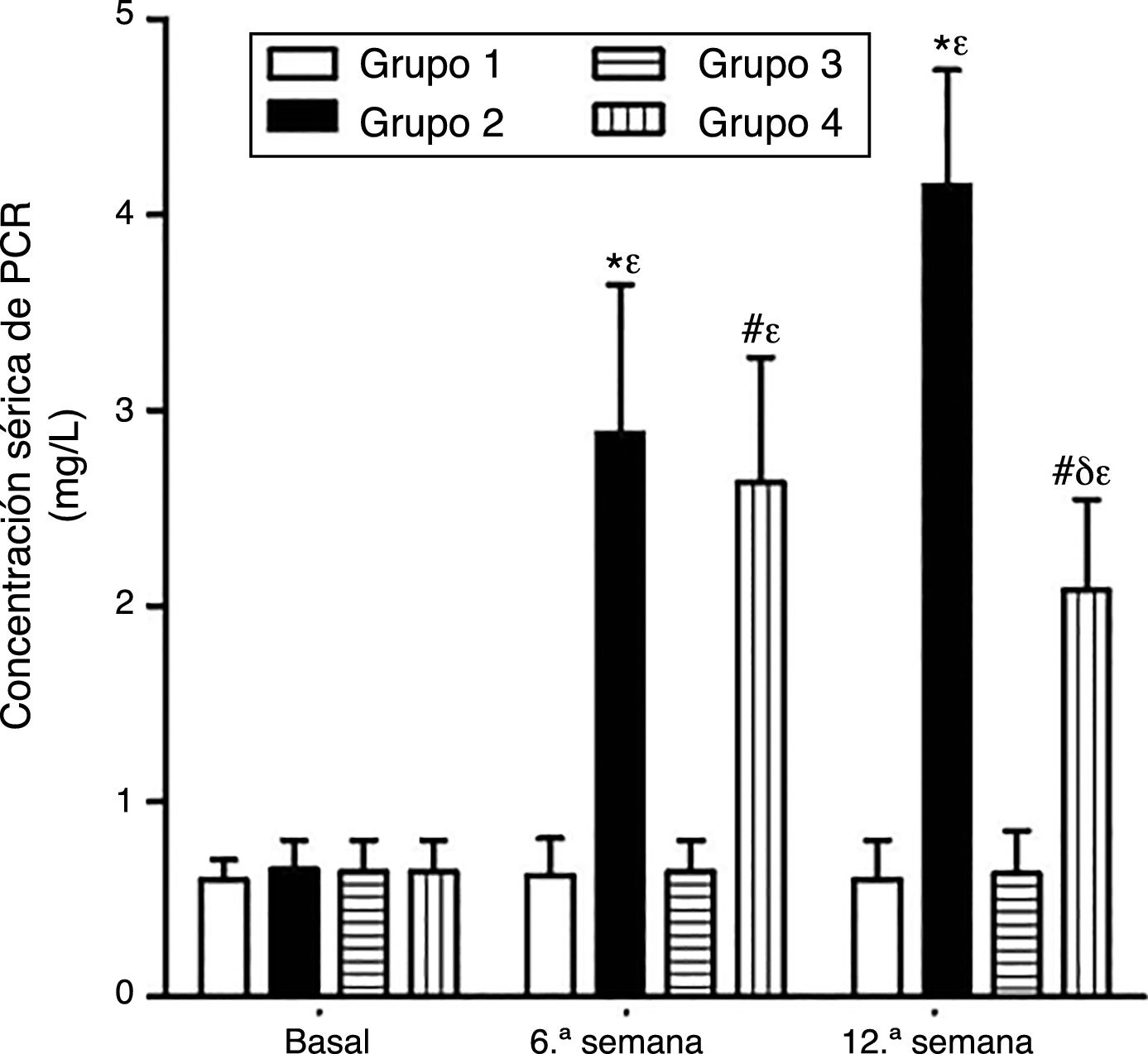
ResultadosEl VEGF y la PCR aumentaron en los grupos2 y 4 desde la 6.a semana de experimentación con respecto a los grupos1 y 3, respectivamente (p<0,001). En la duodécima semana se observó una disminución de los niveles de VEGF y PCR en el grupo4 con respecto al grupo2 (p<0,004). El tratamiento con resveratrol disminuyó la formación de ateromas.
ConclusionesEl VEGF y la PCR séricos constituyen marcadores tempranos no invasivos de inflamación y aterosclerosis. La suplementación oral de resveratrol ejerce efectos antiinflamatorios y antiateroscleróticos, disminuyendo las concentraciones séricas de VEGF y PCR, y la formación y evolución de las lesiones ateroscleróticas.
Although it is known that resveratrol has anti-inflammatory and anti-atherogenic actions, its effect on vascular endothelial growth factor (VEGF) in atherosclerosis is unknown.
ObjectiveTo evaluate the effect of resveratrol on serum concentrations of VEGF during the progression and evolution of atherosclerosis, as well as and its evolution over time in rabbits fed with a cholesterol diet.
Materials and methodsA total of 48 New Zealand white male rabbits were randomly divided into four groups of 12 rabbits: group1 (control): standard diet (commercial rabbit food); group2: cholesterol diet (0.5% cholesterol); group3 (control resveratrol): standard diet (commercial rabbit food) and resveratrol (2mg/Kg); group4: cholesterol diet (0.5% cholesterol) and resveratrol (2mg/Kg), for 12weeks. Blood samples of overnight-fasted rabbits were collected at baseline and the sixth and twelfth weeks, and the lipid profile, VEGF, and C-reactive protein (CRP) levels were determined. Half of the animals were sacrificed on the sixth or twelfth week, and the aorta was dissected for histological studies.
ResultsVEGF and CRP levels were significantly higher in groups2 and 4 than in groups1 and 3, respectively, from the 6th week (p<0.001). VEGF and CRP were significantly lower in group4 than in group2 on 12th week (p<0.004). Supplementation of resveratrol reduced the formation of atherosclerotic lesions.
ConclusionsSerum VEGF and CRP levels are early markers of atherosclerosis. Oral supplementation of resveratrol exerts anti-inflammatory and anti-atherosclerotic effects, decreasing serum concentrations of VEGF and CRP and the formation and evolution of atherosclerotic lesions.
El resveratrol (3’,5,4’-trihidroxiestilbeno) es un compuesto polifenólico encontrado en la uva y en el vino tinto al que se le han descrito propiedades antioxidantes, antiinflamatorias, antiproliferativas y antiangiogénicas1,2, y ha demostrado ser un agente beneficioso para prevenir el inicio y progresión de la aterosclerosis, pues inhibe la oxidación de las lipoproteínas de baja densidad (LDL), suprime la agregación plaquetaria, inhibe la proliferación de células de músculo liso vascular in vitro, disminuye el daño de las células endoteliales, atenúa el engrosamiento de la íntima media, reduce el tamaño de las lesiones ateroscleróticas, modula la producción de óxido nítrico (NO), inhibe la producción de quimiocinas y la producción de especies reactivas de oxígeno (ROS) y controla los niveles de colesterol plasmáticos, factores importantes en la aterogénesis2.
La inflamación y la angiogénesis participan en la fisiopatología de la aterosclerosis3. El factor de crecimiento endotelial vascular (VEGF) es un poderoso factor de crecimiento producido por diferentes células como las endoteliales, musculares lisas, plaquetas y macrófago, el cual constituye un determinante en la tasa y en la extensión del remodelado vascular4. Sin embargo, su función en la aterosclerosis no se ha comprendido totalmente, pues ejerce acciones duales e induce efectos beneficiosos y perjudiciales5,6, ya que puede proteger a las células endoteliales mediante la inducción de la expresión de proteínas antiapoptóticas y la producción de NO7; pero además posee efectos pro-aterogénicos, pues estimula la proliferación y el crecimiento de las células endoteliales, induce angiogénesis, incrementa la permeabilidad del endotelio y la expresión de proteínas de adhesión celular5.
La evidencia ha descrito un aumento en las concentraciones séricas del VEGF en pacientes con enfermedad de la arteria coronaria, infarto de miocardio y aterosclerosis4,8, y un incremento en la expresión del VEGF en la placa aterosclerótica de las arterias coronarias y carótida9, principalmente en las porciones profundas de la íntima de los vasos afectados, relacionando dicha expresión con la hemorragia intraplaca6, sugiriendo su participación en la patogénesis de la aterosclerosis. Sin embargo, hasta los momentos no está claro el efecto del resveratrol sobre las concentraciones séricas del VEGF durante la progresión y evolución de la aterosclerosis; aún más, se conoce todavía menos la relación del VEGF con la inflamación y su evolución a lo largo del proceso aterogénico. Es por ello que en el presente estudio se evaluó el efecto del resveratrol sobre los niveles séricos del VEGF y su evolución en el tiempo en conejos alimentados con una dieta enriquecida con colesterol.
Materiales y métodosSe emplearon 48 conejos macho de la cepa Nueva Zelanda (Bioterio del Instituto de Higiene Rafael Rangel, Caracas, Venezuela) de 12 semanas de edad con un peso entre 1.200 a 1.300gramos. Los animales fueron mantenidos en jaulas en condiciones controladas de luz y oscuridad (L:O, 12:12) y temperatura (25±1°C). Después de una semana de ambientación en el Bioterio Experimental de la Universidad de Carabobo (Valencia, Venezuela) los conejos fueron divididos aleatoriamente en 4 grupos de 12 conejos cada uno: grupo1 (control): alimentados diariamente con dieta estándar (Protinal, Venezuela); grupo2: alimentados diariamente con dieta estándar enriquecida con 0,5% p/p de colesterol; grupo3 (control resveratrol): alimentados diariamente con dieta estándar y suplementados con resveratrol en el alimento (2mg/kg de peso corporal, vía oral); grupo4: alimentados diariamente con dieta estándar, enriquecida con 0,5% p/p de colesterol y resveratrol mezclado en el alimento (2mg/kg de peso corporal, vía oral).
La administración de colesterol se realizó mediante el enriquecimiento de la dieta estándar con colesterol disuelto en etil éter y etanol absoluto. Los granos de la conejarina fueron cubiertos con la solución de colesterol en una relación de 0,5g de colesterol por cada 100g de alimento y se eliminó el solvente por evaporación durante 24h10. La concentración de resveratrol se seleccionó con base en estudios in vivo en conejos11 y a pruebas realizadas en nuestro laboratorio, en las cuales el resveratrol posee efectos biológicos a dosis de 2mg/kg por vía oral. El resveratrol (3,5,4¿-trihidroxi-trans-estilbeno) administrado a los conejos fue de origen natural.
Todos los conejos consumieron agua a libre demanda. El periodo experimental tuvo una duración de 12 semanas. Los conejos fueron pesados antes, durante y después de la experimentación. Los experimentos fueron aprobados por el Comité de Bioética y siguieron las buenas prácticas para el manejo de animales de laboratorio del National Institutes of Health (NIH Publications No. 8023, revisado 1978).
Procedimiento experimentalDeterminaciones bioquímicas. Las muestras de sangre fueron extraídas por punción intracardiaca a todos los conejos, previo ayuno de 14h, al inicio,a la 6.a y a la 12.a semana, utilizando tubos sin anticoagulante. Las muestras, previamente mantenidas en frío, se centrifugaron a 3.000rpm durante 15min y el suero obtenido fue conservado en congelación a −70°C hasta el momento del procesamiento. Se realizaron determinaciones séricas de colesterol total (CT) y triglicéridos (TG) por métodos enzimáticos (Linear Chemicals, España). Las determinaciones del colesterol asociado a las lipoproteínas de alta densidad (cHDL) y asociado a las lipoproteínas de baja densidad (cLDL) se realizaron por precipitación y posterior determinación enzimática (Linear Chemicals, España). La determinación cuantitativa de la proteína C reactiva (PCR) se realizó por método inmunoturbidimétrico (Alpco, EE.UU.). Las concentraciones séricas del VEGF fueron determinadas por ensayo inmunoenzimático (NeoBiolab, Cambridge, Massachusetts, EE.UU.).
Sacrificio de los animalesPreparación de tejidos y tipificación histológica de las lesiones ateroscleróticas. A la 6.a semana y al final del estudio la mitad de los animales de cada grupo fueron sacrificados por dislocación cervical. Tras la realización de la autopsia, se extrajo la arteria aorta para estudio histológico. Las muestras de tejido extraídas fueron fijadas en formaldehído al 10% en PBS durante 24h y procesadas según la técnica de rutina y posteriormente teñidas con hematoxilina-eosina, para luego ser observados por microscopia óptica. Las lesiones fueron tipificadas de acuerdo a la clasificación de la American Heart Association12.
Análisis de los datosSe calculó promedio y desviación estándar para las variables estudiadas. Se realizó las pruebas de normalidad de Shapiro-Wilk, Kolmogorov-Smirnov, Jarque-Bera. Se empleó el análisis de Kruskall-Wallis con análisis post hoc mediante la prueba de U de Mann-Whitney sobre cada par de grupos. Se empleó la correlación de Spearman para relacionar el VEGF con las variables del estudio. Se consideró significativo p<0,05. Se utilizó el programa GraphPad Prism versión 5.
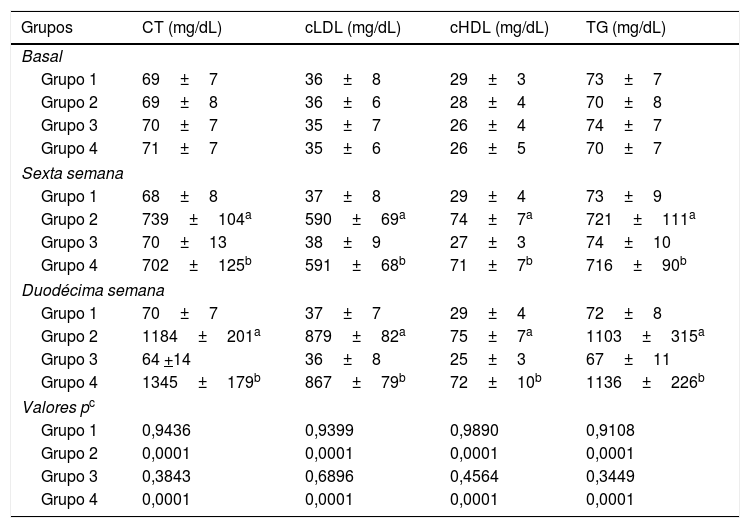
ResultadosPerfil lipídico de los conejosEn la tabla 1 se resumen las concentraciones de los lípidos séricos de los conejos. No se observaron diferencias estadísticamente significativas en las concentraciones séricas de CT, cHDL, cLDL y TG entre los grupos de conejos. El CT, el cHDL, el cLDL y los TG en los grupos 1 y 3 permanecieron sin cambios significativos a lo largo del estudio. Por su parte, en la 6.a y 12.a semanas de experimentación se apreció un aumento significativo en la concentración de CT, cHDL, cLDL y TG en el grupo 2 y en el grupo 4 con respecto a sus respectivos controles (grupo 1 y 3, respectivamente) (p<0,0001). Para los grupo 2 y 4 las concentraciones de los lípidos séricos variaron desde el inicio hasta el final del experimento (p<0,0001); sin embargo, no se observaron diferencias estadísticamente significativas en las concentraciones séricas de CT, cHDL, cLDL y TG en el grupo 4 con respecto al grupo 2 a lo largo del estudio (tabla 1).
Perfil lipídico en los conejos sujetos a estudio
| Grupos | CT (mg/dL) | cLDL (mg/dL) | cHDL (mg/dL) | TG (mg/dL) |
|---|---|---|---|---|
| Basal | ||||
| Grupo 1 | 69±7 | 36±8 | 29±3 | 73±7 |
| Grupo 2 | 69±8 | 36±6 | 28±4 | 70±8 |
| Grupo 3 | 70±7 | 35±7 | 26±4 | 74±7 |
| Grupo 4 | 71±7 | 35±6 | 26±5 | 70±7 |
| Sexta semana | ||||
| Grupo 1 | 68±8 | 37±8 | 29±4 | 73±9 |
| Grupo 2 | 739±104a | 590±69a | 74±7a | 721±111a |
| Grupo 3 | 70±13 | 38±9 | 27±3 | 74±10 |
| Grupo 4 | 702±125b | 591±68b | 71±7b | 716±90b |
| Duodécima semana | ||||
| Grupo 1 | 70±7 | 37±7 | 29±4 | 72±8 |
| Grupo 2 | 1184±201a | 879±82a | 75±7a | 1103±315a |
| Grupo 3 | 64 +14 | 36±8 | 25±3 | 67±11 |
| Grupo 4 | 1345±179b | 867±79b | 72±10b | 1136±226b |
| Valores pc | ||||
| Grupo 1 | 0,9436 | 0,9399 | 0,9890 | 0,9108 |
| Grupo 2 | 0,0001 | 0,0001 | 0,0001 | 0,0001 |
| Grupo 3 | 0,3843 | 0,6896 | 0,4564 | 0,3449 |
| Grupo 4 | 0,0001 | 0,0001 | 0,0001 | 0,0001 |
cHDL: colesterol asociado a lipoproteínas de alta densidad; cLDL: colesterol asociado a lipoproteínas de baja densidad; CT: colesterol total; TG: triglicéridos.
Los resultados fueron expresados como la media±desviación estándar de la media. Significativo: p<0,05.
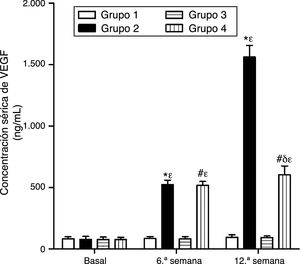
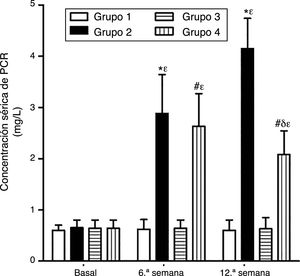
Como se puede apreciar en las figuras 1 y 2, no se observaron diferencias estadísticamente significativas en las concentraciones séricas basales de VEGF y PCR entre los grupos de conejos sujetos a estudio. Asimismo, el VEGF y la PCR en los grupos 1 y 3 permanecieron sin cambios a lo largo del experimento; por su parte, los niveles de VEGF y PCR en los grupos 2 y 4 variaron a lo largo del estudio (p<0,0001). En la sexta semana y al final del experimento las concentraciones séricas de VEGF y PCR aumentaron en el grupo2 con respecto al grupo1 (p<0,0010), y en el grupo4 con respecto al grupo3 (p<0,0010). Sin embargo, en la duodécima semana se observó una disminución significativa de los niveles de VEGF y PCR en el grupo 4 con respecto al grupo 2 (p<0,0049).
Efecto del resveratrol sobre las concentraciones séricas de VEGF en los conejos sujetos a experimentación en la semana 0, 6.a y 12.a. Los resultados fueron expresados como la media ±desviación estándar de la media (n=12 basal y 6.a semana; n=6 en 12.a semana). *p<0,0001 vs. control (grupo 1). #p<0,0010 vs. control resveratrol (grupo 3). δp=0,0051 vs. grupo 2. ¿p<0,0001 vs. su valor basal.
Efecto del resveratrol sobre las concentraciones séricas de PCR en los conejos sujetos a experimentación en la semana 0, 6.a y 12.a. Los resultados fueron expresados como la media =desviación estándar de la media (n=12 basal y 6.a semana; n=6 en 12.a semana). *p<0,0010 vs. control (grupo 1). #p<0,0010 vs. control resveratrol (grupo 3). δp=0,0049 vs. grupo 2. ¿p<0,0001 vs. su valor basal.
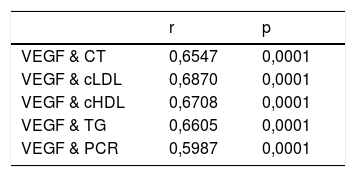
En la tabla 2 se muestra el análisis de Spearman de las correlaciones entre la concentración de VEGF, el perfil lipídico y PCR, evidenciando correlación positiva significativa entre el VEGF con el perfil lipídico y PCR (p<0,0001).
Análisis de la correlación de Spearman entre las concentraciones del factor de crecimiento endotelial vascular (VEGF), proteína C reactiva (PCR) y el perfil lipídico
| r | p | |
|---|---|---|
| VEGF & CT | 0,6547 | 0,0001 |
| VEGF & cLDL | 0,6870 | 0,0001 |
| VEGF & cHDL | 0,6708 | 0,0001 |
| VEGF & TG | 0,6605 | 0,0001 |
| VEGF & PCR | 0,5987 | 0,0001 |
cHDL: colesterol asociado a lipoproteínas de alta densidad; cLDL: colesterol asociado a lipoproteínas de baja densidad; CT: colesterol total; PCR: proteína C reactiva; TG: triglicéridos, VEGF: factor de crecimiento endotelial vascular.
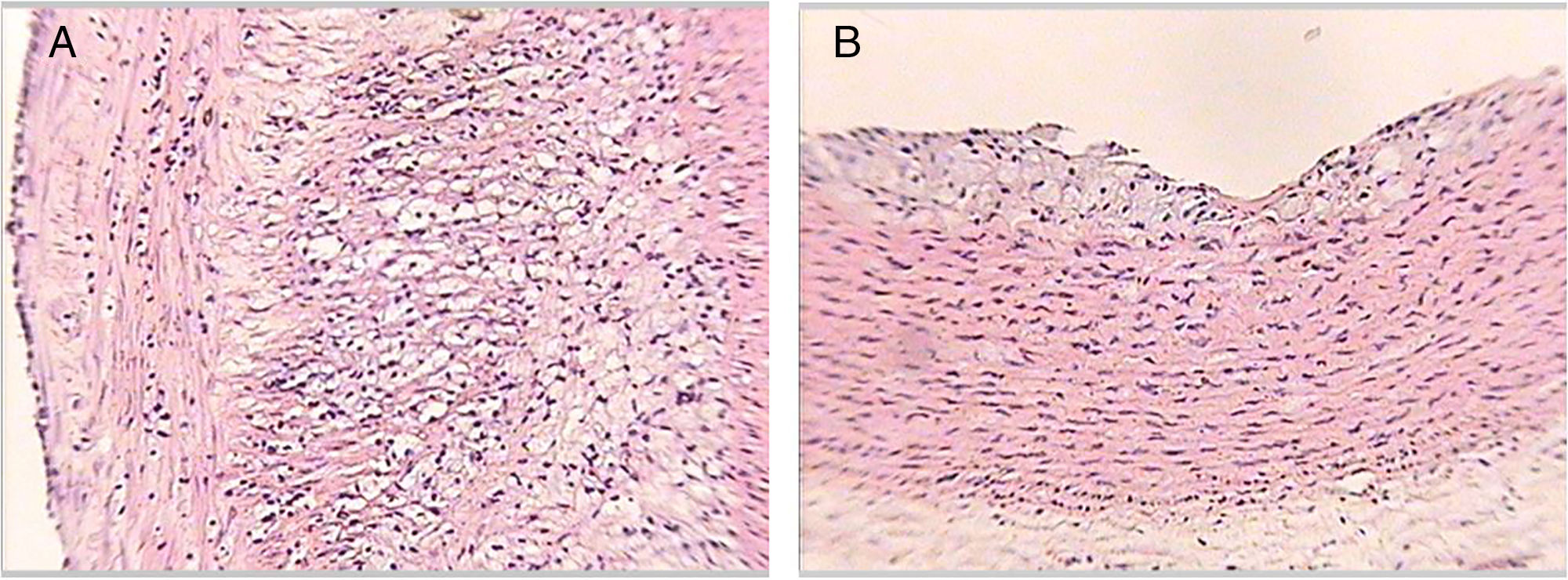
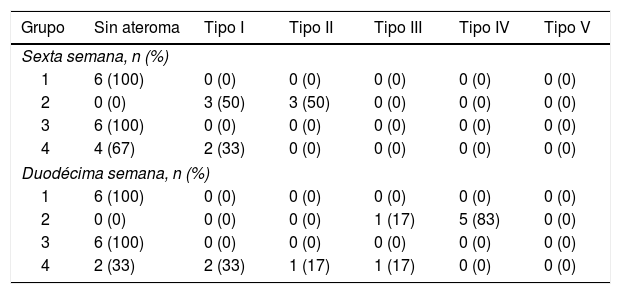
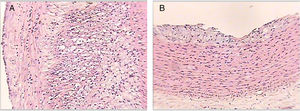
En la tabla 3 se presenta la distribución de los conejos según el máximo grado de ateroma encontrado en los cortes de aorta, evidenciando que ningún conejo de los grupos1 y 3 presentaron lesiones ateroscleróticas a lo largo del estudio. Por su parte, los conejos del grupo2 presentaron lesiones de grado variable a lo largo del estudio. En el grupo4 algunos conejos no presentaron lesiones y otros evidenciaron lesiones de grado variable (fig. 3).
Distribución de los conejos según el máximo grado de ateroma encontrado en los cortes de aorta
| Grupo | Sin ateroma | Tipo I | Tipo II | Tipo III | Tipo IV | Tipo V |
|---|---|---|---|---|---|---|
| Sexta semana, n (%) | ||||||
| 1 | 6 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| 2 | 0 (0) | 3 (50) | 3 (50) | 0 (0) | 0 (0) | 0 (0) |
| 3 | 6 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| 4 | 4 (67) | 2 (33) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Duodécima semana, n (%) | ||||||
| 1 | 6 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| 2 | 0 (0) | 0 (0) | 0 (0) | 1 (17) | 5 (83) | 0 (0) |
| 3 | 6 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| 4 | 2 (33) | 2 (33) | 1 (17) | 1 (17) | 0 (0) | 0 (0) |
Cortes histológicos de las aortas de los conejos al final del estudio. Lesión tipo IV (panel A). Se observan en la íntima arterial cúmulos de lípidos intracelulares y extracelulares en mayor extensión de un conejo perteneciente al grupo 2. Lesión tipo II (panel B). Se observan en la íntima arterial cúmulos de lípidos intracelulares de un conejo perteneciente al grupo 4. Tinción hematoxilina-eosina, ×50.
En el presente estudio se evidenció que el VEGF y la PCR podrían constituir marcadores tempranos no invasivos de aterosclerosis, pues la administración de una dieta enriquecida con colesterol ocasionó lesiones ateroscleróticas de grado intermedio y avanzado y un incremento en la concentraciones séricas de VEGF y PCR a partir de la sexta semana de estudio, sugiriendo el papel de estas molécula desde las primeras fases de la aterosclerosis. En este sentido, algunos estudios han demostrado un aumento en los niveles plasmáticos del VEGF en pacientes con enfermedad de la arteria coronaria, infarto de miocardio y aterosclerosis, pudiendo reflejar la severidad de la lesión8,13. De hecho, diferentes estudios apoyan el papel pro-aterogénico del VEGF. En efecto, se ha descrito que el tratamiento con VEGF recombinante humano ocasiona un aumento en la densidad de macrófagos en la placa, en el crecimiento de la misma y neovascularización14, lo cual sugiere que el VEGF es importante e influye en el crecimiento y en la extensión de la inflamación en la placa aterosclerótica7.
Sin embargo, el papel del VEGF en procesos inflamatorios de baja intensidad es aún controvertido debido a la acción dual de esta molécula, pues por un lado el VEGF-A puede incrementar la permeabilidad endotelial, la expresión de proteínas de adhesión celular y de factores quimiotácticos, promoviendo la adhesión de monocitos, su migración transendotelial y activación15; pero por otro lado el VEGF-A protege a las células endoteliales mediante la inducción de proteínas antiapoptóticas, incrementa la expresión de la sintasa de óxido nítrico endotelial (eNOS) y la síntesis de NO y puede actuar como un mitógeno que promueve la re-endotelización previniendo o reparando el daño endotelial que inicia la aterosclerosis5.
El incremento en las concentraciones de VEGF observado en el presente estudio pudo ser debido a las condiciones de hipoxia e inflamación presentes en la aterosclerosis; pues los conejos evidenciaron lesiones ateroscleróticas de grado intermedio y avanzado. De hecho, se ha descrito que durante la aterosclerosis el engrosamiento de la íntima ocasiona una disminución en la suplementación de oxígeno hacia la pared arterial, lo cual provoca la liberación de factores estimulantes de la angiogénesis como el VEGF16 promoviendo la neovascularización, la cual podría permitir la suplementación de nutrientes así como la infiltración de macrófagos, engrosamiento de pared, deposición lipídica, inflamación y progresión de la lesión aterosclerótica5,17.
Por lo tanto, el aumento en las concentraciones de VEGF y PCR observado en el presente estudio sugiere la existencia de un estado inflamatorio inducido por la dieta enriquecida con colesterol, la cual ocasionó lesiones ateroscleróticas de grado intermedio y avanzado. De hecho, se ha descrito que el aumento en la expresión de moléculas de adhesión celular y citoquinas promovido por la hiperlipidemia, con la consecuente acumulación de monocitos en la íntima, podría estar implicado en la aparición de las lesiones ateroescleróticas observadas18, pues la inflamación juega un papel importante en la fisiopatología de la aterosclerosis10.
De hecho, la PCR constituye el marcador de inflamación más estudiado relacionado con pronóstico cardiovascular19-21. Diferentes autores han encontrado que la PCR está presente en las lesiones ateroscleróticas de humanos y animales, y se ha postulado que puede tener influencia directa sobre la aterogénesis debido a que es sintetizada en los macrófagos del núcleo lipídico y está asociado con el grosor de la capa fibrosa19. Por lo tanto, el aumento en las concentraciones séricas de PCR observado a partir de la sexta semana de experimentación en los grupos a los que se les administró una dieta enriquecida con colesterol sugiere que el mismo es un marcador sistémico de la inflamación que se eleva de manera temprana, tal y como se ha encontrado en otros estudios1,22-27, pues esta proteína participa desde la fase inicial de la aterosclerosis, promoviendo el incremento en la expresión de moléculas de adhesión celular, incrementando la adhesión y migración de los monocitos, determinando la síntesis de factores quimiotácticos e induciendo la secreción endotelial de otros factores pro-inflamatorios como el factor nuclear kappaB (NF-κB), interleucina6 (IL-6) e IL-828. Adicionalmente, estudios epidemiológicos y clínicos han demostrado que los niveles séricos elevados de PCR constituyen un factor de riesgo así como un marcador de enfermedad cardiovascular, pues esta proteína es un predictor de riesgo de infarto de miocardio y de enfermedad arterial periférica, aun en individuos aparentemente sanos21.
De igual manera, nuestros hallazgos muestran una asociación positiva entre el VEGF con el perfil lipídico y la PCR, tal y como ha sido reportado en otros estudios29,30, sugiriendo que el incremento de la concentración de los lípidos séricos puede contribuir a la instauración del proceso inflamatorio sistémico, lo cual se ve acompañado del aumento del VEGF y la PCR, favoreciendo el proceso aterosclerótico. Asimismo, estos datos podrían sugerir que el VEGF sérico puede constituir un marcador de riesgo y de aterosclerosis, pues el aumento de los lípidos séricos viene acompañado de un aumento del estado inflamatorio.
Diferentes estudios in vivo e in vitro han demostrado que el resveratrol tiene efecto sobre la aterosclerosis1,2,11. El resveratrol es una fitoalexina con efectos cardioprotectores, los cuales se deben a sus propiedades antioxidantes, ya que es capaz de inhibir el daño oxidativo actuando sobre el radical anión superóxido e hidroxilo, inhibiendo la producción de ROS y la peroxidación lipídica31. Por otra parte, el resveratrol posee efectos antiinflamatorios, pues es capaz de inhibir la activación de factores de transcripción relacionados con la inflamación como el NF-κB, por lo que su administración se asocia con reducidos niveles séricos de citoquinas pro-inflamatorias como el ligando 3 de la quimioquina, la interleucina1beta (IL-1β) y el factor de necrosis tumoral alfa (TNF-α)1,2,11,31.
En el presente estudio se evidenció que el resveratrol tiene efecto antiinflamatorio y antiaterogénico, pues se observó una disminución en las concentraciones séricas de VEGF y PCR en la duodécima semana de experimentación y una disminución en la formación de lesiones ateroscleróticas en los conejos suplementados con este polifenol a los que se les administró una dieta enriquecida con colesterol, demostrando por primera vez el efecto del resveratrol sobre las concentraciones séricas de VEGF en la aterosclerosis in vivo. En este sentido, se ha descrito que el resveratrol puede regular la expresión del VEGF en diversas células, ya que disminuye los niveles de VEGF en fibroblastos gingivales32, en carcinoma de las células escamosas de la lengua y en células de hepatoma humano33.
Por otra parte, el resveratrol ha demostrado disminuir el incremento de la expresión y de la secreción del VEGF y la hiperpermeabilidad celular inducida por alta glucosa en cultivo de monocapas de células endoteliales de aorta34, y además previene la regulación hacia arriba del VEGF en macrófagos incubados con 1-oxo colesterol, lo cual refuerza el posible papel terapéutico de este polifenol para contrarrestar la señalización pro-aterogénica de los oxiesteroles dentro de la placa aterosclerótica35. Por lo tanto, considerando que el resveratrol fue capaz de disminuir las concentraciones séricas del VEGF, el cual ha demostrado estimular la migración, la permeabilidad y la proliferación endotelial, se puede inferir que uno de los efectos antiaterogénicos de esta molécula se deba a la disminución en la secreción de esta molécula in vivo durante la aterosclerosis, lo cual podría contribuir a disminuir la permeabilidad endotelial. Es relevante señalar que el efecto del resveratrol sobre los niveles de VEGF y PCR se observó en los conejos a los que se le indujo la aterosclerosis con una dieta hipercolesterolémica, lo cual indica la necesidad de un ambiente «estimulado» o inflamado, tal y como se ha apreciado in vitro35.
De igual manera es relevante señalar que el resveratrol fue capaz de disminuir las concentraciones séricas de la PCR, una importante proteína de fase aguda y marcador de riesgo cardiovascular19, lo cual reafirma la propiedad antiinflamatoria de esta fitoalexina, tal y como han reportado otros estudios11,31,36.
A pesar de que la evidencia señala que el resveratrol tiene propiedades hipolipemiantes2, en la presente investigación no se evidenció dicho efecto, tal y como ha sido reportado en otros estudios11,37, que sugieren que esto pudo ser debido al corto periodo experimental11; sin embargo, nuestros datos y la evidencia sugieren que la ausencia del efecto hipolipemiante observado en este modelo experimental pudo ser debido a la acumulación de lípidos exógenos provenientes de su dieta, ya que los mismos no pueden incrementar la excreción de esteroles26.
Sin embargo, a pesar de que la suplementación del resveratrol no tuvo efecto sobre los lípidos séricos, fue capaz de reducir la formación y la progresión de la aterosclerosis, inducida por la dieta hipercolesterolémica desde la sexta semana de estudio, tal y como ha sido demostrado previamente2,11; se reporta además una disminución en la expresión de proteínas pro-inflamatorias en la aorta, como la molécula de adhesión vascular tipo1 (VCAM-1), proteína quimiotáctica de monocitos tipo1 (MCP-1) e IL-611 y del factor NF-κB2. De igual modo, se ha descrito que el resveratrol es un agente preventivo en el desarrollo de las lesiones ateroscleróticas, siendo dicho efecto posiblemente debido a la inhibición de la oxidación de las LDL, la agregación plaquetaria y la proliferación de células de músculo liso vascular, y mediante la inhibición de la expresión de genes pro-inflamatorios y pro-aterogénicos en las células endoteliales, como el factor NF-κB y la proteína activadora-1 (AP-1)31. Por otra parte, estudios in vitro han encontrado además que los efectos antioxidantes median la acción antiaterogénica del resveratrol, pues el pre-tratamiento con resveratrol en una línea celular de macrófagos fue capaz de inhibir la formación de células espumosas y la producción de ROS inducida por lipopolisacárido mediante la inhibición de la expresión de la nicotinamida adenina dinucleótido fosfato oxidasa (NADPH oxidasa)38. Por lo tanto, se sugiere que el efecto antiaterogénico del resveratrol observado en el presente estudio pudo ser debido en parte a su efecto antiinflamatorio, sugiriendo que el mismo puede actuar como un agente preventivo en el desarrollo de lesiones ateroscleróticas.
En conclusión, de acuerdo a nuestras condiciones experimentales, se sugiere que el VEGF y la PCR sérica constituyen marcadores tempranos no invasivos de inflamación y aterosclerosis, pues los mismos se elevaron desde la sexta semana de estudio, reafirmando su papel en la fisiopatología de la aterosclerosis, por lo que su cuantificación en sangre pudiera ser útil para proporcionar información diagnóstica de la aterosclerosis. Por otra parte, se observó que la suplementación oral de resveratrol ejerció efectos antiinflamatorios y antiateroscleróticos, pues disminuyó las concentraciones séricas de VEGF y PCR y disminuyó la formación y la evolución de las lesiones ateroscleróticas, sugiriendo que la administración de este polifenol podría ser beneficioso para prevenir la aterosclerosis.
FinanciamientoEste trabajo ha sido posible gracias al financiamiento recibido por parte de la Distribuidora Gonzalab.
Conflictos de interesesNinguno.
Agradecemos la asistencia técnica de María José de Freitas y de Manuel Avelino Dinis.