La pérdida del rol modulador del endotelio podría estar implicada en la patogénesis de las complicaciones vasculares diabéticas. Los compuestos de metales de transición tales como wolframio y vanadio se han propuesto como posibles agentes en el tratamiento de la diabetes al simular los efectos de la insulina. El lecho vascular mesentérico interviene en la resistencia vascular y constituye una fuente de compuestos vasoactivos como los prostanoides. El objetivo de este trabajo fue estudiar los efectos de los tratamientos con tungstato de sodio y sulfato de vanadilo sobre los parámetros metabólicos y la liberación de prostanoides del lecho vascular mesentérico en un modelo experimental de diabetes inducida por estreptozotocina. En ratas diabéticas se observó un aumento significativo de los niveles plasmáticos de glucosa, triglicéridos y colesterol total. Por su parte, se observó una reducción significativa en la liberación de los prostanoides vasodilatadores como la prostaciclina y la prostaglandina E2 y del vasoconstrictor tromboxano A2 por el lecho vascular mesentérico. Tanto el tungstato de sodio como el sulfato de vanadilo normalizaron la glucemia, la trigliceridemia y la colesterolemia en las ratas diabéticas. Por otra parte, solo el tratamiento con tungstato de sodio revirtió la reducción en la liberación de prostanoides vasodilatadores, mejorando en los animales diabéticos la relación prostaciclina/tromboxano, un indicador de disfunción vascular. En conclusión, a diferencia del sulfato de vanadilo, el tungstato de sodio demuestra ser más eficaz para controlar las alteraciones metabólicas y de la producción de prostanoides vasodilatadores observadas en la diabetes experimental inducida por estreptozotocina.
The loss of the modulator role of the endothelium could be involved in the pathogenesis of diabetic vascular complications. Transition metal compounds, such as tungsten and vanadium, have been proposed as possible agents in the treatment of diabetes by simulating the effects of insulin. The mesenteric vascular bed intervenes in vascular resistance and is a source of vasoactive compounds, such as prostanoids. The aim of this work was to study the effects of sodium tungstate and vanadyl sulphate treatments on the metabolic parameters and the release of prostanoids of the mesenteric vascular bed in an experimental model of Streptozotocin-induced diabetes. In diabetic rats, a significant increase was observed in plasma levels of glucose, triglycerides and total cholesterol. On the other hand, there was a significant reduction in the release of vasodilator prostanoids, such as prostacyclin and prostaglandin E2 and vasoconstrictor thromboxane A2 through the mesenteric vascular bed. Both sodium tungstate and vanadyl sulphate normalised glycaemia, triglyceridaemia and cholesterolaemia in rats diabetics. On the other hand, only treatment with sodium tungstate reversed the reduction in the release of vasodilator prostanoids, improving in diabetic animals the prostacyclin/thromboxane ratio, an indicator of vascular dysfunction. In conclusion, unlike vanadyl sulphate, sodium tungstate is shown to be more effective in controlling metabolic changes and the production of vasodilator prostanoids observed in experimental diabetes induced by streptozotocin.
Las complicaciones vasculares constituyen una causa importante de morbimortalidad en la diabetes mellitus. Aunque el vínculo no se comprende completamente, la pérdida del rol modulador del endotelio podría estar implicada en la patogénesis de las complicaciones vasculares diabéticas1.
Entre los diversos trastornos vasculares causados por la diabetes mellitus se encuentran las alteraciones en el metabolismo del ácido araquidónico. Los miembros de la familia de los prostanoides, formados por las prostaglandinas (PG) y los tromboxanos (TX), son productos del ácido araquidónico a través de la ruta de las ciclooxigenasas. Estas sustancias vasoactivas exhiben acciones biológicas de gran alcance que incluyen la regulación del tono vasomotor2.
El lecho vascular mesentérico, formado por vasos de resistencia, participa en la resistencia vascular y constituye una fuente de prostanoides3. En la diabetes, las arterias periféricas poseen un alto riesgo de obstrucción, limitando el flujo sanguíneo a los tejidos distales4. Las PG como la prostaciclina (PGI2) y la PGE2 son prostanoides vasodilatadores que mantienen un flujo sanguíneo adecuado a los tejidos periféricos. En este sentido, se ha observado un patrón alterado de liberación de prostanoides en vasos mesentéricos en un modelo experimental de diabetes5.
Los compuestos de metales de transición tales como wolframio y vanadio actúan mimetizando los efectos de la insulina reduciendo los niveles plasmáticos de glucosa, por lo que se han propuesto como posibles agentes en el tratamiento de la diabetes mellitus6,7. Asimismo, se han reportado los efectos del tungstato de sodio y del sulfato de vanadilo en la producción de prostanoides vasculares en ratas tratadas por una sobrecarga oral de fructosa. El tungstato de sodio previno la disminución de la liberación de los vasodilatadores (PGI2 y PGE2) del lecho mesentérico de rata producido por la sobrecarga de fructosa, mientras que el sulfato de vanadilo no ejerció ningún efecto sobre la liberación de dichos prostanoides8.
Con base en los antecedentes mencionados, el objetivo del presente estudio fue analizar los efectos de los tratamientos con tungstato de sodio y sulfato de vanadilo sobre los parámetros metabólicos, y la liberación de prostanoides en el lecho vascular mesentérico en ratas diabéticas por estreptozotocina (STZ).
Métodos y materialesLos experimentos fueron aprobados previamente por el comité de ética local sobre investigación animal (Comité Institucional para el Cuidado y Uso de Animales de Laboratorio [CICUAL], Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Res. N.o 2259). Todos los animales incluidos en los protocolos experimentales fueron manejados y alojados de acuerdo con las pautas del CICUAL.
Se utilizaron 42 ratas macho de la cepa Wistar, con un peso de entre 180 y 240g al comienzo del experimento. Los animales fueron divididos en 6 grupos (n=7 por grupo): control (C); diabéticos (D); tratados con tungstato (CT); tratados con vanadilo (CV); diabéticos tratados con tungstato (DT) y diabéticos tratados con vanadilo (DV). Los grupos CT y DT recibieron tungstato de sodio, 2g/l, mientras que los CV y DV recibieron sulfato de vanadilo, 125mg/l, en el agua de bebida en ambos casos.
La diabetes experimental se indujo con una inyección i.p. de STZ, 55mg/kg en buffer citrato (grupos D, DT y DV). Los animales de los grupos C, CT y CV recibieron solamente buffer. Una semana después se midió la glucemia en muestras de sangre obtenidas de la arteria caudal (Accutrend Glucose Meter, Roche Diagnostics, Mannheim, Alemania). Los animales con glucemia superior a 300mg/dl fueron considerados diabéticos, y a partir de ese momento comenzaron los tratamientos con tungstato de sodio y sulfato de vanadilo. Treinta días después de la administración de STZ o buffer, los animales fueron sacrificados por decapitación. Previamente al sacrificio, se obtuvieron muestras de sangre del seno retroorbital bajo anestesia (ketamina, 80mg/kg PRO-SER SA, y xilacina, 12mg/kg PRO-SER SA) para la medición de glucemia (Accutrend Glucose Meter, Roche Diagnostics, Mannheim, Alemania), colesterol total (Wiener Colestat enzimático, Wiener Lab, Rosario, Argentina) y trigliceridemia (TG Color GPO/PAP AA, método enzimático, Wiener Lab, Rosario, Argentina) utilizando métodos espectrofotométricos (Automatic Analyzer Abbott Spectrum CCX).
Luego del sacrificio se extrajo y se disecó el lecho vascular mesentérico de los animales de todos los grupos, el cual fue transferido a cápsulas de Petri con solución de Krebs de la siguiente composición: NaCl, 118mM; KCl, 4,7mM; MgSO4, 1,2mM; NaH2PO4, 1,0mM; CaCl2, 2,6mM; NaHCO3, 25,0mM; glucosa, 11,1mM. Los tejidos fueron incubados en esa solución durante 60min a 37°C. Con el objeto de medir la liberación de prostanoides, al término del período de incubación, los medios fueron acidificados a pH3,50 con ácido fórmico 1M y extraídos 3 veces con 2 volúmenes de cloroformo. Los extractos clorofórmicos fueron mezclados y evaporados a sequedad.
La medición de los prostanoides se llevó a cabo mediante HPLC en fase reversa con una columna C18 (BBS Hypersil C18, Thermo Electron Co., Bellefonte, PA, EE.UU.), utilizando como fase móvil H3PO4 1,7Mm 67,2:acetonitrilo32,8V/V, con un flujo de 1ml·min–1 y midiendo la absorbancia UV a 218nm. Las muestras fueron resuspendidas en 0,15ml de fase móvil e inyectadas en el sistema de HPLC. Junto con las muestras se corrieron estándares auténticos de los siguientes prostanoides: PG6-cetoF1α (metabolito estable de PGI2), PGE2 y TXB2 (metabolito estable de TXA2) (Sigma Chemical Co., Saint Louis, MO, EE.UU.) y se llevó a cabo un análisis comparativo para determinar las cantidades de prostanoides presentes en las muestras. Todos los valores fueron corregidos por ensayos de recuperación, los cuales se determinaron por estándares paralelos. Los resultados fueron expresados como ng de prostanoide por mg de peso de tejido húmedo.
Análisis estadísticoTodos los datos están expresados como media±EEM. Se realizaron comparaciones entre grupos por análisis de la varianza (ANOVA) de una vía. Se aplicó el postest de Tukey. Un valor de p<0,05 fue considerado estadísticamente significativo.
ResultadosLos valores de peso corporal final mostraron que en las ratas diabéticas inducidas por STZ el peso disminuyó significativamente con respecto a las ratas del grupo C (295±6 vs. 372±6; p<0,01). En los animales diabéticos, el tratamiento con vanadilo produjo una reducción significativa de este parámetro (183±11 vs. D, p<0,01), mientras que el tratamiento con tungstato lo incrementó (394±23 vs. D, p<0,01) hasta valores similares al grupo C. Ninguno de los tratamientos modificó significativamente el peso corporal de los animales control.
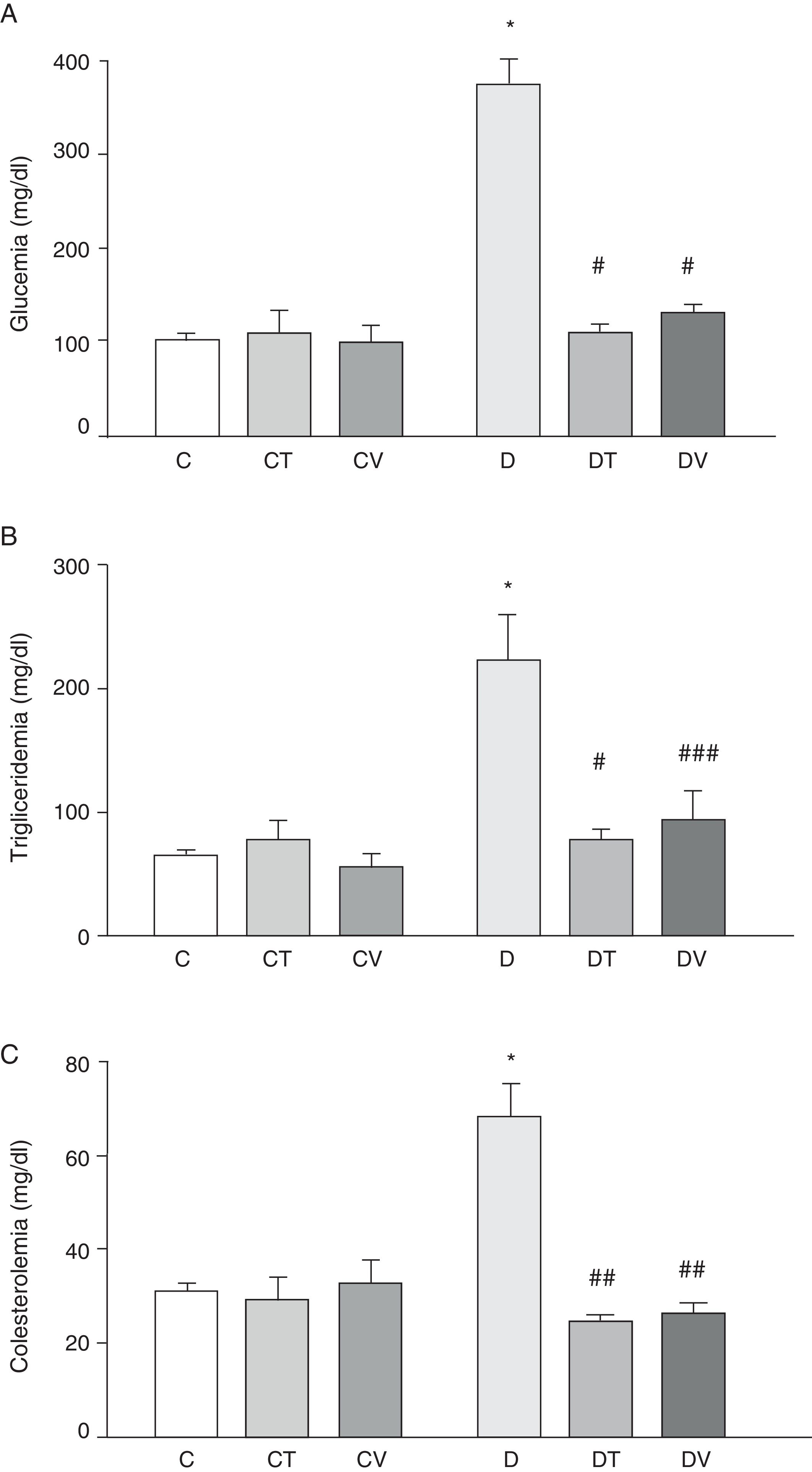
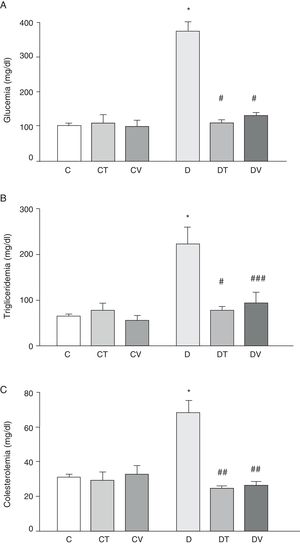
La figura 1 muestra los datos plasmáticos: glucemia, trigliceridemia y colesterolemia. La diabetes por STZ incrementó significativamente los valores de dichos parámetros (p<0,001 vs. C). Ambos tratamientos, con tungstato y vanadilo, fueron capaces de normalizar los valores plasmáticos de glucemia (p<0,001 vs. D) y trigliceridemia (p<0,001 y p<0,05 vs. D, respectivamente), a la vez que revirtieron el aumento de los niveles de colesterol (p<0,01 vs. D). Cabe mencionar que ni tungstato ni vanadilo modificaron los niveles plasmáticos de glucosa, triglicéridos y colesterol total en animales control.
Parámetros metabólicos: A) glucemia (mg/dl), B) trigliceridemia (mg/dl) y C) colesterolemia (mg/dl) en ratas control (C), tratadas con tungstato (CT), tratadas con vanadilo (CV), diabéticas (D), diabéticas-tungstato (DT) y diabéticas-vanadilo (DV). Los resultados están expresados como media±EEM.
*p<0,001 vs. C; #p<0,001 vs. D; ##p<0,01 vs. D; ###p<0,05 vs. D.
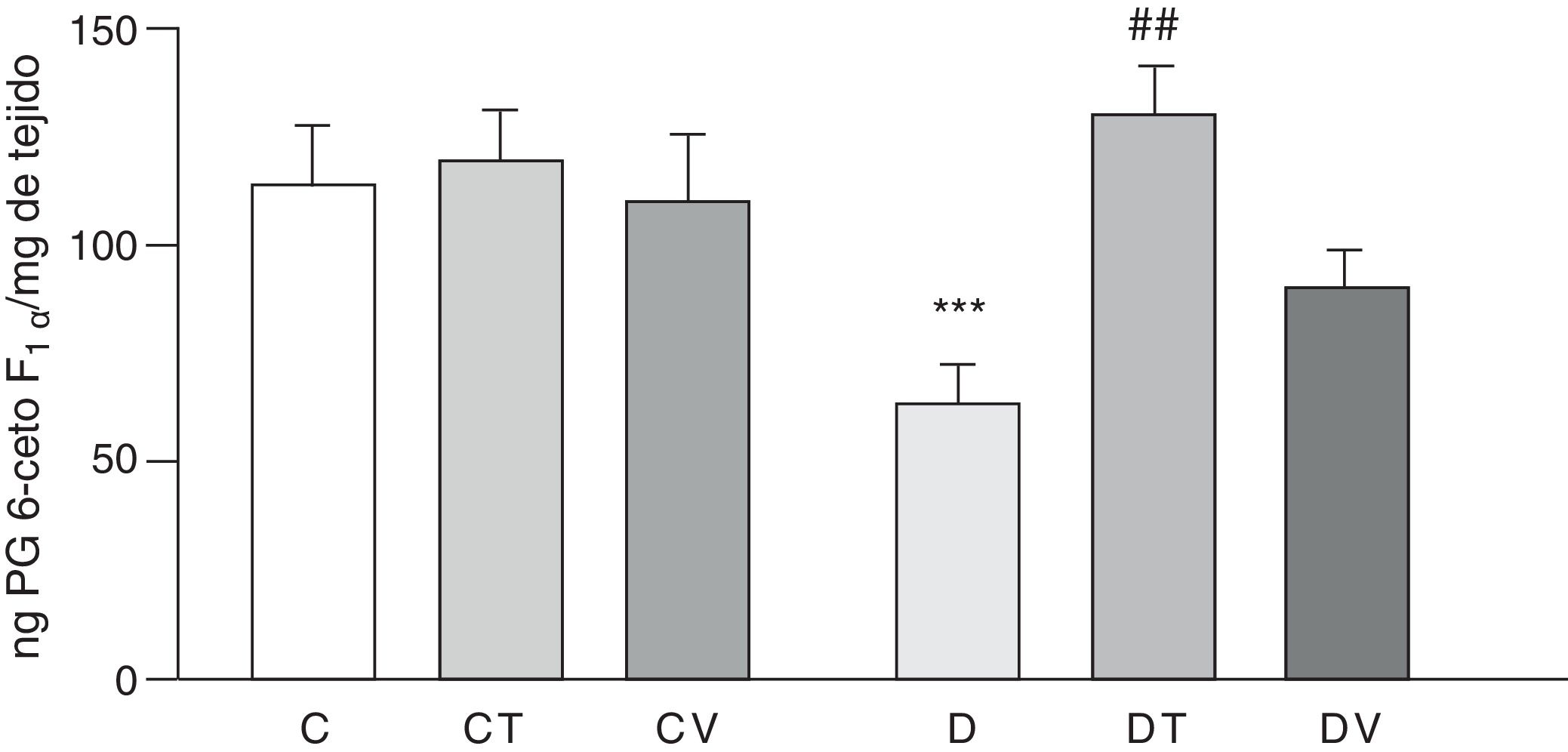
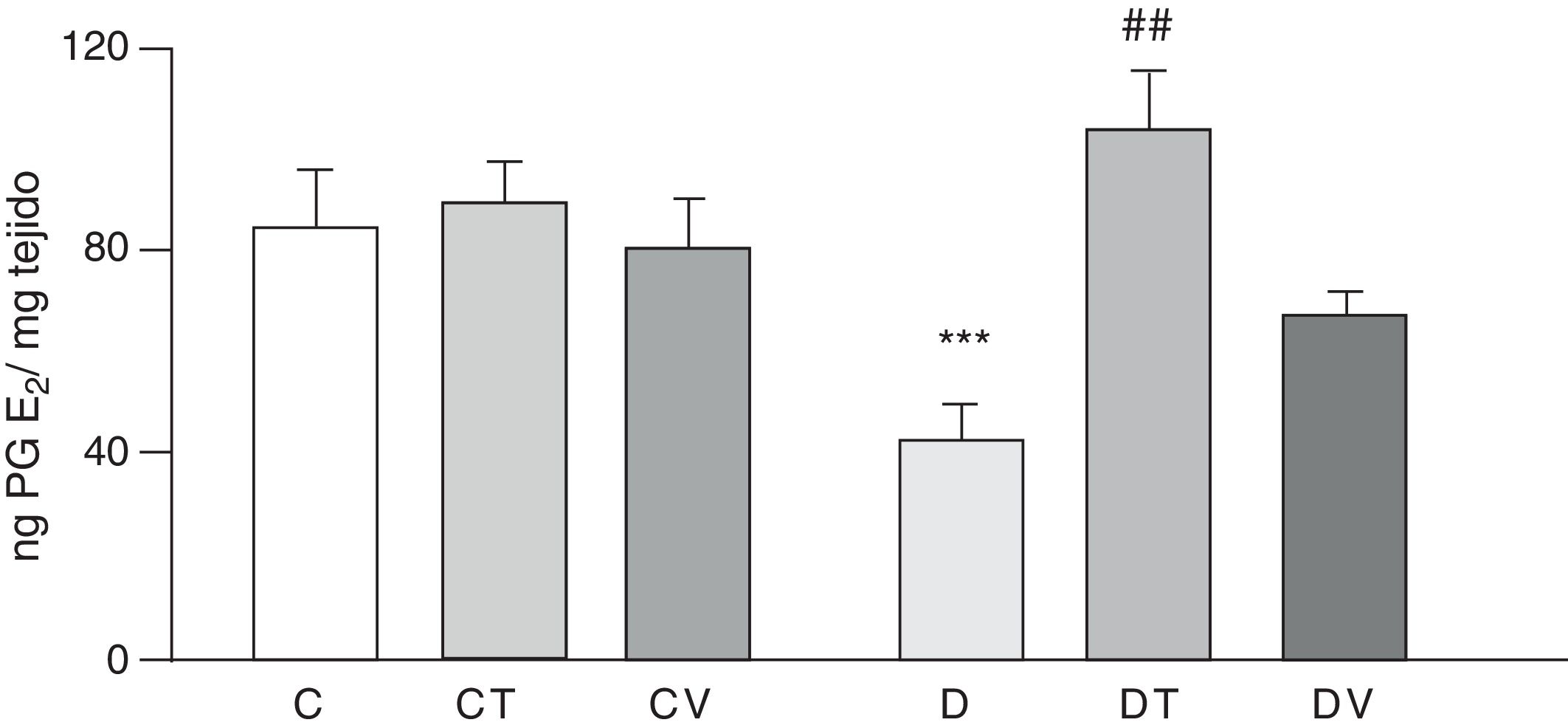
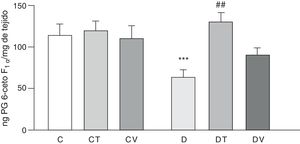
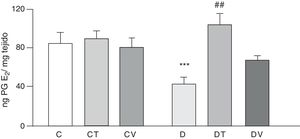
Las figuras 2 y 3 muestran los efectos a 30 días del tratamiento con STZ en ausencia y presencia de los tratamientos con tungstato y con vanadilo sobre la liberación basal de los prostanoides vasodilatadores PG6-cetoF1α (metabolito estable de PGI2) y PGE2, respectivamente, desde lechos mesentéricos al medio de incubación. En ratas diabéticas se observa una reducción significativa en la liberación de ambos prostanoides respecto del grupo C (p<0,05 vs. C), no observándose diferencias en los grupos CT o CV. El tratamiento con tungstato de sodio en ratas diabéticas fue capaz de revertir en forma significativa la reducción de ambos prostanoides (p<0,05 vs. D), efecto que no se observó bajo el tratamiento con sulfato de vanadilo.
Liberación de PG6-cetoF1α por el lecho mesentérico.
Liberación de PG6-cetoF1α (ng·mgtejido−1) de ratas control (C), tratadas con tungstato (CT), tratadas con vanadilo (CV), diabéticas (D), diabéticas-tungstato (DT) y diabéticas-vanadilo (DV). Los resultados están expresados como media±EEM.
***p<0,05 vs. C; ##p<0,01 vs. D.
Liberación de PGE2 por el lecho mesentérico.
Liberación de PGE2 (ng·mgtejido−1) del lecho mesentérico de ratas control (C), tratadas con tungstato (CT), tratadas con vanadilo (CV), diabéticas (D), diabéticas-tungstato (DT) y diabéticas-vanadilo (DV). Los resultados están expresados como media±EEM.
***p<0,05 vs. C; ##p<0,01 vs. D.
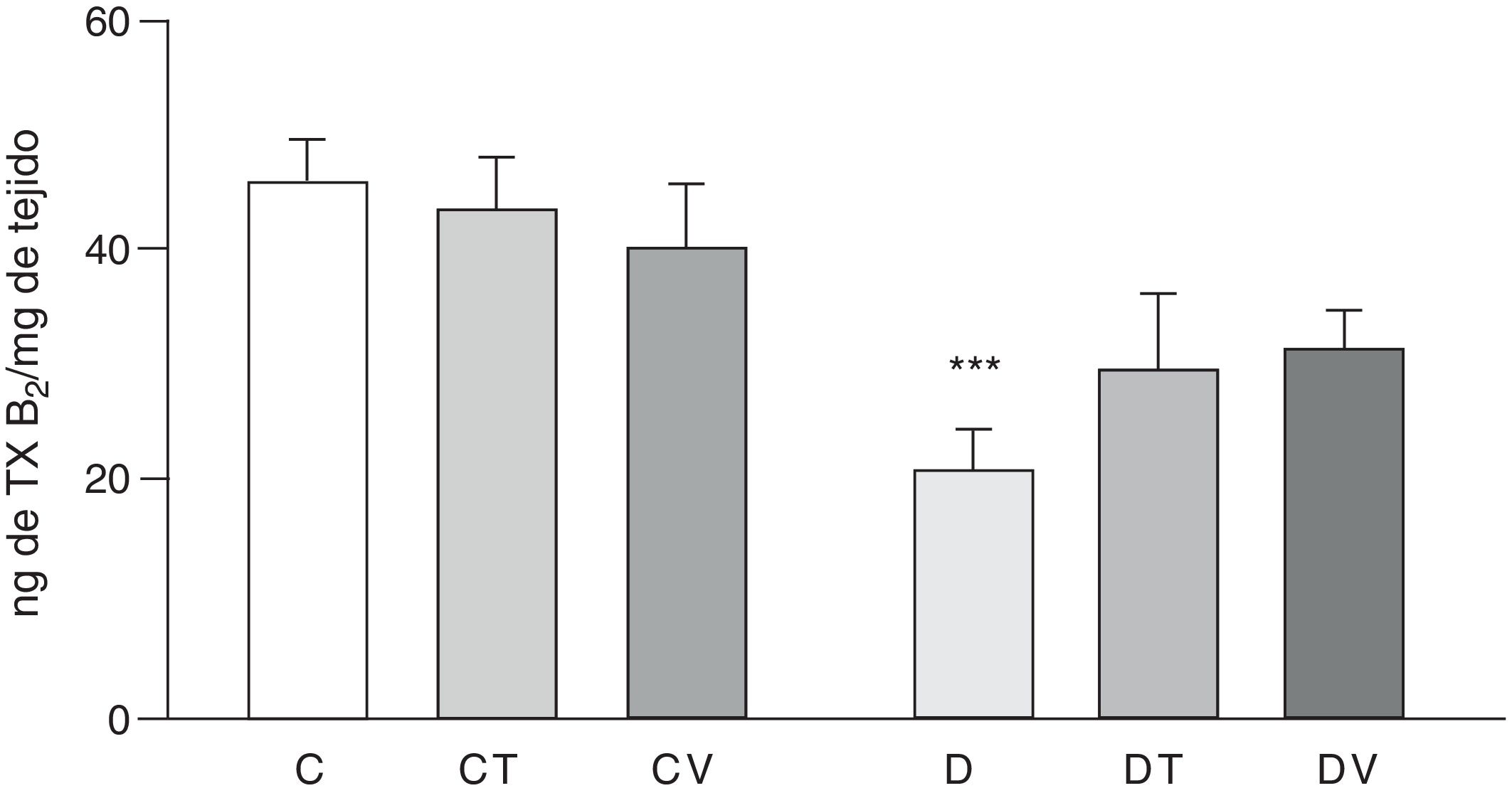
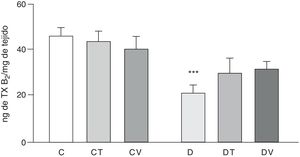
Los efectos sobre la liberación del vasoconstrictor TXB2 (metabolito estable del TXA2) del lecho vascular mesentérico se muestran en la figura 4. En comparación con el grupo C, las ratas con diabetes inducida por STZ presentaron una disminución significativa en la liberación (p<0,05 vs. C), efecto que no fue modificado con el tratamiento con tungstato ni con vanadilo en animales diabéticos. Ninguno de los tratamientos con estos metales de transición modificó la producción de dicho prostanoide en animales controles.
Liberación de TXB2 por el lecho mesentérico.
Liberación de TXB2 (ng·mgtejido−1) del lecho mesentérico de ratas control (C), tratadas con tungstato (CT), tratadas con vanadilo (CV), diabéticas (D), diabéticas-tungstato (DT) y diabéticas-vanadilo (DV). Los resultados están expresados como media±EEM.
***p<0,05 vs. C.
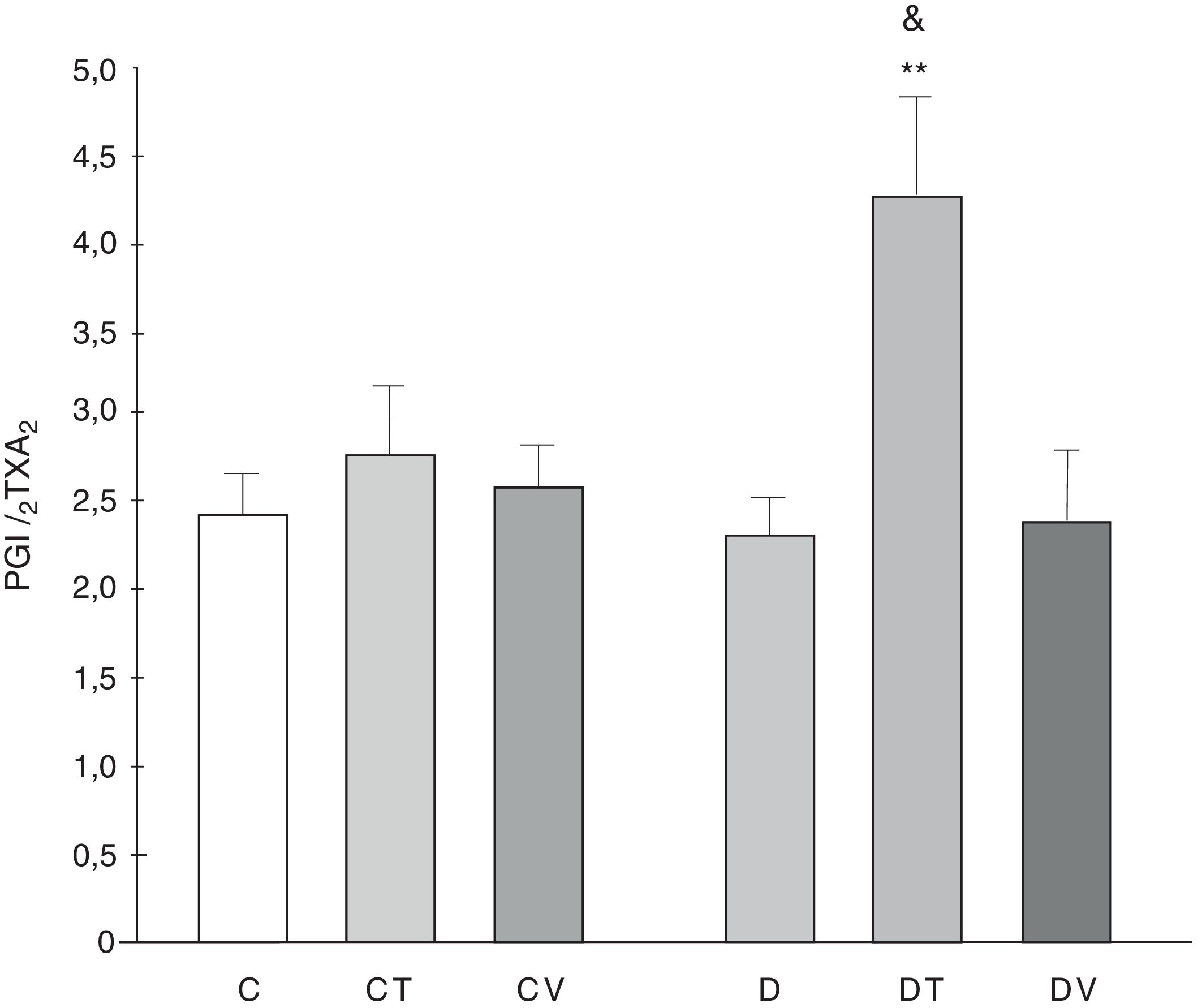
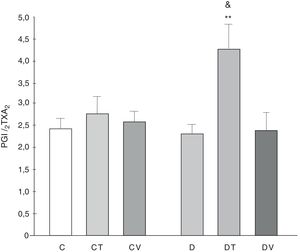
La relación de liberación PGI2/TXA2 (medida como sus metabolitos estables) no fue modificada por la diabetes, aunque el tratamiento con tungstato lo incrementó significativamente (p<0,01 vs. C, fig. 5).
Relación de la liberación PGI2/TXA2 por el lecho mesentérico.
Relación de la liberación PGI2/TXA2 por el lecho mesentérico en ratas control (C), tratadas con tungstato (CT), tratadas con vanadilo (CV), diabéticas (D), diabéticas-tungstato (DT) y diabéticas-vanadilo (DV). Los resultados están expresados como media±EEM.
**p<0,01 vs. C; &p<0,05 vs. CT.
El presente estudio muestra que tanto el tungstato de sodio como el sulfato de vanadilo administrados por vía oral revirtieron la aparición de alteraciones metabólicas, pero solo el tungstato de sodio pudo mantener la liberación normal en el lecho vascular de prostanoides vasodilatadores como la PGI2 y la PGE2 alterados por el estado diabético.
Una posible explicación de la falta de efecto del sulfato de vanadilo podría ser la dosis seleccionada. No obstante, la dosis utilizada coincide con la empleada por otros autores6,9-16, y por otra parte, dicha dosis produce efectos equivalentes sobre el metabolismo lipídico y glucídico respecto al sulfato de vanadilo, como demostramos en el presente trabajo y en un trabajo previamente publicado8. En un modelo de sobrecarga de fructosa, se utilizó una dosis menor de sulfato de vanadilo (100mg/l) que tampoco fue capaz de alterar la producción de prostanoides. En el presente trabajo, aun incrementando la dosis previamente utilizada de 100 a 125mg/l, y sin acentuar los efectos sobre el metabolismo lipídico y glúcido, tampoco fue capaz de alterar la producción de prostanoides. Por otra parte, se ha considerado evitar el uso de dosis mayores de sulfato de vanadilo con la finalidad de evitar la toxicidad del mismo11.
En referencia al peso corporal, se puede observar que el tratamiento con sulfato de vanadilo lo redujo significativamente en animales diabéticos. Este efecto podría atribuirse a una menor ingesta de alimento más que a un efecto tóxico adicional17. Esta reducción de la ingesta se debería a un efecto anorexígeno por parte del vanadilo a nivel del sistema nervioso central, como fue descripto previamente18.
En nuestro modelo de diabetes mellitus inducida por STZ encontramos elevados los valores de glucemia, trigliceridemia y colesterolemia total. Los tratamientos con tungstato de sodio y con sulfato de vanadilo revirtieron estas alteraciones. Estos resultados coinciden parcialmente con los de Nagareddy et al.19, quienes reportaron que en ratas diabéticas por STZ el tratamiento con tungstato producía una reducción significativa de la glucosa y triglicéridos plasmáticos. Ahmed El-Shazly et al.20 encontraron que el sulfato de vanadilo normalizó los niveles plasmáticos de glucosa y triglicéridos pero no de colesterol total, aunque sí encontraron que el complejo de hidrocloruro de vanadilo (II) tiamina fue más efectivo para revertir los 3 parámetros en ratas diabéticas por STZ.
En lo referido a los mecanismos involucrados en las acciones observadas de estos agentes, se ha sugerido que el tratamiento con tungstato podría ser capaz de regenerar una población estable y funcional de células beta, lo cual conduciría a la normoglucemia21. En la rata diabética por STZ, la principal acción del tungstato parece ser la restauración del metabolismo hepático de la glucosa y del aumento de la capacidad del hígado de utilizarla a través de glucólisis y gluconeogénesis. Más aún, el tungstato también disminuye el potencial del hígado para producir glucosa mediante la reducción de la expresión de la principal enzima clave en la gluconeogénesis, la fosfoenolpiruvato carboxiquinasa22.
Por otra parte, los compuestos de vanadio podrían mimetizar las acciones de la insulina a través de vías de señalización alternativas, las que incluirían la inhibición de la fosfotirosina fosfatasa y la interacción entre dos receptores de tirosina quinasa no insulínicos17. Además, se ha sugerido que el sulfato de vanadilo podría regenerar células beta en ratas con diabetes experimental23. También se ha reportado que el tratamiento con vanadio estimula la translocación de GLUT4 mediada por insulina en ratas diabéticas por STZ24. Por otra parte, el factor de transcripción lipogénico (SREBP-1c), regulador de las expresiones génicas de las enzimas para la síntesis de ácidos grasos y de triglicéridos, es inducido por la insulina y regulado negativamente en ratas diabéticas por STZ. En este sentido, se ha descripto que el tratamiento con sulfato de vanadilo aumenta significativamente la expresión de SREBP-1c en comparación con el grupo diabético20, lo que podría explicar en parte los efectos sobre los niveles de triglicéridos y colesterol observados en nuestro modelo.
La progresión de las complicaciones vasculares en la diabetes se ha asociado con una disminución en la proporción vascular de PGI2 y TXA225. Tal como se reportó previamente5, la diabetes por STZ durante 30 días reduce significativamente la liberación de los prostanoides vasodilatadores PGI2 y PGE2, así como del vasoconstrictor TXA2 en el lecho vascular mesentérico. En nuestros experimentos, únicamente el tratamiento con tungstato de sodio fue capaz de incrementar y normalizar la producción de PGI2 y PGE2 disminuida por la diabetes a valores similares a las ratas control. Sin embargo, el tratamiento no fue efectivo para restaurar la liberación de TXA2 en las ratas diabéticas. Este efecto diferencial llevó a un incremento de la relación PGI2/TXA2, lo cual es un indicador de buen funcionamiento endotelial.
Los mecanismos involucrados en este efecto aún no se han dilucidado. Sin embargo, una mayor producción de sustancias reactivas al oxígeno (ROS) por hiperglucemia se reconoce como una de las principales causas de complicaciones diabéticas26. Además, se ha estudiado extensamente la influencia del estrés oxidativo sobre las alteraciones vasculares que ocurren en la diabetes tipo 127, y en esta condición la producción excesiva de ROS puede inhibir la producción de óxido nítrico (NO) y PGI228. En este sentido, De la Cruz et al.29 han demostrado una actividad reducida de la NO sintasa vascular en animales diabéticos por STZ, al igual que los niveles de nitrito/nitrato en plasma, utilizado como indicador indirecto de la producción global de NO. Por su parte, Heidari et al.30 describieron los efectos protectores del tungstato de sodio sobre el estrés oxidativo en ratas diabéticas, demostrando elevaciones significativas de los niveles de especies reactivas del ácido tiobarbitúrico en sangre y páncreas de ratas diabéticas en comparación con ratas control, y que la administración de tungstato de sodio fue capaz de disminuir significativamente dichos niveles. De la misma manera, se ha reportado que la administración del tungstato de sodio mejora las propiedades biomecánicas óseas al restablecer la actividad de enzimas antioxidantes como glutatión peroxidasa, catalasa y superóxido dismutasa en fémur de ratas diabéticas31. Otro estudio demostró las propiedades antioxidantes del sulfato de vanadilo. En este estudio se comprobó que en el estómago de ratas diabéticas por STZ las actividades de las enzimas catalasa, superóxido dismutasa, glutatión reductasa, glutatión peroxidasa, glutatión S-transferasa, anhidrasa carbónica, glucosa 6-fosfato deshidrogenasa y lactato deshidrogenasa se encontraban incrementadas. En estas condiciones, el tratamiento con sulfato de vanadilo en el agua de bebida por 60 días se asoció a una reducción significativa de las actividades de la glutatión reductasa, glutatión peroxidasa y glutatión S-transferasa32.
Por otro lado, es un hecho bien conocido que el tungstato es un inhibidor efectivo de la xantina oxidasa, una enzima involucrada en la formación de radicales libres33. Consideradas en conjunto, estas observaciones podrían explicar de manera parcial las alteraciones en la liberación vascular de prostanoides en la diabetes experimental y su reversión por el tungstato de sodio. Por el contrario, el tratamiento con sulfato de vanadilo no modificó la liberación de prostanoides en el lecho mesentérico en ninguno de los grupos experimentales. Misurski et al.34 observaron que el efecto de vasorrelajación mediada por ortovanadato de sodio en el lecho vascular perfundido de ratas Sprague-Dawley estaba implicado en el reclutamiento tanto del factor hiperpolarizante derivado del endotelio como del NO derivado del endotelio y no de los eicosanoides vasodilatadores.
La ciclooxigenasa (COX) es una enzima que transforma el ácido araquidónico en prostaglandina H2, la cual luego es convertida en diferentes PG y TX por sintetasas respectivas. De las isoformas más caracterizadas, la COX-1 es una enzima constitutiva cuya expresión raramente está sujeta a cambios35. La isoforma COX-2, en cambio, es una enzima adaptativa sujeta a una compleja regulación de su expresión y actividad. Al respecto se ha observado que la diabetes se asocia a una alteración en la actividad vascular de la COX que conduce a una alteración en la producción de prostanoides36. En este sentido, se ha reportado que el efecto vasodilatador del ácido araquidónico a través de la PGI2 en arterias mesentéricas de perros no diabéticos se invierte a un efecto vasoconstrictor mediado por TXA2 en animales diabéticos37. También se ha demostrado en ratones diabéticos (db/db) un incremento de los niveles de COX-2 y un aumento en la producción de TXA2 que se acompañan de un incremento del tono vascular a nivel de la aorta y las arteriolas del músculo esquelético38,39. Adicionalmente, se demostró una mayor expresión de COX-2 en placas ateroscleróticas de pacientes diabéticos. Contrariamente, a nivel de las arteriolas coronarias de pacientes diabéticos, se observó un incremento en la expresión vascular de COX-2 que se asoció a una producción aumentada de las PG vasodilatadoras PGE2 y PGI240. Estos antecedentes indican una clara asociación entre la condición diabética con alteraciones en la expresión y actividad de la COX-2, que podrían explicar las alteraciones en la producción de prostanoides en el lecho vascular mesentérico observado en ratas diabéticas por STZ. Asimismo, el incremento en la síntesis de las PG puede deberse no solo a cambios en la actividad de la COX, sino también en la cantidad disponible de ácido araquidónico. En este sentido, los compuestos de vanadio pueden activar la fosfolipasa A2, incrementando la liberación de ácido araquidónico y la producción de PGE2 o TXA241. Por otra parte, otro estudio ha demostrado que a concentraciones de 10mM de sal orgánica, ortovanadato de sodio, no se observaron modificaciones en la actividad de la COX-2 en un cultivo celular de macrófagos42. Si bien se ha descripto en experimentos in vitro que los compuestos de vanadio incrementan la actividad o expresión proteica de COX-2, las concentraciones a las cuales se observa dicho efecto son altamente tóxicas en un modelo in vivo, dificultando alcanzar dichas acciones sin resultar en hipoglucemia, daño hepático, falla renal aguda severa y disfunción de la respiración celular43,44. Por último, se ha demostrado que la actividad de la isoforma COX-1 no se ve afectada por los compuestos de vanadio45.
En conclusión, los presentes experimentos muestran que, en nuestras condiciones de trabajo, el tungstato de sodio parece ser más eficaz que el sulfato de vanadilo para revertir las condiciones metabólicas y vasculares asociadas al tratamiento por STZ.
Conflicto de interesesNinguno.
Este trabajo fue financiado con fondos provenientes de los siguientes subsidios: Universidad de Buenos Aires (UBACyT 20020130200105BA y UBACYT 20020130100019BA) (2014-2017).