La lisil oxidasa (LOX) contribuye al ensamblaje de las fibras de colágeno y elastina de la matriz extracelular (MEC). Hemos determinado las consecuencias de la sobreexpresión vascular de LOX sobre la estructura de la MEC y su contribución al estrés oxidativo.
MétodosLos estudios se desarrollaron en ratones que sobreexpresan la LOX (Tg) específicamente en células musculares lisas vasculares (CMLV). Se realizaron análisis por PCR a tiempo real, tinción de rojo sirio, producción de H2O2 y actividad NADPH oxidasa. Se caracterizaron las fenestras de la lámina elástica interna mediante microscopia confocal.
ResultadosLas CMLV de ratones transgénicos presentaron niveles de actividad LOX superiores a los de animales control. En consonancia, las células transgénicas depositaron más fibras de elastina organizada y sus sobrenadantes indujeron un mayor ensamblaje de colágeno en ensayos in vitro. El nivel de colágeno maduro fue superior en la pared vascular de ratones Tg, que presentaban una menor área de las fenestras y un aumento de la expresión de la fibulina-5. La producción vascular de H2O2 y la actividad NADPH oxidasa fueron superiores en los ratones transgénicos. La incubación de CMLV con catalasa atenuó el incremento en la deposición de fibras de elastina madura inducido por la transgénesis de LOX.
ConclusionesLa sobreexpresión de la LOX en CMLV se asocia a una alteración de la estructura vascular del colágeno y la elastina. La LOX podría constituir una nueva fuente de estrés oxidativo que participaría en la alteración estructural de la MEC y podría contribuir al remodelado vascular.
Lysyl oxidase (LOX) participates in the assembly of collagen and elastin fibres. The impact of vascular LOX over-expression on extracellular matrix (ECM) structure and its contribution to oxidative stress has been analysed.
MethodsStudies were conducted on mice over-expressing LOX (Tg), specifically in smooth muscle cells (VSMC). Gene expression was assessed by real-time PCR analysis. Sirius Red staining, H2O2 production and NADPH oxidase activity were analysed in different vascular beds. The size and number of fenestra of the internal elastic lamina were determined by confocal microscopy.
ResultsLOX activity was up-regulated in VSMC of transgenic mice compared with cells from control animals. At the same time, transgenic cells deposited more organised elastin fibres and their supernatants induced a stronger collagen assembly in in vitro assays. Vascular collagen cross-linking was also higher in Tg mice, which showed a decrease in the size of fenestrae and an enhanced expression of Fibulin-5. Interestingly, higher H2O2 production and NADPH oxidase activity was detected in the vascular wall from transgenic mice. The H2O2 scavenger catalase attenuated the stronger deposition of mature elastin fibres induced by LOX transgenesis.
ConclusionsLOX over-expression in VSMC was associated with a change in the structure of collagen and elastin fibres. LOX could constitute a novel source of oxidative stress that might participate in elastin changes and contribute to vascular remodelling.
La lisil oxidasa (LOX) cataliza una de las etapas clave en la síntesis y estabilización de la matriz extracelular (MEC)1,2. Esta enzima es una aminooxidasa dependiente de cobre que participa en el ensamblaje covalente de las fibras de colágeno y elastina de la MEC. Concretamente, la LOX cataliza la desaminación oxidativa de residuos de lisina e hidroxilisina, lo que da lugar a la formación de peptidil semialdehídos altamente reactivos que condensan entre sí formando enlaces tanto intramoleculares como intermoleculares, una reacción que genera H2O2 como subproducto1.
La actividad LOX condiciona las propiedades mecánicas y estructurales de los tejidos conectivos y su alteración se ha vinculado con múltiples procesos patológicos, entre ellos cáncer y enfermedades cardiovasculares2,3. Estudios recientes sugieren que la actividad LOX y el mayor ensamblaje en las fibras de colágeno asociado podrían jugar un papel fundamental en la rigidez vascular4. En lo que respecta a la elastina, la alteración en su estructura determina la mecánica vascular tanto en arterias de gran calibre como en las de pequeño calibre5-7 y contribuye, al menos en parte, al aumento de la rigidez vascular en la hipertensión8,9, si bien existen menos evidencias del papel de la LOX en dicho proceso.
Sorprendentemente, además de su función meramente estructural, la LOX se ha implicado en el control de múltiples procesos celulares, entre los que destacan la diferenciación celular, la migración, la transformación y la regulación de la expresión génica1,2. Es interesante señalar que algunas de estas funciones biológicas, tales como el control de la migración celular y de la quimiotaxis de las células musculares lisas de la pared vascular (CMLV), se han vinculado con el aumento en la producción de H2O2 derivado de la actividad LOX10,11. Sin embargo, no se ha establecido si la LOX podría contribuir al estrés oxidativo vascular ni su posible impacto sobre la estructura vascular. Nuestros resultados obtenidos en un modelo de ratón transgénico que sobreexpresa la LOX específicamente en CMLV muestran que la sobreexpresión de LOX se asocia a un mayor estrés oxidativo en la pared vascular que contribuye a la alteración de la estructura de la elastina, lo que podría tener importantes repercusiones fisiopatológicas.
Material y métodosModelo animalLos estudios se realizaron en un modelo de ratón transgénico que sobreexpresa la LOX en CMLV (Tg) en un fondo genético C57BL/6J12. Como controles se incluyeron ratones C57BL/6J hermanos de camada de la misma edad (3meses). Los animales fueron mantenidos en un ambiente libre de patógenos bajo condiciones estándar de iluminación (ciclos de 12h de luz/oscuridad) y temperatura (21±1°C) en la unidad de experimentación animal (CSIC-ICCC, Barcelona, España) con acceso ad libitum a bebida y alimento durante todo el procedimiento. La investigación fue realizada de acuerdo con los principios y las directrices establecidas por la Sociedad Americana de Fisiología para la investigación animal, y todos los procedimientos fueron aprobados por el Comité Ético del Centro de Investigación Cardiovascular de Barcelona, de acuerdo con la Política Española de Protección de Animales RD53/2013, que cumple con la Directiva de la Unión Europea 2010/63/UE relativa a la protección de animales de experimentación.
Los animales se sacrificaron por inhalación de CO2 y los distintos lechos vasculares se aislaron, se limpiaron para eliminar el exceso de grasa y tejido conectivo y se procesaron para los distintos análisis.
Organización de la lámina elástica internaSe utilizaron segmentos de arterias mesentéricas de resistencia presurizados con un miógrafo de presión (45mmHg) fijados con paraformadehído al 4%. La organización de la elastina en la lámina elástica interna se estudió mediante microscopia confocal de fluorescencia basada en las propiedades autofluorescentes de la elastina (longitud de onda de excitación: 488nm; longitud de onda de emisión: 500-560nm) tal y como se describió previamente5. Los experimentos se realizaron con un microscopio confocal Leica TCS SP2 (Leica Microsistemas S.L.U., Barcelona, España). Se capturaron secciones ópticas seriadas desde la adventicia a la luz vascular (distancia entre secciones en el eje z=0,5μm) capturadas con un objetivo de inmersión en aceite ×40 zoom4. Se capturaron un mínimo de dos series de imágenes de diferentes regiones en cada segmento arterial. El análisis cuantitativo de la lámina elástica interna se realizó con el software de análisis de imagen Metamorph (Molecular Devices, Sunnyvale, CA, EE.UU.) como se describió anteriormente5. De cada serie de imágenes se reconstruyeron las proyecciones máximas individuales de la lámina elástica interna y se determinó el área y el número de fenestras.
InmunohistoquímicaLas arterias carótidas de los ratones se perfundieron con PBS, se fijaron en paraformaldehído al 4% durante 24h y se embebieron en parafina. Se prepararon secciones de 5μm de grosor con un micrótomo (Jung RM2055, Leica Microsistemas S.L.U., Barcelona, España) que se desparafinaron y rehidrataron en un gradiente de soluciones de etanol. Los portaobjetos se tiñeron con rojo picrosirio y la refringencia se visualizó mediante microscopia de luz polarizada13.
Determinación de la actividad NADPH oxidasaLa actividad NAD(P)H oxidasa se determinó en homogenados vasculares mediante un método quimioluminiscente con lucigenina. Los tejidos se homogenizaron en un tampón de lisis (50mM de KH2PO4, 1mM de ácido tetraacético de etilenglicol y 150mM de sacarosa, pH 7,4). La reacción se inició con la adición de NAD(P)H (0,1mM) a la suspensión que contenía la muestra, lucigenina (5μM) y tampón fosfato. La luminiscencia se midió en un luminómetro de placa (Auto-Lumat LB 953, Berthold Technologies GmbH, Bad Wildbad, Alemania). La lectura correspondiente al blanco del tampón se sustrajo al valor de cada lectura. La actividad NADPH oxidasa se normalizó por el contenido en proteína y se expresó relativo a los animales control (WT)14.
Determinación de la producción de H2O2La producción de H2O2 se analizó en segmentos aórticos utilizando el compuesto Amplex Red (Molecular Probes, Eugene, OR, EE.UU.) como sustrato fluorogénico de la peroxidasa de rábano (HRP). Concretamente, se añadió Amplex Red (100μM) y HRP de tipoii (0,2U/ml) al homogenado aórtico. Las lecturas de fluorescencia se realizaron por triplicado en placas de 96 pocillos a una Ex/Em de 530/580nm utilizando 50μl de muestra. El nivel de H2O2 se extrapoló de una curva patrón, se normalizó por el contenido de proteína y se expresó en porcentaje respecto a los animales control (WT).
Cultivo celularLas CMLV de aorta murina se obtuvieron mediante una modificación de la técnica de explantes tal y como se ha descrito previamente15. Brevemente, la aorta se abrió longitudinalmente, se eliminó la adventicia y el endotelio y la capa media se dividió en fragmentos de 1-2mm que se transfirieron a frascos de cultivo de 25cm2 que contenían 5ml de medio DMEM (Dulbecco's modified Eagle's medium, Gibco, Carlsbad, CA, EE.UU.) suplementado con un 10% de suero bovino fetal (Biological Industries, Kibbutz Beit-Haemek, Israel) y antibióticos (Gibco, Carlsbad, CA, EE.UU.). Las CMLV migraron de los explantes al cabo de entre 2 y 3semanas, momento en el que se extrajeron los explantes y las células se tripsinizaron y se subcultivaron de manera rutinaria. Las células se utilizaron entre los pases 3 a 6.
PCR a tiempo realEl ARN total se aisló mediante Ultraspec™ (Biotecx, Houston, TX, EE.UU.) y se realizó una transcripción reversa mediante el kit High Capacity cDNA Reverse Transcription kit (Applied Biosystems, Thermo Fisher Scientific Inc, Waltham, MA, EE.UU.) en presencia de hexámeros al azar. La cuantificación de los niveles de ARNm se realizó usando el equipo ABI PRISM 7900HT sequence detection system y oligonucleótidos y sondas específicos proporcionados por el sistema TaqMan™ gene expression assays-on-demand (Applied Biosystems, Thermo Fisher Scientific Inc, Waltham, MA, EE.UU.) para la amplificación de la FBLN5 murina (Mm00488601_m1). La gliceraldehído 3-fosfato deshidrogenasa (GAPDH; Mm99999915_g1) se usó como control endógeno. Cada muestra se amplificó por duplicado y los niveles relativos de ARNm se determinaron mediante el método de 2-ΔΔCT.
Ensayo de polimerización de colágeno in vitroLas CMLV de ratones WT y Tg se sembraron en placas de 6 pocillos (150.000células/pocillo). Al cabo de 3días se recogieron los sobrenadantes celulares y se centrifugaron a 10.000×g durante 5min a temperatura ambiente. A continuación los sobrenadantes se concentraron 4 veces mediante centrifugación con filtros Amicon Ultra 10K (Merck Millipore, Darmstadt, Alemania). El colágeno tipoi de cola de rata (150μl) se neutralizó, se añadió sobre placas con fondo de vidrio (Willco Wells B.V., Amsterdam, Holanda) y se incubó durante 40min a 37°C hasta su gelificación. Entonces se añadieron 400μl de sobrenadante concentrado sobre la superficie del gel y se incubó durante 24h a 37°C. La matriz de colágeno se visualizó mediante microscopia confocal de reflexión (Leica DMIRE2) tal y como se describió previamente16.
Actividad lisil oxidasaLa actividad LOX se determinó mediante un método fluorescente tal y como se describió previamente17. Las CMLV se sembraron a una densidad de 150.000células/pocillo en placas de 6pocillos, y al cabo de 48h el medio se reemplazó por medio RPMI sin rojo fenol (Gibco, Carlsbad, CA, EE.UU.), suero, antibióticos ni glutamina. Tras 24h la actividad LOX se cuantificó en el sobrenadante celular. Para ello, se incubó una alícuota de medio (50μl) en presencia y ausencia de β-aminopropionitrilo (BAPN; 500μM) a 37°C durante 30min con 1U/ml de HRP, 10μM de Amplex Red (Molecular Probes, Eugene, OR, EE.UU.) y 10mM de 1,5-diaminopentano en 1,2M de urea y borato sódico 0,05M a pH8,2. La reacción se detuvo en hielo y se determinó la diferencia en intensidad de fluorescencia (λ de excitación: 563nm; λ de emisión: 587nm) entre muestras con y sin BAPN17.
InmunocitoquímicaLas CMLV de ratones WT y Tg se sembraron en placas μ-Dishes de 35mm de diámetro (Ibidi, Planegg/Martinsried, Alemania) en las que se mantuvieron en crecimiento en medio completo durante 10días. El medio se cambió cada 2días. En algunos experimentos se adicionó catalasa (500U/ml). A continuación las células se fijaron con paraformaldehído al 4% y, sin permeabilización previa, se incubaron con un anticuerpo policlonal de conejo contra la elastina (Abcam, Cambridge, Reino Unido; ab21607) durante toda la noche. Tras varios lavados exhaustivos, las placas se incubaron durante 1h con un anticuerpo secundario conjugado con fluorescencia (Alexa Fluor 488 contra conejo generado en cabra; Thermo Fisher Scientific Inc, Waltham, MA, EE.UU.). Los núcleos se tiñeron con Hoechst 33342 (Thermo Fisher Scientific Inc, Waltham, MA, EE.UU.)18. Las imágenes de fluorescencia se captaron con un microscopio confocal Leica DMIRE2 (Leica Microsistemas S.L.U., Barcelona, España). El análisis cuantitativo se realizó usando el software Image J.
Análisis estadísticosLos resultados se muestran como media ±SEM. Las diferencias estadísticamente significativas se establecieron mediante t-test o ANOVA seguido del test de Bonferroni utilizando el software GraphPad Prism 5 (GraphPad Software Inc, La Jolla, CA, EE.UU.). Se consideraron significativas diferencias con p<0,05.
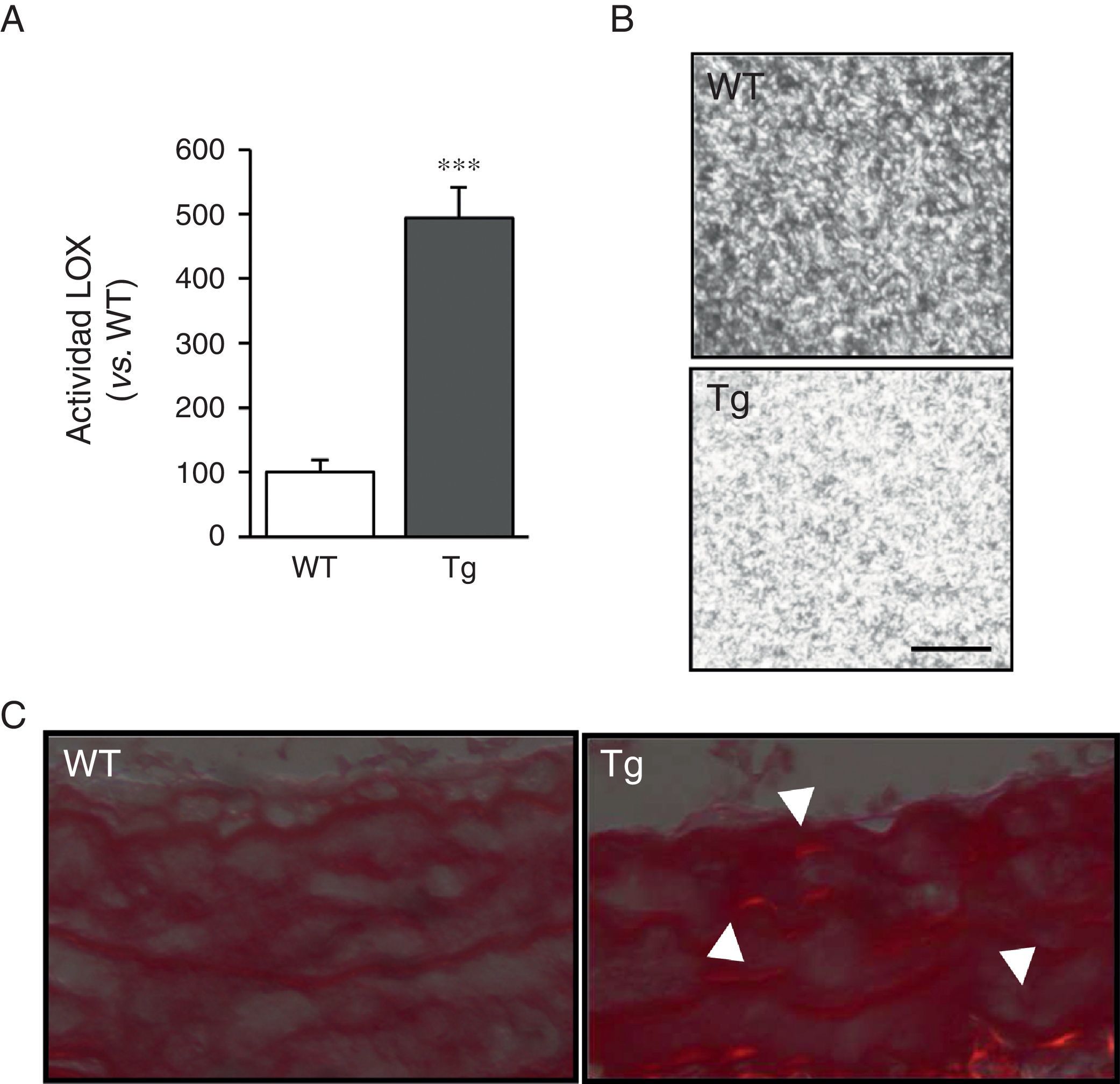
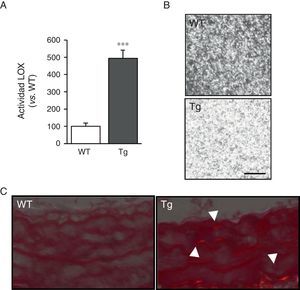
ResultadosLos ratones transgénicos para la LOX presentan una mayor actividad LOX y alteraciones en ensamblaje del colágeno vascularLas CMLV de la aorta de ratones transgénicos mostraron niveles de actividad LOX aproximadamente 4veces superiores a los de las células aisladas de ratones control (WT; fig. 1A). En concordancia, los sobrenadantes de las CMLV de animales transgénicos indujeron un mayor ensamblaje de las fibras de colágeno cuando se incubaron con colágeno tipoi soluble (fig. 1B). Asimismo, tras la tinción con rojo sirio y la visualización con luz polarizada, se observó un incremento del colágeno maduro en la capa media de la carótida de dichos animales (fig. 1C). Estos resultados indican que la elevada actividad LOX de las CMLV de los animales transgénicos promovería un mayor ensamblaje del colágeno en la pared vascular.
La transgénesis de LOX incrementa la actividad lisil oxidasa e induce el ensamblaje de las fibras de colágeno. A)Actividad LOX evaluada en el sobrenadante de CMLV procedentes de ratones transgénicos para la LOX (Tg) y animales control (WT). Los resultados se expresan como media ±SEM (*: p<0,001 vs. WT). B)Los sobrenadantes de CMLV procedentes de ratones Tg y WT se adicionaron sobre geles de colágeno de tipoi y se incubaron a 37°C durante 24h. Se muestra una imagen representativa de la visualización por microscopia confocal de reflexión de dichos geles. Las imágenes corresponden a la máxima proyección de una serie en z (18 secciones). Barra: 20μm. C)Imagen representativa de la tinción con rojo sirio visualizada bajo luz polarizada de arterias carótidas procedentes de dichos animales. Las puntas de flecha indican regiones refringentes en rojo correspondientes a fibras de colágeno gruesas y compactas (i.e., colágeno maduro).
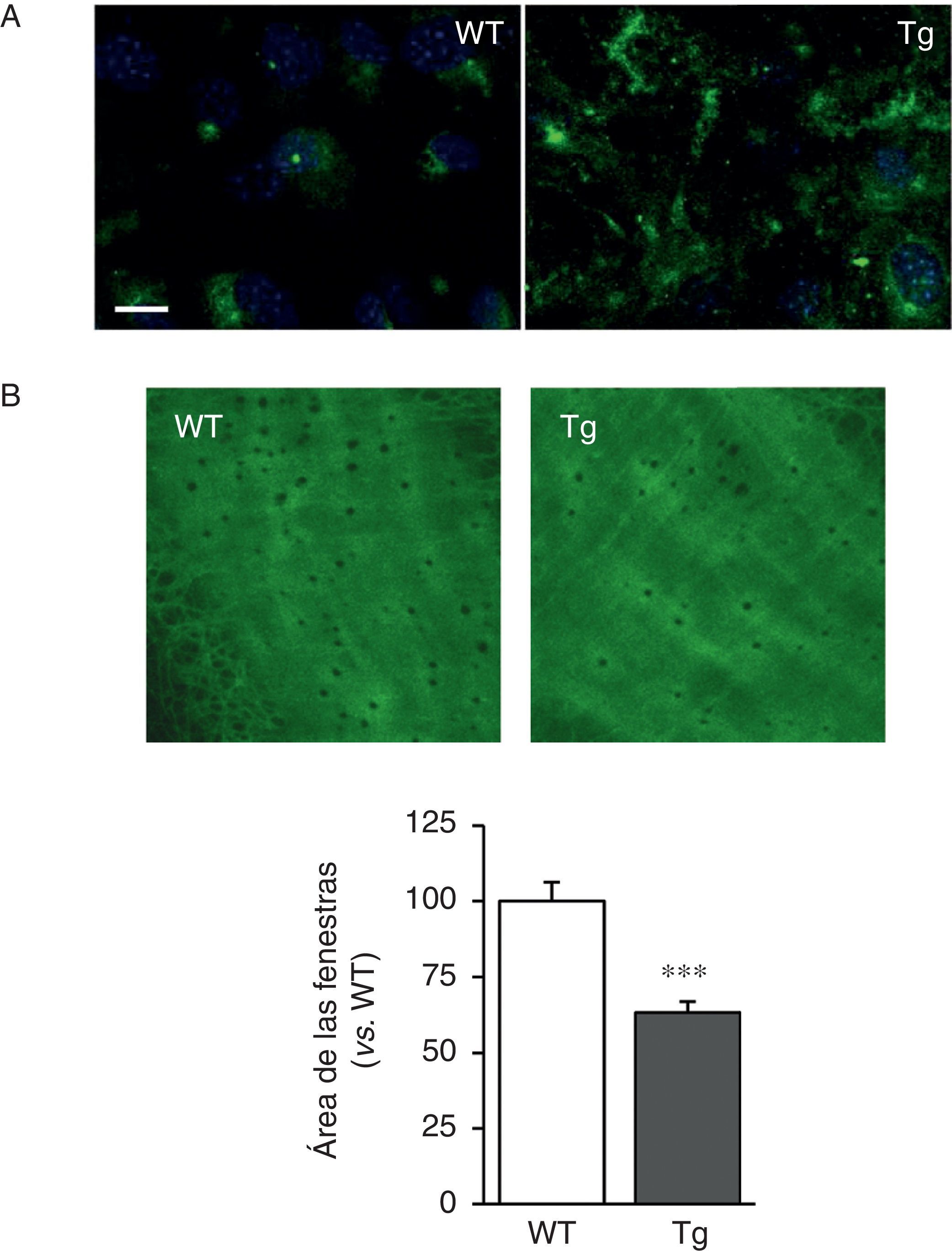
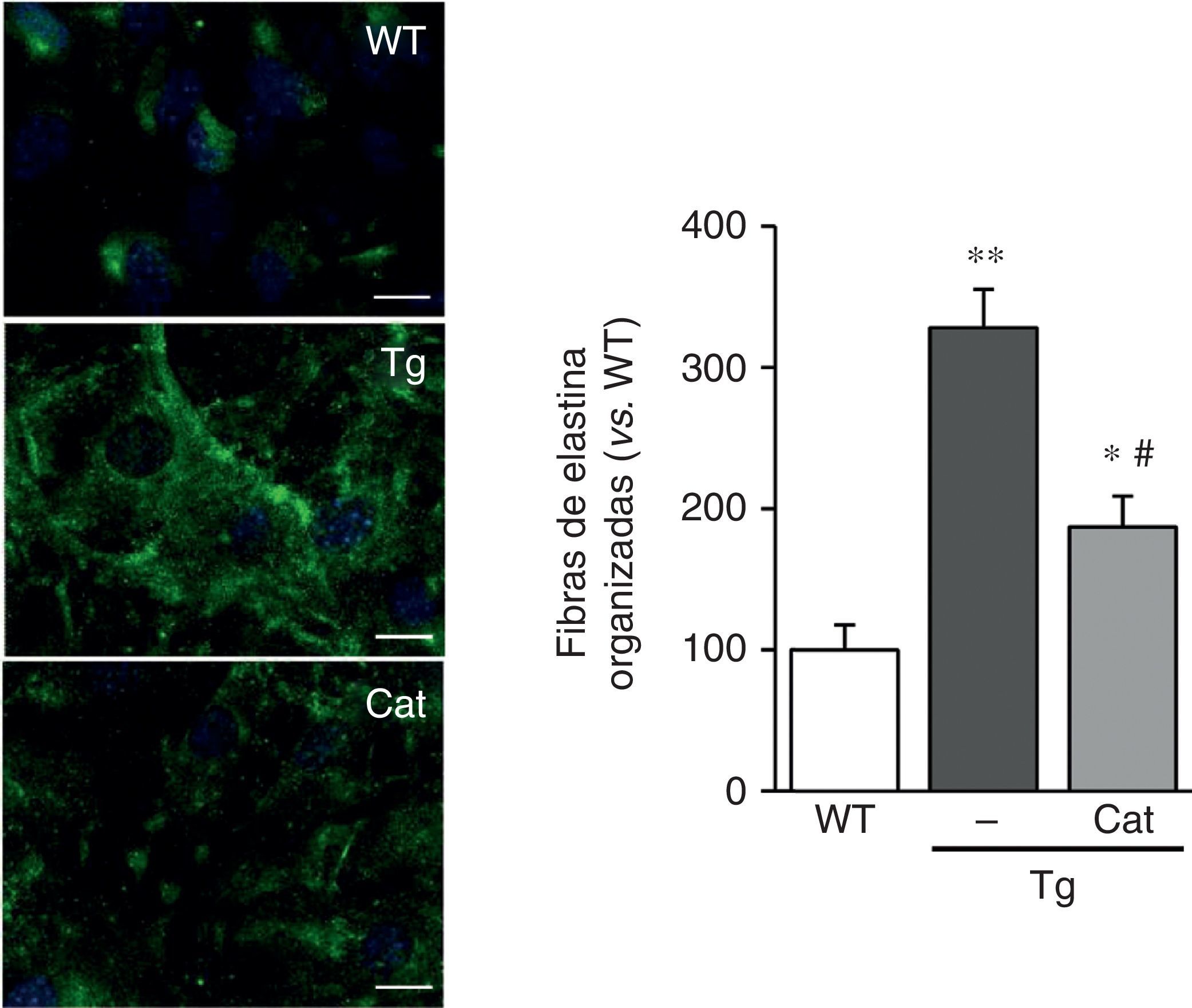
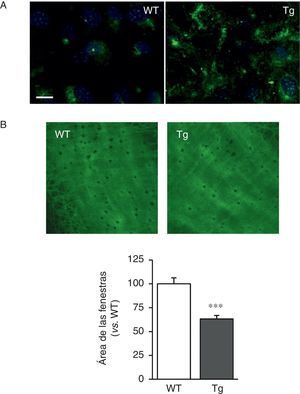
Las CMLV de los ratones transgénicos para la LOX depositaron fibras de elastina más gruesas y estructuralmente organizadas, indicativo de un alto grado de ensamblaje que las aisladas de ratones WT (fig. 2A). Asimismo, la transgénesis de LOX se asoció a una disminución en el tamaño (fig. 2B) y en el número de las fenestras de la lámina elástica interna (WT: 3.804±258; Tg: 2.550±170, n=6; p<0,01 vs. WT).
La transgénesis de LOX altera la estructura de la elastina. A)Tinción de elastina (en verde) en CMLV no permeabilizadas aisladas de ratones control (WT) y transgénicos para la LOX (Tg). Los núcleos se tiñeron con Hoechst 33342 (azul). Barra: 20μm. B)Proyecciones máximas de la lámina elástica interna de arterias mesentéricas procedentes de los animales indicados en A. Las proyecciones se obtuvieron a partir de secciones ópticas seriadas capturadas con un microscopio confocal de fluorescencia (objetivo de inmersión en aceite ×40 zoom 4). Tamaño de imagen 93,75×93,75μm). Los resultados se expresan como media ±SEM (n=4-10; *: p<0,001 vs. WT).
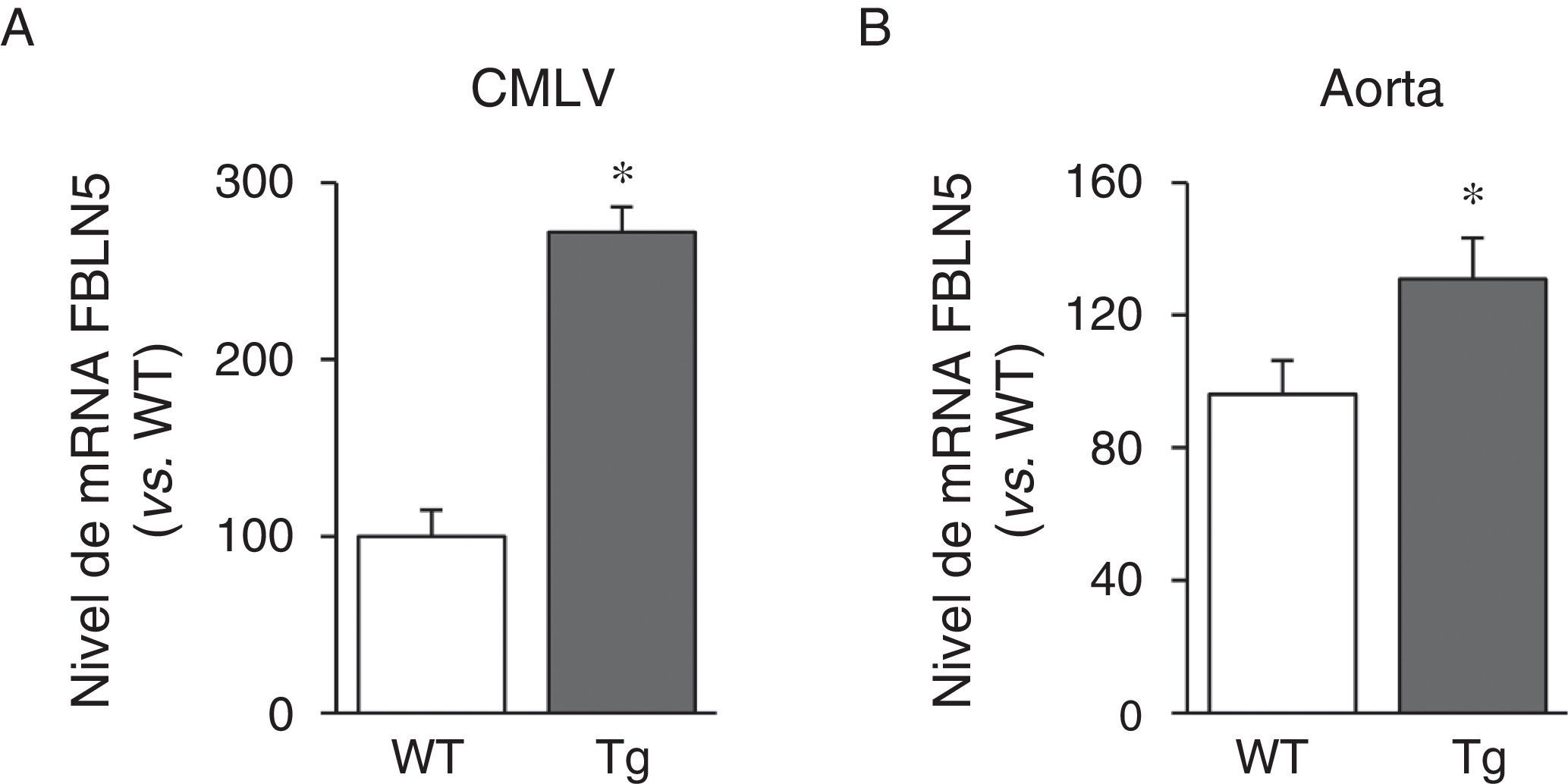
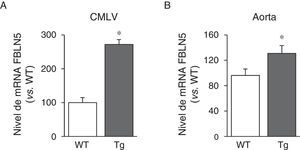
A continuación analizamos si la transgénesis de LOX podía afectar a la expresión de proteínas elastogénicas como la FBLN5. Como se observa en la figura 3A, la sobreexpresión de LOX en CMLV incrementó la expresión de la FBLN5 en aproximadamente 2,7veces en comparación con células de ratones WT. Análogamente, se detectó un incremento significativo del nivel de mRNA de la FBLN5 en la aorta de los ratones transgénicos (fig. 3B).
La sobreexpresión vascular de la LOX incrementa la expresión de la FBLN5. Nivel de mRNA de la FBLN5 evaluado mediante PCR a tiempo real en CMLV (A) y aorta (B) de ratones control (WT) y transgénicos para la LOX (Tg). Los resultados se muestran como media ±SEM (n=4-7; *: p<0,05 vs. WT).
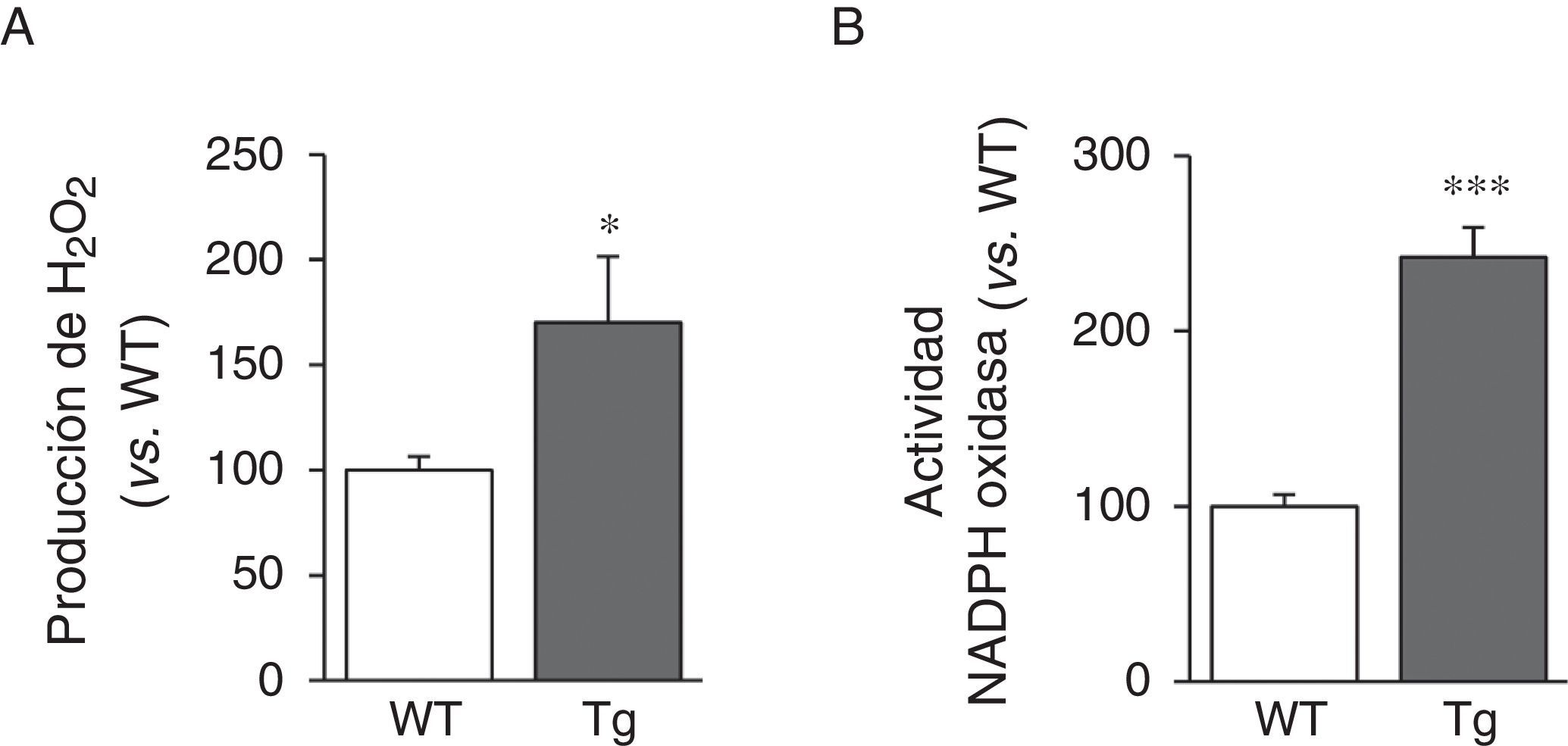
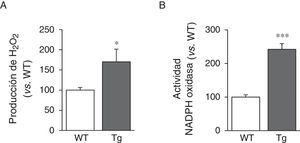
Puesto que la actividad LOX da lugar a la producción de H2O2 como subproducto, analizamos sus niveles en la aorta de los ratones transgénicos. Puede observarse que la producción aórtica de H2O2 se incrementó en los animales transgénicos para la LOX (fig. 4A). De forma similar, la sobreexpresión de LOX indujo un aumento significativo de la actividad NADPH oxidasa, importante enzima productora de anión superóxido (fig. 4B).
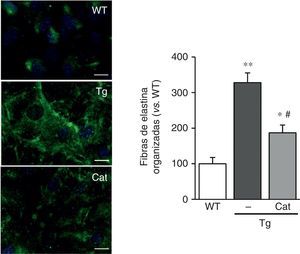
La catalasa previene la alteración en la estructura de la elastinaEn vista de los resultados descritos anteriormente quisimos evaluar si el estrés oxidativo inducido por la transgénesis de LOX podía participar en la alteración en la estructura de la elastina observada en este modelo. Para ello, analizamos el impacto de la incubación con catalasa, una enzima detoxificadora del H2O2, sobre la deposición de elastina en CMLV. Como se observa en la figura 5, la incubación con catalasa atenuó parcialmente la mayor organización de las fibras de elastina depositada por las CMLV procedentes de animales transgénicos.
La producción de H2O2 participa en la alteración de la estructura de la elastina inducida por la sobreexpresión de LOX. Las CMLV procedentes de ratones control (WT) y transgénicos para la LOX (Tg) se incubaron en presencia o ausencia de catalasa (Cat) durante 10días. Se muestra la tinción de elastina (en verde) en CMLV no permeabilizadas. Los núcleos se tiñeron con Hoechst 33342 (azul). Barra: 20μm. Los resultados se muestran como media±SEM (n=6-10; *: p<0,05 vs. WT; #: p<0,05 vs. Tg).
En los últimos años ha quedado patente la importancia de la LOX en el desarrollo de múltiples patologías y su implicación en el control de procesos clave en la fisiopatología cardiovascular1,2,4,12,19-21. El carácter multifuncional de esta enzima, junto al descubrimiento de la actividad biológica del propéptido de la LOX (que se libera durante la maduración de la enzima) y la existencia de formas intracelulares activas localizadas incluso en el núcleo celular han incrementado el interés por esta enzima1,2. Los estudios en este ámbito se han visto beneficiados por el desarrollo de un modelo animal transgénico que sobreexpresa la LOX específicamente en CMLV. Este modelo nos ha permitido demostrar que la LOX juega un papel fundamental en el remodelado vascular, ya que limita la proliferación de las CMLV12. Se trata del único modelo animal modificado genéticamente disponible actualmente para mejorar nuestro conocimiento sobre la biología de esta enzima, ya que los animales deficientes en LOX no son viables22.
Las CMLV aisladas de los animales transgénicos para la LOX tienen una alta producción de proteína LOX bioactiva12 y, en consecuencia, presentan niveles elevados de actividad LOX, lo que conlleva un incremento en la capacidad de los sobrenadantes de estas células para polimerizar el colágeno, uno de los principales sustratos de esta enzima. En concordancia, los animales transgénicos muestran también un mayor grado de ensamblaje de las fibras de colágeno en la pared vascular.
Análogamente, las fibras de elastina depositadas por las CMLV aisladas de los animales transgénicos muestran un mayor grado de ensamblaje que se traduce en fibras de mayor grosor. Puesto que la elastogénesis es un proceso complejo que involucra múltiples etapas, el incremento en la organización de las fibras de elastina observado en los animales transgénicos podría estar asociado no solo a la elevada actividad LOX, sino a otros efectos derivados de la sobreexpresión de esta enzima, entre ellos el aumento en la expresión vascular de la FBLN5 observada en este estudio. La FBLN5 es una glucoproteína que regula la activación proteolítica de la LOX y que es esencial en el mantenimiento de las fibras elásticas y en el remodelado vascular23,24. Además, la FBLN5 regula la señalización mediada por integrinas y controla la adhesión, migración, proliferación y supervivencia de las células vasculares18,25,26, por lo que su inducción en respuesta a la sobreexpresión de LOX podría afectar profundamente a la homeostasis vascular. Asimismo, el análisis de la estructura de la elastina de la lámina elástica interna en los ratones transgénicos reveló una reducción en el número y el tamaño de las fenestras. En estudios previos, hemos demostrado que la disminución en el área de las fenestras de la lámina elástica interna explica, al menos en parte, el aumento de la rigidez vascular en modelos animales de hipertensión5,27-29, y se ha sugerido que la reducción en el tamaño de las fenestras observada en animales hipertensos podría conllevar alteraciones significativas en la comunicación mioendotelial y por tanto afectar de manera crítica a la función vascular30. Por tanto, la alteración en el número y el tamaño de las fenestras inducida por la transgénesis de LOX podría repercutir en una mayor rigidez y en una alteración de la función vascular. Es evidente, sin embargo, que esta hipótesis deberá ser confirmada en un futuro y que se requerirán nuevos estudios para esclarecer las consecuencias fisiopatológicas de este efecto.
La LOX cataliza la transformación de un grupo amino por un grupo aldehído en residuos peptidil lisina de las fibras de colágeno y elastina, lo que da lugar a la generación de H2O2 como subproducto1,2. Los animales transgénicos para la LOX muestran niveles elevados de H2O2 en la pared vascular, fruto muy probablemente de la mayor actividad LOX que presentan las CMLV de estos animales. Estudios recientes en corazón de rata en desarrollo han identificado a la LOX como una fuente significativa de H2O2 en la pared vascular31. Nuestros resultados amplían estas observaciones y ratifican la contribución de LOX a la producción de H2O2 vascular. Asimismo, la transgénesis de LOX se asocia con un incremento en la actividad NADPH oxidasa vascular. El mecanismo que subyace a este efecto es en este momento desconocido. Sin embargo, cabe destacar que el H2O2 es una especie reactiva de oxígeno (ROS) estable y permeable que ejerce múltiples funciones en la pared vascular y que, entre otras respuestas, puede afectar a la producción de estrés oxidativo procedente de otras fuentes de ROS, entre ellas la propia NADPH oxidasa32,33. El incremento en la producción de H2O2 derivado de la actividad LOX está implicado en la capacidad de esta enzima para inducir la migración celular y la quimiotaxis de CMLV entre otros efectos10,11,34. Los resultados obtenidos en CMLV cultivadas en presencia de catalasa sugieren precisamente que los elevados niveles de H2O2 producidos por las CMLV que sobreexpresan la LOX contribuyen, al menos en parte, a la mayor deposición de fibras de elastina madura detectada en estas células. De hecho, se ha descrito que el H2O2 induce la deposición de diferentes componentes microfibrilares, lo que podría contribuir también a la alteración en la estructura de la MEC observada en nuestro modelo35.
En resumen, nuestros hallazgos demuestran que la sobreexpresión de la LOX se asocia a un incremento del estrés oxidativo vascular y sugieren que este mecanismo contribuiría, al menos en parte, a la alteración de la estructura de la elastina inducida por la activación de esta enzima. Puesto que el estrés oxidativo juega un papel fundamental en el desarrollo de enfermedades cardiovasculares, estos resultados sugieren que el control de la actividad LOX podría ser una estrategia útil para limitar la producción de ROS en patologías caracterizadas por un incremento de la actividad/expresión de la LOX.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste estudio ha sido financiado por la Fundación Española de Aterosclerosis, Beca SEA/FEA de Investigación básica 2016, y por el Ministerio de Economía y Competitividad (MINECO)-Instituto de Salud CarlosIII (ISCIII) [proyectos PI15/01016, PI13/01488, SAF2012-36400; SAF2015-64767-R]. El CIBER de Enfermedades Cardiovasculares es una iniciativa del ISCIII. AMB recibió una ayuda del programa Ramón y Cajal (RYC-2010-06473). El estudio ha sido cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER), una manera de hacer Europa.
AutoríaCR y AMB diseñaron el estudio, llevaron a cabo la interpretación de los datos y escribieron el manuscrito. SV y ABGR realizaron los experimentos y el análisis de los datos y participaron en la elaboración del borrador del manuscrito. JMG y MS participaron en el análisis de los resultados y la escritura del manuscrito. Todos los autores aprobaron la versión final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el apoyo técnico de Laura García Redondo y Silvia Aguiló.
Ambos autores contribuyeron igualmente.
Los resultados presentados son fruto del desarrollo del proyecto titulado «Contribución de la lisil oxidasa (LOX) al estrés oxidativo, la rigidez vascular y la hipertensión arterial», galardonado con una BECA FEA/SEA 2016 para investigación básica.