El depósito de matriz extracelular (MEC) es el resultado de la respuesta fisiológica ante una agresión. Cuando ésta se hace crónica se producen cambios en la composición, estructura y acúmulo de componentes de la MEC originando fibrosis, la cual contribuye directamente a un remodelado adverso. A nivel cardiovascular, la fibrosis altera la composición del tejido miocárdico o de la pared vascular, confiriendo rigidez, pérdida de elasticidad y, en último término, compromete la función del tejido u órgano afecto. La fibrosis ocurre cuando la síntesis de colágeno fibrilar (tipos i y iii), componente fundamental de la MEC, predomina sobre la degradación. En pacientes hipertensos, se ha descrito, más que un aumento en el contenido de colágeno, una alteración del ensamblaje o entrecruzamiento (cross-linking) de sus fibras, lo cual contribuiría a la rigidez miocárdica, cuya consecuencia final sería la insuficiencia cardiaca1. La fibrosis es, asimismo, un determinante de la senescencia vascular2.
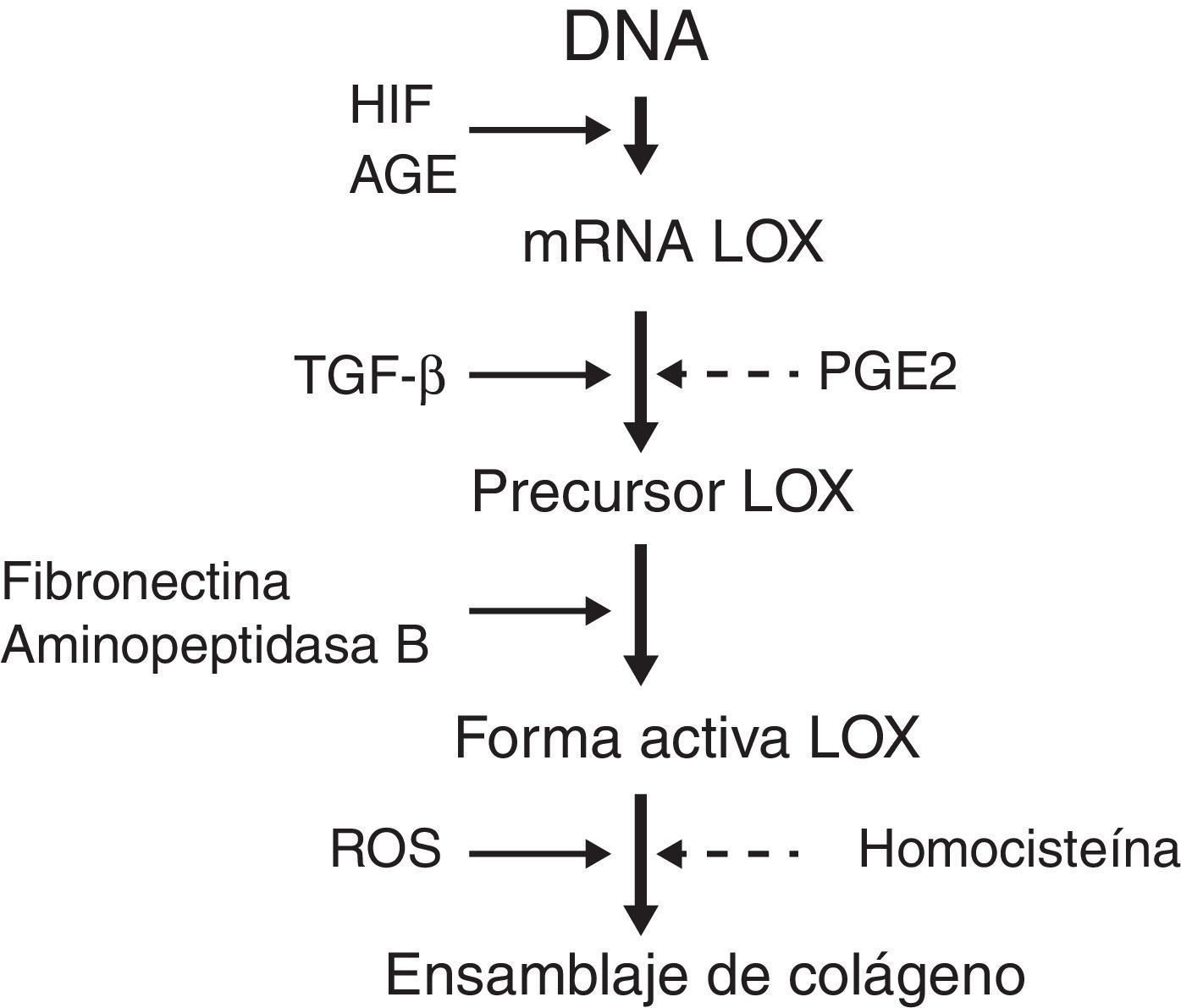
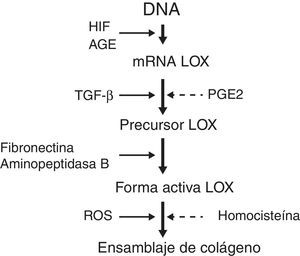
Estudios recientes han identificado moléculas que intervienen en el procesamiento del colágeno. Entre ellas emerge la enzima lisil oxidasa (LOX) que es una aminooxidasa dependiente de cobre que participa en el ensamblaje covalente de las fibras de colágeno y elastina de la MEC. Además, la LOX controla la expresión de genes involucrados en la migración y diferenciación celular y también modula la actividad biológica de factores de crecimiento3. La LOX puede ser regulada a 3 niveles (fig. 1): síntesis del precursor por fibroblastos y miofibroblastos, conversión del precursor en la enzima madura y estimulación directa de la actividad de la enzima. Se ha observado que el aumento de especies reactivas de oxígeno relacionadas con el estrés oxidativo estimula la actividad de LOX en cultivos de fibroblastos.
Factores que regulan la sobreexpresión de LOX y el ensamblaje de colágeno. AGE: productos de glucosilación avanzada; HIF: factor inducible por hipoxia; LOX: enzima lisil oxidasa; PGE2: prostaglandina E2; ROS: especies reactivas de oxígeno; TGF-β: factor de crecimiento transformante beta.
Existen evidencias clínicas y experimentales que muestran que la desregulación de LOX podría ser un factor importante en el desarrollo de enfermedades cardiovasculares3. El ensamblaje del colágeno impacta en su calidad y afecta la función del tejido u órgano dañado. Una causa importante de insuficiencia cardiaca, proceso que conlleva una mortalidad del 50% a los 5 años, es el remodelado tisular adverso acompañado de fibrosis intersticial, no existiendo en la actualidad terapias eficaces capaces de frenar estos procesos. A nivel miocárdico, el grado de entrecruzamiento determina la rigidez, grosor y resistencia a la degradación, lo que tiene consecuencias sobre las propiedades funcionales del ventrículo izquierdo3. Se ha observado un aumento de la expresión de LOX en el miocardio fibrótico de pacientes con cardiopatía hipertensiva e insuficiencia cardiaca crónica, indicando que la sobreexpresión de LOX podría comprometer significativamente la función cardiaca4. También se ha demostrado correlación entre esta enzima y biomarcadores circulantes de fallo cardiaco. Finalmente, se ha relacionado la LOX con factores de riesgo vascular, con componentes del síndrome metabólico y con la hipertensión arterial pulmonar5,6.
En el artículo de Varona et al. en este número de Clin Investig Arterioscler7 se analiza el papel de la sobreexpresión de LOX sobre la estructura de la MEC y el estrés oxidativo vascular en un modelo murino. Para ello, los autores emplearon ratones transgénicos que sobreexpresan la LOX y realizaron análisis cuantitativo de la lámina elástica interna, estudios de inmunohistoquímica, determinación de NADPH oxidasa y H2O2 y cultivos con células musculares lisas. Los resultados mostraron que los ratones transgénicos presentan alteraciones en el ensamblaje del colágeno vascular y en la estructura de la elastina, así como un mayor estrés oxidativo detectado por el aumento de H2O2. Asimismo, la sobreexpresión vascular de LOX indujo la expresión de proteínas elastogénicas por las células musculares lisas. También se observó in vitro que la catalasa, un agente antioxidativo, atenuó la organización de las fibras de elastina. En conjunto, los resultados de este interesante estudio experimental demuestran que la LOX desempeña un papel fundamental en el remodelado vascular, en parte mediado por estrés oxidativo y por un efecto sobre las células musculares lisas. Sería interesante una aproximación preclínica ulterior analizando si la inhibición de LOX sobre ambos procesos fisiopatológicos, de gran repercusión sobre la homeostasis vascular, puede tener aplicabilidad en enfermedades cardiovasculares caracterizadas por aumento de esta enzima. En este sentido, un estudio reciente en un modelo murino demostró que la inhibición de LOX con anticuerpos o mediante manipulación genética redujo la fibrosis cardiaca inducida por estrés, previno la dilatación y mejoró las funciones sistólica y diastólica del corazón8. A nivel clínico, la administración crónica de torasemida fue eficaz en la reducción de la expresión de LOX, del ensamblaje del colágeno y de la rigidez del ventrículo izquierdo en pacientes con insuficiencia cardiaca4.
En los últimos años, además de LOX, han emergido nuevos candidatos que contribuyen a la desregulación del colágeno en la fibrosis9. Entre ellos, la cardiotrofina-1, galectina-3, NADPH oxidasas (NOX2 y 4), lipocalina asociada a gelatinasa de neutrófilos y microARN, son relevantes ya que su exceso o deficiencia pueden conducir a alteraciones en el colágeno fibrilar. Es de esperar que en los próximos años se desarrollen agentes que, modulando selectivamente la acción de estas moléculas, tengan un gran potencial antifibrótico para que puedan trasladarse a corto plazo al ámbito clínico.