El embarazo constituye un factor de riesgo independiente de eventos tromboembólicos, provocado por los cambios en la hemostasia que se producen durante la gestación. Las trombofilias son trastornos de la hemostasia que predisponen a eventos trombóticos. La creciente evidencia sugiere que las trombofilias se asocian a enfermedad tromboembólica y resultados obstétricos desfavorables. Sin embargo, las limitaciones metodológicas han dificultado la obtención de una visión general clara de los riesgos que suponen durante la gestación. El objetivo del presente artículo es realizar una revisión bibliográfica exhaustiva sobre el uso de tromboprofilaxis durante la gestación, con especial interés en esclarecer qué trombofilias tienen indicación de anticoagulación durante el embarazo basada en una mejora de los resultados obstétricos demostrados en la literatura científica.
Pregnancy is an independent risk factor for thromboembolic events, caused by changes in haemostasis that occur during pregnancy. Thrombophilia comprises disorders of haemostasis that predispose to thrombotic events. Increasing evidence suggests that thrombophilia is associated with thromboembolic disease and poor obstetric outcomes. However, methodological limitations have made it difficult to obtain a clear overview of the risk they pose during pregnancy. The objective of this article is to carry out an exhaustive bibliographic review on the use of thromboprophylaxis during pregnancy, with special interest in clarifying the thrombophilia for which anticoagulation is indicated during pregnancy based on an improvement in obstetric results demonstrated in the scientific literature.
El embarazo es reconocido como un factor de riesgo independiente de tromboembolismo venoso (TEV) que conduce a eventos tromboembólicos, particularmente en mujeres con trombosis venosa previa, antecedentes familiares de trombosis o factores de riesgo trombofílicos adicionales1,2. La incidencia de enfermedad tromboembólica (ETE) en el embarazo se estima entre uno a dos casos por cada 1.000 embarazos, siendo el tromboembolismo pulmonar la segunda causa de muerte materna en países desarrollados1. Durante la gestación se producen cambios fisiológicos en la coagulación materna que pretenden garantizar una correcta hemostasia de cara al parto y al alumbramiento3. Los cambios en el sistema hemostático dan lugar a un estado de hipercoagulabilidad e hipofibrinólisis que predisponen a un aumento del riesgo de ETE2. Si bien el embarazo por sí solo es un factor de riesgo para ETE, los factores de riesgo adicionales como la obesidad, son cada vez más comunes3,4. Por otro lado, la creciente evidencia sugiere que las trombofilias se asocian a ETE y resultados adversos del embarazo4. Sin embargo, las limitaciones metodológicas han dificultado la obtención de una visión general clara de los riesgos que suponen durante la gestación, dado que la mayoría de recomendaciones sobre la evidencia del uso de tromboprofilaxis en la gestación se basan en estudios observacionales y extrapolación de otras poblaciones, por lo que son necesario estudios correctamente diseñados para cada población4,5.
El objetivo del presente artículo es realizar una revisión bibliográfica exhaustiva sobre el uso de tromboprofilaxis durante la gestación, con especial interés en esclarecer qué trombofilias tienen indicación de anticoagulación durante el embarazo basada en una mejora de los resultados obstétricos demostrados en la literatura científica.
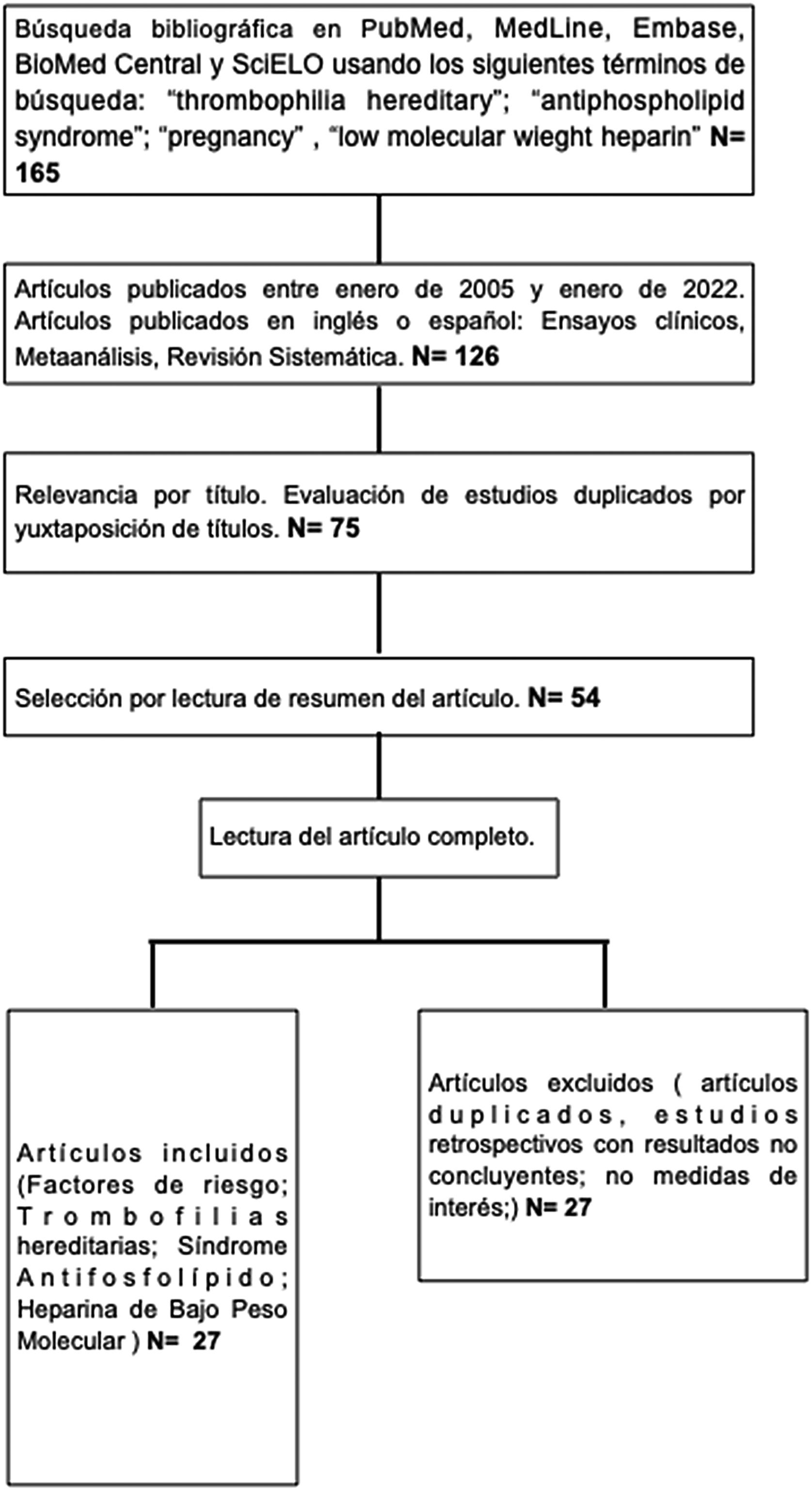
Material y métodosSe realizó una búsqueda bibliográfica de literatura a través de las bases de datos PubMed, Medline, Embase, BioMed Central y SciELO, para identificar artículos publicados en inglés o español que abordaran el manejo de las trombofilias hereditarias y adquiridas, así como las indicaciones de tromboprofilaxis durante la gestación. Seleccionamos artículos publicados entre enero de 2005 y enero de 2022, con la finalidad de recoger la última evidencia sobre el tema; aunque la revisión incluye referencias más antiguas, dado que algunos artículos contienen reseñas de publicaciones anteriores a esta fecha. Se han excluido los artículos con resultados incompletos, deficientes o de escasa relevancia. Se ha recogido toda la información relacionada con la búsqueda bibliográfica en el siguiente diagrama de flujo (fig. 1)
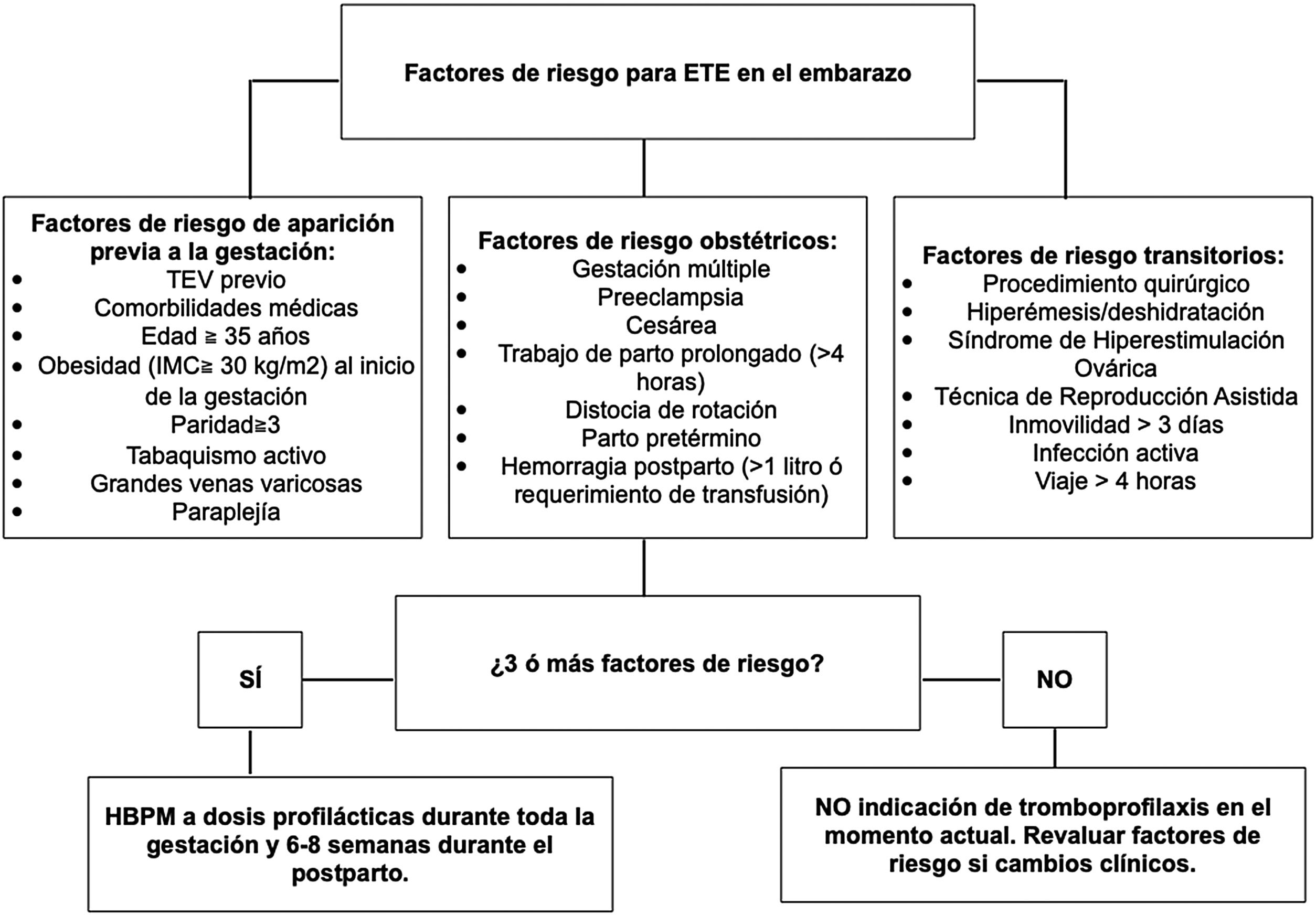
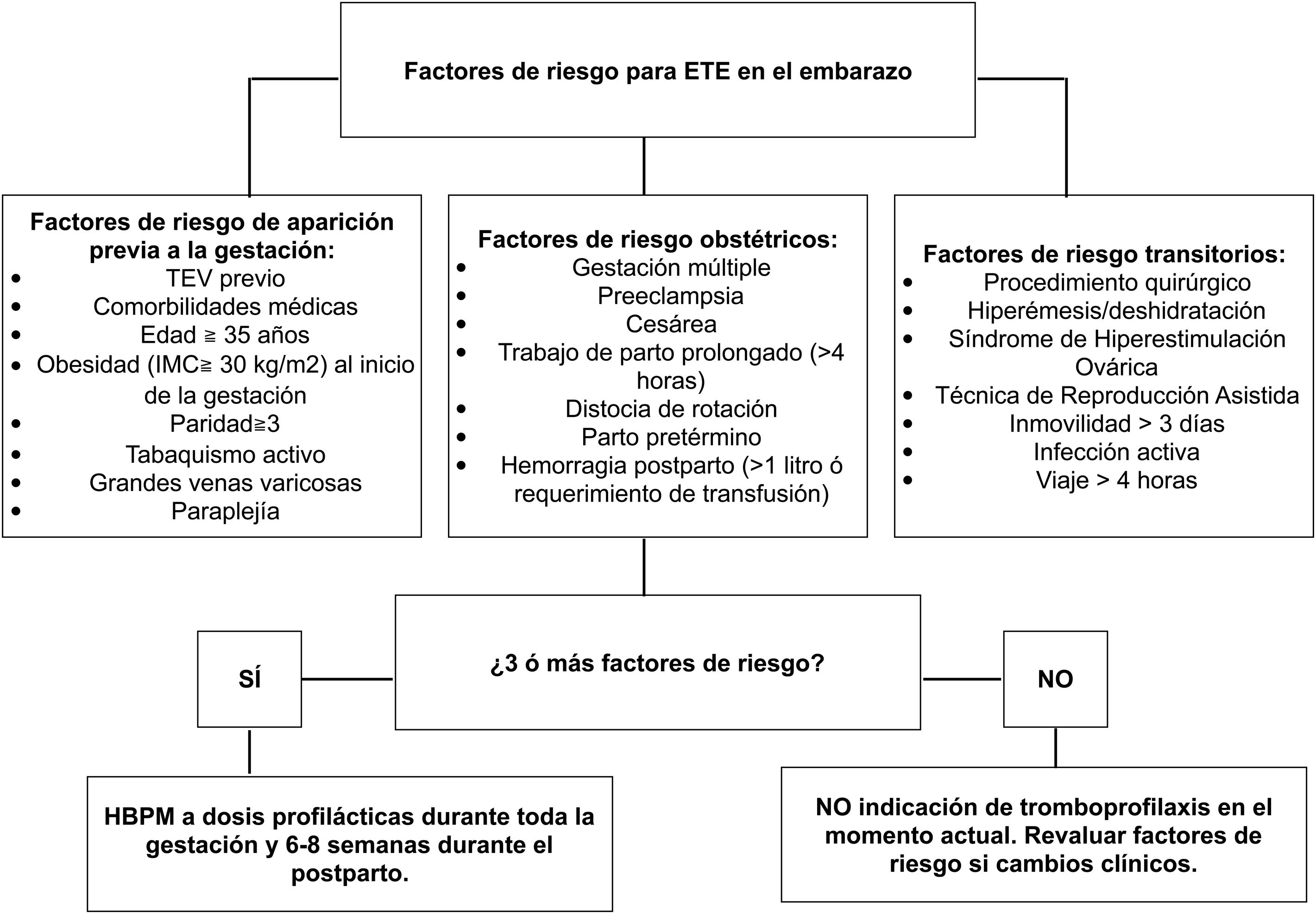
Factores de riesgoEn 2015, el Royal College of Obstetricians & Gynecologist publica la última actualización de su guía de práctica clínica para la reducción del riesgo de tromboembolismo durante el embarazo y el puerperio. Asimismo, divide los factores de riesgo para tromboembolismo durante la gestación en tres bloques bien diferenciados, en función de si dichos factores de riesgos son de aparición previa al embarazo, factores de riesgo obstétricos propiamente dichos o factores de riesgo transitorios (tabla 1)6. Se establece la indicación de tromboprofilaxis con heparina de bajo peso molecular (HBPM) a dosis profilácticas durante el embarazo y seis a ocho semanas posparto si coexisten tres o más de dichos factores de riesgo (fig. 2)6.
Factores de riesgo de aparición previa a la gestación
| TEV previo |
| Trombofilia hereditaria o adquirida |
| Comorbilidades médicas: cáncer, enfermedad cardiaca, enfermedad autoinmune, diabetes mellitus tipo I, artropatía inflamatoria, síndrome nefrótico, uso de drogas por vía parenteral |
| Edad ≥ 35 años |
| Obesidad (IMC ≥ 30 kg/m2) al inicio de la gestación |
| Paridad ≥ 3 |
| Tabaquismo activo |
| Grandes venas varicosas |
| Paraplejía |
| Factores de riesgo obstétricos |
| Gestación múltiple |
| Preeclampsia |
| Cesárea |
| Trabajo de parto prolongado (> 4 h) |
| Distocia de rotación |
| Parto pretérmino |
| Hemorragia posparto (> 1 litro o requerimiento de transfusión) |
| Factores de riesgo transitorios |
| Procedimiento quirúrgico |
| Hiperémesis/deshidratación |
| Síndrome de hiperestimulación ovárica |
| Técnica de reproducción asistida |
| Inmovilidad > 3 días |
| Infección activa |
| Viaje > 4 h |
Adaptado y traducido del Royal College of Obstetricians & Gynecologist6.
TEV: tromboembolismo venoso.
Por otro lado, cabe destacar el incremento de la obesidad en la población gestante como factor de riesgo para la aparición de eventos trombóticos6, dado que el aumento de la obesidad en la población embarazada se estima entre un 70 y un 100% en una década, y una de cada cinco mujeres embarazadas es obesa7.
En cuanto a los antecedentes personales de trombosis, en mujeres con un solo episodio de trombosis previa asociada a un factor de riesgo transitorio (como cirugía o traumatismo), y sin factor de riesgo genético adicional, la probabilidad de una trombosis previa asociada al embarazo es baja8. Por el contrario, en mujeres con una trombosis venosa idiopática previa que son portadoras de un factor de riesgo hereditario adicional o que tienen antecedentes familiares de trombosis, se puede esperar un alto riesgo de aparición de esta complicación durante la gestación (> 10%), que apoye la indicación de profilaxis activa anteparto y posparto8.
Trombofilias hereditariasEn 2006, Robertson et al. publican los resultados del estudio TREATS, una revisión sistemática para determinar el riesgo de TEV y de resultados obstétricos adversos en el embarazo asociados a trombofilia. Se evaluó la efectividad de las intervenciones profilácticas durante la gestación. Se incluyeron 79 estudios y se calcularon las razones de probabilidad estratificadas por tipo de trombofilia para cada resultado. Los riesgos de cada trombofilia se determinaron para TEV, pérdida temprana del embarazo, pérdida tardía del embarazo, preeclampsia, desprendimiento de placenta y restricción del crecimiento intrauterino. Los resultados confirmaron que las pacientes con trombofilia corren el riesgo de desarrollar TEV y complicaciones obstétricas. Sin embargo, a pesar del aumento del riesgo relativo, el riesgo absoluto de TEV y de resultados adversos en la gestación sigue siendo bajo9.
En 2010, Rodger et al. basándose en que los estudios retrospectivos de cohortes publicados previamente sugerían de manera variable un vínculo entre mutación en el factor V de Leiden y gen de la protrombina con la presencia de complicaciones en el embarazo, realizaron una revisión sistemática y un metanálisis para estimar la asociación de estado de portador de la madre y las complicaciones del embarazo mediadas por la placenta. Concluyeron que las mujeres con mutación en el factor V de Leiden parecen tener un pequeño aumento del riesgo relativo de pérdida precoz (< 20 semanas) en el embarazo (RR 1,52; IC 95%: 1,06 a 2,12). Por el contrario, no parecen tener mayor riesgo de preeclampsia ni la mutación en el factor V de Leiden (RR 1,23; IC 95%: 0,89 a 1,70), ni la mutación de la protrombina (RR 1,25; IC 95%: 0,79 a 1,99)10.
Posteriormente en 2014, Rodger et al. publican el estudio TIPPS que parte de la hipótesis de que la dalteparina anteparto reduciría el riesgo de TEV asociado al embarazo, así como la preeclampsia grave, la restricción del crecimiento y el desprendimiento de placenta. Se realizó un ensayo aleatorizado, abierto y multicéntrico que se desarrolló simultáneamente en cinco países en el que participaron un total de 292 pacientes. El grupo sometido a tromboprofilaxis realizó tratamiento con 500 UI de dalteparina cada 24 h hasta la semana 20 de gestación, y con 500 UI de dalteparina cada 12 h hasta la 37 semanas. Por su parte el grupo control no recibió ningún tratamiento. En cuanto a los resultados, la dalteparina no redujo la incidencia de TEV, preeclampsia grave, restricción de crecimiento ni desprendimiento de placenta tanto en el análisis de intención de tratar (dalteparina 25/146 [RR 17,1%; IC 95%: 11,4 a 24,2%] vs. sin dalteparina 27/143 [RR 18,9%; IC 95%: 12,8 a 26,3%]; diferencia de riesgo -1,8% [IC 95%: -10,6 a 7,1%]) como en el análisis durante el tratamiento (dalteparina 28/143 [19,6%] vs. sin dalteparina 24/141 [17%]; diferencia de riesgo +2,6% [IC 95%: -6.4 a 11,6%]). En el análisis de seguridad, la aparición de hemorragias mayores no difería entre los dos grupos. Sin embargo, la hemorragia menor fue más común en el grupo de dalteparina (28/143 [19,6%]) que en el grupo sin dalteparina (13/141 [9,2%]; diferencia de riesgo del 10,4%, IC 95%: 2,3 a 18,4; p = 0,01)11.
Actualmente, la tromboprofilaxis con HBPM durante toda la gestación y hasta las seis semanas posteriores al parto está justificada en mujeres asintomáticas con déficit de proteína C, déficit de proteína S, déficit de antitrombina, factor V de Leiden homocigoto y mutación G20210A de la protrombina homocigota9–11. En casos de mutación en el factor V de Leiden heterocigoto y mutación G20210A de la protrombina heterocigota se recomienda la tromboprofilaxis prenatal y en el puerperio solo si existen antecedentes de TEV en un familiar de primer grado, y se establece la realización de vigilancia clínica en todas las demás mujeres asintomáticas y los antecedentes familiares descritos que sean portadoras de estas mutaciones10. Tales recomendaciones se basan principalmente en el estudio TREATS, comentado anteriormente, que informó de un aumento de 34,4 y 26,4 veces el riesgo de TEV relacionado con el embarazo en mujeres con mutación homocigótica del factor V de Leiden o mutación G20210A de la protrombina homocigota, respectivamente; un aumento de 3,2 a 4,8 veces mayor en aquellas con deficiencia de antitrombina, proteína C o proteína S; y un riesgo 8,3 y 6,8 veces mayor en aquellas con heterocigoto o mutación G20210A de la protrombina heterocigota, respectivamente9.
Síndrome antifosfolípidoEl síndrome antifosfolípido (SAF) es una enfermedad autoinmune, que se clasifica dentro de las trombofilias adquiridas, cuyas manifestaciones clínicas son causadas por anticuerpos que se dirigen a los fosfolípidos de la membrana celular y de las proteínas asociadas12. Hasta en un 30% de los casos se asocia a lupus eritematoso sistémico (LES), siendo la prevalencia actual del SAF de 40 por 100.000 individuos13. El embarazo es una situación de alto riesgo para las pacientes con SAF debido al aumento de trombosis y de complicaciones obstétricas14. Aproximadamente entre uno de cada 10 y uno de cada 50 embarazos con SAF se complicará con trombosis, a pesar del tratamiento14. De forma similar ocurre con las morbilidades obstétricas, pues aproximadamente el 15% de las mujeres con SAF en tratamiento las experimentarán15.
Los criterios clasificatorios de SAF fueron revisados por Miyakis et al. en 2006, siendo necesario para el diagnóstico al menos cumplir un criterio clínico y otro de laboratorio (tabla 2)16. En cuanto a los criterios clínicos, el criterio de «trombosis vascular» se cumple con la aparición de ≥ 1 episodio de trombosis arterial, venosa o de pequeños vasos confirmada objetivamente, en cualquier tejido u órgano, excepto la trombosis venosa superficial16. Continuando con los mencionados criterios clínicos, el de «complicaciones obstétricas» se cumple con la ocurrencia de al menos uno de los siguientes eventos, sin que haya ninguna otra causa alternativa que los justifique: ≥ una muerte inexplicable de un feto morfológicamente normal (≥ 10 semanas de gestación); ≥ un parto prematuro de un recién nacido morfológicamente normal (< 34 semanas de gestación) debido a insuficiencia placentaria, preeclampsia severa o eclampsia; ≥ tres abortos espontáneos inexplicables consecutivos (≥ 10 semanas de gestación). Respecto a los criterios clasificatorios de laboratorio, el primero de ellos es la existencia de anticoagulante lúpico (AL) que se establece mediante la presencia en plasma de AL en dos o más determinaciones separadas al menos 12 semanas. Los anticuerpos anticardiolipina (aCL), constituyen otro criterio de laboratorio siempre y cuando se haya detectado IgG y/o IgM en suero o plasma en títulos medios o altos (> p99), en dos o más determinaciones separadas al menos 12 semanas por ELISA. En cuanto a los anticuerpos anti-β2-glicoproteína-I (aβ2GPI) para ser considerada su presencia criterio de laboratorio deben detectarse en suero o plasma IgG y/o IgM en títulos medios o altos (> p99), en dos o más determinaciones separadas al menos 12 semanas por ELISA16.
Criterios diagnóstico de SAF (síndrome antifosfolípido)
| Criterios clasificatorios SAF | Criterios clínicos |
|---|---|
| Trombosis vascular | Uno o más episodios confirmados de trombosis, arterial, venosa o de pequeño vaso en cualquier localización |
| Complicaciones obstétricas | Una o más muertes fetales > 10 semanas morfológicamente normalesUno o más nacidos pretérmino por insuficiencia placentariaTres o más abortos inexplicables consecutivos con visualización de embrión < 10 semanas |
| Criterios clasificatorios SAF | Criterios laboratorio |
| Anticoagulante lúpico | Presencia en plasma en dos o más determinaciones separadas al menos 12 semanas |
| Anticuerpos anticardiolipina | IgG y/o IgM en suero o plasma en títulos medios o altos (> p99), en 2 o más determinaciones separadas al menos 12 semanas por ELISA |
| Anticuerpos anti-ß2-glicoproteína-I | IgG y/o IgM en suero o plasma en títulos medios o altos (> p99), en 2 o más determinaciones separadas al menos 12 semanas por ELISA |
Adaptado de Miyakis et al.16
El embarazo también puede desencadenar la forma más grave del síndrome, llamado SAF catastrófico. Esta rara manifestación se caracteriza por trombosis multiorgánica, a menudo microvascular, que puede derivar en fallo multiorgánico. El embarazo es el factor precipitante en aproximadamente el 8% de los casos, la mitad de los cuales ocurren durante el embarazo y la otra mitad después17. Es importante considerar la posibilidad del desarrollo de SAF catastrófico en pacientes con síndrome de HELLP y fallo multiorgánico durante el embarazo o puerperio, especialmente si existe historia previa de abortos y/o trombosis de repetición17. En 2016, Rodríguez-Pintó et al. publicaron un estudio descriptivo en el que analizaron características demográficas, clínicas y serológicas de 500 pacientes que habían sufrido SAF catastrófico18. Entre los resultados destacó como el 40% de las pacientes presentaba una enfermedad autoinmune asociada, que fue el LES 75% de los casos18. Se identificó un factor desencadenante en el 65% de las pacientes, en su mayoría infecciones concomitantes (49%). La clínica se caracterizó por afectación multiorgánica incluyendo riñones (73%), pulmones (60%), cerebro (56%), corazón (50%) y piel (47%)18. En cuanto a los marcadores serológicos el AL, aCL y aβ2GPI fueron los anticuerpos antifosfolípidos implicados con mayor frecuencia (83%, 81% y 78% respectivamente). La mortalidad representó el 37% de los episodios SAF catastrófico18.
El tratamiento del SAF en la gestación (tabla 3) está estandarizado, aunque es necesario individualizar en algunos casos dado que el riesgo de complicaciones varía entre los subtipos clínicos, lo que puede modificar la estrategia de manejo19. En mujeres asintomáticas positivas para anticuerpos antifosfolípidos debe considerarse ácido acetilsalicílico (AAS) de 100 mg desde el periodo preconcepcional hasta el parto, reservando la tromboprofilaxis con HBPM en dosis profilácticas hasta las seis semanas posparto para casos en los que existan factores de riesgo adicionales de trombosis19. En pacientes con SAF obstétrico, se recomienda AAS de 100 mg desde el periodo preconcepcional hasta el parto. Se comenzará con HBPM a dosis profilácticas desde la confirmación del embarazo hasta seis semanas posparto19. Las pacientes con SAF vascular deben realizarse pruebas de embarazo frecuentes y recibir HBPM en lugar de anticoagulantes orales (warfarina o acenocumarol) después de la confirmación del embarazo. Durante el embarazo, en estas pacientes, se recomienda HBPM más AAS de 100 mg19.
Tratamiento SAF (síndrome antifosfolípido)
| Paciente con SAF y antecedente de trombosis | Cambiar AVK antes de la semana 7 por HBPM en dosis anticoagulantes. Tras parto volver a AVK |
| Paciente con SAF obstétrico | AAS 100 mg desde periodo preconcepcional hasta parto.HBPM a dosis profilácticas desde comienzo del embarazo a seis semanas posparto |
| Paciente con AAF persistente, pero sin criterios clínicos de SAF | AAS 100 mg desde periodo preconcepcional hasta parto.Si existen factores de riesgo de trombosis añadir HBPM a dosis profilácticas desde comienzo del embarazo a seis posparto |
Adaptado de Tektonidou MG et al.20
HBPM: heparina de bajo peso molecular; AVK: fármacos antivitamina K; AAS: ácido acetilsalicílico; AAF: anticuerpos antifosfolípido.
Distintos trabajos han sido publicados recientemente con la finalidad de evaluar la eficacia de las pautas de tratamiento anteriormente mencionadas. En 2019, Tektonidou et al. publican los resultados de una revisión sistemática realizada con el fin de informar de las recomendaciones europeas para el manejo de SAF en adultos, en la que incluyen un total de 7.534 artículos. Entre las conclusiones menciona que el tratamiento combinado con AAS en dosis bajas y heparina fue más efectivo que el tratamiento únicamente con AAS en dosis bajas en varios tipos de SAF obstétrico20.
En 2021, Urbano et al. ponen de manifiesto los resultados de un metaanálisis, realizado a partir de ensayos clínicos aleatorizados y estudios observacionales de cohortes prospectivos, con el fin de esclarecer los datos publicados en la literatura sobre la eficacia y seguridad de los diferentes tratamientos farmacológicos para la prevención de restricción de crecimiento fetal en mujeres embarazadas con SAF obstétrico. El estudio incluyó un total de 395 mujeres embarazadas con SAF obstétrico, tratadas con cinco enfoques farmacológicos diferentes (AAS a dosis bajas; AAS a dosis bajas + HBPM; AAS a dosis bajas + heparina no fraccionada [HNF]; AAS a dosis bajas + corticoides; AAS a dosis bajas + HNF + inmunoglobulinas intravenosas) o con placebo y sin tratamiento, para la prevención de resultados adversos del embarazo. En líneas generales, no encontraron diferencias estadísticamente significativas en el desarrollo de un crecimiento fetal restringido entre los distintos tratamientos, ni entre los distintos tratamientos y el placebo21.
En el 2021, Guerby et al. muestran los resultados de una revisión sistemática y metaanálisis realizado con el objetivo de evaluar la eficacia y la seguridad de la heparina (ya sea HBPM o HNF) para prevenir resultados obstétricos adversos en mujeres embarazadas con SAF. El resultados primario fue la tasa de nacidos vivos. Los resultados secundarios incluyeron preeclampsia, parto prematuro, restricción del crecimiento intrauterino y tromboembolismo. Los resultados de seguridad incluyeron hemorragias maternas o neonatales, trombocitopenia inducida por heparina y reacciones alérgicas al fármaco. Se incluyeron 13 ensayos aleatorizados con un total de 1.916 pacientes. Se evidenció como la heparina, asociada o no con AAS, aumentó significativamente la tasa de nacidos vivos (RR 1,20; IC 95%1,09 a 1,33). Asimismo, la heparina asociada o no a AAS disminuyó significativamente la tasa de preeclampsia (RR 0,32; IC 95%: 0,12 a 0,87), pero no demostró disminuir la tasa de parto prematuro ni restricción de crecimiento fetal. En cuanto al análisis de seguridad, la heparina se asoció de forma significativa con hemorragia menor, principalmente hematomas en la zona de punción y epistaxis (RR 2,58; IC 95%: 1,03 a 6,43)22.
En cuanto al alto riesgo existente de pérdida recurrente en el embarazo en mujeres con anticuerpos antifosfolípidos (AL, aCL, aβ2GPI) persistentes, en 2020, Hamulyák et al. realizan una revisión Cochrane para evaluar los efectos de la AAS en dosis bajas y heparina (incluyendo HBPM y HNF) a este respecto. Revisaron 11 estudios con un total de 1.672 mujeres. Los resultados demostraron que el uso de heparina más AAS frente a AAS solo puede aumentar la tasa de recién nacidos vivos (RR 1,27; IC 95%: 1,09 a 1,49). Del mismo modo, al comparar HBPM más AAS vs. AAS solo, el RR para nacidos vivos fue 1,20 (IC 95%: 1,04 a 1,38). Además, la mencionada combinación de heparina más AAS puede reducir el riesgo de pérdida del embarazo (RR 0,48; IC 95%: 0,32 a 0,71)23.
Para evaluar la seguridad de los tratamiento antitrombóticos utilizados durante la gestación en las pacientes con SAF, Yelnik et al. elaboran en 2018 un estudio multicéntrico internacional a partir de dos estudios de cohortes prospectivos con un total de 264 pacientes tratadas con AAS a dosis bajas y con HBPM, en monoterapia o en combinación. En cuanto a los resultados adversos, tuvieron un total de 45 eventos hemorrágicos, pero se informó de sangrado mayor en solo 6 casos. Ni la heparina ni la AAS en monoterapia ni tampoco la terapia combinada aumentaron el riesgo de hemorragia. Tampoco se observó un aumento en la tasa de sangrado en el caso de un intervalo corto entre la última dosis de HBPM (menos de 24 h) o AAS (menos de cinco días) y el parto. Excepcionalmente, la cesárea de emergencia se asoció significativamente (p = 0,016) con un mayor riesgo de sangrado (RR 5,03; IC 95%:1,41-17,96)24.
Heparina de bajo peso molecularDurante la gestación está recomendado el uso HBPM para la prevención y el tratamiento del TEV, en lugar de HNF 25. La HBPM es una opción de tromboprofilaxis segura y eficaz en estas pacientes y tiene una serie de ventajas administrativas y farmacocinéticas sobre la HNF, entre las que se encuentran una mayor vida media y biodisponibilidad, una farmacocinética más predecible, una menor morbilidad, menor tasa de complicaciones obstétricas en relación con el sangrado, menor tasa osteoporosis y menor tasa de trombopenia asociada25. Asimismo, merecen un seguimiento más estrecho aquellas pacientes con insuficiencia renal, pesos extremos o alto riesgo trombótico25. Entre los efectos secundarios más frecuentes se encuentran la hemorragia, la trombocitopenia, la osteoporosis y la hiperpotasemia25.
Dado que los cambios fisiológicos en el metabolismo materno durante la gestación han dado lugar a controversia sobre las estrategias de dosificación óptima de la HBPM y la necesidad de monitorización, en 2021, Kjaergaard et al. realizaron una revisión sistemática a este respecto esclarecer si el ajuste de dosis de la HBPM de acuerdo con anti-Xa proporciona una eficacia y seguridad superiores en comparación con las HBPM ajustadas por peso o en dosis fijas en mujeres embarazadas. En total se incluyeron 33 estudios: cuatro ensayos clínicos aleatorizados y 29 estudios observacionales de cohortes. La efectividad se definió como episodios de trombosis y la seguridad como episodios hemorrágicos. Dado que no se encontraron diferencias ni en eventos trombóticos ni hemorrágicos en el grupo controlado con anti-Xa respecto al grupo control, los resultados de esta revisión sistemática no respaldan la necesidad de una monitorización anti-Xa cuando se utiliza HBPM como tromboprofilaxis o como tratamiento durante el embarazo26.
En cuanto a las contraindicaciones descritas en la literatura se encuentran la existencia de un sangrado activo antenatal o postparto, alto riesgo de sangrado, alteración preexistente de la coagulación, trombocitopenia (< 75.000/μL), antecedente de accidente cerebrovascular en las últimas cuatro semanas, enfermedad renal con un filtrado glomerular menor de 30 mL/min, enfermedad hepática severa o hipertensión arterial incontrolada27.
ConclusionesEn cuanto a las trombofilias hereditarias, la tromboprofilaxis está justificada en mujeres asintomáticas con déficit de proteína C, déficit de proteína S, déficit de antitrombina, factor V de Leiden homocigoto y mutación G20210A de la protrombina homocigota. En casos de mutación en el factor V de Leiden heterocigoto y mutación G20210A de la protrombina heterocigota se recomienda la tromboprofilaxis prenatal y en el puerperio solo si existen antecedentes de TEV en un familiar de primer grado, y se establece la realización de vigilancia clínica en todas las demás mujeres asintomáticas y los antecedentes familiares descritos que sean portadoras de estas mutaciones. El tratamiento con AAS en dosis bajas y con HBPM a dosis profilácticas ha demostrado mejorar los resultados obstétricos en las pacientes con SAF.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.