valorar la morbilidad de los diferentes abordajes quirúrgicos en mujeres con cáncer de endometrio e índice de masa corporal (IMC) superior o igual a 35kg/m2.
Material y métodosse ha realizado un estudio descriptivo retrospectivo de 36 mujeres con cáncer de endometrio e IMC superior o igual a 35 kg/m2 tratadas quirúrgicamente en este centro desde 1996 hasta enero de 2007. Se han definido 2 grupos según el abordaje quirúrgico: laparoscopia (LPC) y laparotomía (LPM). Se han analizado diferentes factores como edad, IMC, cirugía previa, factores de riesgo, tipo de cirugía, duración, complicaciones, estancia media, tasa de conversión, transfusión, estadio según la Federación Internacional de Ginecología y Obstetricia (FIGO), tipo histológico y supervivencia.
Resultadosla edad media fue de 64,40±1,28 años (rango de 50 a 83) y el IMC fue de 39,94±0,73kg/m2 (rango de 35,1 a 55,3), sin que hubiera diferencias significativas. El 8,3% (3 mujeres) tenía algún tipo de cirugía abdominal previa; en el 69,4% (25 mujeres) había factores de riesgo de afección endometrial y el 8,3% (3 mujeres) había recibido tratamiento con tamoxifeno. El abordaje quirúrgico inicial fue LPC en 16 mujeres (44,4%) y LPM en 20 mujeres (55,5%). La realización de linfadenectomía fue posible en el 55% con LPM y en el 93,8% con LPC. La tasa de conversión a LPM fue necesaria en 3 mujeres (18,8%) debido a problemas de tratamiento anestésico. La estancia media y las cifras de hemoglobina media fueron mejores para la serie en la que se utilizó LPC (p<0,001). No hubo diferencias significativas en los ganglios extraídos. La tasa de supervivencia fue similar (p=0,29).
Conclusionesel IMC elevado no puede considerarse una contraindicación para el abordaje laparoscópico. El tratamiento y la estadificación quirúrgica laparóscópica disminuye la morbilidad y la estancia media.
To evaluate morbidity in distinct surgical approaches for the treatment of endometrial cancer in patients with a body mass index (BMI)⩾35(kg/m2).
Material and methodsWe performed a descriptive, retrospective study of 36 consecutive patients with a BMI >35 and endometrium cancer who underwent surgery from January 1996 to January 2007. The patients were classified into two groups according to whether the laparoscopic (LPS) or laparotomic (LPM) approach was used. The following factors were analyzed: age, BMI, previous surgery, risk factors, type of surgery, operating time, complications, mean length of hospital stay, conversion rate, transfusion rate, FIGO stage, histological type, and survival.
ResultsThe mean age was 64.40±1.28 (50–83) years and the mean BMI was 39.94±0.73(35.1–55.3)kg/m2. A total of 8.3% (three patients) had previous abdominal surgery, 69.4% (25 patients) had endometrial risk factors and 8.3% (three patients) had received tamoxifen treatment. The initial surgical access was LPS in 16 patients (44.4%) and was LPM in the remaining 20 patients (55.5%). Lymphadenectomy was feasible in 55% of LPM and in 93.8% of LPS. Conversion to laparotomy was required in three patients (18.8%) due to anesthetic problems. The length of hospital stay and hemoglobin balance were more favorable in LPS (p<0.001). No differences were found in nodal extraction. The survival rate was similar with the two approaches (p=0.29).
ConclusionsHigh BMI should not be considered as a contraindication for LPS. Successful laparoscopic management and staging reduces hospital stay and morbidity.
El cáncer de endometrio es uno de los cánceres ginecológicos más frecuentes en países desarrollados1.
La edad y la obesidad son 2 de los principales factores de riesgo epidemiológicos asociados a este tipo de cáncer2–4.
La obesidad es uno de los factores de riesgo más importantes implicado en el desarrollo de cáncer de endometrio. La incidencia de este cáncer se asocia directamente al consumo de grasas de la población estudiada. Se considera que un aumento ponderal por encima de 9 a 22kg sobre el peso ideal puede conllevar a un aumento de 3 veces el riesgo de la población normal. Si este peso sobrepasa los 22kg, el riesgo se multiplica por 91–3.
La mujer con cáncer de endometrio y obesidad suele asociar, además, problemas de procesos patológicos, como hipertensión arterial, diabetes, enfermedad cardíaca y enfermedad respiratoria que dificultan todavía más, si cabe, el tratamiento4–6.
La obesidad en sí misma supone un riesgo añadido para el tratamiento quirúrgico de estas mujeres, ya que conlleva un incremento de las dificultades técnicas de exposición tumoral y de la realización de linfadenectomía, lo que aumenta la morbilidad intraoperatoria; el tratamiento anestésico es más complejo y aumenta la tasa de complicaciones postoperatorias asociada. Además, la obesidad complica la exposición adecuada a radioterapia adyuvante cuando ésta es necesaria6.
El hecho de poder realizar un tratamiento quirúrgico adecuado identificando los factores de riesgo pronóstico asociados a este cáncer (infiltración miometrial, grado de diferenciación, afectación ganglionar y del espacio linfovascular) es importante para adecuar tratamientos adyuvantes posteriores y porque se ha visto que mejora la tasa de supervivencia7.
Tradicionalmente, el tratamiento quirúrgico ha sido la vía laparotómica y se ha planteado la vía vaginal como alternativa en aquellos casos de riesgo quirúrgico muy elevado, donde la estaficación completa no fuera posible debido a las condiciones de la mujer. En la última década han aparecido diferentes trabajos publicados sobre la utilización de la LPC en la estadificación quirúrgica de estas mujeres, en los que se muestran buenos resultados8,9.
El objetivo de este trabajo es valorar las diferentes vías quirúrgicas empleadas en este centro para el tratamiento quirúrgico y la estadificación del cáncer de endometrio, así como la morbilidad y las posibles ventajas de cada uno de estos accesos en el grupo de mujeres con un IMC (índice de masa corporal) superior o igual a 35kg/m2 en el momento de la cirugía.
Material y métodosSe ha realizado un estudio descriptivo retrospectivo de 170 mujeres intervenidas de cáncer de endometrio en el Servicio de Obstetricia y Ginecología del Hospital Universitario Príncipe de Asturias de Alcalá de Henares, Madrid, entre enero de 1996 y enero de 2007.
En este trabajo se ha estudiado a las mujeres con un IMC superior o igual a 35kg/m2 en el momento de la cirugía. El total de esta muestra fue de 42 mujeres. Se excluyó a 6 mujeres intervenidas previamente por vía vaginal; por tanto, se analizó y estudió a 36 mujeres, lo que supone el 21,11% de la población intervenida quirúrgicamente de cáncer de endometrio en esta área, durante el período antes mencionado.
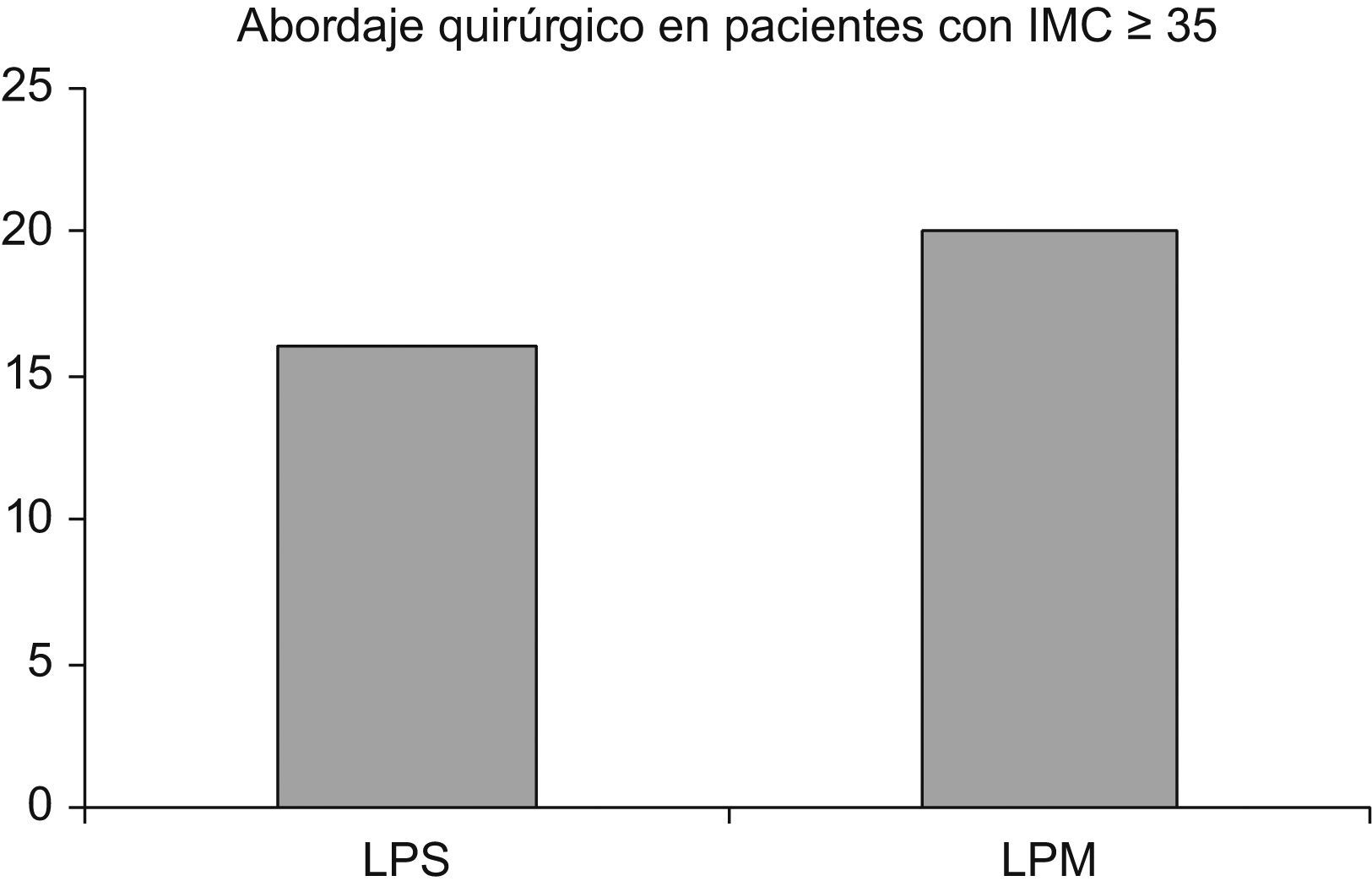
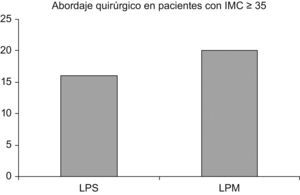
Se clasificó a las mujeres según la vía quirúrgica empleada: 16 mujeres (44,4%) recibieron LPC y 20 mujeres (55,5%) recibieron LPM.
Se realizó un estudio preoperatorio con analítica, incluidos marcadores tumorales, radiografía de tórax, electrocardiograma, resonancia magnética o tomografía computarizada; también se recogió el consentimiento informado tras la explicación y aclaraciones pertinentes sobre el tipo de cirugía, la vía quirúrgica y posibles complicaciones. En todos los casos, previamente a la cirugía se procedió a la preparación intestinal, la preparación antibiótica y la profilaxis de trombosis venosa profunda.
Los ginecólogos de este sevicio realizaron las LPM, y endoscopistas con amplia experiencia realizaron las LPC. En los primeros años, 2 endoscopistas realizaron estas últimas y en los últimos 4 años se incorporaron a la cirugía laparoscópica otros 2 miembros del servicio. Las mujeres se incluyeron en uno u otro acceso quirúrgico según la propuesta dada desde las diferentes consultas de este centro. Con la introducción progresiva de la LPC en este centro, la tendencia inicial de indicar LPM se ha sustituido por la utilización de la LPC.
El primer paso en la cirugía consistió (en ambas vías) en la visualización de la cavidad abdominal y la inspección y toma de muestra de líquido peritoneal para citología. Posteriormente se realizó linfadenectomía, que incluyó el espacio de Lebeuf-Gorard, lateral a la arteria vesical inferior, ventral al origen de la arteria uterina y medial y caudal a la vena ilíaca externa, incluida la fosa obturatriz por encima del nervio obturador. Los ganglios obtenidos se remitieron siempre a estudio anatomopatológico y, mientras tanto, se realizó la histerectomía con doble anexectomía10–12.
El abordaje laparotómico se realizó según criterios convencionales de la Federación Internacional de Ginecología y Obstetricia (FIGO): LPM media infra y supraumbilical; inspección de la cavidad abdominal con extirpación y biopsia del nódulo sospechoso; revisión del intestino delgado y el colon en todo su recorrido; citologías peritoneales con 50 a 100ml de suero fisiológico del fondo de saco de Douglas; espacios paracólicos y subdiafragmáticos; histerectomía total abdominal extrafascial y salpingooforectomía bilateral; linfadenectomía pélvica (o muestreo) bilateral, y linfadenectomía paraaórtica o muestreo hasta la mesentérica inferior. Esta parte quirúrgica quedó reservada (tanto en la LPC como en la LPM) sólo para aquellos casos con ganglios pélvicos positivos en el estudio intraoperatorio o tipos histológicos considerados de mal pronóstico8.
El abordaje laparoscópico se realizó mediante el uso de la columna de vídeo cirugía convencional, que incluyó una endocámara Mono-CDD (Telecam Storz®), digitalizador de imagen (Digivideo Storz®), fuente de xenón 175W (Storz®) e insuflador automático de CO2 con flujos de reposición de hasta 9l/min. Se empleó una óptica de 10mm y 0°, 2 trocares de 10mm que se introducen por vías umbilical e interxifoumbilical y 2 trocares de 5mm que se sitúan en los cuadrantes derecho e izquierdo de la parte inferior de la cavidad abdominal. En todos los casos, los ganglios extraídos se recogieron dentro de un saco (Endobag Tyco®) colocado en saco de fondo de Douglas desde el comienzo de la intervención. Los trocares umbilicales de 10mm y los de 5mm se utilizan para introducir y utilizar el instrumental y recoger el saco durante la cirugía. La óptica puede desplazarse a una posición más craneal e introducirla por el trocar interxifoumbilical. Durante la histerectomía, la hemostasia del pedículo uterino y parametrial se realizó indistintamente por vía vaginal o por LPC, de acuerdo con las condiciones quirúrgicas. Se utilizó como movilizador uterino el histeróforo de Hourcabie13.
Se recogieron los datos de las diferentes variables estudiadas en una base de datos diseñada en el programa SPSS.
Los resultados se analizaron mediante estudio estadístico a través del sistema informático SPSS (Statistal Package for the Social Science) versión 15.0 para Windows.
En primer lugar se realizó estudio descriptivo: se estudiaron las variables cualitativas mediante cálculo de frecuencias absolutas y relativas. En las variables cuantitativas se calcularon las medidas de tendencia central (media, mediana y moda), así como de dispersión (desviación típica, variancia y rango intercuartílico).
La significación estadística se definió para p<0,05.
Se han estudiado y comparado las diferentes variables a través de contrastes.
En las mujeres con un IMC superior o igual a 35kg/m2 se ha realizado un estudio descriptivo y se han comparado las diferentes variables cuantitativas mediante el test de la t de Student y, para el resto, los test no paramétricos, como el test de la U de Mann-Whitney y el test de Wilcoxon.
El análisis de supervivencia se ha estudiado mediante la aplicación del método de Kaplan-Meier.
ResultadosSe estudiaron aquellas mujeres cuyo IMC era superior o igual a 35kg/m2: un total de 36 mujeres, lo que supone el 21,11% de la población tratada quirúrgicamente de cáncer de endometrio en esta área.
La edad media fue de 64,40 años ±1,28 (rango de 50 a 83). No hubo diferencias significativas entre los 2 grupos: en el que se utilizó la LPC como vía quirúrgica, la media fue de 62 años ±1,67 (rango de 50 a 72) y en el que se utilizó LPM, la media fue de 66,40 años ±1,89 (rango de 52 a 81). El IMC medio tampoco fue estadísticamente diferente cuando se compararon ambos grupos: en el que se utilizó la LPC como vía quirúrgica fue de 38,99kg/m2 ±1,11 (rango de 35,1 a 52) y en el que se utilizó LPM fue de 39,08kg/m2 ±0,78 (rango de 35,33 a 49). No hubo diferencias epidemiológicas entre los 2 accesos quirúrgicos: se hallaron antecedentes de cirugía abdominal previa en 3 mujeres (8,3%); factores de riesgo de desarrollo de enfermedad endometrial (como diabetes, hipertensión, etc.) en 25 mujeres (69,4%), y antecedentes de tratamiento previo con tamoxifeno en 3 mujeres (8,3%).
Procedimiento quirúrgicoEl tiempo quirúrgico, medido desde la incisión en la piel hasta el cierre de ésta, fue más largo (p<0,01) para el grupo en el que se utilizó LPC: 168,25 min +8,57 (rango de 82 a 220) frente al grupo en el que se utilizó LPM: 147,06 min ±10,60 (rango de 75 a 240). Hubo complicaciones intraoperatorias en 5 mujeres (11,9%) del grupo en el que se utilizó LPC. Dos casos se debieron a hemorragias: uno de la epigástrica inferior derecha, que se consiguió controlar con sutura transparietal, y otro a la altura del ligamento infundibulopélvico, que también se pudo controlar por vía laparoscópica. Aunque no hubo complicaciones que podrían definirse como mayores, en 3 casos (18,8%) se precisó la conversión a LPM de mujeres tratadas inicialmente mediante LPC debido a la existencia de hipercapnia incontrolable que dificultaba el tratamiento anestésico de estas mujeres.
El acceso quirúrgico está descrito en la figura 1.
El procedimiento quirúrgico se muestra en la tabla 1.
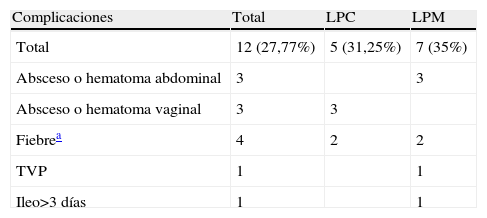
Período postoperatorioHubo complicaciones en 12 casos (33,33%), sin que hubiera diferencias significativas entre los 2 abordajes quirúrgicos (p=0,41) (tabla 2).
Complicaciones postoperatorias
| Complicaciones | Total | LPC | LPM |
| Total | 12 (27,77%) | 5 (31,25%) | 7 (35%) |
| Absceso o hematoma abdominal | 3 | 3 | |
| Absceso o hematoma vaginal | 3 | 3 | |
| Fiebrea | 4 | 2 | 2 |
| TVP | 1 | 1 | |
| Ileo>3 días | 1 | 1 |
LPC: laparoscopia; LPM: laparotomía; TVP: trombosis venosa profunda.
A pesar de no ser estadísticamente diferentes, el tratamiento de los abscesos o hematomas abdominales requirió mayores cuidados y estancias más prolongadas que los tratamientos de abscesos o hematomas vaginales. La estancia media fue significativamente menor (p<0,001) en el grupo en el que se utilizó LPC: 5,25 días ±2,49 (rango de 3 a 11) que en el grupo en el que se utilizó LPM: 7,60 días ±6,2 (rango de 4 a 33). Las cifras de diferencia de hemoglobina (prequirúrgica y posquirúrgica) fueron también significativamente menores en el grupo en el que se utilizó LPC (p<0,001): 2,31g/dl +0,34 (rango de 0,7 a 5,8) frente al grupo en el que se utilizó LPM: 3,01g/dl +0,34 (rango de 0,8 a 5,2). Y además, en aquellos casos en los que no se precisó la conversión a LPM, los resultados fueron todavía mejores: 1,90g/dl +0,24 (rango de 0,70 a 2,90). Hubo 2 casos que precisaron transfusión (5,5%), sin que hubiera diferencias entre los 2 grupos (p=0,67). Un caso se debió a una LPC 1 (6,25%) reconvertida a LPM, y otro caso se presentó en el grupo en el que se utilizó LPM (5%). El reingreso fue necesario en 2 casos (4,8%), ambos en el grupo en el que se utilizó LPM, aunque no se describieron diferencias significativas (p=0,55).
Hallazgos anatomopatológicosSe realizaron linfadenectomías en 26 mujeres (72,22%): en15 mujeres del grupo en el que se utilizó LPC (93,8%) y en 11 mujeres del grupo en el que se utilizó LPM (55%). En todos los casos se realizó un estudio intraoperatorio por congelación. El número de ganglios extraídos fue de 15,06 ganglios ±1,44 (rango de 2 a 21) en el grupo en el que se utilizó LPC, y de 13,52 ganglios ±2,2 (rango de 2 a 21) en el grupo en el que se utilizó LPM. No hubo diferencias significativas entre ambas vías (p=0,47). No se requirieron la disección ni el estudio de ganglios paraaórticos ya que todos los ganglios pélvicos resultaron sin afectación en el estudio intraoperatorio. El estudio en diferido de los ganglios con parafina confirmó la ausencia de afectación ganglionar. Todos los casos fueron del tipo histológico endometrioide. El estadio quirúrgico según la FIGO se analiza en la tabla 3. En todos los casos, los estadios iii según la FIGO se debieron al estudio de citología peritoneal positiva (iiia) sin que hubiera afectación de los ganglios o de los anexos.
Estadios según la Federación Internacional de Ginecología y Obstetricia
| Estadios según la FIGO | LPC | LPM |
| Estadio i | ||
| iaG1 | 1 | 1 |
| iaG2 | 3 | |
| iaG3 | 1 | 1 |
| ibG1 | 4 | 5 |
| ibG2 | 6 | 3 |
| icG1 | 1 | 3 |
| icG2 | 3 | |
| Estadio ii | ||
| iiaG1 | 1 | |
| iiaG2 | 1 | |
| iibG2 | ||
| Estadio iiia | ||
| iiiaG2 | 1 | |
| iiiaG3 | 1 | |
FIGO: Federación Internacional de Ginecología y Obstetricia; LPC: laparoscopia; LPM: laparotomía; TVP: trombosis venosa profunda.
No se han descrito metástasis en la zona de los lugares de inserción de trocar ni en la cicatriz de la pared abdominal. Se protocolizó la radioterapia coadyuvante para estadios superiores a iaG1, iaG2, ibG1 según la FIGO, siempre que las características médicas de las mujeres lo permitiesen, y se administró en 24 mujeres (66,66%). El tiempo medio de seguimiento no fue estadísticamente diferente entre los 2 grupos: en el que se utilizó LPC fue de 37,79 meses ±4,91 (rango de 2 a 63) y en el que se utilizó LPM fue de 45,15 meses ±6,82 (rango de 7 a 95). Tampoco hubo diferencias en el período libre de enfermedad ni en la tasa global de supervivencia (p=0,29). De las mujeres operadas de cáncer de endometrio con un IMC superior o igual a 35kg/m2, han fallecido 7 (19,44%), 2 intervenidas por vía laparoscópica y 5 intervenidas por vía laparotómica. La supervivencia de estas mujeres, hasta la fecha, es del 80,55% (29 mujeres).
DiscusiónEn 1988, la FIGO hizo una revisión de la clasificación actual del cáncer de endometrio que se basó en los datos obtenidos en el abordaje quirúrgico. La estadificación del cáncer de endometrio marcado por la FIGO es la LPM convencional, con histerectomía y doble anexectomía, asociada a lavados y toma de muestra de citología peritoneal y a linfadenectomía pélvica bilateral y aórtica. Aunque el tratamiento de referencia sigue siendo la LPM, se acepta la posibilidad del tratamiento por vía vaginal en aquellos casos asociados a una gran morbilidad quirúrgica y anestésica. Desde que en 1991 comenzaron a presentarse en las diversas publicaciones los resultados sobre la viabilidad del tratamiento laparóscópico del cáncer de endometrio y esta vía ha sido ampliamente aceptada8,9,14–18.
El tratamiento quirúrgico adecuado permite conocer los factores pronósticos y establecer qué mujeres se beneficiarán con el tratamiento adyuvante7.
La obesidad representa uno de los problemas de salud más frecuentes. Su asociación a problemas médicos y a diferentes tipos de cánceres supone una de las consultas más frecuentes de la clínica diaria1,2.
En este medio, como ya se ha comentado, la obesidad es un factor que aparece asociado al cáncer de endometrio con una gran incidencia. El 21,11% de las mujeres intervenidas quirúrgicamente de cáncer de endometrio en los últimos 10 años en este centro presentaban en el momento de la cirugía un IMC superior o igual a 35kg/m2.
Probablemente, el IMC elevado es, junto con la edad, uno de los 2 factores epidemiológicos1,2,4 que se asocian con mayor incidencia al cáncer de endometrio. Esta asociación, descrita en la literatura médica, también fue alta en el caso del presente estudio: sólo 40 mujeres (23,52%) tenían un IMC menor o igual a 28kg/m2 (de las que sólo una mujer tenía un IMC inferior a 18kg/m2 y 20 mujeres tenían un IMC inferior a 25kg/m2); esto implica que la mayoría de esta población presenta al menos un grado de obesidad moderada: IMC entre 28 y 35kg/m2 en 88 mujeres (51,76%).
Los IMC estudiados en esta población han sido similares en las 2 series correspondientes a las 2 vías quirúrgicas. Se han realizado cirugías en mujeres cuyo IMC ha alcanzado 50kg/m2 en el grupo en el que se utilizó LPC, y 52kg/m2 en el grupo en el que se utilizó LPM. Sólo hubo un caso de reconversión a LPM atribuible a la obesidad directamente y se debió a la imposibilidad del tratamiento anestésico en esta mujer.
Diferentes autores2,18,19 coinciden en que el aumento del peso ideal, la obesidad troncular, la ausencia de actividad física diaria y una dieta rica en grasas se relacionan directamente con un aumento del riesgo de tener cáncer de endometrio. En el presente trabajo estos parámetros no han podido valorarse. Sí se ha visto una alta asociación al proceso patológico médico.
La edad media de estas mujeres ha sido elevada, como los datos que aparecen en la bibliografía20–22 muy próxima a los 65 años.
La obesidad es también un factor importante que debe enfrentarse tanto en el tratamiento quirúrgico como en el tratamiento anestésico. El acceso a la cavidad abdominal en estos casos es más complicado en ambas vías, ya que la infiltración grasa del retroperitoneo dificulta la visualización adecuada de los vasos durante la linfadenectomía y la posición de Trendelenburg no es siempre bien tolerada23–25.
Los autores del presente estudio, al igual que otros autores24,26, coinciden en que la obesidad no es una contraindicación en sí misma de ninguna de las vías quirúrgicas, y que la LPC es una alternativa factible como tratamiento quirúrgico en las mujeres obesas que presentan cáncer de endometrio, ya que no sólo permite el tratamiento y la estadificación quirúrgica, sino que además los resultados de morbilidad peroperatoria son mejores respecto a la vía laparotómica en manos expertas. De hecho, las linfadenectomías pélvicas han podido realizarse en un número elevado de casos por vía laparoscópica, mientras que por la vía laparotómica ha habido un mayor porcentaje de problemas técnicos que han impedido completar adecuadamente la estadificación. Los autores de este estudio, como diversos autores, aceptan que la obesidad puede asociarse a un aumento de la tasa de conversión a LPM (básicamente debido al difícil tratamiento anestésico de estas mujeres), a un aumento del tiempo quirúrgico y a un aumento en la tasa de complicaciones peroperatorias respecto a la de mujeres con IMC menores que recibieron intervención por vía laparoscópica27–31.
Sobre la base de la experiencia, las 16 mujeres con un IMC superior a 35kg/m2 intervenidas por vía laparoscópica presentaron una edad media similar (e incluso menor) que la muestra formada por todas las mujeres intervenidas mediante LPC; un número mayor de casos de antecedentes de interés; un tiempo de cirugía superior tan sólo en 12min al tiempo medio utililizado en la LPC global de este centro (similar al que aportaron otros autores24–26) y 21min mayor al tiempo medio obtenido en las LPM de grandes obesas; un número de ganglios similar; unas cifras de hemoglobina media y una estancia media (aunque algo peor que la serie en la que se utilizó LPC global), significativamente menores que las grandes obesas operadas por vía laparotómica. Aunque la tasa de complicaciones no ha sido diferente, la gravedad de éstas ha sido mayor en las mujeres intervenidas por vía laparotómica. La tasa de conversión ha sido aproximadamente el doble que la serie de LPC global. No ha habido diferencias respecto a la tasa de supervivencia. Y, además, se ha podido completar estadificación con linfadenectomía a pesar del IMC alto en la mayoría de los casos.
Respecto a las 20 mujeres con un IMC superior a 35kg/m2 intervenidas por vía laparotómica, los resultados obtenidos son similares a la serie global de LPM32. Se encontraron un mayor número de antecedentes médicos de interés y unas cifras de complicaciones tanto intraoperatorias como postoperatorias discretamente superiores, sobre todo a expensas de un número de infecciones de herida mayor, así como de una pérdida hemática más elevada; la tasa de reingreso fue el doble que la de la serie global y la tasa de supervivencia fue similar. Sólo se pudo completar la estadificación con linfadenectomías en 11 casos (55%). La estancia media ha sido significativamente mayor en el grupo en el que se utilizó la vía laparotómica, y también si se lo compara con la serie general de este centro y con el grupo de mujeres con un IMC inferior a 35kg/m2, en muchos casos debido a la enfermedad de base de estas mujeres.
Cuando se estudió la tasa de transfusión, no se obtuvieron diferencias, probablemente debido al número escaso de éstas; sí hubo diferencias cuando se estudió pormenorizadamente la diferencia de hemoglobina, y se obtuvieron los mejores resultados mediante la vía laparoscópica. Por tanto, podría considerarse a la LPC como una alternativa para reducir el problema de la morbilidad asociada a las mujeres obesas y de las complicaciones postoperatorias.
Sobre la base de la experiencia de los autores de este estudio, así como la de otros autores32 respecto al tratamiento de mujeres obesas, se estima que la LPM en estas mujeres es una técnica complicada. La LPC, sin embargo, permitió acceder a los ganglios pélvicos y a la fosa obturatriz con más facilidad, lo que podría explicarse por el efecto magnificador y aproximador de esta técnica.
No hubo diferencias en el número de ganglios obtenido por las diferentes vías. En el estudio intraoperatorio no se observó ningún ganglio pélvico afectado; dato que se confirmó en el estudio definitivo en diferido con parafina. Estaba previsto realizar linfadenectomía aórtica en aquellos casos de tipo histológico diferente al endometrioide, o en casos con afectación ganglionar pélvica; esto se basa en la escasa afectación ganglionar aórtica (del uno al 2%) cuando los ganglios pélvicos son negativos y para no incrementar innecesariamente la gran morbilidad de estas mujeres con obesidad mórbida. Como ya se ha comentado, el protocolo de este centro es la linfadenectomía pélvica seguida de histerectomía y doble anexectomía en todos los estadios con el fin de evitar los infradiagnósticos de estadios clínicos descritos en estudio preoperatrio y los falsos negativos o discordancias del estudio intraoperatorio de la pieza quirúrgica de infiltración miometrial y cervical; no parece que la realización sistemática de linfadenectomía pélvica aumente signicativamente la morbilidad, sobre todo en los casos en los que la estadificación consigue completarse por vía laparoscópica33–37.
En relación con los estadios y el IMC (de acuerdo con la experiencia de este grupo de estudio), la mayoría fueron estadios precoces.
Respecto a la supervivencia, al comparar las 2 vías quirúrgicas no se obtuvieron diferencias significativas, sí se aprecia una mayor tasa de metástasis o recidivas en los primeros 4 años de seguimiento, tendencia descrita en la bibliografía publicada27,36–38. Hasta la fecha, no se ha observado ninguna recidiva en el lugar de inserción del trocar, posiblemente debido al uso rutinario de sacos endoscópicos para extracción de ganglios; tampoco se han descrito recidivas en la zona de la cicatriz de la LPM.
Con los resultados obtenidos, el acceso laparoscópico en este medio se considera de primera elección para el tratamiento del cáncer de endometrio. Los IMC elevados no son una excepción, ya que se estima que ese abordaje facilita el acceso a la fosa obturatriz y la realización de una estadificación quirúrgica correcta con una morbilidad baja.