Comparar las concentraciones plasmáticas de factor de crecimiento vascular endotelial total en eclámpsicas, preeclámpsicas y embarazadas normotensas.
Materiales y métodoSe incluyó a 30 pacientes con preeclampsia leve (grupo A), 30 pacientes con preeclampsia grave (grupo B) y 30 pacientes con eclampsia (grupo C). El grupo control fue seleccionado por tener edad e índice de masa corporal similar a los grupos en estudio y consistió en 30 embarazadas sanas (grupo D). Solo se incluyó a pacientes nulíparas. Las muestras de plasma se recolectaron antes del parto y, en los grupos en estudio, inmediatamente después del diagnóstico para la determinación de factor de crecimiento vascular endotelial total.
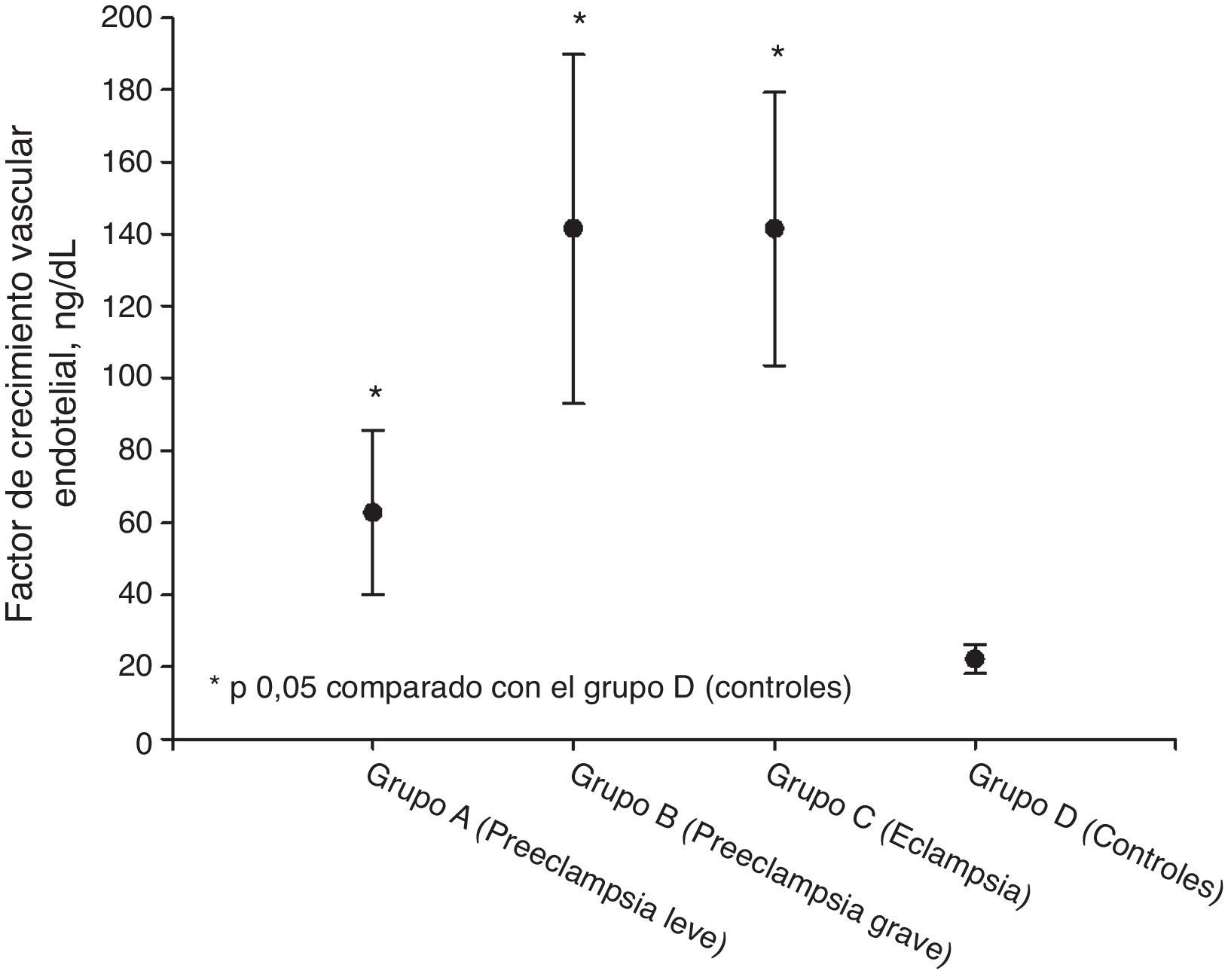
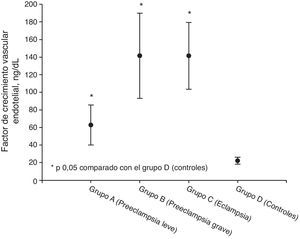
ResultadosLos valores más altos de factor de crecimiento vascular endotelial total se observaron en el grupo de pacientes eclámpsicas (141,4±37,9ng/ml) junto con las preeclámpsicas graves (141,5±48,4ng/ml). Se encontraron valores más bajos en las preeclámpsicas leves (62,8±22,8ng/ml). Los grupos en estudio presentaron valores de factor de crecimiento vascular endotelial significativamente superiores a los controles (22,1±3,99ng/ml; p<0,05). El análisis de regresión lineal mostró que los factores que se relacionaban significativamente con la concentración plasmática de factor de crecimiento vascular endotelial total fueron la proteinuria en 24 h, ácido úrico, transaminasas y creatinina (p<0,05).
ConclusiónLas pacientes eclámpsicas y preeclámpsicas presentan concentraciones plasmáticas de factor de crecimiento vascular endotelial total más altas que las embarazadas normotensas sin estas complicaciones.
To compare plasma concentrations of total vascular endothelial growth factor in eclamptic, preeclamptic and normotensive pregnant women.
Materials and methodWe included 30 patients with mild preeclampsia (group A), 30 patients with severe preeclampsia (group B) and 30 patients with eclampsia (groupC). A control group with a similar age and body mass index to the study groups was selected, consisting of 30 healthy pregnant women (group D). Only nulliparous patients were selected. Plasma samples were collected in all patients before delivery and in the study groups immediately after diagnosis for plasma total vascular endothelial growth factor determination.
ResultsValues of total vascular endothelial growth factor were higher in severe preeclamptic patients (141.5± 48.4ng/ml) and in patients with eclampsia patients (141.4±37.9ng/ml). Values were lower in mild preeclamptic patients (62.8±22.8ng/ml). Values of total vascular endothelial growth factor were higher in the study groups than in controls (22.1±3.99ng/ml; P<.05). Linear regression analysis showed that the factors significantly related to plasma total vascular endothelial growth factor concentrations were 24-hour proteinuria, uric acid, transaminases and creatinine (P<.05).
ConclusionThe results of this study show that eclamptic and preeclamptic patients had higher plasma total vascular endothelial growth factor concentrations than normotensive pregnant women without these complications.
La preeclampsia es un desorden multisistémico exclusivo del embarazo en humanos, que está caracterizado por hipertensión y proteinuria después de las 20 semanas de embarazo. Es la principal causa de morbimortalidad materna y neonatal1. La preeclampsia ocurre en 2 fases: la implantación anormal de la placenta lleva a alteración del flujo sanguíneo placentario, el cual induce la liberación de sustancias por la placenta hacia la circulación materna. A pesar de la investigación, la causa o causas de la preeclampsia son desconocidas2.
El crecimiento vascular durante la implantación y la placentación son críticos para el éxito del embarazo. Se considera que la insuficiencia vascular durante la placentación contribuye a la preeclampsia3. Se ha demostrado que la hipoxia y las citocinas también afectan la expresión del factor de crecimiento vascular endotelial (VEGF) en el trofoblasto, e indican que esta particular familia de proteínas angiogénicas juega un papel crucial en la vasculogénesis fisiológica y la permeabilidad vascular y ha sido implicada en la patogénesis de la preeclampsia2–4.
Varios estudios han demostrado que las concentraciones de VEGF circulantes están aumentadas en forma significativa en la preeclampsia4–6. Sin embargo, otras investigaciones han demostrado que las concentraciones biológicamente activas están disminuidas y las concentraciones de la tirosinacinasa soluble similar a la FMS (también conocida como receptor 1 de VEGF o sFLT-1) están elevadas en las preeclámpsicas7. Sin embargo, tiene muchas de las características necesarias para ser un factor circulante importante en el desarrollo de la preeclampsia, como inducción de la permeabilidad vascular y promoción de la coagulación, 2 hallazgos característicos de la preeclampsia7,8. Más aún, la incubación de arterias de resistencia miometriales con VEGF produce una disminución de la relajación dependiente del endotelio que es similar a la reducción inducida por el plasma de las preeclámpsicas9.
Otros investigadores han reportado disminuciones o ausencia de cambio en las concentraciones plasmáticas de VEGF total10–12. Estas discrepancias pueden reflejar la variedad de pruebas usadas y los diferentes estados físicos de esta proteína (libre o unida a otras sustancias)13. Merchant et al.14, usando una prueba de ELISA de inmunofluorescencia, demostraron la elevación en algunas preeclámpsicas mientras que en las embarazadas normotensas y en las controles no embarazadas las concentraciones no fueron detectables. Kupferminc et al.5 y Eremina et al.15 también demostraron concentraciones elevadas en las preeclámpsicas con el uso de un inmunoanálisis enzimático competitivo. Sin embargo, Wikström y et al.16, usando una prueba de ELISA comercial, encontraron que las concentraciones de VEGF total disminuían en la preeclampsia y en las embarazadas sanas comparadas con los controles no embarazados. El hallazgo de ausencia de elevación en el embarazo es sorprendente, debido a que es un elemento clave en la embriogénesis y formación placentaria14,16.
La determinación de las concentraciones del VEGF total puede ser clínicamente útil para diagnosticar con precisión la preeclampsia10, y se desconocen sus concentraciones en las eclámpsicas, por lo que el objetivo de la investigación fue comparar las concentraciones plasmáticas del VEGF en eclámpsicas, preeclámpsicas y embarazadas normotensas.
MétodosEste estudio de casos y controles se realizó en el Servicio de Obstetricia del Hospital Central Dr. Urquinaona en Maracaibo (Venezuela), de enero del 2006 a febrero del 2012. La investigación fue aprobada por el Comité de Ética e Investigación del hospital y se obtuvo consentimiento por escrito de todas las pacientes. Se incluyó a 30 pacientes con preeclampsia leve (grupo A), 30 pacientes con preeclampsia grave (grupo B) y 30 pacientes con eclampsia (grupoC). El grupo control fue seleccionado por tener edad materna e índice de masa corporal similar a los grupos en estudio y consistió en 30 embarazadas sanas sin enfermedades obstétricas ni sistémicas (grupo D). Solo se incluyó a pacientes nulíparas en la investigación. En las pacientes con eclampsia el consentimiento informado se obtuvo luego de la desaparición del episodio convulsivo o de coma.
La preeclampsia grave se definió si la presión arterial diastólica estaba por encima de 110mmHg o la presión arterial sistólica era de 160mmHg o más, con 3 cruces de proteinuria en un examen cualitativo o 5g en una muestra de orina de 24 h, con presencia de cefalea, alteraciones visuales, dolor abdominal, oliguria (menos de 500ml/24 h), hiperbilirrubinemia, elevación de las concentraciones séricas de creatinina (mayor de 1,0mg/dl), trombocitopenia (menos de 150.000 mm3) y elevación de las concentraciones de las transaminasas después de las 20 semanas de gestación. Las pacientes que cumplieron los criterios para el diagnóstico de preeclampsia, pero no para ser consideradas en el grupo de preeclampsia severa, fueron asignadas al grupo de preeclampsia leve. La eclampsia se definió como la aparición de convulsiones o coma en pacientes con signos y síntomas de preeclampsia17. La presión sanguínea se midió en posición sentada después de 15 min de descanso.
Se excluyó a las embarazadas con polihidramnios, hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso inferior al percentil 10 de referencia), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), tratamiento con antihipertensivos, enfermedad cardiaca, hepática, renal o sistémica crónica, diabetes mellitus pre- o gestacional, hábito tabáquico. También se excluyó a las pacientes que se negaron a participar en la investigación.
Las muestras de sangre se recolectaron en un tubo libre de pirógenos en todas las pacientes antes del parto y, en los grupos en estudio, inmediatamente después del diagnóstico y antes de cualquier intervención. Estas fueron centrifugadas inmediatamente después de que se produjo la coagulación a temperatura ambiente y el sobrenadante del suero fue separado y almacenado a −20° C. Se utilizó una prueba de inmunoanálisis ligado a enzima (ELISA) para la medición cuantitativa de VEGF total (R&D Systems, Minneapolis, EE. UU.). Todas las mediciones fueron hechas por duplicado y el promedio fue el resultado final. Los coeficientes de variación intra- e interensayo fueron de 5 y 7%, respectivamente.
El análisis estadístico usó los procedimientos disponibles en el programa del Sistema de Análisis Estadístico (SAS, SAS Institute. EE. UU.). Los datos se presentan como valores promedios±desviación estándar. El análisis estadístico entre los grupos se realizó con la prueba de ANOVA con posprueba de Dunnett para comparar las características demográficas, el promedio de presión arterial y las concentraciones de VEGF total entre los grupos, tomando como controles a las normotensas sanas (grupo D). Los coeficientes de correlación entre la VEGF total y los parámetros de laboratorio en las preeclámpsicas y eclámpsicas se evaluaron usando la prueba de Pearson. Se consideró un valor p<0,05 como estadísticamente significativo.
ResultadosLas características generales de las pacientes de los 4 grupos se muestran en la tabla 1. No hubo diferencias significativas en la edad materna ni en el índice de masa corporal entre los controles y los grupos en estudio. Se encontraron diferencias estadísticamente significativas en la edad gestacional al momento del parto entre los grupos B y C comparados con los controles (p<0,05). También se encontraron diferencias estadísticamente significativas entre los controles y los 3 grupos de estudio con respecto al peso de los recién nacidos (p<0,05). Se observaron diferencias estadísticas en los valores promedio de presión arterial sistólica, presión arterial diastólica y proteinuria de los 3 grupos en estudio comparados con los controles (p<0,05).
Características generales de los grupos de estudio y control
| Promedio ± desviación estándar | Grupo A preeclampsia leve (n=30) | Grupo B preeclampsia grave (n=30) | Grupo C eclampsia (n=30) | Grupo D controles (n=30) |
|---|---|---|---|---|
| Edad materna, años | 20,4 ± 2,2 | 20,1 ± 2,5 | 21,6 ± 3,2 | 21,3 ± 1,8 |
| Edad gestacional al momento del parto, semanas | 37,0 ± 1,7 | 34,1 ± 1,3* | 34,7 ± 1,9* | 37,6 ± 1,78 |
| Índice de masa corporal, kg/m2 | 27,9 ± 1,1 | 27,4 ± 1,2 | 27,1 ± 0,8 | 27,6 ± 0,8 |
| Peso del recién nacido, gramos | 2.845 ± 295* | 2.319 ± 357* | 2.041 ± 301* | 3.251 ± 469 |
| Presión arterial sistólica, mmHg | 136,0 ± 6,7* | 152,3 ± 7,7* | 142,3 ± 13,3* | 104,9 ± 6,59 |
| Presión arterial diastólica, mmHg | 97,6 ± 5,0* | 110,3 ± 6,1* | 112,3 ± 6,9* | 73,9 ± 7,7 |
| Proteinuria, g/24h | 1,7 ± 0,6* | 5,6 ± 0,8* | 6,2 ± 1,1* | 0,2 ± 0,1 |
Las pacientes con preeclampsia grave presentaron las mayores concentraciones de hemoglobina de los 4 grupos estudiados, siendo esta diferencia estadísticamente significativa comparada con los controles (p<0,05). Las preeclámpsicas graves y las eclámpsicas presentaron valores más altos de transaminasas, deshidrogenasa láctica y ácido úrico comparadas con los controles (p<0,05; tabla 2). Los niveles promedio de plaquetas fueron significativamente menores en los 3 grupos de estudio comparados con los controles (p<0,05).
Parámetros de laboratorio grupos estudio y control
| Promedio ± desviación estándar | Grupo A preeclampsia leve (n=30) | Grupo B preeclampsia grave (n=30) | Grupo C eclampsia (n=30) | Grupo D controles (n=30) |
|---|---|---|---|---|
| Hemoglobina, g/dl | 10,3 ± 1,0 | 11,9 ± 1,6 | 9,4 ± 0,9 | 10,1 ± 1,5 |
| Plaquetas, por mm3 | 199.000 ± 29.914* | 149.000 ± 41.292* | 138.343 ± 28.945* | 252.000 ± 32.335 |
| AST, UI/dl | 31,3 ± 10,0 | 133,1 ± 46,3* | 170,7 ± 60,3* | 23,8 ± 5,1 |
| ALT, UI/dl | 20,8 ± 5,0 | 148,4 ± 46,9* | 137,9 ± 33,1 | 18,9 ± 0,4 |
| LDH, UI/dl | 614,8 ± 97,6 | 1169,3 ± 181,1* | 1733,8 ± 641,2* | 531,8 ± 64,0 |
| Creatinina, mg/dl | 0,8 ± 0,2 | 0,9 ± 0,6 | 1,0 ± 0,3* | 0,7 ± 0,2 |
| Ácido úrico, mg/dl | 5,9 ± 1,1* | 7,1 ± 1,5* | 8,6 ± 0,9* | 3,6 ± 0,4 |
| Factor de crecimiento vascular endotelial, ng/dl | 62,8 ± 22,8* | 141,5 ± 48,4* | 141,4 ± 37,9* | 22,1 ± 3,99 |
Las concentraciones de VEGF total en cada uno de los grupos se muestran en la tabla 2 y figura 1. Los valores más elevados se observaron en el grupo de preeclámpsicas graves (141,5±48,4ng/ml) junto con las pacientes eclámpsicas (141,4±37,9ng/ml). También se encontraron valores elevados en las preeclámpsicas leves (62,8±22,8ng/ml). Los grupos en estudio presentaron valores de VEGF total significativamente superiores a los controles (22,1±3,99ng/ml; p<0,05).
Al correlacionar las concentraciones de VEGF total con los diferentes parámetros de laboratorio, se observó una correlación positiva y significativa con los valores de proteinuria en 24 h (r=0,458; p<0,05), ALT (r=0,529; p<0,05), AST (r=0,525; p<0,05), ácido úrico (r=0,502; p<0,05) y creatinina (r=0,100; p<0,05) y correlación negativa y significativa con el número de plaquetas (r=−0,495; p<0,05). El análisis de regresión lineal mostró que los factores que se relacionaban significativamente con la concentración plasmática de VEGF total eran: el valor de la proteinuria en 24 h, ácido úrico y ALT (p<0,05).
DiscusiónLos resultados de esta investigación demuestran que las pacientes eclámpsicas y preeclámpsicas tienen concentraciones plasmáticas de VEGF total más altas comparadas con las pacientes normotensas. También se demostró que las concentraciones de VEGF total se correlacionan en forma positiva con la proteinuria en 24 h, aminotransaminasas, ácido úrico y creatinina y en forma negativa con el número de plaquetas.
La alteración del balance entre estimulantes e inhibidores de la angiogénesis podría estar involucrada en la patogénesis de varias enfermedades en las cuales la disfunción endotelial es un factor contribuyente, como en pacientes con diferentes tipos de cáncer o endometriosis18. El aumento de las concentraciones de VEGF total podría ser derivado de la placenta, plaquetas maternas o células del músculo liso. Su elevación puede contribuir a la extravasación de proteínas plasmáticas, el desarrollo de proteinuria, disminución de la dilatación vascular dependiente del endotelio, aumento del tono basal, permeabilidad y señales de disfunción endotelial1.
Existe evidencia indirecta que apoya que el VEGF es el mediador de la activación de las células endoteliales en la preeclampsia, ya que induce incremento significativo dependiente de la concentración en la producción de prostaciclina en forma similar a los efectos agudos del plasma de las preeclámpsicas, que pueden ser inhibidos por anticuerpos contra el VEGF19. Además, se ha descrito que también incrementa la producción de óxido nítrico en las células endoteliales humanas20. Hayman et al.21 demostraron que el plasma de las preeclámpsicas altera la función endotelial de las arterias de resistencia miometriales, comparadas con mujeres con embarazos sin complicaciones, al demostrar una reducción en la relajación de los vasos previamente contraídos. En forma similar, la incubación de vasos de resistencia miometrial de embarazadas normotensas sanas con VEGF produjo una reducción en la relajación dependiente del endotelio, lo cual es similar a la reducción inducida por el plasma de las preeclámpsicas18.
Los hallazgos en esta y otras investigaciones de concentraciones elevadas de VEGF total señalan que podrían ser parte de los mecanismos moleculares en el desarrollo anormal de la placenta y es un factor importante involucrado en la patogénesis de la preeclampsia y sus complicaciones. Se ha demostrado que el VEGF aumenta la permeabilidad vascular a través de la producción de óxido nítrico y prostaciclina en las células endoteliales22. Además, se ha demostrado que produce vasodilatación acompañada de hipotensión y taquicardia a través de mecanismos dependientes del óxido nítrico23.
Las necesidades de los efectos biológicos del VEGF son mayores en el glomérulo que en cualquier otro tejido, probablemente para el mantenimiento de la barrera de filtración glomerular, lo cual se demostró por la correlación observada con la proteinuria, ácido úrico y creatinina. Una tendencia crítica es necesaria para mantener la vasculatura establecida en el adulto. La reducción o sobreexpresión o incremento de la sFLT-1 se traduce en endoteliosis glomerular (la lesión característica de la preeclampsia), hipertensión y proteinuria15.
Aún se debe comprobar si los cambios en las concentraciones del VEGF reflejan los cambios funcionales que produce esta proteína in vivo, relativos a las tasas de degradación y la alteración a la unión de proteínas. Las concentraciones circulantes existen en forma libre y unida a proteínas. El sFLT-1 y la alfa2-macroglobulina son proteínas que se unen al factor. Solo una pequeña porción se une al sFLT-1 in vivo. Mientras que se ha demostrado que la sFLT-1 es un potente antagonista del VEGF, no está claro como la alfa2-macroglobulina afecta la función8,13,24. Bhattacharjee et al.25 demostraron que, bajo condiciones fisiológicas, la alfa2-macroglobulina no afecta la disponibilidad para inducir la proliferación celular o para regular el calcio. Por lo tanto, la unión del VEGF con la alfa2-macroglobulina puede preservar la acción biológica. Considerando que la globulina está presente en el plasma humano a concentraciones más altas (2-4mg/ml) que el sFLT-1, si la unión a la alfa2-macroglobulina preserva su actividad biológica, el incremento del VEGF total puede contribuir a la patogénesis de la preeclampsia6. El sFLT-1 regula en forma positiva las señales a través de la Flk-1 y antagoniza las acciones del VEGF24,26. Quizás esta es una respuesta protectora de la placenta para bloquear el exceso de las concentraciones séricas del VEGF total circulante en la sangre materna11.
Hasta la fecha, no se conoce ninguna investigación que suministre datos sobre las concentraciones de VEGF en pacientes con eclampsia. Los resultados de esta investigación demuestran que las preeclámpsicas severas y las eclámpsicas presentaron concentraciones significativamente superiores de VEGF total comparadas con las embarazadas normotensas. Este hallazgo podría ser explicado porque los cambios fisiopatológicos de ambos cuadros clínicos son similares y, por tanto, no permiten diferenciar a aquellas pacientes que presentaron convulsiones.
ConclusionesLos hallazgos de esta investigación demuestran que las pacientes eclámpsicas y preeclámpsicas presentan concentraciones de VEGF total plasmática más altas que las embarazadas sin estas complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.