Comparar el efecto del tratamiento con hierro oral e intravenoso en la anemia ferropénica posparto.
Material y métodoTrece mujeres con hemoglobina 7-10g/dl y ferritina < 15μg/l a las 24h posparto fueron aleatorizadas en 2 grupos, uno recibió hierro intravenoso (2 dosis de 200mg de hierro sacarosa) los días 2 y 4 tras el parto, y el otro el tratamiento estándar, 200mg de sulfato ferroso oral 2 veces/día durante 6 semanas.
ResultadosEn el grupo del hierro intravenoso los valores de ferritina el día 7 fueron superiores (p=0,002) (298,3±159,1μg/l) que el hierro oral (21,3±9,4μg/l). El día 14 también se detectaron diferencias entre ambos grupos (123,7±65,1μg/l en el grupo con hierro intravenoso y 24,6±9,3μg/l en el grupo de hierro oral, p=0,004). Los valores de hemoglobina y hematocrito aumentaron en ambos grupos los días 7, 14 y 42, sin encontrar diferencias estadísticamente significativas. Sólo se detectaron efectos secundarios en el grupo del hierro oral (29%, n=2) todos de carácter leve.
ConclusionesEl hierro intravenoso puede ser una alternativa en el tratamiento de la anemia ferropénica posparto especialmente en pacientes que no toleren o rechacen las formulaciones orales.
To compare the effect of treatment with oral and intravenous iron in postpartum iron deficiency anemia.
Material and methodThirteen women with hemoglobin values of 7-10g/dl and ferritin values of < 15 microgram/l at 24h postdelivery were randomized in two groups: one group received intravenous iron (two doses of 200mg ferrous sucrose) on days 2 and 4 after labor and the other group received standard treatment with oral ferrous sulphate 200mg twice daily for 6 weeks.
ResultsBy day 7, ferritin levels were significantly higher (p=0.002) in the group treated with intravenous iron (298.3±159,1μg/l) than in that treated with oral iron (21.3±9.4μg/l). By day 14, differences between these two groups were also detected (123.7±65.1μg/l in the intravenous iron group and 24.6±9.3μg/l in the oral iron group, p=0.004). Hemoglobin and hematocrit levels increased in both groups on days 7, 14 and 42 with no statistically significant differences. Adverse effects were detected in the oral iron group only (29%, n=2), although all were mild.
ConclusionsIntravenous iron could be an alternative in the treatment of postpartum iron deficiency anemia, especially in patients who are unable to tolerate or who reject oral formulations.
La anemia ferropénica en el embarazo es una entidad que aparece entre el 10-30% de las mujeres gestantes1,2, llegando a ser severa en un 10% de los casos1, por lo que merece especial atención debido a sus potenciales consecuencias, tanto para la madre como para el feto3.
La causa principal de este tipo de anemia es el déficit de hierro, debido fundamentalmente al aumento de la demanda por parte de la unidad fetoplacentaria durante el embarazo y a la pérdida sanguínea durante el parto4–7. Estas situaciones se acentúan en caso de hemorragias crónicas durante la gestación o sangrados mayores durante el parto.
A las consecuencias clínicas habituales de la anemia (síntomas cardiovasculares, disminución del rendimiento físico y mental, cefaleas y anorexia, entre otros) se une, en el caso de la mujer en el periodo posparto, una merma importante en su capacidad para cuidar del recién nacido, un mayor riesgo de infecciones8–10, endometritis, fallo en la lactancia y depresión posparto10.
En definitiva, la anemia afecta a las actividades de la vida diaria de la paciente, lo que se traduce en un deterioro de su calidad de vida11,12.
El tratamiento estándar de la anemia posparto es el hierro oral12,16, un tratamiento seguro aunque con efectos secundarios leves frecuentes13,14, como pirosis, dolor epigástrico, náuseas, diarrea o estreñimiento que limitan el cumplimiento terapéutico12. Mediante este tratamiento la recuperación del estado óptimo de las reservas de hierro así como de los valores de hemoglobina exige un periodo de tiempo considerable en el cual la paciente sufrirá las consecuencias negativas de la anemia12. En definitiva, aunque se trata de un tratamiento útil en la mayoría de la población, es poco efectivo en caso de pacientes con problemas gástricos, bajo cumplimiento terapéutico o anemias severas15 por lo que siempre se ha tratado de buscar otras alternativas terapéuticas.
Hasta hace unos años, la medida más rápida para mejorar el estado de estas pacientes, y sobre todo en caso de anemias severas, eran las transfusiones4. Pese a ser un procedimiento seguro, no está exento de riesgos como reacciones alérgicas, febriles y hemolíticas16,17, por lo que la transfusión debería verse como último recurso en mujeres jóvenes y sanas como son la mayoría de las puérperas18.Además, la falta una indicación protocolizada ha producido una gran variabilidad entre los equipos médicos y hospitales, con una significante proporción de transfusiones realizadas innecesariamente19.
El hierro intravenoso puede ser, según ciertos estudios, una forma eficaz de corregir este tipo de anemias en un corto tiempo16,17,20,21 y una buena alternativa a las transfusiones17. La administración parenteral de hierro sacarosa se usa de rutina en muchos países europeos aunque su precio es muy superior al del hierro oral e implica un coste adicional de personal. Otros preparados intravenosos han sido usados previamente, particularmente el hierro dextrano, pero debido al riesgos de reacciones anafilácticas existe hoy en día un notable rechazo a su administración22,23. El hierro sacarosa, sin embargo, tiene un buen perfil de seguridad siendo las reacciones adversas más frecuentes de carácter leve17 aunque existen efectos secundarios propios o asociados a la administración del fármaco que no hay que olvidar22.
Nuestro estudio pretende comparar la efectividad y seguridad del hierro sacarosa intravenoso frente al hierro oral en el tratamiento de la anemia posparto.
Material y métodosEnsayo clínico comparativo, aleatorizado y abierto, realizado entre el día 1 de marzo y el día 31 de mayo del año 2008. En el estudio se incluyeron mujeres mayores de 18 años con anemia ferropénica posparto, definida por la presencia de una cifra de hemoglobina (Hb) de 7 a 10g/dl y de ferritina < 15μg/l a las 24h posparto24,25. Los criterios de exclusión se exponen en la tabla 1.
Criterios de exclusión
| Intolerancia a derivados del hierro |
| Anemia no ferropénica, hemolítica o talasemia |
| Hemocromatosis y hemosiderosis |
| Necesidad de transfusión durante el parto |
| Asma y atopia graves |
| Tromboembolia |
| Abuso de alcohol o drogas |
| Serología positiva para virus de hepatitis B, C o VIH |
| Infección aguda o crónica |
| Disfunción renal o hepática |
| El no consentimiento de la paciente |
El tratamiento comenzó 24-48h después del parto, tras obtener los resultados de la primera analítica y establecer el diagnóstico de anemia por déficit de hierro. Las mujeres fueron divididas en 2 grupos, mediante un sistema de aleatorización basado en sobres cerrados con una relación 1:1 que permitía tamaños muestrales similares en ambos grupos. El grupo A recibió tratamiento con hierro intravenoso que constaba de 2 dosis de 200mg de hierro sacarosa (Venofer®) los días 2 y 4 después del parto. Dado el posible riesgo de reacciones anafilactoides, la administración de hierro intravenoso se realizó durante el ingreso de la paciente o en el hospital de día. En todo momento, la paciente estuvo monitorizada y se dispusieron los medios pertinentes para el tratamiento de este tipo de complicaciones.
El otro grupo, grupo B, recibió el tratamiento de hierro por vía oral: 200mg de sulfato ferroso oral (Tardyferon®) 2 veces al día durante 6 semanas (1 cápsula/12h, antes de las comidas).
Se les pidió a las pacientes que registraran todos los efectos adversos producidos por el tratamiento y se les recordó que no podían tomar durante el estudio ningún otro suplemento que contuviera hierro. El estudio fue aprobado por el Comité de Ensayos Clínicos de la Unidad de Investigación de Álava y se realizó de acuerdo con las normas de la declaración de Helsinki. Todas las pacientes fueron informadas de las características y objetivos del estudio y se obtuvo su consentimiento informado antes de su inclusión.
Se elaboraron hojas de recogida de datos específicas para la obtención de las características de la paciente y del parto, así como los efectos adversos detectados.
Se recogieron los resultados de hemoglobina, hematocrito y marcadores del estado del hierro (ferritina y hierro sérico) obtenidos el día de la selección (día 0), y los días 7, 14 y 42. Estos puntos en el tiempo están elegidos en función de estudios previos16. Intentan detectar variaciones en la velocidad de restauración de los valores de hemoglobina y reservas de hierro, queriendo a su vez minimizar las molestias de las mujeres que forman parte del estudio.
Las entrevistas de seguimiento se realizaron en ambos grupos tras los resultados de las analíticas que las pacientes se debían realizar los días establecidos. En dichas entrevistas se les informaba de los resultados y se les preguntaba por el cumplimiento del tratamiento (en el caso del hierro oral) y los efectos adversos.
Se realizó un análisis descriptivo de las características de las pacientes al inicio del estudio. Se describieron los factores de riesgo en estudio mediante su distribución de frecuencias y porcentual. Las variables de resultado se han descrito mediante su media, mediana, desviación estándar y valores mínimo y máximo.
El cambio observado en ferritina, hemoglobina o hierro plasmático entre el momento basal y las 3 determinaciones de seguimiento se ha evaluado mediante la prueba de Wilcoxon debido al pequeño tamaño final de la muestra.
La comparación entre el cambio observado en función de la presencia o ausencia de los distintos factores de riesgo estudiados se ha evaluado mediante la prueba no paramétrica de Mann-Whitney debido también al pequeño tamaño final de la muestra.
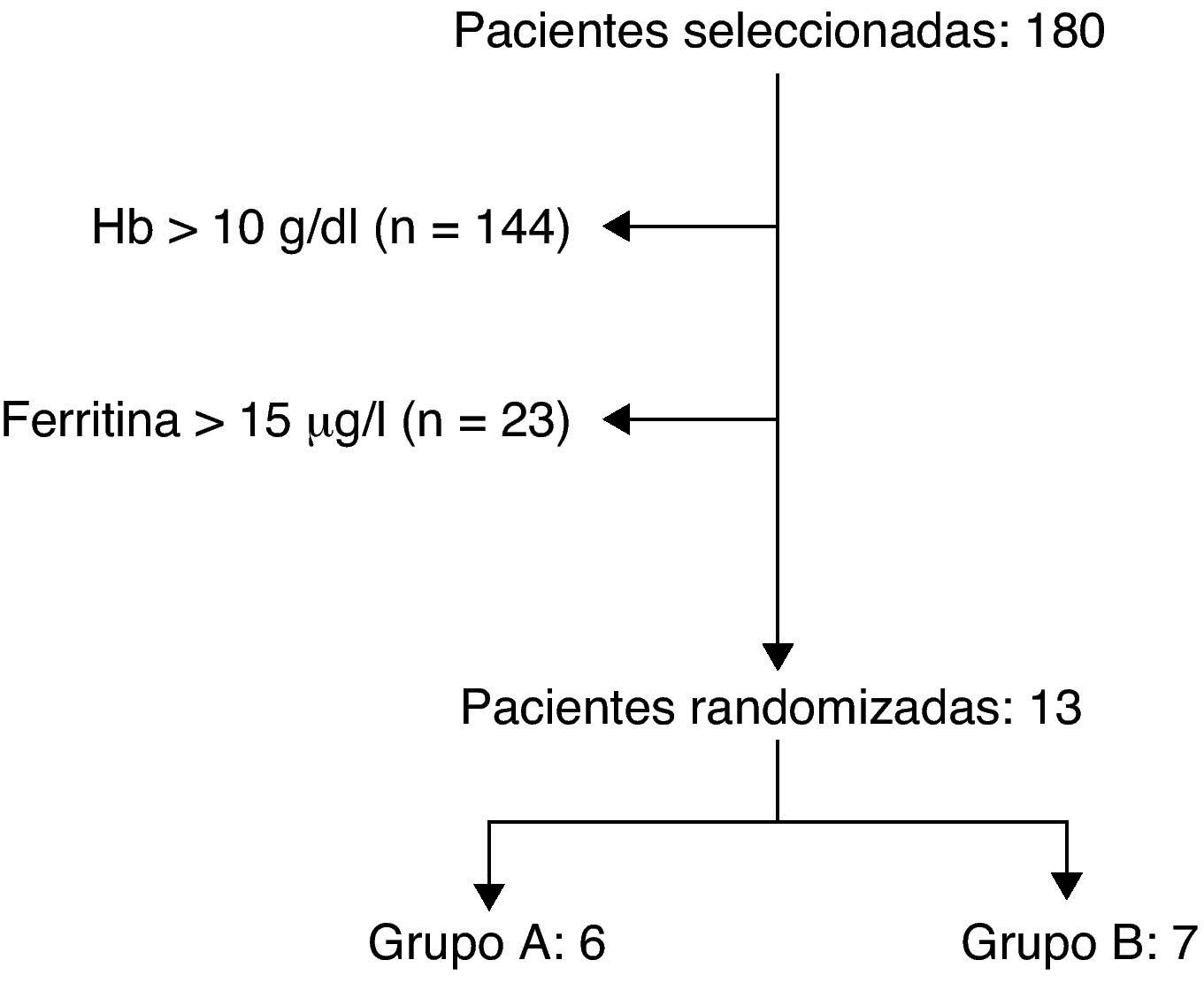
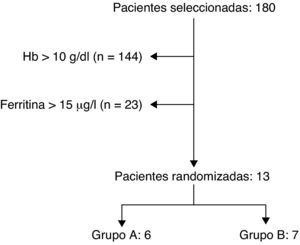
ResultadosSe estudiaron 180 mujeres en este periodo realizándose un hemograma y perfil férrico a las 24h del parto. En el periodo posparto, el 20% (n=36) de las mujeres se veían afectadas por una anemia con cifras de hemoglobina inferiores a 10g/dl, y hasta un 4% (n=7) sufrían una anemia grave (hemoglobina < 8g/dl). El 31% (n=56) de las mujeres tenían rangos de hemoglobina entre 10-11,4g/dl, catalogándose como una anemia leve. En las restantes 88 mujeres (49%) no se encontró anemia posparto. Sólo cumplieron los criterios de inclusión 13 mujeres, aunque únicamente se dispone de datos completos de 11 de ellas (fig. 1).
Dentro de las mujeres con una hemoglobina inferior a 10g/dl en el posparto, posibles candidatas a participar en nuestro estudio, se observó que el 56% (n=20) de ellas tuvieron un parto eutócico, al 28% (n=10) se les practicó una cesárea segmentaria transversa, al 11% (n=4) se les realizó una ventosa y al 5% (n=2) un fórceps.
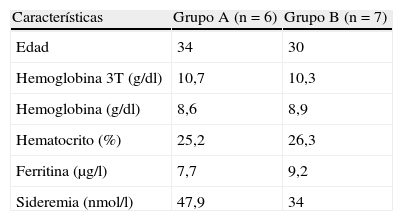
Todas las pacientes estaban hemodinámicamente estables en el momento de la inclusión en el estudio. Los grupos no difirieron en las características basales de laboratorio (tabla 2).
En el grupo del hierro intravenoso, grupo A, se incluyeron 6 mujeres. Cinco de ellas tuvieron un parto vaginal normal y a una se le practicó una ventosa como alivio del expulsivo. Las 6 mujeres (100%) completaron el estudio, acudiendo a todos sus controles analíticos. El análisis de los parámetros bioquímicos no determinó relación alguna entre el tipo de parto y la evolución de la anemia.
En el grupo del hierro oral, grupo B, se incluyeron 7 mujeres, 6 (86%) tuvieron un parto vaginal normal y a una se le practicó una cesárea por haber tenido 2 cesáreas anteriores. Del total de las mujeres del grupo, sólo completaron el estudio 5 (71%), ya que 2 (29%) no se presentaron para realizar los controles sucesivos. En ambos casos el abandono del estudio fue por motivos personales, sin relación alguna con el tratamiento.
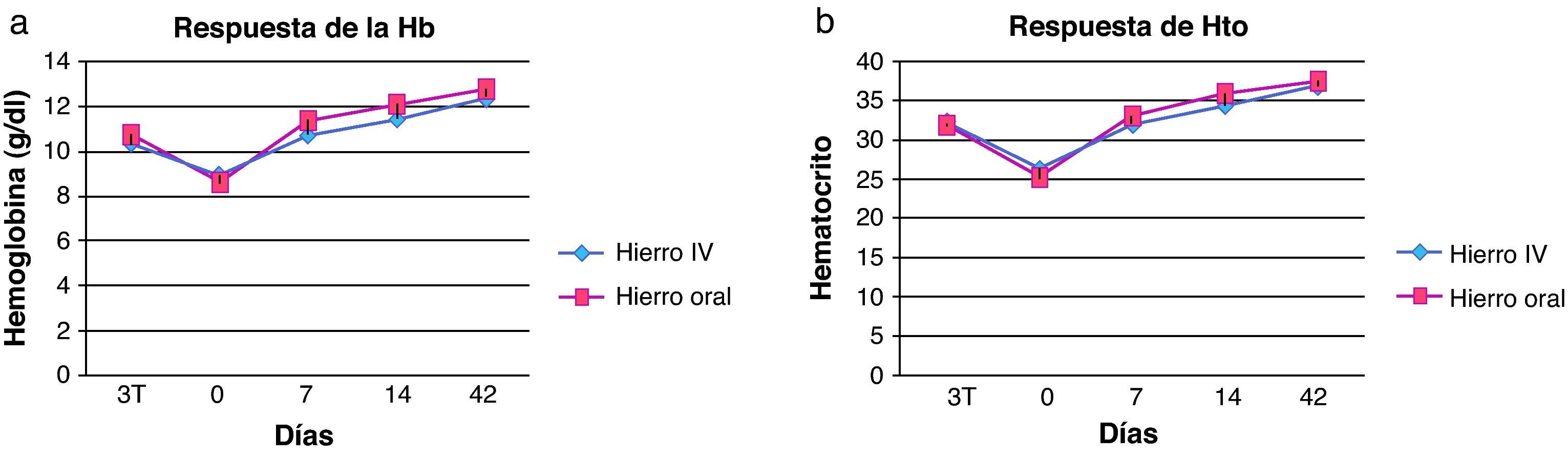
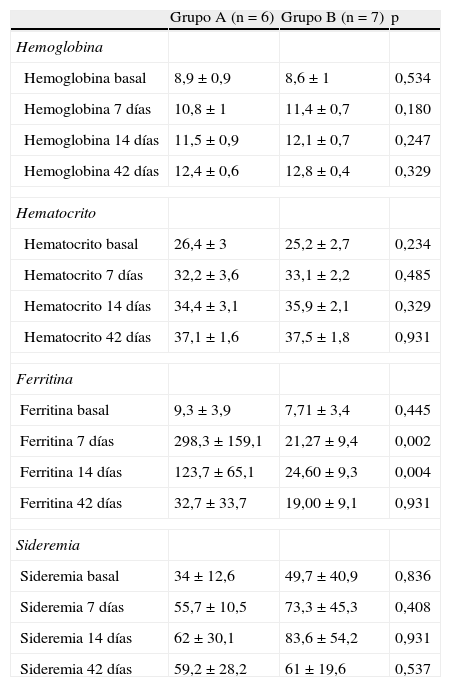
Los niveles de hemoglobina y hematocrito (tabla 3) aumentaron respecto a los valores basales (día 0) en ambos grupos los días 7, 14 y 42, sin encontrar diferencias estadísticamente significativas entre el grupo de tratamiento oral y el intravenoso. Ambos grupos el día 42 habían superado la anemia, encontrándose los valores de estos parámetros dentro de los límites normales (figs. 1 y 2).
Resultados evolutivos (días 7,14 y 42 del estudio)
| Grupo A (n=6) | Grupo B (n=7) | p | |
| Hemoglobina | |||
| Hemoglobina basal | 8,9±0,9 | 8,6±1 | 0,534 |
| Hemoglobina 7 días | 10,8±1 | 11,4±0,7 | 0,180 |
| Hemoglobina 14 días | 11,5±0,9 | 12,1±0,7 | 0,247 |
| Hemoglobina 42 días | 12,4±0,6 | 12,8±0,4 | 0,329 |
| Hematocrito | |||
| Hematocrito basal | 26,4±3 | 25,2±2,7 | 0,234 |
| Hematocrito 7 días | 32,2±3,6 | 33,1±2,2 | 0,485 |
| Hematocrito 14 días | 34,4±3,1 | 35,9±2,1 | 0,329 |
| Hematocrito 42 días | 37,1±1,6 | 37,5±1,8 | 0,931 |
| Ferritina | |||
| Ferritina basal | 9,3±3,9 | 7,71±3,4 | 0,445 |
| Ferritina 7 días | 298,3±159,1 | 21,27±9,4 | 0,002 |
| Ferritina 14 días | 123,7±65,1 | 24,60±9,3 | 0,004 |
| Ferritina 42 días | 32,7±33,7 | 19,00±9,1 | 0,931 |
| Sideremia | |||
| Sideremia basal | 34±12,6 | 49,7±40,9 | 0,836 |
| Sideremia 7 días | 55,7±10,5 | 73,3±45,3 | 0,408 |
| Sideremia 14 días | 62±30,1 | 83,6±54,2 | 0,931 |
| Sideremia 42 días | 59,2±28,2 | 61±19,6 | 0,537 |
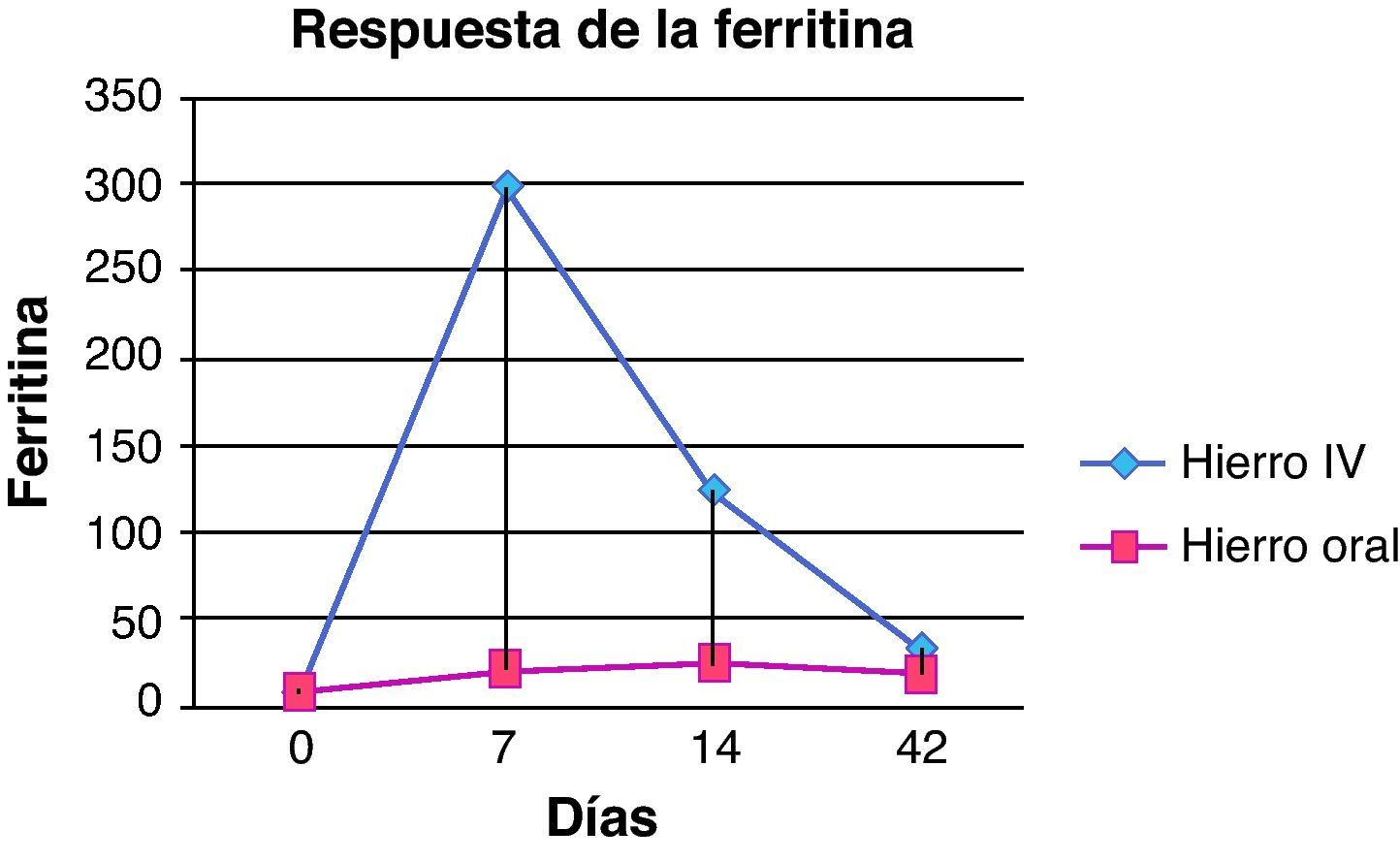
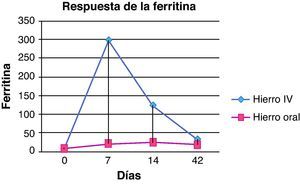
En cuanto a la ferritina (fig. 3), en el grupo del hierro intravenoso los valores en el día 7 fueron superiores (298,3±159,1μg/l) que el hierro oral (21,3±9,4μg/l) siendo la diferencia significativa en el aumento de la ferritina (p=0,002). Asimismo, el día 14 también se detectaron diferencias entre ambos grupos (123,7±65,1μg/l en grupo con hierro intravenoso y 24,6±9,3μg/l el grupo de hierro oral, p=0,004). Sin embargo, el día 42 los niveles en ambos grupos eran similares, sin encontrarse diferencias estadísticamente significativas (32,7±33,7 y 19±9,1μg/l en grupo de hierro intravenoso y el grupo de hierro oral respectivamente, p=0,931). Los valores de hierro sérico también aumentaron en ambos grupos sin observarse diferencias significativas entre ellos en ninguna determinación realizada durante el estudio.
El grupo al que se le administró el hierro intravenoso no declaró ningún efecto secundario ni alteración hemodinámica mientras que en el caso de las pacientes que utilizaron el hierro oral el 29% (n=2) refirieron efectos adversos leves, todos ellos gastrointestinales: dispepsia, náuseas y estreñimiento.
DiscusiónLa anemia ferropénica posparto es un problema habitual al que tienen que enfrentarse los obstetras15. Para su tratamiento, la vía oral es la forma de administración preferida debido a su sencillez y aceptabilidad por parte de los pacientes y facultativos, pese a ello, nos encontramos situaciones como anemias severas o problemas gastrointestinales graves en las que la administración de hierro oral no es eficaz4,17 y es necesario plantear otras alternativas, sobre todo en caso de ser necesario obtener resultados en periodo corto de tiempo12,17.
En estos casos, la administración de hierro intravenoso es una alternativa que debe evaluarse para determinar si es una opción válida para alcanzar los niveles óptimos establecidos y evitar transfusiones sanguíneas.
En nuestro caso, el porcentaje de mujeres que presentaban una anemia ferropénica fue del 7,2%, porcentaje inferior al reportado por otros autores1,2, lo que condicionó el tamaño muestral final. La explicación a esta menor incidencia de anemia ferropénica posparto podría ser un control más exhaustivo del embarazo y sus posibles complicaciones en nuestro medio.
En el estudio se ha observado que las 2 dosis de 200mg de hierro intravenoso reponen de una forma más rápida los depósitos de hierro dentro de la primera semana. Sin embargo, no se han observado diferencias significativas en el incremento de los valores de hemoglobina y hematocrito, remontándose la anemia en ambos grupos en el día 42. Aunque el tipo de parto condiciona en muchas ocasiones las pérdidas sanguíneas, en nuestro estudio no ha afectado a los resultados analíticos, ya que no se detectaron diferencias entre ambos grupos.
Estos datos indican que la administración intravenosa logra resultados rápidos pero no supera a las formulaciones orales a medio-largo plazo26. Las razones por las que el tratamiento oral necesita un periodo más largo se encuentra en el propio mecanismo de absorción del fármaco. Sabemos que los fármacos destinados a la ferroterapia oral inundan la mucosa gastrointestinal de iones de hierro, cuya cantidad rebasa considerablemente la capacidad de absorción de la mucosa. Como consecuencia se detectan menores coeficientes de absorción, irritaciones de las mucosas y, como secuela, fenómenos de intolerancia que sobre todo con dosis altas.
Por otro lado, el periodo posparto se produce un aumento de la proteína C reactiva (PCR)27,28 que bloquea la absorción gastrointestinal de hierro y disminuye la movilización de las reservas de hierro29. Teniendo esto en cuenta, sería de esperar que la respuesta en el grupo de tratamiento oral fuera peor que en el grupo del tratamiento intravenoso, sin embargo, en nuestro estudio hemos detectado una efectividad similar en los principales parámetros utilizados en los 2 tratamientos.
En nuestro estudio la adhesión al tratamiento oral fue buena según lo descrito por las pacientes30, aunque no fue objetivado de ningún modo. Sin embargo, otros estudios en los que sí se determinó la adhesión al tratamiento de forma objetivada esta fue muy inferior12,31.
En cuanto al perfil de seguridad y tolerancia, en nuestro estudio el hierro sacarosa intravenoso no se ha asociado a ningún efecto adverso, y ha sido bien tolerado en todos los casos aunque otros investigadores han detectado episodios de carácter leve o moderado15. Este hallazgo está sostenido por estudios previos que investigaron el perfil de seguridad de este fármaco durante el embarazo y el posparto. Entre las pacientes que tomaron hierro oral el 29% sufrieron efectos adversos, todos ellos gastrointestinales de carácter leve, valores similares a los detectados en otros estudios15,30. Aunque los efectos secundarios suelen ser uno de los principales escollos en el cumplimiento de este tratamiento, a diferencia de otros estudios31, en nuestro caso no interfirió en el cumplimiento.
Las principales limitaciones de este estudio son el limitado número de pacientes que participaron y el hecho de tratarse de un estudio abierto. Ambos factores limitan de forma considerable la interpretación y hace que sea más importante si cabe valorar de forma cuidadosa los resultados.
Los resultados de este estudio indican que el hierro intravenoso puede ser una alternativa que se debe valorar en el tratamiento de la anemia ferropénica posparto con un excelente perfil de seguridad. Además, al utilizar dosis inferiores a las empleadas en otros estudios, se plantea la opción de lograr resultados óptimos con menos dosis, lo cual se traduce en una disminución del coste del tratamiento, molestias y riesgos para la paciente.
En conclusión, el hierro intravenoso puede ser una opción útil para el tratamiento de esta enfermedad en pacientes que no toleren o rechacen las formulaciones orales e intentando evitar transfusiones sanguíneas innecesarias. Pese a esto, las limitaciones presentes en este estudio unido a los costes del tratamiento obligan a realizar estudios más amplios en nuestro entorno que permitan valorar este tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.