El tratamiento para cáncer de ovario es cirugía citorreductora primaria óptima y quimioterapia adyuvante basada en platinos. La mayoría se diagnostica en etapas avanzadas; la cirugía en enfermedad recurrente no se asocia con aumento en la sobrevida global. El manejo con quimioterapia intraperitoneal expone el tejido tumoral a altas concentraciones dentro de la cavidad peritoneal. La toxicidad, morbilidad perioperatoria o efectos por la hipertermia no están establecidos. La morbimortalidad asociada con citorreducción oncológica radical y quimioterapia abdominal es alta, puede derivar directamente de la cirugía, de la quimioterapia o de ambas. Se han publicado cifras del 0% al 43% de morbilidad y del 0-20% de mortalidad.
Material y métodosSe realizó un estudio de tipo observacional, retrospectivo, no experimental y descriptivo de pacientes con diagnóstico de cáncer de ovario recurrente o avanzado, tratadas con peritonectomía pélvica o total y cirugía citorreductora con quimioterapia intraperitoneal. Se realizó el análisis con estadística descriptiva con medidas de tendencia central y de dispersión.
ResultadosLa mortalidad perioperatoria fue del 0%, una paciente a la que se le realizó resección intestinal con peritonectomía pélvica presentó trombosis venosa profunda, sepsis abdominal por dehiscencia de colo-recto anastomosis. Ninguna paciente presentó complicaciones secundarias al uso de quimioterapia intraperitoneal.
ConclusionesLa morbimortalidad, encontradas tras el procedimiento de peritonectomía total o pélvica, y quimioterapia intraperitoneal en nuestra institución, se sitúa en la media de los resultados publicados a nivel mundial.
Treatment for ovarian cancer consists of primary cytoreductive surgery and platinum-based adjuvant chemotherapy. Most patients are diagnosed when the disease is at an advanced stage. Surgery for recurrent disease is not associated with increased overall survival. Intraperitoneal chemotherapy exposes tumoural tissue to high doses within the peritoneal cavity. Perioperative morbidity, toxicity, and the effects of hyperthermia have not been established. The morbidity and mortality associated with ultraradical cytoreductive surgery and intraperitoneal chemotherapy are high and may be directly due to the surgery, the chemotherapy, or both. Studies have reported morbidity and mortality rates of 0% to 43% and 0% to 20%, respectively.
Material and methodAn observational, retrospective, non-experimental, descriptive study was carried out in patients with advanced or recurrent ovarian cancer treated with cytoreductive surgery with total or partial peritonectomy and intraperitoneal chemotherapy. A descriptive statistical analysis was performed with measurement of central tendency and dispersion.
ResultsPerioperative mortality was 0%. One patient with intestinal resection and pelvic peritonectomy developed complications with deep venous thrombosis and abdominal sepsis due to colorectal anastomotic dehiscence. No patients developed complications due to intraperitoneal chemotherapy.
ConclusionsThe morbidity and mortality rates associated with total or partial peritonectomy with intraperitoneal chemotherapy in our institution are similar to those reported in other institutions.
El cáncer de ovario es el sexto en frecuencia, y por lo general se diagnostica en etapas avanzadas, es la principal causa de muerte por cáncer ginecológico. Pacientes con cáncer de ovario recurrente son incurables con las terapias actuales, y la esperanza de vida es de 12 a 18 meses después del diagnóstico1,2. La quimioterapia intraperitoneal hipertérmica aumenta la eficacia terapéutica3,4.
La cirugía en enfermedad recurrente no aumenta la sobrevida global5. El manejo con quimioterapia intraperitoneal expone el tejido tumoral a altas concentraciones dentro de la cavidad peritoneal; la hipertermia ha demostrado mejorar la sobrevida global y el periodo libre de enfermedad6. La toxicidad o morbilidad perioperatoria no está establecida y no puede considerarse como manejo estándar7,8. Los esquemas basados en cisplatino o mitomicina pueden usarse con hipertermia; esquemas de cisplatino, carboplatino o paclitaxel están establecidos en normotermia9. Se sugieren dosis de 80 a 100mg/m2 de cisplatino en hipertermia10, sin embargo a dosis de cisplatino 75mg/m2 a 41,5°C durante 90min no registraron muertes ni toxicidades severas, reportando un 93% de remisión completa y un 7% de progresión11.
La administración de quimioterapia intraperitoneal expone concentraciones más altas de citostáticos, minimizando la toxicidad sistémica12. La barrera peritoneo-plasmática disminuye la absorción de sustancias de alto peso molecular, permitiendo un mayor tiempo de exposición peritoneal13. Los fármacos citostáticos deben ser hidrosolubles y con alto peso molecular, tener sinergia con la hipertermia, no ser específicos del ciclo celular y tener vida media corta≤90min14.
La morbimortalidad puede derivar directamente de la cirugía, de la quimioterapia o de ambas. Se han publicado tasas muy diversas, con cifras del 0% al 43% de morbilidad y del 0-20% de mortalidad15–18. La duración de la cirugía y la pérdida hemática son factores que se han relacionado con la morbilidad19. No existen estudios comparativos que permitan determinar si la utilización de quimioterapia intraabdominal aumenta la incidencia de complicaciones respecto a la cirugía sola20.
Las principales causas de muerte son la sepsis secundaria a perforación intestinal o dehiscencia de anastomosis, fístulas intestinales, fugas biliares, pancreatitis o hemorragias postoperatorias. Las complicaciones sistémicas son la trombosis venosa profunda, la embolia pulmonar, el neumotórax, la insuficiencia cardíaca, los infartos cerebrales o la toxicidad hematológica21. Están relacionadas las pérdidas hemáticas con la morbilidad perioperatoria, presentando complicaciones grado iii-iv aquellas que recibieron una o más transfusiones17; la curva de aprendizaje necesaria para reducir la mortalidad y morbilidad es de 130 casos22.
Material y métodosSe realizó un estudio de tipo observacional, retrospectivo, no experimental y descriptivo de pacientes con diagnóstico de cáncer de ovario recurrente o avanzado, valorados en el Servicio de Ginecología Oncológica del Hospital de Oncología Centro Médico Nacional Siglo XXI, tratadas con peritonectomía pélvica o total y cirugía citorreductora con quimioterapia intraperitoneal de marzo del 2012 a julio de 2014. Se realizó el análisis con estadística descriptiva (razones, proporciones y frecuencias) con medidas de tendencias central (mediana, media, moda) y medidas de dispersión (desviación estándar).
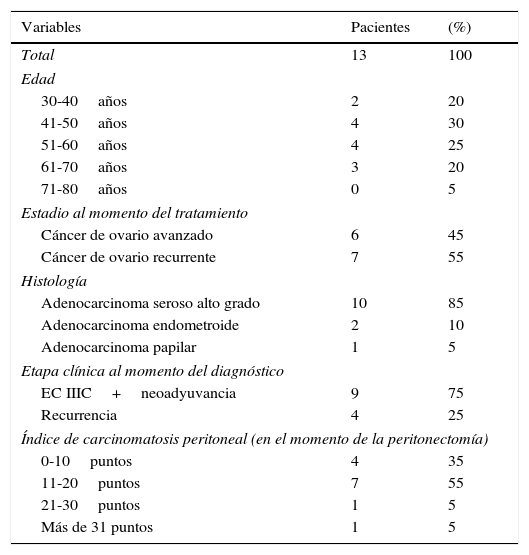
ResultadosEn 13 pacientes (n=100%) el 45% tenían cáncer ovárico avanzado y el 55% cáncer de ovario recurrente. La edad media al momento de la cirugía fue de 50 años; 9 pacientes tenían el antecedente de tabaquismo antes de la enfermedad oncológica. En cuanto a comorbilidades 3 con hipertensión arterial sistémica, una con hipotiroidismo y una paciente con insuficiencia renal crónica de causa no especificada. La histología reportada más frecuente fue el carcinoma seroso de alto grado en 10 (85%), y 3 (15%) otras histologías, entre ellas papilar y endometroide.
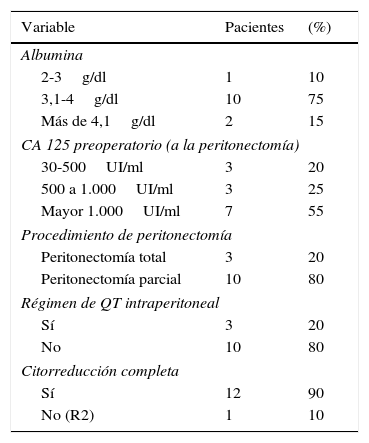
Dentro de los antecedentes quirúrgicos de las pacientes a 9 (70%) se les realizó laparotomía diagnóstica o citorreductora como parte inicial del manejo oncológico, siendo la cirugía más frecuente la laparotomía diagnóstica en 4 de las pacientes, una citorreducción no óptima y 4 (30%) citorreducción óptima. El índice de carcinomatosis peritoneal promedio fue de 18 puntos (15-25) en el momento de la primera intervención quirúrgica (procedimiento inicial o previo a la peritonectomía), durante la intervención o peritonectomía la media del índice de carcinomatosis peritoneal fue de 12 puntos, con una mediana de 11 puntos (rango 4-25). Todas las pacientes recibieron tratamiento con quimioterapia sistémica con carboplatino/paclitaxel previo a la peritonectomía y 3 de ellas doxorrubicina liposomal como segunda línea. Los niveles de albúmina sérica mostraron una mediana de 3,55g/dl (rango 3-4,5), la hemoglobina sérica preoperatoria con mediana de 12,5g/dl (rango 10-15,7) y el CA 125 con media de 1.200U/ml (rango 25-1500) (tablas 1 y 2).
Características generales de las 13 pacientes con diagnóstico de cáncer de ovario sometidas a cirugía citorreductora con peritonectomía pélvica o total y quimioterapia intraperitoneal
| Variables | Pacientes | (%) |
|---|---|---|
| Total | 13 | 100 |
| Edad | ||
| 30-40años | 2 | 20 |
| 41-50años | 4 | 30 |
| 51-60años | 4 | 25 |
| 61-70años | 3 | 20 |
| 71-80años | 0 | 5 |
| Estadio al momento del tratamiento | ||
| Cáncer de ovario avanzado | 6 | 45 |
| Cáncer de ovario recurrente | 7 | 55 |
| Histología | ||
| Adenocarcinoma seroso alto grado | 10 | 85 |
| Adenocarcinoma endometroide | 2 | 10 |
| Adenocarcinoma papilar | 1 | 5 |
| Etapa clínica al momento del diagnóstico | ||
| EC IIIC+neoadyuvancia | 9 | 75 |
| Recurrencia | 4 | 25 |
| Índice de carcinomatosis peritoneal (en el momento de la peritonectomía) | ||
| 0-10puntos | 4 | 35 |
| 11-20puntos | 7 | 55 |
| 21-30puntos | 1 | 5 |
| Más de 31 puntos | 1 | 5 |
Características perioperatorias de las 13 pacientes con diagnóstico de cáncer de ovario sometidos a cirugía citorreductora con peritonectomía pélvica o total y quimioterapia intraperitoneal
| Variable | Pacientes | (%) |
|---|---|---|
| Albumina | ||
| 2-3g/dl | 1 | 10 |
| 3,1-4g/dl | 10 | 75 |
| Más de 4,1g/dl | 2 | 15 |
| CA 125 preoperatorio (a la peritonectomía) | ||
| 30-500UI/ml | 3 | 20 |
| 500 a 1.000UI/ml | 3 | 25 |
| Mayor 1.000UI/ml | 7 | 55 |
| Procedimiento de peritonectomía | ||
| Peritonectomía total | 3 | 20 |
| Peritonectomía parcial | 10 | 80 |
| Régimen de QT intraperitoneal | ||
| Sí | 3 | 20 |
| No | 10 | 80 |
| Citorreducción completa | ||
| Sí | 12 | 90 |
| No (R2) | 1 | 10 |
Se realizó peritonectomía parcial en 10 pacientes y en 3 peritonectomía total; en 4 pacientes se efectuó algún tipo de resección visceral, siendo la más frecuente la del recto-sigmoides, seguida de la vesícula biliar y el bazo. Se realizó anastomosis manual en la ileotransverso y la colorrectal.
La duración promedio de la citorreducción con peritonectomía total fue de 12h y un tiempo anestésico de 13h; la cirugía más larga duró 17h. El tiempo promedio de duración de la quimioterapia intraperitoneal fue de 150min a dosis calculada de 150mg de cisplatino. En las pacientes que se sometieron a peritonectomía parcial el tiempo promedio de cirugía fue 4h, con un tiempo anestésico promedio de 5h. El procedimiento más largo duró 8h, incluido la citorreducción óptima. Se presentó una media de sangrado de 2.000ml, 4 pacientes fueron transfundidas durante la cirugía y 6 pacientes en el posquirúrgico.
El promedio de estancia hospitalaria fue de 6 días y una mediana de 5 días (rango 4-13), con una estancia máxima en la unidad de cuidados intensivos de 3 días para los pacientes con resección intestinal y anastomosis. El promedio de estancia hospitalaria fue de 7 días, a diferencia de 4 días en las pacientes sin resección intestinal. Todos los pacientes fueron egresados por mejoría. Las pacientes ingresaron en la unidad de cuidados intensivos al finalizar el procedimiento por choque hipovolémico y postoperatorio de alto riesgo, ameritaron apoyo con aminas y con ventilación asistida por un lapso no mayor a 24h; el uso de hemocomponentes fue en promedio de 2 paquetes globulares (1-5) y 2 plasmas frescos (1-3), y ninguna de las pacientes presentó reacciones adversas a la transfusión. De las pacientes a quienes se les realizó citorreducción con peritonectomía pélvica o parcial, ninguna necesitó estancia en la unidad de cuidados intensivos, y no hubo requerimientos de hemocomponentes.
La mortalidad perioperatoria fue del 0%, incluso en aquellas pacientes que recibieron quimioterapia intraperitoneal; solo una paciente a quien se le realizó colo-recto anastomosis con peritonectomía pélvica presentó a los 4 días trombosis venosa profunda de miembro pélvico izquierdo, y a los 11 días sepsis abdominal y dehiscencia de colo-recto anastomosis, ameritando colostomía terminal con cierre distal y hemicolectomía izquierda. Egresó a los 22 días por mejoría y no ameritó estancia en la unidad de cuidados intensivos; en total se transfundieron 5 paquetes globulares y 4 plasmas frescos, y completó tratamiento sistémico con carboplatino/paclitaxel. Ninguna paciente presento complicaciones secundarias al uso de quimioterapia intraperitoneal (tablas 3 y 4).
Complicaciones perioperatorias de las pacientes sometidas a cirugía citorreductora con peritonectomía pélvica o total más quimioterapia intraperitoneal
| Variables | Pacientes (n) | (%) |
|---|---|---|
| General | ||
| Total de pacientes | 13 | 100 |
| Total de pacientes con citorreducción: peritonectomía total | 3 | 20 |
| Total de pacientes con citorreducción: peritonectomía pélvica | 10 | 80 |
| Total de pacientes complicados | 4 | 100 |
| Pacientes complicados con citorreducción: peritonectomía total y quimioterapia intraperitoneal | 3 | 75 |
| Total de pacientes con citorreducción: peritonectomía pélvica | 1 | 25 |
| Complicaciones | Número | (%) |
|---|---|---|
| Total de complicaciones | 4 | 100 |
| Complicaciones relacionadas con citorreducción con peritonectomía total más quimioterapia intraperitoneal hipertérmica (HIPEC) | 2 | 50 |
| Complicaciónes relacionadas con peritonectomía y quimioterapia intraabdominal normotérmica | 1 | 25 |
| Total de pacientes con citorreducción: peritonectomía pélvica | 1 | 25 |
Manejo de las complicaciones perioperatorias de las pacientes sometidas a cirugía citorreductora con peritonectomía pélvica o total más quimioterapia intraperitoneal
| Tipo de tratamiento | Pacientes (n) | (%) |
|---|---|---|
| Pacientes tratados conservadoramente | 3 | 75 |
| Pacientes tratados quirúrgicamente | 1 | 25 |
| Complicaciones tratadas (4) | Número | (%) |
|---|---|---|
| Complicaciones con manejo conservador | Tres choque hemorrágico una trombosis venosa profunda | 100 |
| Complicaciones con manejo quirúrgico | ||
| Dehiscencia de anastomosis | Una (estoma) | 25 |
| Sepsis abdominal | Una (lavado mecánico) | 25 |
La frecuencia del cáncer de ovario en nuestra institución se sitúa en primer lugar entre los cánceres ginecológicos, esto debido a que el hospital es de referencia para pacientes complicados o avanzados. De igual manera, se considera el primer lugar de mortalidad por cáncer ginecológico.
El tratamiento estándar del cáncer de ovario es la cirugía de citorreducción primaria óptima, anteriormente considerado como implantes tumorales residuales <1cm de diámetro, actualmente como ausencia de enfermedad macroscópica y posteriormente quimioterapia adyuvante basada en platinos. La mayoría se diagnostica en etapas avanzadas y su tratamiento no está definido, debido a que existe riesgo de recurrencia; la cirugía en enfermedad recurrente no se asocia con aumento en la sobrevida global5. El manejo con quimioterapia intraperitoneal expone el tejido tumoral a altas concentraciones dentro de la cavidad peritoneal, la hipertermia ha demostrado mejorar sobrevida global y el periodo libre de enfermedad6. La toxicidad, morbilidad perioperatoria, efectos por la hipertermia, sangrado o transfusión masiva y riesgos anestésicos no están establecidos, por lo que no se puede considerar como manejo estándar7,8. La peritonectomía con quimioterapia hipertérmica podría ser una opción alentadora3, sin embargo hay pocos datos sobre la morbilidad perioperatoria y del beneficio terapéutico en sobrevida y periodo libre de enfermedad23,24, por lo que únicamente se seleccionan casos de recurrencia, donde esta opción terapéutica es una alternativa que puede incrementar la sobrevida de las pacientes en comparación con el tratamiento sistémico25.
La morbimortalidad encontrada tras el procedimiento de peritonectomía total o pélvica y quimioterapia intraperitoneal en nuestra institución se sitúa en la media de los resultados publicados a nivel mundial. Nuestros eventos adversos más comunes fueron el choque hemorrágico, la trombosis venosa profunda y la dehiscencia de anastomosis con sepsis abdominal, lo cual no es diferente a series reportadas17, en donde las complicaciones para la mortalidad son dehiscencia de anastomosis y para morbilidad trombosis venosa pulmonar, embolia pulmonar y hemorragia postoperatoria. Un 70% del grupo de pacientes no presentó complicaciones y cursó con una evolución satisfactoria, lo que es parecido a lo reportado en la revisión Cochrane26, que revisó los resultados de centros de tratamiento especializado que no presentaron complicaciones en alrededor del 75%, siendo más evidente en centros altamente especializados, en donde existe una mejor selección de pacientes, experiencia quirúrgica y del manejo tanto en el transoperatorio como en el postoperatorio, con lo cual se logra disminuir la morbilidad. El uso de la hipertermia en la quimioterapia intraperitoneal no mostró resultados diferentes a lo reportado, demostrando que no es un factor de riesgo asociado a complicaciones postoperatorias7,8,27.
ConclusionesLas complicaciones derivadas de toxicidad a la quimioterapia intraperitoneal o derivadas dell procedimiento quirúrgico como infección, oclusión intestinal, efectos por la hipertermia, sangrado, transfusión masiva o riesgos anestésicos no se encuentran establecidos, y por lo tanto no se puede considerar como manejo estándar. El riesgo podría estar significativamente relacionado con la institución donde se realiza el procedimiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.