Desde las últimas décadas se ha visto incrementado el uso de fármacos en el ámbito de la esterilidad; dicho uso ha incrementado de modo paralelo el número de los recién nacidos al año mediante técnicas de reproducción asistida en parejas estériles. Debido a la conocida hormonodependencia de algunos de los cánceres, y considerando al cáncer de mama como un clásico modelo de tumor hormonodependiente, este aumento suscita una alarma razonable por los posibles efectos carcinogénicos de dichos fármacos, ya que aumentan el valor de las hormonas gonadales endógenas.
En este trabajo, se ha pretendido revisar los estudios llevados a cabo sobre este tema, para lo cual se ha realizado una búsqueda bibliográfica de los últimos 15 años en Pubmed y artículos relevantes de las principales revistas científicas.
Como conclusión se puede afirmar que se necesitaría un seguimiento más prolongado y un diseño correcto de los trabajos (con una potencia estadística y una población adecuadas), y puntualizar el tipo de esterilidad y el tipo de fármacos y dosis de cada caso.
The use of fertility drugs has greatly increased in the last few decades, leading to a parallel increase in the number of infants born as a result of assisted reproduction technology in sterile couples. However, because some tumors are hormone dependent– and considering breast cancer as a classical model of a hormone-dependent tumor – the increase in the use of this kind of drug raises reasonable doubts about possible carcinogenic adverse effects, as these agents increase endogenous gonadal hormone levels.
The present article reviews the studies carried out on this subject. A literature search of articles published in the previous 15 years was performed in Pubmed and bibliographic references were retrieved from relevant articles published in the main scientific journals. We conclude that further studies with longer follow- up periods and more meticulous designs (with greater statistical power and adequate populations) are required. Such studies should specify details on the type of sterility in each patient, as well as the type of drug used and the dose.
Dos grandes problemas generan, en la actualidad, especial preocupación entre los profesionales encargados del cuidado de la salud de la mujer, por estar ambos en claro incremento: el cáncer de mama y los trastornos de esterilidad. Dos problemas con no tan poca relación como en apariencia se pudiera pensar y que ha suscitado el estudio de la presente revisión.
El cáncer de mama es el tumor maligno más común entre las mujeres de los países desarrollados y la principal causa de muerte en el subgrupo de mujeres con edades comprendidas entre los 40 y los 55 años.
Su prevalencia varía geográficamente y es mayor en países como EE.UU., Canadá y países del norte de Europa, y es menor en Asia, África y países de América Latina. La raza judía, independientemente de otros factores, tiene un mayor riesgo, y en un mismo hábitat las mujeres de raza blanca están afectadas en mayor proporción que las de raza negra.
La incidencia de la enfermedad se ha ido incrementando paulatinamente durante las últimas décadas y, a pesar de la mejora en los programas de detección precoz y el abordaje terapéutico de las pacientes, el cáncer de mama sigue, hoy por hoy, suponiendo la segunda causa de muerte por cáncer. Se estima que en la actualidad en EE.UU. se diagnostican más de 178.000 casos nuevos al año y son más de 43.000 las muertes debidas al cáncer de mama. En España se diagnostican 16.000 casos nuevos al año, que originan 5.700 muertes directas. Por todo ello, y ante estas cifras, es indiscutible que tenemos que considerar el cáncer de mama como un verdadero problema de salud pública.
La neoplasia maligna de mama tiene una etiología multifactorial. Pocos factores de riesgo para esta enfermedad afectan a más del 10-15% de la población, aunque algunos de ellos se relacionan con mayores riesgos relativos. La estimación del riesgo atribuible poblacional para el cáncer de mama está sólo entre el 21 y el 55%, y la mayor parte de los riesgos atribuibles poblacionales quedan sin explicación. Entre los factores de riesgo más importantes y que más se han relacionado con dicho cáncer se encuentran los siguientes1:
- –
Historia familiar.
- –
Sexo femenino.
- –
Edad.
- –
Menarquia temprana.
- –
Menopausia tardía.
- –
Factores dietéticos.
- –
Factores ambientales.
- –
Nivel de actividad física.
- –
Valores hormonales.
- –
Menor tasa de lactancia materna.
- –
Paridad y retraso en la concepción del primer hijo.
Los nuevos estilos de vida que varones y mujeres han ido adquiriendo durante los últimos años han sido la causa del incremento de múltiples factores de riesgo para la esterilidad (retraso de la edad media del primer parto, estrés psicosocial, factores ambientales y hábitos tóxicos). En EE.UU., la proporción de mujeres con edades comprendidas entre los 15 y los 44 años que presentan algún tipo de problema de esterilidad rondaba el 10% en el año 1988. Un estudio reciente realizado en Holanda estimaba que entre un 14 y un 16% de las parejas solicitaban asistencia sanitaria relacionada con su vida reproductiva (más del 10% de estas parejas cumplían los criterios de definición de pareja estéril). En EE.UU. el número de mujeres tratadas anualmente con fármacos para la fertilidad se ha doblado entre 1973 y 1991. En Holanda, las ventas de gonadotropinas –fármacos ampliamente utilizados para la inducción de la ovulación– se incrementaron desde 60.000 ampollas/año en 1984 a casi 400.000 ampollas/año en 19902. Se estima que casi el 2% de todos los nacimientos acontecidos en un año provienen de técnicas de reproducción asistida.
En vista de estas cifras, en las últimas décadas la industria farmacéutica se ha visto obligada a perfeccionar a gran velocidad las técnicas para provocar la inducción folicular múltiple, cuyo objeto es amplificar la estimulación normal del ovario. Se han ido desarrollado, pues, modernas técnicas de reproducción asistida, que han expuesto a muchas mujeres a potentes regímenes de estimulación folicular suprafisiológica. De modo secundario a esta hiperrespuesta ovárica, se alcanzan concentraciones anormales de estrógenos, progesterona y gonadotropina coriónica humana (hCG) en el organismo.
Se ha especulado sobre la posibilidad de que estas hormonas, elevadas de modo iatrogénico, pudieran alterar la normal proliferación de las células epiteliales de la mama y aumentar así la enfermedad maligna de ésta. La posible asociación entre el uso de estos fármacos inductores de la ovulación y el riesgo de presentar cáncer de mama ha creado gran inquietud y ha animado a unos pocos autores a realizar estudios epidemiológicos que, de modo crítico, puedan ayudar a comprender este hecho. En vista del fuerte incremento en el uso de fármacos inductores de la ovulación, es sorprendente el escaso conocimiento acerca de los efectos a largo plazo de éstos en el sistema reproductor de la mujer.
Se han diseñado múltiples estudios para intentar aclarar si estos fármacos pueden o no alterar la incidencia y desarrollo de determinados tipos de cánceres, entre ellos el de ovario, mama y útero, así como el posible desarrollo de nuevos tumores en los recién nacidos de madres sometidas a estos tratamientos de esterilidad. Ante semejante polémica surge ahora la discusión sobre la seguridad de dichos fármacos y de los riesgos que se derivan de su utilización.
ESTIMULACIÓN OVÁRICA Y AMBIENTE HORMONALLa estimulación folicular múltiple controlada, como objetivo de las técnicas de reproducción asistida, implica la exposición de la mujer a altos valores de gonadotropinas, que inducen en su estimulación ovárica gran cantidad de estrógenos, progesterona y hCG.
De modo teórico, al menos, esta elevada carga hormonal conduce a pensar que podría afectar la proliferación celular del epitelio ductal y lobulillar de la mama y de ese modo aumentar el riesgo de cáncer de este órgano.
A continuación, se revisan una serie de características propias de cada hormona implicada.
EstrógenosLa información experimental, clínica y epidemiológica de la que hoy disponemos continúa sugiriendo una clara relación de los estrógenos como hormona promotora en el cáncer de mama. Sin embargo, los mecanismos exactos de la patogenia de los cánceres hormonodependientes están aún hoy por aclarar. Podemos destacar una serie de hechos correlacionados:
- –
La frecuencia de aparición es 100 veces mayor en la mujer que en el varón.
- –
Los estrógenos estimulan in vitro la proliferación de células humanas de cáncer de mama.
- –
Se ha visto un 65% de exceso de riesgo de cáncer de mama, entre las mujeres que habían tenido cáncer de endometrio3.
- –
El cáncer de mama es significativamente menor en las mujeres a las que se les ha realizado una ooforectomía antes de los 50 años4.
- –
Algunos tumores de mama tienen receptores de estrógenos, y la disminución de los valores de estrógenos por ooforectomía, adrenalectomía o tratamiento con fármacos antiestrogénicos puede detener temporalmente el crecimiento de estos tumores.
- –
La incidencia de cáncer de mama está creciendo entre los varones que están sometidos a excesivos valores de estrógenos, como en transexuales, cirróticos, afectados por el síndrome de Klinefelter o con carcinoma metastásico de próstata5.
Si se analizan en conjunto todos estos datos, parece obvio pensar que hay un elemento de estrogenodependencia, si no de provocación directa, en muchos cánceres de mama.
El papel de las hormonas exógenas de la mujer, a modo de anticonceptivos hormonales o terapia hormonal sustitutiva, parece ya resuelto en la actualidad, por lo menos en teoría. En cuanto al uso de anticonceptivos orales, parece ser que las mujeres que alguna vez utilizaron las primeras fórmulas de anticonceptivos y que también tienen familiares de primer grado afectados de cáncer de mama pueden tener un incremento del riesgo de presentar la enfermedad. Hay estudios que avalan que, mientras las mujeres utilizan anticonceptivos orales y durante los 10 años siguientes de suspenderlos hay un 24% de incremento del riesgo relativo (RR) de cáncer de mama diagnosticado (RR = 1.24; intervalo de confianza [IC] del 95%, 1,15-1,33). Pero, afortunadamente, son edades en las que la enfermedad es muy poco prevalente y no hay un riesgo significativo de tener un diagnóstico de cáncer de mama a los 10 años o más tras suspender el uso de la anticoncepción. Por otro lado, los casos diagnosticados en ese momento son menos avanzados clínicamente que los acontecidos entre las que nunca los utilizaron. Hay más datos que relacionan el empleo de terapia hormonal sustitutiva con el riesgo de desarrollar cáncer de mama, sobre todo ligado al tiempo de exposición, aunque parece ser un incremento comparable al efecto en el cáncer de mama de la menopausia tardía y que desaparece a los 5 años del cese del uso6–10.
Se discute sobre la posibilidad de que los altos valores de estrógenos endógenos puedan provocar los mismos efectos que los exógenos. Esta posibilidad se apoyó en parte por la observación de un peor pronóstico en las mujeres operadas de cáncer de mama en fase proliferativa del ciclo ovárico, comparándolas con las que fueron operadas en fase lútea. Algunos investigadores podrían encontrar la explicación en que, en un ciclo estimulado, los valores elevados de estrógenos son generalmente seguidos de unos altos valores de progesterona, que podrían producir un efecto de oposición en el efecto estimulador del estrógeno en el cáncer de mama. Esta teoría de la «no oposición de los estrógenos», aunque ha demostrado ser exitosa en la explicación y predicción de las hormonas exógenas en el cáncer de endometrio, no lo ha hecho en el cáncer de mama.
ProgesteronaEl efecto de la progesterona en el desarrollo del cáncer de mama no está aún bien aclarado. Estudios in vivo han mostrado que, en concentraciones fisiológicas, la progesterona puede producir tanto estimulación como inhibición de la proliferación de las células tumorales. Muchos de los datos que sugieren un efecto protector de la progesterona frente al cáncer de mama han sido extrapolados desde los datos del cáncer de endometrio, lo que hace que carezcan de validez científica.
Se ha visto que el pico de la actividad proliferativa en el cáncer de mama ocurre durante la fase lútea del ciclo menstrual. Esto se opone a lo que se había demostrado para el endometrio, donde el pico proliferativo ocurre durante la fase folicular. Es decir que, al tiempo en que se da el pico proliferativo en la mama, la proliferación en el endometrio está en su punto más bajo, momento en que, además, la progesterona endógena está relativamente alta.
La hipótesis del «estrógeno ventana»11 es una teoría que postula que los progestágenos disminuyen el riesgo de cáncer de mama mediante la regulación de los estrógenos. La teoría sugiere que existen 2 ventanas durante la vida reproductiva de la mujer, la pubertad y la perimenopausia, durante las cuales los bajos niveles de progesterona no se oponen a que los estrógenos causen exceso de proliferación del tejido mamario. Sin embargo, el descubrimiento de que la menarquia precoz se asocia a un establecimiento más temprano de ciclos ovulatorios regulares, y que los ciclos cortos en el período de la perimenopausia se han asociado a un aumento de riesgo de cáncer de mama, han promovido investigaciones para validar la teoría, y para sospechar que, a lo mejor, un período de exposición prolongado a la progesterona pueda incrementar el riesgo de presentar cáncer de mama.
Algunos de los métodos de estimulación folicular están involucrados en un aumento prolongado en las concentraciones de progesterona en plasma durante toda la fase lútea del ciclo. Además, la mayoría de las pautas de los programas de fecundación in vitro y de otras técnicas de reproducción asistida incluyen el soporte de la fase lútea mediante la administración de progesterona, natural o derivados sintéticos. Dicha administración se lleva a cabo durante períodos prolongados, al menos 2 semanas tras la transferencia embrionaria o tras la inseminación, y durante los primeros 3 meses de embarazo si se alcanza la gestación.
En teoría, la exposición incrementada a progestágenos exógenos podría ser perjudicial por estímulo de los tejidos mamarios, especialmente si este hecho ocurre antes del primer embarazo.
Gonadotropina coriónica humanaLa βhCG es una hormona que se utiliza en reproducción asistida para provocar la ovulación mediante la rotura del folículo maduro. En el ciclo ovulatorio fisiológico, la hormona encargada de la eclosión ovular es la hormona luteinizante (LH), pero la βhCG, en su defecto, imita la función de la LH, con una mayor potencia biológica, ya que tiene una mayor vida media y mayor afinidad por los receptores de LH. De modo que, entre 34 y 36h después de su administración será el momento adecuado para que las relaciones sexuales, la inseminación artificial o la transferencia embrionaria tengan lugar.
La gestación no empeora el pronóstico de un cáncer de mama previamente tratado. Además, los embarazos múltiples y el hecho de que la primera gestación ocurra a una edad temprana siempre se han considerados factores protectores contra el cáncer de mama. Se ha sugerido, por todo ello, que la βhCG tiene un efecto favorable sobre la mama y un efecto protector contra la transformación maligna.
Estudios sobre inducción de tumores mamarios en un modelo animal de rata han demostrado que la administración de hCG reduce la incidencia de tumor de modo comparable a una gestación completa. Extrapolando estos resultados, se ha propuesto que el tratamiento con dicha hormona a jóvenes nulíparas podría reducir el riesgo de cáncer de mama de modo similar a una gestación a término.
Fármacos inductores de la ovulaciónCitrato de clomifenoSe trata de un fármaco modulador selectivo de los receptores estrogénicos; parece actuar como un antiestrogénico directamente en el hipotálamo, de modo que se utiliza en mujeres cuyo fallo ovulatorio tiene origen en dicho órgano o en la hipófisis.
Cuando se administra en la primera parte del ciclo menstrual (del día 3 al día 8 del ciclo), suprime la cantidad de estrógeno circulante y estimula la glándula pituitaria para que produzca más LH y hormona foliculostimulante (FSH). Estas gonadotropinas naturales estimulan entonces el ovario para que madure un folículo y libere un óvulo. El uso de citrato de clomifeno se asocia a un aumento de 2 a 3 veces del valor de estradiol, lo que da lugar a una duplicación de las ovulaciones durante los ciclos de tratamiento, así como a un incremento de los valores de progesterona12.
De acuerdo con el «concepto umbral», la dosis así denominada de FSH es la menor cantidad de FSH a la cual la mujer debería responder con un desarrollo monofolicular. Cuando un valor umbral se sobrepasa, podrá ocurrir el desarrollo de nuevos folículos mientras los valores de FSH estén por encima de éste. Tan pronto como los valores bajen del valor umbral, ya no se reclutarán más folículos, pero aquellos que ya se han comenzado a desarrollar probablemente continúen haciéndolo, dando lugar a una ovulación múltiple.
GonadotropinasLas gonadotropinas se han usado durante más de 30 años para inducir la ovulación en mujeres infértiles. El tratamiento puede aplicarse mediante diversas pautas y se mantendrá durante una cantidad variable de días en la primera fase del ciclo genital13.
Hay 3 tipos de gonadotropinas exógenas en el mercado:
- –
Gonadotropina menopáusica humana (hMG), que contiene igual proporción de LH y de FSH. El componente FSH de esta gonadotropina se encarga de reclutar folículos ováricos y de estimular su crecimiento. El componente LH facilita la maduración del folículo, pero no es suficiente para producir la ovulación. Se habla de una posible mejora en la calidad de los ovocitos de las pacientes sometidas a estimulación ovárica con el efecto aditivo de la LH.
- –
FSH. Acción similar a la de la hMG, aunque sólo será la molécula de FSH la que actúe en los receptores que se hallan en el folículo para ella.
- –
LH. En esterilidad, su uso queda reservado como complemento de la FSH, a pacientes en quienes se prevea una baja respuesta a la estimulación ovárica.
La misión global de las gonadotropinas es causar la maduración de uno o múltiples folículos (dependiendo de las dosis empleadas y de la técnica reproductiva que se vaya a llevar a cabo) y provocar una ovulación única o múltiple. El tratamiento con gonadotropinas en la fecundación in vitro (FIV) puede llegar a incrementar el número de ovulaciones de 6 a 9 veces respecto a las mujeres no tratadas.
Hormona liberadora de gonadotropinaLa hormona liberadora de gonadotropina (GnRH) estimula, en la hipófisis, la liberación hipofisaria de LH y FSH, en consecuencia, como ya se ha explicado antes, la foliculogénesis.
Los análogos de la GnRH, tanto los agonistas como los antagonistas, se utilizan habitualmente en los ciclos de reproducción asistida. En apariencia, estos fármacos parecen ser supresores de la fertilidad, pero el uso que se les da en este tipo de tratamiento pretende suprimir la liberación endógena de gonadotropinas, y obtener así una respuesta mejor y más ajustada a las gonadotropinas exógenas administradas en la primera fase del ciclo por el médico, a la dosis y la pauta requeridas por cada paciente.
USO DE FÁRMACOS EN ESTERILIDAD Y RIESGO DE CÁNCER DE MAMA. ESTUDIOS REALIZADOSSe han publicado varios casos de mujeres diagnosticadas de cáncer de mama después de haber llevado a cabo un tratamiento con fármacos inductores de la ovulación (citrato de clomifeno, gonadotropinas solas o varias combinaciones hormonales diferentes utilizadas en FIV); sin embargo, para una enfermedad tan conocida e importante como el cáncer de mama, los estudios aportados han tenido relativamente poco valor.
- –
Venn et al14 (Australia) estudian la incidencia del cáncer de mama y ovario en una cohorte de 10.358 mujeres relacionadas con un tratamiento de FIV. El objetivo era comparar la incidencia de cáncer ginecológico en un grupo de 5.564 mujeres que habían sido sometidas a estimulación para inducción de la ovulación múltiple, con un grupo de 4.794 mujeres relacionadas con la FIV pero que no habían sido tratadas, o tuvieron un tratamiento de ciclo natural. La duración del seguimiento osciló entre 1 y 15 años. El RR de cáncer de mama en el grupo de las tratadas comparado con el grupo de las no tratadas, ajustado por la edad y el tipo de infertilidad, fue de 1,11 con un IC del 95% de 0,56-2,2. Estos resultados, publicados en 1995, sugieren que, en este subgrupo de pacientes con FIV, la estimulación ovárica no se asocia a un incremento significativo de presentar cáncer de mama15.
- –
Rossing et al16 (EE.UU.) elaboran un estudio de casos y controles, en el que los casos reciben citrato de clomifeno. El resultado que se obtuvo se publicó en 1995 y mostraba un descenso del riesgo de cáncer de mama, no significativo, para el grupo de las mujeres tratadas con el fármaco en estudio. El riesgo estimado se basaba en 15 casos observados de cáncer de mama (de los 28 esperados) entre las mujeres del subgrupo que había usado el agente inductor. No se observó, sin embargo, una clara tendencia descendente con el uso prolongado de citrato de clomifeno.
Las mujeres estériles tratadas con hCG tenían una menor probabilidad de desarrollar un cáncer de mama que las mujeres estériles que nunca habían recibido esta hormona (RR = 0,5). Sin embargo, tras el ajuste con el uso de citrato de clomifeno, esta asociación se volvía más débil. Los autores sugieren que el clomifeno podría tener efecto protector frente al cáncer de mama por la similitud estructural con el tamoxifeno. Esta asociación, no obstante, no fue observada posteriormente en los casos estudiados en Israel.
- –
Brzezinski et al17 presentaron, en 1997, 16 casos de cáncer de mama en mujeres con edades comprendidas entre los 31 y los 47 años, que habían sido atendidas en una clínica de fertilidad en Israel entre los años 1982 y 1991, y tratadas con inductores de la ovulación (hMG y/o citrato de clomifeno). Los casos se obtuvieron de un total de 950 mujeres estudiadas.
La estimación de la incidencia bruta de cáncer de mama en dicho grupo de mujeres puso de manifiesto que era 2,2 veces mayor que en las mujeres de la población general. Cuatro de los casos se diagnosticaron de modo muy temprano tras el tratamiento, mientras que las otras 12 mujeres fueron diagnosticadas entre 1 y 12 años después de que el tratamiento de fertilidad hubiera finalizado.
En resumen, aunque el número de casos con el que trabajan estos autores es demasiado pequeño para demostrar que este tipo de medicamentos se asocia a un riesgo de cáncer de mama incrementado, fue suficiente para provocar la preocupación por el hecho de que la inducción de la ovulación pudiera ser la causa de dicho aparente incremento del riesgo.
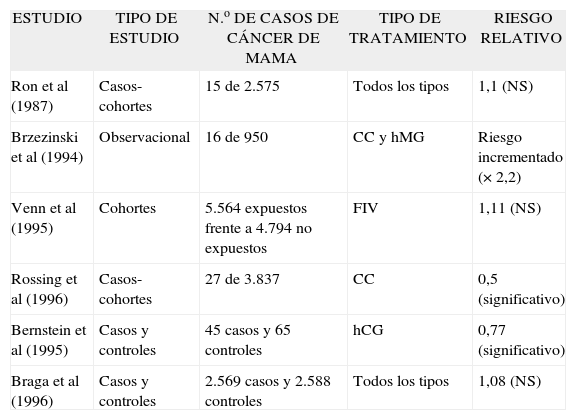
Sin embargo, no han sido muchos los autores que han buscado respuestas ante la cuestión planteada acerca del posible efecto nocivo de la estimulación ovárica en la incidencia del cáncer de mama, diseñando estudios epidemiológicos específicos (tabla I).
Estudios relevantes sobre la asociación entre tratamientos de fertilidad y cáncer de mama entre 1987 y 1997
| ESTUDIO | TIPO DE ESTUDIO | N.o DE CASOS DE CÁNCER DE MAMA | TIPO DE TRATAMIENTO | RIESGO RELATIVO |
| Ron et al (1987) | Casos-cohortes | 15 de 2.575 | Todos los tipos | 1,1 (NS) |
| Brzezinski et al (1994) | Observacional | 16 de 950 | CC y hMG | Riesgo incrementado (× 2,2) |
| Venn et al (1995) | Cohortes | 5.564 expuestos frente a 4.794 no expuestos | FIV | 1,11 (NS) |
| Rossing et al (1996) | Casos-cohortes | 27 de 3.837 | CC | 0,5 (significativo) |
| Bernstein et al (1995) | Casos y controles | 45 casos y 65 controles | hCG | 0,77 (significativo) |
| Braga et al (1996) | Casos y controles | 2.569 casos y 2.588 controles | Todos los tipos | 1,08 (NS) |
CC: citrato de clomifeno; FIV: fecundación in vitro; hCG: gonadotropina coriónica humana; hMG: gonadotropina menopáusica humana; NS: no significativo.
Uno de ellos, en el que se estudió una corte de mujeres australianas remitidas para FIV, aportó 34 casos de cáncer invasivo de mama14. Tras realizar los ajustes oportunos por edad y por tipo de esterilidad, el RR fue de 1,1 para el grupo de mujeres tratadas con FIV comparadas con el grupo no tratado. No se observó un incremento del riesgo significativo para ningún tipo especial de pauta, ni tendencias que dependieran del número de ciclos realizados ni del número de ovocitos obtenidos por ciclo de estimulación. Sin embargo, en el grupo de las mujeres expuestas hubo significativamente más cánceres de mama que los esperados en las que fueron diagnosticadas dentro del primer año tras la FIV. Los investigadores sugieren que este incremento transitorio del riesgo de cáncer de mama podría explicarse por el efecto promotor de este tipo de fármacos en el desarrollo de cánceres preexistentes.
- –
Braga et al18 diseñaron un importante ensayo clínico de casos y controles, en el que encontraron que la odds ratio (OR) entre las mujeres tratadas con fármacos en un servicio de esterilidad estaba incrementada de modo no significativo con relación a aquellas del grupo que nunca habían recibido ese tipo de tratamientos (OR = 1,4; IC del 95%, 0,9-2,3). Las OR en relación con el uso de estos fármacos fueron similares entre los subgrupos de acuerdo con la paridad, el estado de la menopausia, la educación y la historia familiar de cáncer de mama.
Los resultados de un estudio histórico retrospectivo de seguimiento a largo plazo llevado a cabo en Israel por el grupo de Potashnik19 muestran que no hay, en conjunto, un incremento ni una disminución del riesgo de cáncer de mama entre las mujeres infértiles tratadas con citrato de clomifeno cuando se comparan con las mujeres no tratadas de la población femenina general, de modo que en 1999 publicaron, en una prestigiosa revista sobre fertilidad, que la asociación entre el uso de fármacos para la esterilidad y el incremento del cáncer de mama no puede confirmarse.
- –
Bernstein et al20 llevaron a cabo un estudio poblacional de casos y controles, en el que se incluyó a mujeres de 40 años o menos, a las que se preguntó si habían recibido alguna vez un tratamiento con inyecciones de hCG como parte de un programa de pérdida de peso o como componente de una pauta de tratamiento de esterilidad. Las participantes en el estudio fueron 744 mujeres recientemente diagnosticadas de cáncer de mama y 744 controles. De ellas, 45 casos y 65 controles presentaron exposición a la hCG (OR multivariante = 0,77; IC del 95%, 0,5-1,19). El riesgo se reducía significativamente en las mujeres cuyo índice de masa corporal máximo del período gestacional era menor de 27,5kg/m2, pero no se observó una disminución del riesgo entre las mujeres más obesas. Solamente en el caso de las nulíparas el resultado fue estadísticamente significativo, lo que sugiere que la administración prolongada de hCG podría reducir el riesgo de cáncer de mama.
- –
Klip et al21 (Ámsterdam, Países Bajos) publican una revisión, realizada en el año 2000, sobre «El cáncer asociado a la inducción de la ovulación en la esterilidad», y en sus conclusiones aseguran que son necesarios nuevos estudios en un futuro con un diseño correcto y en los que se especifiquen las características de cada tipo de esterilidad. Además, señalan que en dichos estudios debería haber un subgrupo de mujeres estériles que, a pesar de tener indicación de tratamiento con fármacos para la esterilidad, no recibieran este tratamiento, para así valorar bien los efectos carcinogénicos de los fármacos en el subgrupo de las mujeres tratadas.
- –
Burkman et al22 (Michigan, EE.UU.) realizan un estudio de casos y controles para buscar la asociación entre los fármacos usados en reproducción y el cáncer invasivo de mama. En abril de 2003 publican como conclusiones que el uso prolongado de determinados fármacos podría aumentar el riesgo de cáncer de mama, por lo que refieren que se necesitan más estudios confirmatorios en un futuro.
- –
Venn et al23 (Australia). Años después (2003) vuelven a insistir en el estudio de este tema y concluyen en un trabajo llamado «Riesgo de cáncer asociado al diagnóstico de infertilidad», que a pesar de que no parece haber un incremento de riesgo global de cáncer de mama asociado a los tratamientos para la fertilidad, aún quedan puntos por resolver acerca del riesgo en los diferentes subtipos de esterilidad femenina.
- –
Siegelmann-Danieli et al24 (Danville, EE.UU.). Mediante un estudio de cohortes retrospectivo, pretenden demostrar un peor pronóstico en las pacientes diagnosticadas de cáncer de mama que han tenido una exposición reciente a fármacos usados en la esterilidad, y así lo concluyen en una publicación llevada a cabo en 2003, en la que, además, refieren la similitud en cuanto al pronóstico de estas mujeres con las pacientes embarazadas con cáncer de mama.
- –
Gauthier et al25 (Francia) realizan un estudio de cohortes prospectivo, que concluye en 2004, y aseguran que los tratamientos del ámbito de la esterilidad no parecen influir en el riesgo global del cáncer de mama, pero que, sin embargo, esta interacción sí es posible si además de los tratamientos se parte de una historia familiar del cáncer de mama asociada.
- –
Brinton et al26 (EE.UU., 2004), en un estudio de cohortes retrospectivo, concluyen que, a pesar de que aparentemente no hay asociación entre el uso de fármacos para la estimulación de la ovulación y un incremento del riesgo de cáncer de mama, se necesita un seguimiento más a largo plazo para dar resultados definitivos.
- –
Ayhan et al27, en 2004, realizan una revisión que pretende estudiar la asociación entre dichos fármacos y los cánceres ginecológicos. Los autores concluyen, tras chequear las revisiones de los últimos años, que el riesgo de cáncer de mama no parece estar incrementado, pero que aún es pronto para dar una opinión definitiva al respecto. Refieren, además, la posibilidad de comenzar a informar sobre este posible riesgo a las pacientes antes de comenzar el tratamiento.
- –
Salhab et al28 realizan otra revisión sobre la FIV y el cáncer de mama en el Reino Unido, y finalmente publican, en 2005, como resultado de sus investigaciones, que no hay una clara evidencia de que la inducción de la ovulación en la FIV incremente el riesgo de cáncer de mama, pero que, sin embargo, sí parece haber un ligero incremento de riesgo en aquellas mujeres con historia familiar positiva. Los autores refieren, además, que en futuras investigaciones debería tenerse en cuenta el tipo de fármacos utilizados, y proponen la opción de futuras inducciones de la ovulación con fármacos inhibidores de la aromatasa.
- –
Lerner-Geva et al29 realizan un estudio de cohorte histórica entre las mujeres de Israel para investigar un posible incremento del cáncer de mama como consecuencia del uso de fármacos inductores de la ovulación. En 2006 publican sus resultados, en los que reflejan que, en general, no hay asociación entre la infertilidad y los fármacos utilizados en ella y un aumento del riesgo de cáncer de mama. Los autores refieren también, sin embargo, que parece haber un riesgo aumentado de cáncer de mama en las mujeres estériles tratadas con cictrato de clomifeno.
Los diversos estudios realizados sobre la relación entre los tratamientos de fertilidad y el cáncer de mama han obtenido resultados poco consistentes. Esto puede reflejar, en parte, diferencias en el método de valoración de la causa de subfertilidad y en el control de varios factores de confusión. No deja de ser tarea ardua intentar demostrar una correlación causal en una cadena, en la que todas las variables –etiología, fármacos, dosis, tiempos, tipo de respuesta, etc.– influyen, y no de forma totalmente conocida en un mismo órgano: la mama.
Aunque algunos estudios sugieren que las causas hormonales de esterilidad, como los ciclos anovulatorios y la deficiencia de progesterona, pueden incrementar el riesgo de cáncer de mama, esto no se ha demostrado en otros estudios extensos y bien diseñados. De todos modos, los estudios más grandes tienen un poder estadístico inadecuado para relacionar el valor de riesgo de cáncer de mama con el diagnóstico de la esterilidad.
De acuerdo con las hipótesis sobre la etiología del cáncer de mama, podría ser factible que las anomalías en la ovulación pudieran influir en el riesgo de cáncer de mama y, por tanto, sería interesante tenerlo en cuenta en próximos estudios e identificar los tipos específicos de esterilidad de cada paciente.
La inducción de la ovulación expone a las mujeres a mayores concentraciones de estrógenos endógenos que en los ciclos naturales de menstruación, a veces durante períodos prolongados. Es posible que esos altos valores de estrógenos endógenos, u otros cambios hormonales (p. ej., elevaciones de los valores de gonadotropinas), generen estímulos carcinógenos en la mama.
Por otra parte, la sugerencia de que el citrato de clomifeno pudiera tener un efecto protector contra el cáncer de mama debería documentarse en futuros estudios más completos. El citrato de clomifeno es un antiestrógeno no esteroideo estructuralmente relacionado con el tamoxifeno y el dietilestilbestrol, lo que se ha descrito como un efecto antiproliferativo en células humanas de cáncer de mama. A pesar de esto, posteriormente otros autores han obtenido resultados contrarios.
La mayor parte de los protocolos de la FIV incluyen soporte de la fase lútea, al menos durante 2 semanas, mediante la administración de progesterona exógena. Esto tiene relevancia, puesto que hay algunas evidencias de que la exposición prolongada a la progesterona (en combinación con el estrógeno) puede incrementar el riesgo de cáncer de mama. Sin embargo, en un estudio reciente la progesterona parece tener un posible efecto tanto estimulador como inhibidor de las células de la mama.
Serían necesarias futuras investigaciones que analizaran de modo específico si se produce o no un incremento real en la incidencia del cáncer tras las técnicas de reproducción asistida. Y, si intentamos dar un paso más en nuestra disquisición, se puede plantear el hecho de que la inducción de la ovulación pudiera promover el desarrollo de cánceres ya preexistentes.