INTRODUCCIÓN
Se trata de una fetopatía de etiología indeterminada que viene a complicar las gestaciones múltiples1, especialmente las gemelares univitelinas, y es el feto perfusor o feto bomba el que realiza el mantenimiento de la perfusión tisular en el feto malformado. La incidencia estimada es de 1 de cada 35.000 embarazos, y constituye el 1% de los embarazos gemelares monocigóticos.
En la literatura médica se pueden encontrar varias publicaciones acerca de esta patología, y el diagnóstico, etimológicamente, se basa en la agenesia del corazón fetal, aunque desde el punto de vista embriológico esta malformación abarca un campo más extenso, ya que también engloba a la presencia de rudimentos de tejido cardíaco, según el grado de diferenciación y el momento de la organogénesis cardíaca que se hubiese alcanzado al producirse el evento; es decir, feto acardio es el que carece de función cardíaca especializada, haya o no tejido cardíaco diferenciado.
La presencia del feto acardio incrementa la carga cardíaca del feto bomba debido a que éste mantiene su propia perfusión y la del gemelo receptor. La presencia de comunicaciones vasculares placentarias anor-males entre los gemelos es la teoría más aceptada para explicar esta entidad. Estas anastomosis arterioarteriales facilitan un desequilibrio en la circulación interfetal que genera un flujo reverso en la arteria umbilical del gemelo receptor y la atrofia secundaria del corazón y otros órganos (perfusión arterial inversa del gemelo [PAIG]); la sangre escasamente oxigenada que sale del feto bomba a través de sus arterias umbilicales hacia la placenta fluye por las anastomosis arterioarteriales en dirección retrógrada, y llega al feto acardio en un tipo de circulación completamente invertida, lo cual origina múltiples anomalías en el feto receptor, y causa con frecuencia en el feto perfusor el desarrollo de una insuficiencia cardíaca2.
El feto anormal presenta un desarrollo ausente o incompleto del polo cefálico, el corazón, los miembros superiores y de numerosas vísceras. Las extremidades inferiores están relativamente bien conservadas, aunque con frecuencia se observan pies zambos y anomalías de los dedos de los pies. Por lo general, el cordón umbilical presenta 2 vasos, patrón de desarrollo que probablemente se explique por el mecanismo de perfusión del gemelo acardio previamente descrito.
El hallazgo de anomalías cromosómicas en el 33% de los casos sugiere la posibilidad de que las aneuploidías constituyan un factor etiológico a tener en cuenta.
El feto acardio se comporta como un parásito del feto normal, ya que precisa del aporte sanguíneo de éste para su desarrollo, por lo que el feto normal corre el riesgo de presentar un fallo cardíaco dependiente directamente del tamaño del feto acardio. En el 40-50% de los casos hay polihidramnios asociado a la disfunción cardíaca, que contribuye a la prematuridad, ya que suele aparecer entre las 22 y las 26 semanas de gestación.
Habitualmente sobrevive el 50% de los fetos bomba y la mortalidad de los fetos acardios es del 100%. La diferencia de pesos entre ambos fetos está muy relacionada con la aparición de complicaciones; cuando la diferencia de pesos es ≤50%, el riesgo de polihidramnios, prematuridad y muerte del feto perfusor se incrementan notablemente3.
El manejo terapéutico conservador se basa en controles obstétricos seriados e inducción del parto. Para tratar de mejorar la función cardíaca del feto perfusor se pueden usar digoxina e indometacina. Entre las intervenciones más invasivas están la interrupción del embarazo, la amniocentesis evacuadora de líquido amniótico para reducir el riesgo de parto prematuro, o la interrupción del flujo al feto acardio, con embolización guiada por ecografía de las anastomosis mediante instilación de alcohol o sustancias metálicas, coagulación por láser o ligadura percutánea del cordón del acardio.
CASO CLÍNICO
Paciente de 37 años, que acude a su ginecólogo por dolor abdominal y amenorrea de 7 meses de evolución. Sin antecedentes familiares ni personales de interés. En la historia ginecoobstétrica destaca: menarquia a los 13 años, ciclos menstruales irregulares y parto instrumental 3 años antes.
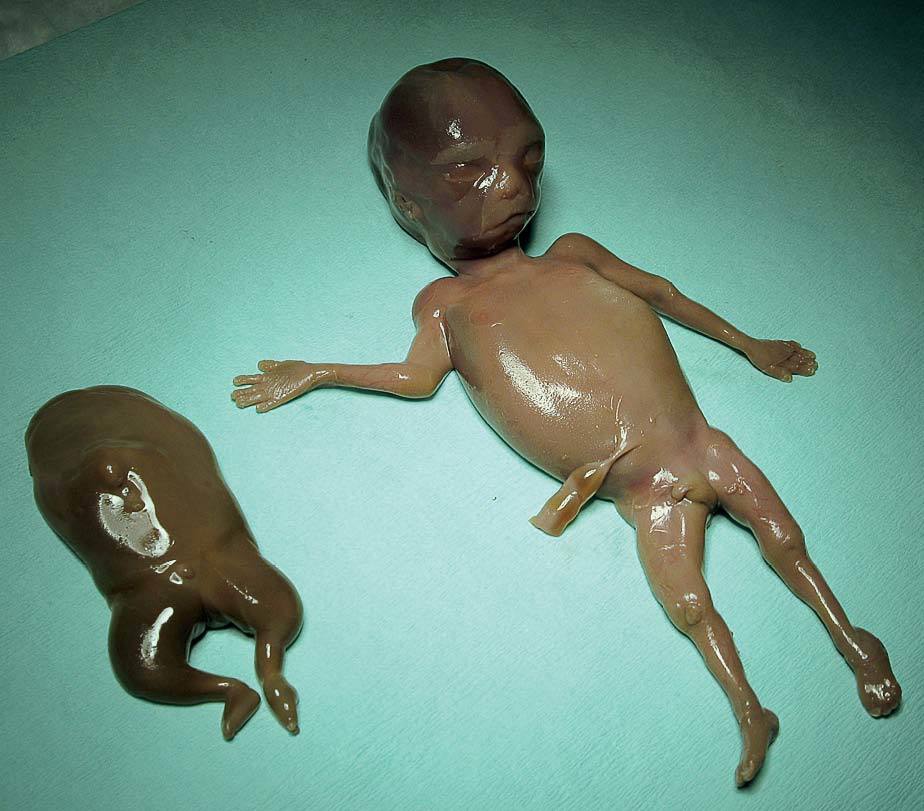
En la exploración se objetiva un útero aumentado de tamaño, blando (aproximadamente 20-22 semanas de gestación); cérvix macroscópicamente sano, formado y cerrado al tacto. En el examen ecográfico inicial se observó que se trataba de una gestación gemelar monocorial, monoamniótica con ambos fetos muertos, uno de ellos con aspecto morfológico normal y biometría correspondiente a 17 semanas de amenorrea; el otro gemelo presentaba un tamaño mucho menor, sin objetivarse el polo cefálico ni los miembros superiores. La paciente fue remitida para su ingreso en el Servicio de Obstetricia del Complexo Hospitalario de Ourense, donde se confirmó el diagnóstico de gestación gemelar interrumpida y la malformación de uno de los gemelos (fig. 1). Se procede a la inducción del parto inmaduro y la evolución de éste fue favorable, con la obtención de 2 fetos muertos, que se enviaron junto con la placenta al Servicio de Anatomía Patológica para su examen (fig. 2). La recuperación de la paciente cursó sin incidencias, con alta hospitalaria a los 2 días de su ingreso.
Fig. 1. Visión macroscópica de ambos fetos.
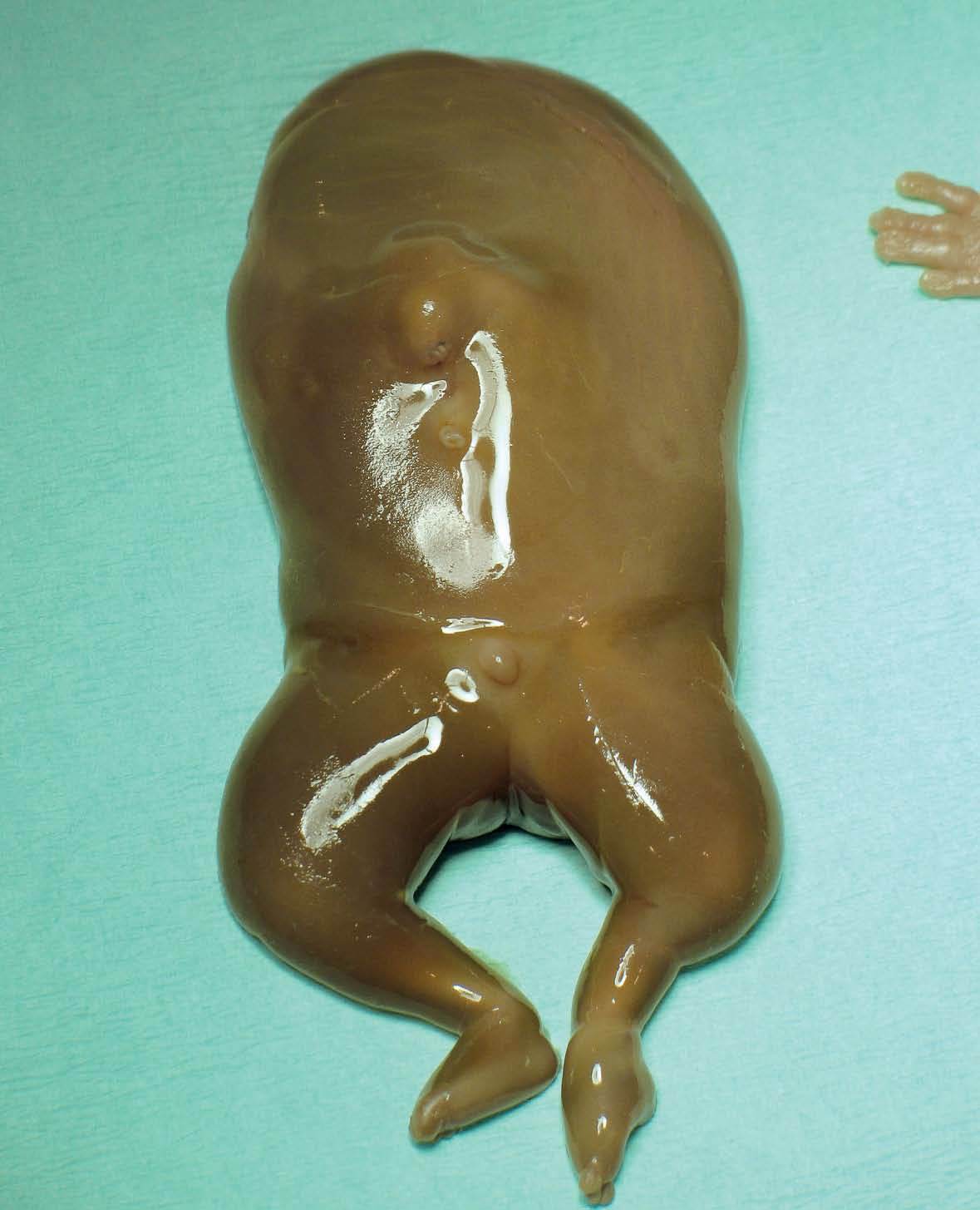
Fig. 2. Detalle del feto acardio.
El informe anatomopatológico describe un primer feto de 20 g de peso constituido por una masa amorfa con extremidades inferiores deformadas (posición anómala, 5 dedos en el pie derecho y 3 en el izquierdo), presencia de un segmento de columna vertebral, una pequeña cavidad abdominal con riñón y glándula suprarrenal únicos, 2 gónadas y un segmento corto de intestino atrésico. Ausencia de polo cefálico, tronco, órganos torácicos, la mayor parte de los órganos abdominales y extremidades superiores (acardius acephalus). Un segundo feto, sin malformaciones congénitas macroscópicamente detectables, fenotipo externo masculino, con un peso de 108 g y 15 cm de longitud, con severa maceración (grado III, más de 8 días de muerte intraútero). Órganos en situs solitus, reblandecidos por la maceración. Placenta monocorial. Cordón umbilical del feto acardio con 2 luces vasculares y el del feto fenotípicamente normal con las 3 luces vasculares habituales.
DISCUSIÓN
El feto acardio constituye una fetopatía de escasa incidencia y de carácter letal, que en un alto porcentaje se asocia con acefalia; generalmente se produce en gestaciones monocigóticas, y se da en menos del 1% de todos los embarazos múltiples. No obstante, hay casos descritos en gestaciones monocoriales dicigóticas, gestaciones triples e incluso en embarazos únicos.
La etiología es desconocida, pero hay 2 posibles teorías para explicar el cuadro. La primera aboga por la presencia de 2 gemelos anatómicamente normales en el inicio de la gestación, que posteriormente, y debido a las anastomosis placentarias establecidas, se convertirían en un feto que dominaría vascularmente al otro invirtiéndose así el flujo vascular4 y llegando al otro feto la sangre hipóxica, hipercápnica y pobre en nutrientes. Los órganos con baja tolerancia a la hipoxia presentarían necrosis isquémica, más acentuada cuanto más alejados se sitúen dichos órganos de las ilíacas primitivas (carótidas, coronarias), y es mejor el desarrollo de los órganos de la mitad inferior del cuerpo.
La otra hipótesis defiende que el feto acardio sería anormal desde el principio y que, de no ser por el hermano que le mantiene en una existencia pasiva, sufriría un aborto espontáneo previa regresión isquémica por la perfusión reversa arterial. En un 33% se trata de fetos con anomalías cromosómicas, en un 66% presenta arteria umbilical única, se asocia a diversas malformaciones, la más frecuente la simelia.
El feto normal tiene una alta mortalidad perinatal (50-70%) a causa del fallo cardíaco congestivo, y en estos casos puede demostrarse cardiomegalia. Además, se han descrito otras alteraciones asociadas, como el ventrículo único.
El diagnóstico se realiza fundamentalmente por examen ecográfico mediante Doppler color, con el cual se pone de manifiesto el flujo umbilical inverso así como las anastomosis placentarias.
El manejo terapéutico abarca un abanico de posibilidades que van desde la actitud expectante, con controles obstétricos seriados, a la más intervencionista; entre estas últimas se incluyen las amniocentesis evacuadoras para aliviar el polihidramnios y disminuir las posibilidades de parto prematuro, la embolización endoscópica de las anastomosis5, con guía ecográfica, mediante la instilación de sustancias metálicas o alcohol, la coagulación por láser6 o la ligadura percutánea del cordón umbilical del feto malformado para interrumpir su aporte de flujo (indicadas si el cariotipo y la morfología del feto no acardio son normales). También se emplean otras medidas no invasivas, como la administración de fármacos con objeto de mejorar la función cardíaca del feto bomba, como la indometacina, la digital y también sustancias con efecto tocolítico7.
Aceptado para su publicación el 10 de abril de 2006.