Determinar las modificaciones en los lípidos y la lipoproteína (a) (Lp(a)) en menopáusicas que utilizan tibolona.
Materiales y métodosUna muestra de 45 menopáusicas que fueron tratadas con una dosis diaria de 2,5mg de tibolona por 6 meses. Se midieron las concentraciones séricas de colesterol, triglicéridos (TG), lipoproteína de alta densidad (HDL-C), lipoproteína de baja densidad (LDL-C), Lp(a), la relación colesterol/HDL-C y la relación TG/HDL-C.
ResultadosSe observaron disminuciones significativas en las concentraciones de colesterol, TG, LDL-C y Lp(a) cuando se compararon las concentraciones después de 6 meses de uso de la tibolona con las concentraciones iniciales (p<0,05). Se observó una disminución estadísticamente significativa en las concentraciones de la HDL-C (p<0,05). En cuanto a la relación TG/HDL-C, ésta presentó una diminución estadísticamente significativa de más del 30% (p<0,05). Con respecto a la relación colesterol/HDL-C, no se encontraron diferencias estadísticamente significativas en los valores promedio antes y después del tratamiento (p=ns).
ConclusiónLa tibolona produjo disminuciones significativas en las concentraciones plasmáticas de colesterol, TG, HDL-C, LDL-C y Lp(a), y modificaciones significativas en la relación TG/HDL-C-C luego de seis meses de uso.
To determine modifications in lipids and lipoprotein (a) in postmenopausal women receiving tibolone.
Materials and methodsA sample of 45 postmenopausal women who were treated with a dose of 2.5mg of tibolone daily for 6 months was selected. Serum concentrations of cholesterol, triglycerides, high-density lipoprotein cholesterol (HDL-C), low-density lipoprotein cholesterol (LDL-C), lipoprotein (a) and the cholesterol/HDL and triglyceride/HDL ratios were measured.
ResultsCholesterol, triglyceride, LDL-C and lipoprotein (a) concentrations were significantly reduced after 6 months of tibolone use compared with initial concentrations (p<0.05). A statistically significant decrease in HDL-C was observed (p<0.05). The triglyceride/HDL ratio showed a significant reduction of more than 30% (p<0.05). No significant differences in mean cholesterol/HDL ratio values before and after treatment (p=ns) were found.
ConclusionsTibolone significantly reduced cholesterol, triglyceride, HDL-C, LDL-C and lipoprotein (a) concentrations and significant modifications in the triglyceride/HDL-C ratio after 6 months of use.
Los cambios en el perfil lipídico han sido propuestos como uno de los principales mecanismos para la reducción del riesgo de la enfermedad cardíaca coronaria en menopáusicas usuarias de estrógenos, con ciertas preocupaciones sobre el efecto opositor de los progestágenos1. Debido al aumento en los triglicéridos (TG) séricos es considerado un factor de riesgo para las enfermedades cardiovasculares en las mujeres, los efectos de la terapia hormonal de reemplazo (THR) sobre estos parámetros es interesante y no son la única consideración para la selección del tratamiento2.
Los estudios prospectivos de cohortes sugirieron que la THR disminuye el riesgo de enfermedades cardiovasculares en las mujeres menopáusicas relativamente jóvenes y sanas3–6. En contraste, dos estudios, el de Reemplazo de Estrógenos/Progestinas7 y la Iniciativa de Salud en las mujeres8, reportaron que la THR no disminuía el riesgo de eventos cardiovasculares y posteriormente demostraron cierto incremento en este riesgo. Las razones que pueden inducir a un aumento en el riesgo de las enfermedades cardiovasculares posterior al uso de la THR es un aumento en la concentración de los TG9–11.
Los niveles plasmáticos de colesterol total y lipoproteína de baja densidad (LDL-C) tienen relación directa con la enfermedad cardiovascular. La reducción del colesterol y de la LDL-C disminuye la incidencia de la enfermedad coronaria. La relación entre la lipoproteína de alta densidad (HDL-C) y la enfermedad coronaria es inversa. Cuando los niveles de HDL-C son menores de 50mg/dl, las menopáusicas tienen tres veces mayor posibilidad de morir que las mujeres con niveles normales12. En el Helsinki Herat Study, la reducción del 34% en la enfermedad coronaria fue relacionada con una reducción del 11% en la LDL-C y el incremento del 12% en la HDL-C2. La deficiencia de los estrógenos, junto con el envejecimiento, incrementa el riesgo de enfermedades cardiovasculares, y esto ha sido establecido en forma definitiva en estudios epidemiológicos y clínicos. Mientras que las concentraciones de colesterol total, LDL-C y TG aumentan, la HDL-C disminuye después de la menopausia5,13,14.
La lipoproteína (a) (Lp(a)) es un marcador independiente de la enfermedad cardiovascular y aumenta en la menopausia. Los estudios epidemiológicos han demostrado una asociación positiva entre las elevadas concentraciones de Lp(a) y el riesgo tanto de enfermedad cardíaca coronaria como de accidentes cerebrovasculares. La administración de algunos tipos de THR puede producir una disminución de los niveles de Lp(a)15.
La tibolona es un esteroide sintético que tiene propiedades estrogénicas, androgénicas y progestagénicas. Se ha usado principalmente para la prevención de la osteoporosis y el tratamiento de los síntomas climatéricos. Por sí misma no tiene actividad biológica, sus efectos son el resultado de la actividad de sus metabolitos en varios tejidos. Las concentraciones de los metabolitos de la tibolona y la regulación metabólica de la actividad varía dependiendo del tejido16. La tibolona tiene un efecto estrogénico en el hueso y tejido vaginal. En el tejido endometrial funciona como un progestágeno, mientras que en el cerebro e hígado tiene un efecto androgénico17.
El objetivo de la investigación fue determinar las modificaciones en los lípidos y la Lp(a) en menopáusicas que utilizan tibolona.
Material y métodosSe seleccionaron al azar 45 menopáusicas que acudieron a la Consulta de Menopausia del Hospital Central Dr. Urquinaona y que fueron tratadas con una dosis diaria de 2,5mg de tibolona oral. La investigación fue aprobada por el Comité de Ética e Investigación del hospital.
Se incluyeron mujeres con menopausia natural con, por lo menos, 1 año de evolución con concentraciones de la FSH superiores a 35U/l y del estradiol (E2) menor de 30pg/ml. Se excluyeron todas las mujeres con antecedentes familiares o personales de alergia a la tibolona, que consumieran cualquier medicamento que alterara la coagulación, la fibrinólisis, el metabolismo lipídico u óseo y con menos de 1 año de menopausia natural. Ninguna de las menopáusicas tenía historia familiar o personal de alteraciones lipídicas o glucémicas.
Antes del inicio del estudio a todas las mujeres se les realizaron determinaciones de FSH y estradiol para confirmar el estado menopáusico. Las concentraciones séricas de colesterol, TG, HDL-C, LDL-C y Lp(a) se determinaron antes del inicio del tratamiento y luego de seis meses del uso de la tibolona.
Después de un ayuno de 12h se tomó una muestra de la vena antecubital con las mujeres en posición sentada. La muestra de suero se almacenó a −201°C antes del ensayo. El colesterol total y los TG se midieron usando procesadores enzimáticos automáticos en un analizador de acceso al azar. La concentración de HDL-C se determinó después de la precipitación selectiva con manganeso-heparina posterior a la determinación enzimática de colesterol. La concentración de la LDL se calculó usando la fórmula de Friedwald. Las concentraciones de la Lp(a) se determinaron por duplicado usando una técnica inmunoabsorbente asociada a enzimas.
Los valores se expresaron como valores absolutos y relativos. Se utilizó la prueba de la t de Student para las muestras relacionadas para evaluar las concentraciones séricas de colesterol, TG, HDL-C, LDL-C, Lp(a), la relación colesterol/HDL-C y la relación TG/HDL-C. Se consideró p<0,05 como estadísticamente significativo.
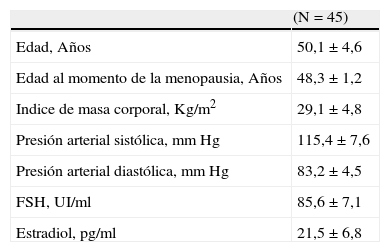
ResultadosLas características generales de las 45 menopáusicas se muestran en la tabla 1. La edad promedio de las pacientes fue de 50,1±4,6 años, con un índice de masa corporal de 29,1±4,8 años y concentraciones de FSH y estradiol de 85,6±7,1U/ml y 21,5±6,8pg/ml, respectivamente.
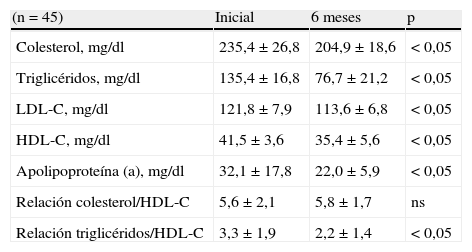
En la tabla 2 se muestran las comparaciones de los valores iniciales y después de seis meses de tratamiento en los lípidos, lipoproteínas y Lp(a). Se observaron disminuciones significativas en las concentraciones de colesterol, TG, LDL-C y Lp(a) cuando se compararon las concentraciones después de seis meses de uso de tibolona con las concentraciones iniciales (p<0,05). Las disminuciones de los componentes lipídicos séricos fueron de la siguiente manera: colesterol, del 12,9%; TG, del 43,3%; LDL-C, del 6,7%, y Lp(a), del 31,4%.
Lípidos y lipoproteínas séricas antes y después de seis meses de tratamiento
| (n=45) | Inicial | 6 meses | p |
| Colesterol, mg/dl | 235,4±26,8 | 204,9±18,6 | < 0,05 |
| Triglicéridos, mg/dl | 135,4±16,8 | 76,7±21,2 | < 0,05 |
| LDL-C, mg/dl | 121,8±7,9 | 113,6±6,8 | < 0,05 |
| HDL-C, mg/dl | 41,5±3,6 | 35,4±5,6 | < 0,05 |
| Apolipoproteína (a), mg/dl | 32,1±17,8 | 22,0±5,9 | < 0,05 |
| Relación colesterol/HDL-C | 5,6±2,1 | 5,8±1,7 | ns |
| Relación triglicéridos/HDL-C | 3,3±1,9 | 2,2±1,4 | < 0,05 |
Igualmente se observó una disminución estadísticamente significativa en las concentraciones de HDL-C (41,5±3,6mg/dl al inicio del estudio comparado con 35,4±5,6mg/dl luego de seis meses de tratamiento (p<0,05). Esta disminución representó una diferencia mayor del 14% del valor a los seis meses comparado con el valor inicial.
Con respecto a la relación colesterol/HDL-C (tabla 2), no se encontraron diferencias estadísticamente significativas en los valores promedio antes y después del tratamiento (5,6±2,1 comparado con 5,8±1,7; p=ns). En cuanto a la relación TG/HDL-C, ésta presentó una disminución estadísticamente significativa de más del 30% (3,3±1,9 para el inicio del tratamiento comparado con 2,2±1,4 seis meses después; p<0,05).
DiscusiónEn la presente investigación se observó que la tibolona produce una disminución significativa en las concentraciones de colesterol, TG, LDL-C, HDL-C y Lp(a) luego de seis meses de tratamiento. También se encontró una disminución en la relación TG/HDL-C, sin alteración de la relación colesterol/HDL-C.
Aunque los factores endoteliales y vasculares son aceptados como los principales responsables en la incidencia de la enfermedad cardiovascular entre las menopáusicas, aún un papel prominente es atribuido al metabolismo de los lípidos y las lipoproteínas como un factor involucrado en la aparición temprana de la enfermedad arterial6,10,18. D’Agostino et al19 propusieron la etiología multifactorial de las enfermedades cardiovasculares. El factor lípidos-lipoproteínas está conformado por varios parámetros interrelacionados, los cuales son modulados en forma diferente por las hormonas y sus potencias esteroidea, progestagénica y androgénica, dosis y rutas de administración de los diferentes esquemas de la THR20.
El impacto aterogénico del factor lípidos-lipoproteínas ha sido evaluado en forma variable por diferentes investigadores. Jacobs et al21 consideraron a la HDL-C como el predictor más importante de riesgo de enfermedad cardiovascular. El panel de tratamiento para el Programa de Educación del Colesterol22 identificó a la LDL-C como el objetivo primario de la terapia de disminución del colesterol. Los TG han adquirido un papel predominante entre los parámetros del perfil lipídico y su concentración es considerada en la actualidad como predictor independiente de riesgo de enfermedad cardiovascular23. Entre las usuarias de la THR, el incremento de los TG inducido por los estrógenos es atribuido a un incremento en la síntesis hepática de las lipoproteínas de muy baja densidad (VLDL-C) y puede ser parcialmente utilizada como factor de riesgo. Los TG son reguladores de las interacciones de las lipoproteínas y están asociados con el diámetro y la densidad de la LDL-C: en esencia, el incremento de los TG refleja la presencia de la altamente aterogénicas de la VLDL-C y la LDL-C pequeñas y densas23–25. En este aspecto, es reconocido que los estrógenos equinos conjugados aumentan significativamente los TG plasmáticos y disminuyen el tamaño de las partículas de las LDL-C, lo cual pone en entredicho el papel antioxidante de los estrógenos. En contraste, como lo demostraron los resultados de la presente investigación, la tibolona disminuye las concentraciones plasmáticas de TG, por lo cual parece poseer un verdadero efecto antioxidante26,27. La disminución significativa de los TG puede estar de acuerdo con la teoría de que la tibolona contribuye a la formación de partículas de la LDL-C más grandes, menos densas y, teóricamente, menos aterogénicas26.
Los estudios experimentales, observacionales y clínicos han establecido, aún con pequeñas diferencias, que la THR produce un perfil de lípidos-lipoproteínas antiaterogénica en forma general. La THR oral disminuye el colesterol, la LDL-C y la Lp(a) y aumenta los TG y la HDL-C6,14,25,28. Las progestinas no presentan esta clase de eventos. Las progestinas del mismo origen pueden tener diferentes efectos metabólicos y vasculares, dependiendo de su afinidad por los receptores de estrógenos, progesterona y andrógenos29.
La tibolona tiene un efecto menos favorable sobre el colesterol y la LDL-C comparado con otras terapias hormonales20,30. En forma similar a informes previos, esta investigación demostró una disminución importante en las concentraciones plasmáticas de colesterol, pero esto es probablemente atribuible a la disminución significativa en las concentraciones de HDL-C31. Pero a diferencia de esos informes, en esta y en otras investigaciones se observó un efecto significativo sobre las concentraciones de LDL-C32, 33. Se puede pensar que la protección de la HDL-C puede no ser necesaria en las mujeres que utilizan THR, ya que se ha propuesto que la reducción observada en las concentraciones de HDL-C en las mujeres que utilizan tibolona no produciría ningún tipo de consecuencias adversas. En apoyo a esta teoría, esta investigación demostró que la tibolona reduce significativamente la relación TG/HDL-C, la cual es predictor poderoso tanto del riesgo de insulinorresistencia como de enfermedad cardíaca coronaria34,35.
Clarkson et al36 demostraron que la tibolona no aumenta ni disminuye la aterosclerosis de las arterias coronarias del mono Cynomolgus. En este estudio, el potencial para inhibir la aterosclerosis coronaria puede ser subestimado principalmente por la disminución que se produce en las concentraciones de HDL-C. Varios estudios recientes han demostrado que la tibolona disminuye las concentraciones de HDL-C por incremento de la actividad de la lipasa hepática, pero no altera la capacidad de salida del colesterol o la actividad paraoxonasa en la menopáusica32. En otras palabras, la actividad antiaterogénica de la HDL-C permanece sin cambios a pesar de la disminución de sus concentraciones plasmáticas. Simoncini et al37 demostraron que la tibolona y su metabolito estrogénico activan la sintetasa de óxido nítrico endotelial a través de mecanismos geonómicos y no geonómicos dependientes de los receptores de estrógenos. La disminución de las concentraciones de la HDL-C puede estar relacionada con la acción del isómero Delta 4. La androgenicidad de este isómero contribuye a la disminución significativa de los TG. Por lo tanto, la tibolona previene la acumulación de colesterol y la formación de bandas lipídicas en la aorta y la aliteración de la relajación del músculo liso dependiente del endotelio, ambos efectos beneficiosos que son independientes a los lípidos plasmáticos. Se ha descrito que un tratamiento de tres meses con tibolona disminuye el grosor de la íntima media de la arteria carótida en un 28%38. La tibolona tiene efectos similares al probucol en los aspectos de los efectos antioxidantes y sobre la disminución de HDL-C. A pesar de la disminución de la HDL-C, el probucol disminuye la tasa de reestenosis y complicaciones después de las intervenciones percutáneas en los pacientes con enfermedades coronarias39.
Como ha sido el caso de otros factores de riesgo relacionado con los lípidos y las lipoproteínas, y la enfermedad cardíaca coronaria en general, la Lp(a) ha sido principalmente estudiada en los hombres33. Con relación a los efectos de la tibolona sobre las concentraciones de la Lp(a), los hallazgos de esta investigación son similares a los de otras investigaciones que indican una reducción significativa32.
Aunque no existe evidencia de que la tibolona esté asociada con un aumento del riesgo de eventos cardiovasculares, sus efectos sobre el perfil lipídico pueden producir dudas sobre los efectos de la asociación de este medicamento con la salud cardiovascular. Estudios animales han sugerido que la tibolona tiene un mecanismo de cardioprotección independiente a sus efectos sobre los lípidos plasmáticos14,40. En un informe, la tibolona no presentó efectos sobre el índice aterogénico en el plasma, sugiriendo que la capacidad del potente isómero Delta 4 para reducir en forma significativa la concentración de TG y de LDL-C puede ser neutralizado por los efectos adversos sobre la HDL-C41.
Se concluye que la tibolona produce disminuciones significativas en las concentraciones plasmáticas de colesterol, TG, HDL-C, LDL-C, la relación TG/HDL-C y Lp(a) luego de seis meses de uso.