El objetivo de la investigación fue evaluar los cambios en las concentraciones de lípidos y lipoproteínas en pacientes menopáusicas tratadas con diosgenina, como tratamiento hormonal sustitutivo después de 6 meses de tratamiento. Se seleccionó a 49 pacientes menopáusicas, que asistieron a la consulta de Menopausia del Hospital Central Dr. Urquinaona y a las que se trató con diosgenina. Se midieron las concentraciones séricas de colesterol, triglicéridos, colesterol unido a lipoproteínas de baja densidad (cLDL) y colesterol unido a lipoproteínas de alta densidad (cHDL). Las concentraciones de colesterol y triglicéridos presentaron aumentos después de 6 meses de tratamiento con diosgenina, comparado con las concentraciones iniciales, pero estos aumentos se consideraron estadísticamente no significativos (NS) (p=NS). Al analizar las concentraciones de cLDL y cHDL, no se encontraron diferencias estadísticamente significativas en las concentraciones después de 6 meses de tratamiento al compararla con las concentraciones iniciales (p=NS). Se concluye que la diosgenina no produce modificaciones significativas en los valores promedio en los lípidos y lipoproteínas estudiados después de 6 meses de tratamiento en pacientes menopáusicas que la utilizan como tratamiento hormonal sustitutivo.
The aim of this study was to evaluate the changes in lipid and lipoprotein concentrations in postmenopausal women after 6 months of treatment with diosgenin as hormone replacement therapy. Forty-nine postmenopausal women attending the menopause unit at the Dr. Urquinaona central hospital who were treated with diosgenin were selected. Serum concentrations of cholesterol, triglycerides, low-density lipoprotein cholesterol (LDL-C) and high-density lipoprotein cholesterol (HDL-C) were measured. Cholesterol and triglyceride concentrations rose after 6 months of treatment with diosgenin compared with initial values, but these increases were not statistically significant (p=ns).
When LDL-C and HDL-C concentrations were analyzed, no statistically significant differences were found in plasma concentrations after 6 months of treatment compared with initial concentrations (p=ns). We conclude that diosgenin produces no significant modifications in mean lipid and lipoprotein values after 6 months of treatment in postmenopausal women administered this drug as hormone replacement therapy.
Los cambios en el perfil lipídico se han propuesto como uno de los mecanismos principales para la reducción del riesgo de la enfermedad cardíaca coronaria en pacientes menopáusicas usuarias de estrógenos, con ciertas preocupaciones sobre el efecto opositor de los progestágenos1. Debido al aumento en los triglicéridos (TG) séricos, se considera un factor de riesgo para las enfermedades cardiovasculares en las mujeres, los efectos del tratamiento hormonal sustitutivo (THS) en estos parámetros es interesante y no son la única consideración para la selección del tratamiento2.
Los estudios prospectivos de cohortes indicaron que el THS disminuye el riesgo de enfermedades cardiovasculares en mujeres menopáusicas relativamente jóvenes y sanas3,4. En contraste, en 2 estudios (el estudio sustitutivo de estrógenos/progestinas [HERS, del inglés Heart and Estrogen/progestin Replacement Study]5 y la Iniciativa de Salud en las Mujeres [WHI, del inglés Women's Health Initiative]6), se informó que el THS no disminuía el riesgo de episodios cardiovasculares y, posteriormente, demostraron cierto incremento en este riesgo. Las razones que pueden inducir a un aumento en el riesgo de enfermedades cardiovasculares posterior al uso de THS es un aumento en la concentración de TG7.
Los valores plasmáticos de colesterol total y del colesterol unido a lipoproteínas de baja densidad (cLDL) tienen relación directa con la enfermedad cardiovascular. La reducción del colesterol y del cLDL disminuye la incidencia de la enfermedad coronaria. La relación entre el colesterol unido a lipoproteínas de alta densidad (cHDL) y la enfermedad coronaria es inversa. Cuando los valores de cHDL son menores de 50mg/dl, las menopáusicas tienen 3 veces más posibilidades de morir que las mujeres con valores normales8. Una reducción del 34% en enfermedad coronaria se relacionó con la reducción del 11% en cLDL y el incremento del 12% en cHDL2. La deficiencia de los estrógenos junto con el envejecimiento incrementa el riesgo de enfermedades cardiovasculares, y esto se ha establecido de forma definitiva en estudios epidemiológicos y clínicos. Mientras que las concentraciones de colesterol total, cLDL y TG aumentan, el cHDL disminuye después de la menopausia9.
Muchas mujeres buscan alternativas al THS para el tratamiento de los síntomas de la menopausia10. Los “tratamientos naturales” para la menopausia incluyen: productos de soja, linaza, ginseng, dong quai y extracto de ñame salvaje. Los productos de ñame salvaje se han promocionado de forma amplia en los medios de comunicación por su supuesta capacidad para aliviar los síntomas menopáusicos y otros beneficios11.
Se conoce que el extracto de ñame salvaje contiene sapogeninas esteroideas, incluida diosgenina. La diosgenina es un precursor hormonal esteroideo in vitro, que fue la principal fuente de corticosteroides farmacéuticos durante la década de 1950, se conoce que afecta al transporte del colesterol12 y que tiene una actividad débil de unión a los estrógenos13. También ha demostrado que tiene posibles efectos proneoplásico y antineoplásico14. Después de la administración oral, parte de ella es absorbida, distribuida en el hígado, las glándulas adrenales y las paredes del aparato gastrointestinal, se metaboliza en el hígado y se elimina en la bilis12,13. Sin embargo, hay pocas investigaciones sobre la seguridad y la eficacia de estas preparaciones en los parámetros del perfil lipídico.
El objetivo de la investigación fue evaluar los cambios en las concentraciones de lípidos y lipoproteínas en pacientes menopáusicas tratadas con diosgenina como THS después de 6 meses de tratamiento.
MétodoLa muestra fue no probabilística de 49 menopáusicas seleccionadas entre las mujeres que acudieron a la consulta de Menopausia del Hospital Central Dr. Urquinaona, a las cuales se indicó el uso de tabletas comerciales de diosgenina con una dosis de 170mg 3 veces al día durante 6 meses. El productor de la cápsula informó que la pureza de la diosgenina es superior al 95%.
Se incluyó a pacientes menopáusicas sanas entre 45 y 60 años de edad, que no presentaran menstruaciones en los 12 meses previos al inicio del estudio y valores de hormona foliculoestimulante (FSH) mayor de 50U/I y de estradiol menor de 35mg/dl. Se excluyó a mujeres con anomalías clínicas o de laboratorio que indicaran alteraciones cardiovasculares, hepáticas o renales, con antecedentes de coagulopatias, uso de estrógenos, andrógenos o progestágenos orales o transdérmicos en los 6 meses previos al estudio, hábito tabáquico de más de 10 cigarrillos/día y uso de medicamentos que modifiquen las concentraciones de lípidos.
Al inicio de la investigación, se realizó un cuestionario clínico en el que se incluyeron los antecedentes familiares, examen físico y un electrocardiograma. A todas las mujeres se realizaron determinaciones de FSH y estradiol para confirmar el estado menopáusico. Las concentraciones séricas de colesterol, TG, cHDL y cLDL se determinaron antes del inicio del tratamiento y después de 6 meses del uso de la diosgenina.
Después de un ayuno de 12h, se tomó una muestra de la vena antecubital con las mujeres en posición sentada. La muestra de suero se almacenó a −20°C antes del ensayo. El colesterol total y los TG se midieron usando procesadores enzimáticos automáticos en un analizador de acceso al azar. La concentración de cHDL se determinó después de la precipitación selectiva usando manganeso-heparina posterior a la determinación enzimática de colesterol. La concentración de cLDL se calculó usando la fórmula de Friedwald.
Los valores se expresaron como valores absolutos y relativos. Para comparar las concentraciones iniciales y después de 6 meses de tratamiento, se utilizó la prueba de la t de Student para muestras relacionadas. El porcentaje de cambio (en comparación al inicio) en las concentraciones (conc) del parámetro se calculó como: ([Conc 6 meses]−[conc Inicial]/[conc Inicial])×100. Se consideró p<0,05 como estadísticamente significativo.
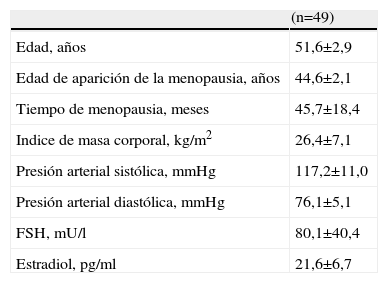
ResultadosEn la tabla 1 se muestran las características generales iniciales de las pacientes. La edad promedio de las pacientes en el momento del inicio del estudio fue de 49,1±4,5 años, con un índice de masa corporal promedio de 27,5±3,2kg/m2 y concentraciones promedio de FSH y estradiol de 90,1±4,6U/ml y 21,4±3,2pg/ml, respectivamente.
Características clínicas y de laboratorio al inicio del estudio
| (n=49) | |
| Edad, años | 51,6±2,9 |
| Edad de aparición de la menopausia, años | 44,6±2,1 |
| Tiempo de menopausia, meses | 45,7±18,4 |
| Indice de masa corporal, kg/m2 | 26,4±7,1 |
| Presión arterial sistólica, mmHg | 117,2±11,0 |
| Presión arterial diastólica, mmHg | 76,1±5,1 |
| FSH, mU/l | 80,1±40,4 |
| Estradiol, pg/ml | 21,6±6,7 |
FSH: hormona foliculoestimulante.
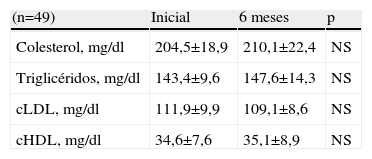
En la tabla 2 se muestran las concentraciones de colesterol, TG, cLDL y cHDL antes y después de 6 meses de tratamiento con diosgenina. Las concentraciones iniciales de colesterol fueron de 204,5±18,9mg/dl, para presentar después un aumento de casi 3% hasta 210,1±22,4mg/dl. Este aumento se consideró no significativo (NS) (p=NS). Respecto a las concentraciones de TG, se observó un aumento de 2,9% entre las concentraciones después de 6 meses de tratamiento con diosgenina y las concentraciones iniciales (147,6±14,3mg/dl a los 6 meses comparado con 143,4±9,6mg/dl al inicio), esta variación también se consideró como no significativa (p=NS).
Lípidos y lipoproteínas séricas antes y después de 6 meses del tratamiento con diosgenina
| (n=49) | Inicial | 6 meses | p |
| Colesterol, mg/dl | 204,5±18,9 | 210,1±22,4 | NS |
| Triglicéridos, mg/dl | 143,4±9,6 | 147,6±14,3 | NS |
| cLDL, mg/dl | 111,9±9,9 | 109,1±8,6 | NS |
| cHDL, mg/dl | 34,6±7,6 | 35,1±8,9 | NS |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; NS: no significativo.
Al analizar las concentraciones de cLDL, no se encontraron diferencias estadísticamente significativas (disminución de 2,5%) en las concentraciones después de 6 meses de tratamiento (111,9±9,9mg/dl) al compararla con las concentraciones iniciales (109,1±8,6mg/dl; p=NS). En relación con las concentraciones de cHDL, tampoco se observó la presencia de diferencias estadísticamente significativas (aumento de 1,4%) entre las concentraciones iniciales (34,6±7,6mg/dl) y las concentraciones después de 6 meses de tratamiento (35,1±8,9mg/dl; p=NS).
DiscusiónLos resultados de esta investigación demuestran que la diosgenina no produce efectos significativos en los elementos del perfil lipídico en pacientes menopáusicas sanas.
Aunque los factores endoteliales y vasculares se aceptan como la causa principal en la incidencia de enfermedad cardiovascular en las pacientes menopáusicas, aún se atribuye un papel prominente al metabolismo de los lípidos y las lipoproteínas como un factor involucrado en la aparición temprana de la enfermedad arterial15. D’Agostino et al16 propusieron la etiología multifactorial de las enfermedades cardiovasculares. El factor lípidos y lipoproteínas está conformado por varios parámetros interrelacionados, los cuales se modulan de forma diferente por las hormonas y sus potencias esteroidea, progestagénica y androgénica, dosis y rutas de administración de los diferentes esquemas del THS17.
Se conoce que la administración de estradiol en un período de 6–12 meses lleva a la disminución de las concentraciones de colesterol plasmático y al incremento del cHDL18,19. Las progestinas no presentan esta clase de episodios. Las progestinas del mismo origen pueden tener diferentes efectos metabólicos y vasculares, dependiendo de su afinidad por los receptores de estrógenos, progesterona y andrógenos20. De acuerdo con esto, la ausencia de cambios detectables en estas variables en estudio puede tomarse como una muestra de la falta de efecto hormonal de la diosgenina. La ausencia de cambios en los lípidos y las lipoproteínas indica que la diosgenina no es una sustancia que pueda convertirse in vivo a progesterona o progestinas en cantidades significativas.
La falta de modificaciones en las concentraciones de TG es llamativa, debido a que la creciente evidencia epidemiológica en el aumento de los TG plasmáticos incrementa en forma independiente el riesgo cardiovascular y los datos de intervención que indican que la disminución de las concentraciones de TG disminuye el riesgo vascular14,19,21. Los cambios en las concentraciones de cLDL son más difíciles de interpretar, ya que los datos epidemiológicos indican que el aumento de las concentraciones de cLDL es un predictor de riesgo vascular. En la presente investigación, no se observaron modificaciones en las concentraciones de colesterol ni en el cLDL. Este hallazgo es contrario a los estudios clínicos de intervención con estradiol y progestinas.
El tratamiento con diosgenina no produjo modificaciones en las concentraciones de cHDL. El mecanismo de los efectos hormonales en el cHDL aún es parcialmente desconocido; sin embargo, el patrón de respuesta a la diosgenina no es similar al de los estrógenos. De igual forma, el suplemento aislado con fitoestrógenos no parece tener efectos en el perfil lipídico, ni en las concentraciones de cHDL22.
Hay un gran conjunto de evidencia del efecto favorable de diferentes sustancias naturales en los lípidos plasmáticos. En un metaanálisis de 38 estudios se informó, en forma general, una disminución del 9,3% en las concentraciones del colesterol y del 12,9% en las concentraciones de cLDL23. Sin embargo, en contraste con el metaanálisis, varios estudios, incluida la presente investigación, demostraron que las pacientes menopáusicas no muestran modificaciones en las concentraciones de cLDL o cHDL24–27, a excepción de un estudio28 en el que se demostraron efectos en el cLDL y el cHDL, pero no en el colesterol.
La alimentación a largo plazo de ratas con una variedad de Dioscorea nipponica causó cambios significativos en los parámetros sanguíneos, incluida disminución de los TG, colesterol, cLDL y las lipoproteínas de muy baja densidad, con aumento del cHDL. La alimentación de las ratas con polvo al 2 y el 5% de esta planta demostró una mejoría en el índice aterogénico. También parece que las saponinas son efectivas para inhibir la absorción de TG en los ratones a los que se le inyecta aceite de maíz29.
Una posible explicación para esta discrepancia entre los datos en la investigación animal y la posterior falta de confirmación en las pruebas en humanos puede deberse a las diferencias en el metabolismo de las diferentes sustancias. Por ejemplo, uno de los principales metabolitos de la daidzeína en los roedores es el equol. En humanos, la transformación a equol depende de la flora intestinal del individuo, pero sólo un tercio de las personas produciría el equol cuando se expone a altas concentraciones de daidzeína14,30. El equol puede ser un modificador importante de los efectos de las sustancias naturales31.
Es posible que el ñame salvaje en forma particular utilizado en esta investigación no contenga la cantidad suficiente de diosgenina para producir efectos biológicos, ya que otras preparaciones han demostrado ser efectivas14,32. Se reconoce que los constituyentes de algunos medicamentos naturales pueden variar de forma marcada32. En ausencia de una hipótesis clara en relación con los mecanismos de acción propuestos y los estándares de los análisis químicos, es imposible hacer un planteamiento acerca de la presencia o la ausencia del componente activo. Sin embargo, es importante que los individuos adopten una actitud crítica cuando se considera el uso de estas sustancias. A falta de estudios a largo plazo o controlados, es imposible establecer una conclusión sobre la seguridad del producto después de su uso continuo. Los riesgos potenciales del uso de medicamentos naturales incluyen riesgo de cáncer, toxicidad por contaminantes de metales pesados y presencia de otros ingredientes activos14,33–35. Estos hechos en conjunto enfatizan la importancia de estudios de los constituyentes químicos y los efectos biológicos de las medicinas naturales, así como de pruebas clínicas aplicadas de forma cuidadosa para definir el perfil de efectos adversos y toxicidad.
Se concluye que la diosgenina no produce modificaciones significativas en los valores promedio de los lípidos y las lipoproteínas estudiados después de 6 meses de tratamiento en pacientes menopáusicas que la utilizan como THS.