La prevalencia de la esterilidad entre la población en edad reproductiva continúa aumentando año tras año en las sociedades occidentales y el recurso terapéutico en la mayoría de los casos, serán las técnicas de reproducción asistida, principalmente la fecundación in vitro. Aunque los avances conseguidos en fecundación in vitro, han repercutido de forma incontestable en las probabilidades de conseguir una gestación, la eficiencia de la técnica, en términos globales, continúa siendo baja. Uno de los factores de mayor impacto en los resultados de fecundación in vitro es la selección de embriones. Es por ello que entre los principales retos de futuro que se plantean en el campo de la reproducción humana asistida, se encuentra el de conseguir métodos de selección embrionaria fiables que permitan la transferencia del embrión con mayor competencia para implantar. En este artículo se revisan los diferentes métodos de selección embrionaria empleados en fecundación in vitro.
The prevalence of infertility among the population of reproductive age continues to increase year after year in Western societies and the therapeutic resource in most cases will be assisted reproductive techniques, mainly in vitro fertilization. Although the advances made in vitro fertilization have had an undeniable impact on the chances of achieving pregnancy, the efficiency of the technique, in global terms, remains low. One of the factors with the greatest impact on in vitro fertilization results is embryo selection. That is why among the main future challenges that arise in the field of assisted human reproduction, is that of obtaining reliable embryo selection methods that allow the transfer of the embryo with greater competence to implant. In this article, the different embryo selection methods used in in vitro fertilization are reviewed.
Aproximadamente un 15% de la población en edad reproductiva tiene problemas para conseguir una gestación en los países desarrollados. La demanda de tratamientos por esterilidad no ha dejado de crecer durante las últimas décadas, tal como lo evidencian los estudios publicados y los registros de las sociedades médicas del ámbito de la reproducción. Este aumento en la demanda de tratamientos puede explicarse por las connotaciones que tiene el problema de la esterilidad conyugal en las sociedades occidentales: una prevalencia que parece ir en aumento y un envejecimiento de la población de mujeres estériles. El aumento en la prevalencia de la esterilidad se ha achacado principalmente al retraso voluntario de la maternidad en la etapa de máxima fertilidad, que podría implicar posteriormente mayores dificultades para la concepción1, o a una disminución de la calidad seminal2. Por otro lado, a medida que aumenta la edad de la mujer, no solo pueden acumularse factores que van en detrimento de su fertilidad, sino que con más frecuencia es necesario someter a la paciente a técnicas de reproducción asistida debido a la disminución de la fertilidad asociada al envejecimiento femenino3.
La técnica de reproducción asistida más eficaz en estos momentos es la fecundación in vitro. Desde el nacimiento de Louise Brown, el primer bebé nacido de la transferencia a útero de un único embrión obtenido por fecundación in vitro (FIV), más de 8.000.000 de niños han nacido en todo el mundo gracias a las técnicas de reproducción asistida. Hoy en día, se estima que alrededor del 5-8% de los niños que nacen anualmente en Europa, y el 1,6% de los que nacen en Estados Unidos, son concebidos utilizando técnicas de reproducción asistida4.
Los avances conseguidos en las últimas décadas en medicina reproductiva, y más concretamente en el campo de la FIV, han repercutido de forma incontestable en los resultados que actualmente se consiguen en los programas de FIV, con tasas globales de nacido vivo superiores al 50% y tasas de implantación superiores al 30% en las pacientes con buena respuesta a la estimulación. No obstante, la FIV continúa teniendo una eficiencia baja, entendida esta en términos de nacidos vivos por ovocito maduro recuperado, embriones generados, embriones transferidos o embriones implantados. En un estudio de Jones5, donde se analizan los resultados de gestación y parto obtenidos a partir de la recuperación de más de 59.000 ovocitos maduros, la eficiencia de la FIV resulta ser de un 9%. Debido al bajo rendimiento de la técnica y con el fin de aumentar las posibilidades de gestación por ciclo, los programas de FIV han optado por la transferencia sistemática de más de un embrión, lo que ha conllevado históricamente una elevada incidencia de embarazo múltiple, con las consabidas complicaciones para el recién nacido y la madre asociadas a este tipo de gestaciones. Es por ello que entre los principales retos de futuro que se plantean en el campo de la reproducción humana asistida, se encuentran, por un lado, el obtener embriones con mayor potencial de desarrollo e implantación y, por otro, conseguir métodos de selección embrionaria fiables que permitan la transferencia de un único embrión.
Métodos de selección embrionariaA lo largo de la historia de la FIV se han intentado implementar diferentes métodos no invasivos de selección embrionaria basados en la búsqueda de biomarcadores de implantación. En ese sentido se han desarrollado tecnologías en el campo de la genómica, la transcriptómica, la proteómica o la metabolómica, las denominadas ómicas, que aunque han dado algunos resultados prometedores, no han conseguido estandarizarse e implantarse como métodos de selección. El screening genético de aneuploidías en estadio de blastocisto se ha afianzado como método de diagnóstico genético del embrión, pero su aplicación generalizada en los programas de FIV, continúa siendo controvertida. Más recientemente, la tecnología time-lapse (TL) y la implementación de modelos de selección embrionaria basados en algoritmos de inteligencia artificial, está abriendo nuevas perspectivas en este campo. Por otro lado, la selección de embriones basada en aspectos morfológicos ha sido y sigue siendo el método de selección no invasivo más utilizado en los programas de reproducción asistida de todo el mundo.
Selección basada en la morfología del embriónLa selección morfológica convencional se basa en la realización de observaciones puntuales del embrión con el objetivo de valorar determinados aspectos morfológicos relacionados con eventos relevantes para la implantación. Estas observaciones suponen una disrupción de las condiciones de cultivo en la que crecen los embriones, puesto que implica extraerlos de los incubadores en los que crecen en condiciones controladas de pH, temperatura, humedad y tensión de oxígeno. Además, la selección de embriones basada en la morfología ha mostrado tener un bajo nivel de eficacia debido a la escasa correlación entre la morfología del embrión y su potencial de implantación, y presentar una elevada variabilidad intra- e interobservador.
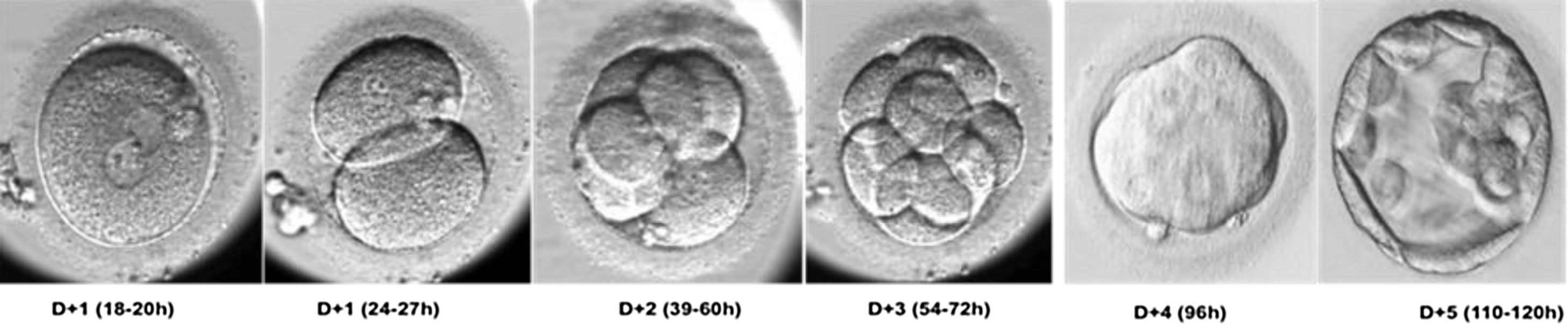
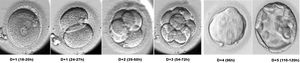
Aspectos relevantes de la morfología del embrión preimplantatorioTras la fecundación, el embrión humano inicia una serie de divisiones sucesivas cada 12-18 h sin que se produzca un incremento de su volumen. Hasta el estadio de 8 células, las blastómeras aparecen bien diferenciadas, son distinguibles, y son totipotentes. A partir de ese momento, entre las 8-16 células, se inicia el proceso de compactación, las células aumentan el contacto entre sí mediante uniones celulares fuertes (tight junctions) y pierden su totipotencia. Se cree que el inicio de la compactación marca el comienzo de la transcripción del DNA y la polarización del embrión6. Tras la compactación, 24 h más tarde, se inicia la progresión hacia el estadio de blastocisto. En él se diferencian dos tipos celulares: la masa celular interna, que dará lugar al embrión, y el trofectodermo, que originará la placenta7 (fig. 1).
Desarrollo embrionario preimplantatorio. Transcurridas alrededor de 18-20 horas desde la inseminación o la microinyección espermática, pueden observarse los signos de fecundación en el ovocito: dos pronúcleos situados en el centro de la célula y dos corpúsculos polares en el espacio perivitelino. Los embriones de 2 células pueden observarse alrededor de las 24-27 horas postinseminación, en el D+1 de cultivo. Los embriones de 4 células aparecen entre las 39 y 60 horas postinseminación, y entre las 54 y las 72 horas aparecen los embriones de 8 células. En el día 4 de desarrollo los embriones aparecen formando mórulas y 24 horas más tarde se inicia la progresión hacia el estadio de blastocisto. El blastocisto aparece alrededor de las 110 horas postinseminación y en él se diferencian dos tipos celulares: la masa celular interna, que dará lugar al embrión, y el trofectodermo, que originará la placenta.
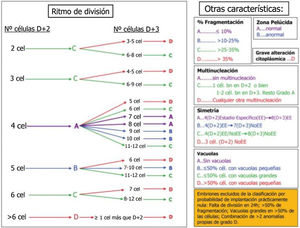
Los aspectos morfológicos evaluados en el embrión tras la fecundación son la división temprana o early cleavage, a las 25-27 h postinseminación; y entre los días 2 y 3 de desarrollo del embrión: el número y simetría de las células, el ritmo de división, el grado de fragmentación, el grado de multinucleación y la presencia de vacuolas. Otros aspectos morfológicos del embrión temprano, como la apariencia homogénea del citoplasma, la granulosidad, la adhesión entre células, el aspecto de la zona pelúcida y muchos otros solo se consideran de forma secundaria. En el cuarto día de cultivo, entre las 90 y las 94 h, el parámetro más importante a valorar es el grado de compactación. El embrión ha de contar con más de 8 células y ha de presentar un patrón de adhesión celular que no permita diferenciar el número de blastómeras. En el quinto día de cultivo, entre las 114-118 h de cultivo postinseminación, los parámetros a tener en cuenta serán el grado de expansión del blastocele, y el número y cohesión de las células que forman el trofectodermo y la masa celular interna8.
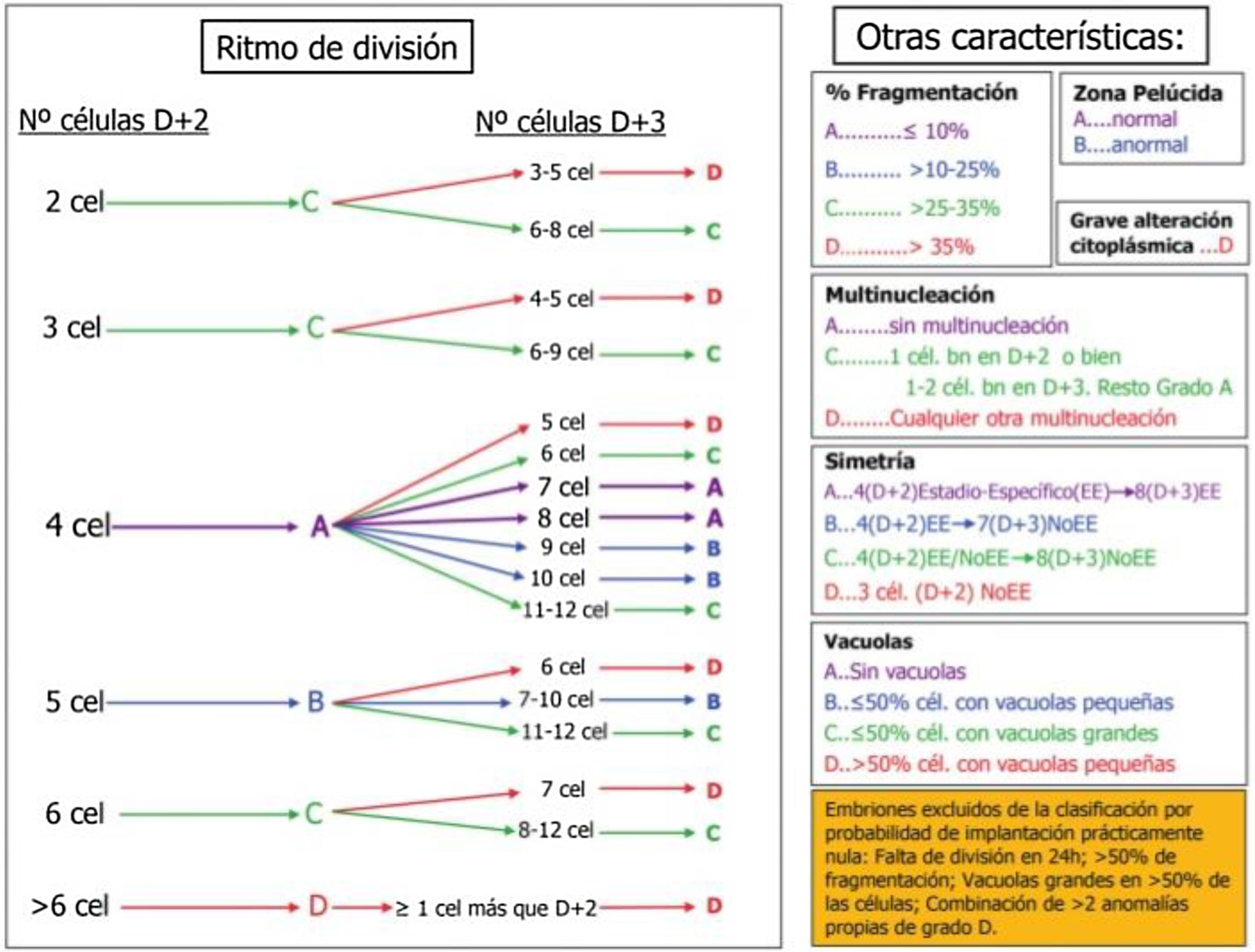
En la figura 2 se muestra la clasificación de embriones hasta D+3 basada en los aspectos morfológicos seleccionados por la Sociedad Española para el estudio de la Reproducción (ASEBIR). La clasificación establece 4 categorías: A, B, C y D, donde A representa la máxima calidad embrionaria y el mayor potencial de implantación, y D la peor calidad embrionaria y el peor pronóstico.
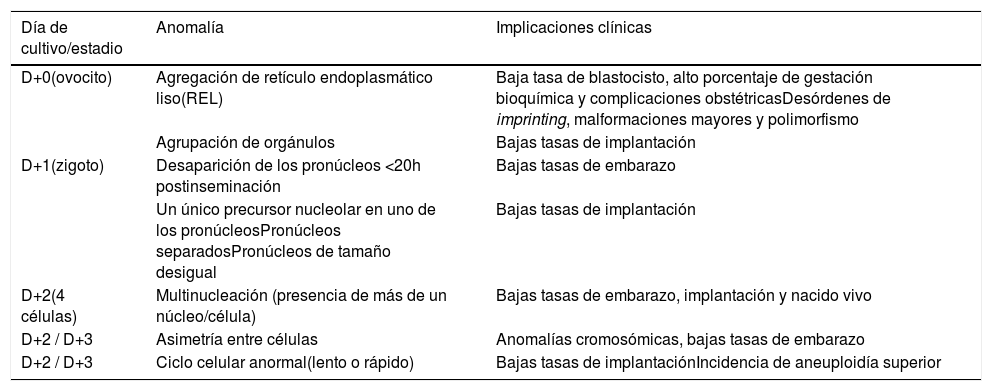
En la tabla adjunta (tabla 1), se muestran los aspectos morfológicos asociados a mal pronóstico reproductivo recogidos en el documento de Consenso de Estambul9 y ASEBIR. La mayoría de los trabajos realizados sobre otros parámetros morfológicos considerados anormales en el ovocito y en el embrión no han podido establecer una relación clara entre la anomalía observada y el potencial de implantación de los embriones estudiados.
Aspectos morfológicos asociados a mal pronóstico reproductivo
| Día de cultivo/estadio | Anomalía | Implicaciones clínicas |
|---|---|---|
| D+0(ovocito) | Agregación de retículo endoplasmático liso(REL) | Baja tasa de blastocisto, alto porcentaje de gestación bioquímica y complicaciones obstétricasDesórdenes de imprinting, malformaciones mayores y polimorfismo |
| Agrupación de orgánulos | Bajas tasas de implantación | |
| D+1(zigoto) | Desaparición de los pronúcleos <20h postinseminación | Bajas tasas de embarazo |
| Un único precursor nucleolar en uno de los pronúcleosPronúcleos separadosPronúcleos de tamaño desigual | Bajas tasas de implantación | |
| D+2(4 células) | Multinucleación (presencia de más de un núcleo/célula) | Bajas tasas de embarazo, implantación y nacido vivo |
| D+2 / D+3 | Asimetría entre células | Anomalías cromosómicas, bajas tasas de embarazo |
| D+2 / D+3 | Ciclo celular anormal(lento o rápido) | Bajas tasas de implantaciónIncidencia de aneuploidía superior |
Durante las últimas dos décadas se ha venido empleando en el ámbito de la FIV el diagnóstico genético preimplantacional para enfermedades monogénicas hereditarias de elevada morbimortalidad, y el diagnóstico de translocaciones cromosómicas equilibradas. El diagnóstico genético preimplantacional también ha sido empleado en parejas sanas como método de selección de embriones euploides en aquellos casos en que la edad materna avanzada predispone a una mayor incidencia de anomalías cromosómicas numéricas10. El screening de aneuploidías en el ámbito de la FIV se ha denominado Preimplantation Genetic Screening (PGS) y consistió inicialmente en la biopsia de una única blastómera del embrión de 6-8 células y el análisis, mediante hibridación in situ fluorescente (FISH) de un set de 5-8 cromosomas, habitualmente X, Y, 1, 13, 16, 17, 18 y 21. En la última década, la indicación de PGS ha sido ampliada a otras situaciones, además de la edad materna avanzada, como el aborto de repetición, el fallo de implantación, el factor masculino severo e incluso se ha realizado en pacientes jóvenes, menores de 35 años, con buen pronóstico reproductivo. Algunas de estas indicaciones han sido controvertidas y discutidas ampliamente por diversos autores.
La publicación de trabajos en los que se argumentaba que el PGS en D+3 mediante FISH no solo no aumentaba la probabilidad de embarazo en las pacientes de edad avanzada sino que incluso la disminuía, marcó un punto de inflexión en la aplicación del PGS11. La ineficacia del PGS en D+3 con FISH se analizó años después de su aplicación, apareciendo trabajos sobre el posible efecto deletéreo en el embrión de la biopsia en D+312 o las limitaciones propias del estudio en célula única y el mosaicismo intrínseco al embrión humano en los primeros estadios de desarrollo13,14.
La estandarización y validación de nuevas técnicas de análisis genético (PCR cuantitativa, hibridación genómica comparada, secuenciación masiva) aplicadas al screening de aneuploidías en el estadio de blastocisto, las mejoras en el cultivo de embriones y de los métodos de criopreservación de blastocistos han permitido la implantación de una nueva modalidad del PGS en los últimos años: el PGS asociado a la transferencia de un único embrión, el PGS-SET o, como se ha denominado más recientemente, Preimplantation Genetic Testing for Aneuploidy (PGT-A). Dependiendo de la técnica de diagnóstico genético empleada y la organización de cada laboratorio de FIV, los embriones biopsiados en D+5 pueden ser transferidos en D+6 o deben ser criopreservados en espera del resultado del screening para ser descongelados y transferidos en un ciclo posterior.
Aunque las tasas de gestación en FIV en pacientes de edad materna avanzada15-18 o fallos de implantación repetidos19 parecen ser superiores cuando se aplica el PGS (PGT-A), diferentes metaanálisis y revisiones sistemáticas de la literatura señalan que la validez de la técnica de PGT-A está por determinar. La Sociedad Americana de Medicina Reproductiva, en un documento de opinión relativamente reciente20, argumenta, en base a los estudios publicados hasta la fecha, los siguientes puntos en contra de la validación del PGT-A como técnica de selección universal para todas las pacientes de FIV:
- 1.
En los estudios que apoyan la superioridad del PGT-A en pacientes de edad materna avanzada, las pacientes incluidas son pacientes consideradas de buen pronóstico, con buena reserva ovárica, buena respuesta a la estimulación y en las que se obtiene un elevado número de embriones. Esa situación no es extrapolable a la mayoría de las pacientes de edad avanzada de FIV. Bien al contrario, en general, las pacientes de edad avanzada (> 38 años) son pacientes con una respuesta a la estimulación limitada, bajo número de embriones y tasas de blastocisto inferiores al 50%.
- 2.
En los estudios randomizados publicados, las pacientes no se randomizan al iniciar el ciclo de FIV (intention to treat); solo se randomizan aquellas pacientes que cuentan al menos con un blastocisto. De nuevo, ese tipo de estudios están sesgados, puesto que solo incluyen pacientes en las que se obtienen blastocistos que biopsiar (pacientes de buen pronóstico).
- 3.
Existen diferentes metodologías para realizar el PGT-A, con diferente poder diagnóstico, sobre todo en lo que al grado de mosaicismo del embrión se refiere. La Sociedad Americana de Medicina Reproductiva considera necesario establecer cuál es la técnica que ofrece los mejores resultados.
- 4.
El diagnóstico de mosaicismo en el embrión, uno de los posibles resultados del PGT-A, obliga a descartar embriones y sabemos que, aunque en menor medida, son embriones que se pueden implantar21.
- 5.
Se precisan estudios prospectivos randomizados adicionales en los que se consideren las tasas de gestación acumulada/niños nacidos por ciclo iniciado, es decir, en los que se contabilicen, además del número de nacidos por transferencia en fresco, los nacimientos conseguidos por transferencia de embriones criopreservados.
En resumen, podemos decir que la comunidad científica considera la técnica de selección de embriones basada en la ploidía del embrión, PGT-A, como una técnica pendiente de validación en la que aspectos clave, como la metodología empleada en el diagnóstico o las indicaciones del PGT-A, todavía no están claramente definidas11,22-24. No obstante, con los resultados actuales, parece haber cierto consenso respecto a que las pacientes de edad avanzada con buena reserva ovárica y las pacientes con abortos recurrentes de causa cromosómica podrían verse beneficiadas de la aplicación del PGT-A, al menos en cuanto al tiempo necesario para conseguir una gestación viable25.
Paralelamente a la controversia generada por la aplicación indiscriminada del PGT-A en los programas de FIV, en los últimos años han ido aparecido estudios sobre el diagnóstico genético de los embriones mediante técnicas no invasivas. Estas técnicas basan el diagnóstico genético del embrión en el análisis del DNA secretado por el embrión al medio de cultivo en el que se desarrolla in vitro o en el análisis del DNA acumulado en la cavidad del blastocisto (blastocele). En este sentido, cabe decir que, si bien los resultados publicados hasta la fecha parecen prometedores, la baja eficiencia de las técnicas no invasivas en comparación con el PGT-A convencional, y el desconocimiento del origen del DNA analizado por cualquiera de los métodos no invasivos mencionados, impiden por el momento la aplicación clínica de esas técnicas26.
Las ómicasLos avances producidos durante las dos últimas décadas en el campo de las denominadas ómicas (la genómica, la transcriptómica, la metabolómica y la proteómica), han llevado a la publicación de un buen número de trabajos en el ámbito de la reproducción asistida. En la mayoría de estos estudios se analizan diferentes biomarcadores con el objetivo de relacionarlos con la calidad de ovocitos, espermatozoides y embriones, y con el potencial de estos de generar embarazo. Estos estudios incluyen análisis de expresión génica en células de la granulosa, cuantificación de metabolitos en el medio de cultivo, consumo de aminoácidos, glucosa u oxígeno por parte del embrión, y análisis de proteínas27. En numerosas publicaciones se ha establecido una correlación entre el biomarcador analizado y la calidad del embrión o el potencial de implantación. Es el caso de algunas proteínas, como la apolipoproteína A1, secretada en el medio de cultivo por el embrión; los niveles de esta lipoproteína se han correlacionado con la calidad del blastocisto28,29. Otro ejemplo lo constituyen el consumo de determinados nutrientes presentes en el medio de cultivo, como algunos aminoácidos específicos como la asparragina, la glicina y la leucina30 o el consumo de glucosa. Numerosos estudios de Gardner demuestran que el consumo de glucosa por parte del embrión a partir del cuarto día de cultivo se correlaciona con el consumo de oxígeno y la capacidad de implantación de los blastocistos generados31.
A pesar de los esfuerzos realizados en el campo de las ómicas, sobre todo en el campo de la metabolómica, y los resultados obtenidos en no pocos estudios, el análisis de biomarcadores no ha conseguido implementarse en la práctica clínica como herramienta de selección de los embriones con mayor potencial de implantación. Un análisis reciente sobre la aplicación de la metabolómica como método no invasivo de selección concluye que, en base a los estudios publicados, no hay evidencia científica de la superioridad de la metabolómica sobre los métodos convencionales de selección embrionaria utilizando criterios morfológicos32.
La morfocinética como herramienta de selección embrionariaEl bajo valor predictivo (del orden del 0,3-0,4) de la selección de embriones mediante criterios morfológicos clásicos33 y los escasos resultados obtenidos con otros métodos no invasivos, como los basados en las ómicas, han conducido a la búsqueda de nuevas herramientas para la selección de embriones utilizando los criterios morfológicos como punto de partida.
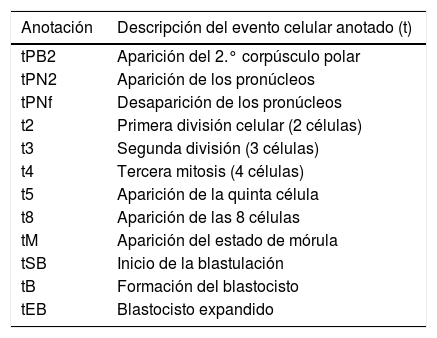
Basándose en la limitación que supone la observación puntual de los embriones para su evaluación morfológica, se han desarrollado sistemas de incubación dotados de microscopio y cámaras adaptadas para la grabación de imágenes, que permiten realizar un seguimiento continuo del desarrollo embrionario. Son los denominados equipos TL. Existen diferentes tipos de sistemas TL en el mercado, pero todos tienen en común que permiten realizar la monitorización continua del desarrollo del embrión sin extraerlos del incubador, por tanto, sin perturbar las condiciones de temperatura, pH, luz y humedad que tienen los embriones en los incubadores. Los equipos TL realizan capturas de imágenes del embrión cada 5-20 min en diferentes planos focales (normalmente 3-7 planos), generando un elevado número de imágenes (hasta 1420 imágenes en 72 h de cultivo). Con la ayuda de un software específico, a partir de las imágenes capturadas se genera un vídeo que permite analizar con detalle cada aspecto del crecimiento del embrión. El software está diseñado para realizar anotaciones sobre los eventos más relevantes del desarrollo en el momento en que se producen. Las anotaciones que se realizan normalmente se detallan en la tabla 2.
Anotaciones en un sistema de time-lapse
| Anotación | Descripción del evento celular anotado (t) |
|---|---|
| tPB2 | Aparición del 2.° corpúsculo polar |
| tPN2 | Aparición de los pronúcleos |
| tPNf | Desaparición de los pronúcleos |
| t2 | Primera división celular (2 células) |
| t3 | Segunda división (3 células) |
| t4 | Tercera mitosis (4 células) |
| t5 | Aparición de la quinta célula |
| t8 | Aparición de las 8 células |
| tM | Aparición del estado de mórula |
| tSB | Inicio de la blastulación |
| tB | Formación del blastocisto |
| tEB | Blastocisto expandido |
La utilización de los sistemas TL en todo el mundo ha generado multitud de estudios que analizan las variables morfocinéticas registradas habitualmente en los laboratorios de FIV (tabla 2) y su relación con los resultados reproductivos, con el objetivo de encontrar marcadores morfocinéticos predictores de implantación. Se han propuesto diferentes variables, o combinaciones de variables, como marcadores morfocinéticos predictores de implantación, niño nacido o capacidad de formación del blastocisto. Algunos ejemplos son los tiempos de aparición y desaparición de los pronúcleos tras la inseminación, duración de la primera citocinesis, tiempo transcurrido desde la inseminación hasta determinados estadios de división del embrión (5 células, 8 células), tiempo que el embrión permanece en estadio de 2 células…
Los artículos de revisión y metaanálisis publicados recientemente sobre este tema, señalan que no hay una evidencia clara de que la selección de embriones basada en parámetros morfocinéticos sea superior a la selección de embriones basada en la morfología convencional. Una dificultad añadida a la hora de analizar los resultados obtenidos en esos estudios son las diferencias en las condiciones en las que se realizaron: diferentes medios de cultivo, concentración de oxígeno baja o alta, origen de los ovocitos diferentes, edad de las pacientes34. Independientemente de la validez última de la morfocinética como herramienta de selección, la introducción progresiva y gradual en los laboratorios de FIV de la tecnología TL ha supuesto un avance importantísimo en el cultivo de embriones, al permitir la observación continua del embrión sin alterar las condiciones de cultivo.
Aplicación de la inteligencia artificial en la selección de embrionesEl futuro de la tecnología TL está claramente vinculado a la inteligencia artificial y a la creación de modelos predictivos de formación de blastocisto, gestación o implantación, que tengan en cuenta las características de las pacientes además de las características morfocinéticas del embrión.
Con la ayuda de software específicos, los sistemas de TL permiten anotar el instante en el que se producen los eventos celulares más relevantes. Estas anotaciones han permitido analizar la cinética de los embriones y, en combinación con la morfología embrionaria clásica, ha sido utilizada para la creación de algoritmos y modelos de predicción de la implantación. Uno de los primeros algoritmos morfocinéticos publicado por Meseguer35, que incluyó cuatro parámetros cinéticos en un modelo de regresión logística, alcanza un área bajo la curva (AUC) de 0,720. La enorme variabilidad en todo lo referente al proceso de FIV (condiciones de cultivo, tipo de pacientes incluidos, etc.), entre los estudios publicados desde entonces, y las variables cinéticas incluidas en cada modelo, han dificultado la aplicación de los algoritmos en la rutina clínica. Por otro lado, ha quedado demostrado que los algoritmos morfocinéticos publicados, no son universales36. A la luz de estos resultados, diferentes grupos han desarrollado sus propios algoritmos37-40. Es de destacar que, los modelos de predicción basados en parámetros morfocinéticos publicados hasta el momento, en los que se ha empleado la regresión logística o el machine learning, apenas alcanzan un AUC de 0,7541.
Profundizando en este campo, los algoritmos de deep learning, en particular las redes neuronales convolucionales (CNN), se han utilizado para tratar varios problemas de imágenes médicas, como la detección de glaucoma o de degeneración macular42. En el campo de la reproducción asistida, Tran et al.43, utilizaron este enfoque para abordar las debilidades expuestas anteriormente en referencia a la selección embrionaria. Específicamente, se propuso un modelo de deep learning para predecir el embarazo. El trabajo de Tran generó críticas por parte de los expertos por la poca explicabilidad del algortimo y la escasa información aportada sobre la metodología aplicada44,45. Dado que el factor más crítico en fertilidad es la edad, otro grupo aplicó técnicas de deep learning en una CNN a imágenes de blastocistos clasificadas por edad, como método de predicción de implantación y compararlo con la valoración morfológica convencional de los embriones46. En trabajos como el de Khosravi47, se desarrollaron modelos de deep-learning para predecir la calidad del blastocisto, utilizando imágenes de TL. Es de destacar que los resultados al aplicar este tipo de selección embrionaria automatizada fueron superiores a los obtenidos por expertos embriólogos utilizando las técnicas de selección y predicción convencionales. En uno de los trabajos publicados más recientemente, el resultado de embarazo, como marcador de viabilidad del embrión, fue predicho por otro modelo que combinaba métodos de procesamiento de imágenes (computer visión image processing) y técnicas de deep learning, aunque utilizando imágenes estáticas únicas de blastocistos, procedentes de observaciones en microscopios ópticos convencionales48.
A la vista de los últimos trabajos sobre la selección de embriones automatizada mediante herramientas de inteligencia artificial, podemos afirmar que esta metodología se está consolidando como la herramienta más potente en la selección de embriones.
ConclusionesLa relevancia que tiene en los tratamientos de fecundación in vitro la elección de un único embrión para su transferencia a útero, con competencia para implantar y generar una nueva vida, ha llevado a los especialistas en reproducción a investigar diversos métodos de selección embrionaria, que reemplacen o complementen la selección basada en la morfología. Por el momento, técnicas de selección embrionarias no invasivas, como las basadas en el análisis de biomarcadores, no parecen factibles por las dificultades que plantea su implementación en la práctica clínica diaria. El diagnóstico genético preimplantacional, por otra parte, es una técnica de selección de embriones invasiva que ha mostrado su eficacia solo en una subpoblación de las pacientes tratadas en los programas de FIV y que la comunidad científica no considera validada. Teniendo en cuenta que la metodología empleada para la selección de embriones no debería comprometer el potencial intrínseco del embrión para generar un embarazo, la metodología que, hoy por hoy, parece más prometedora, es la selección de embriones basada en los modelos de predicción generados a partir de las imágenes y las anotaciones morfocinéticas que proporcionan los sistemas de incubación dotados de tecnología.
FinanciaciónLos autores declaran no tener financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.