INTRODUCCIÓN
En 1937 Meigs y Cass presentaban 7 casos de fibromas ováricos con ascitis e hidrotórax cuyos signos y síntomas se resolvían con la extirpación del tumor. Aunque previamente, en 1934, Meigs ya había descrito 3 casos similares en su libro Tumors of the female pelvic organs1-3, fueron Rhoads y Terrell los que en 1937, tras comunicar otro caso, denominaron a esta patología «síndrome de Meigs».
Ya en el siglo xix distintos autores describieron la asociación de tumores de ovario con ascitis e hidrotórax2,3. Las primeras aportaciones fueron la de Spigelberg en 1866 y la de Cullinworth en 1879, y en ambos casos se realizó el diagnóstico de fibroma ovárico en la autopsia2,3. Posteriormente, Demons en 1887 observó que 9 de 50 pacientes con quiste de ovario, ascitis e hidrotórax se curaron tras la resección del quiste2,3. En 1888 Pascale también comunicó que 3 de 21 pacientes con quistes de ovario tenían ascitis y derrame pleural que se resolvieron tras la intervención2,3. El mismo año, Terrier informó de una mujer con fibroma bilateral de ovario, ascitis e hidrotórax, pero no se sabe si la paciente se recuperó tras la cirugía ni si el resultado histológico fue de benignidad2,3. Tait en 1892 y Demons en 1900, 1902 y 1903 publicaron los 4 primeros casos del síndrome con todas sus características, y hubo nuevas aportaciones a cargo de Hoon en 1923, de Leo en 1926 y de Salmon en 19342,3. En 1948 el doctor Funck-Brentano consideró que, debido a la importante contribución de Demons, su nombre debería preceder al de Meigs en la denominación del síndrome, de ahí que en la bibliografía francesa y rusa sea conocido como síndrome de Demons-Meigs3.
Meigs2 realizó en 1954 una revisión de las publicaciones sobre tumores abdominales con ascitis e hidrotórax y pensó que había que redefinir el síndrome y limitarlo para el tipo de tumores que fueron descritos inicialmente, y por tanto se trataría de tumores de ovario benignos fibrosos, sólidos y duros que incluían fibromas, tecomas, tumores de células de la granulosa y tumor de Brenner; las otras características del síndrome serían la ascitis y el derrame pleural, que se resolverían tras la extirpación del tumor. Definió también el «falso síndrome de Meigs» como la asociación de los mismos hallazgos con otros tumores de ovario benignos como teratomas del tipo estruma, quistes, papiloma de trompa, con tumores malignos (cistoadenoma papilar, tumor de Krukenberg, carcinoma, fibrosarcoma) e incluso con leiomiomas uterinos.
En este artículo presentamos 2 casos clínicos: un síndrome de Meigs asociado a fibroma celular y un segundo caso de falso síndrome de Meigs en una paciente con carcinoma mucinoso sincrónico de ovario (bilateral) y de endometrio.
CASOS CLÍNICOS
Caso 1: síndrome de Meigs
Paciente de 58 años que acudió a urgencias por presentar disnea de esfuerzo en progresión desde hacía 2 semanas, coincidiendo con síndrome catarral con tos, expectoración y dolor pleurítico. Como antecedentes personales destacaba hipertensión arterial en tratamiento, consumo de 10 cigarrillos/día e intolerancia al ácido acetilsalicílico, y como historia obstétrico-ginecológica tenía 5 embarazos, con 4 partos normales y 1 aborto; la menopausia se produjo a los 56 años y no se había realizado revisiones en los últimos años, salvo una mamografía hacía 6 meses, que resultó normal.
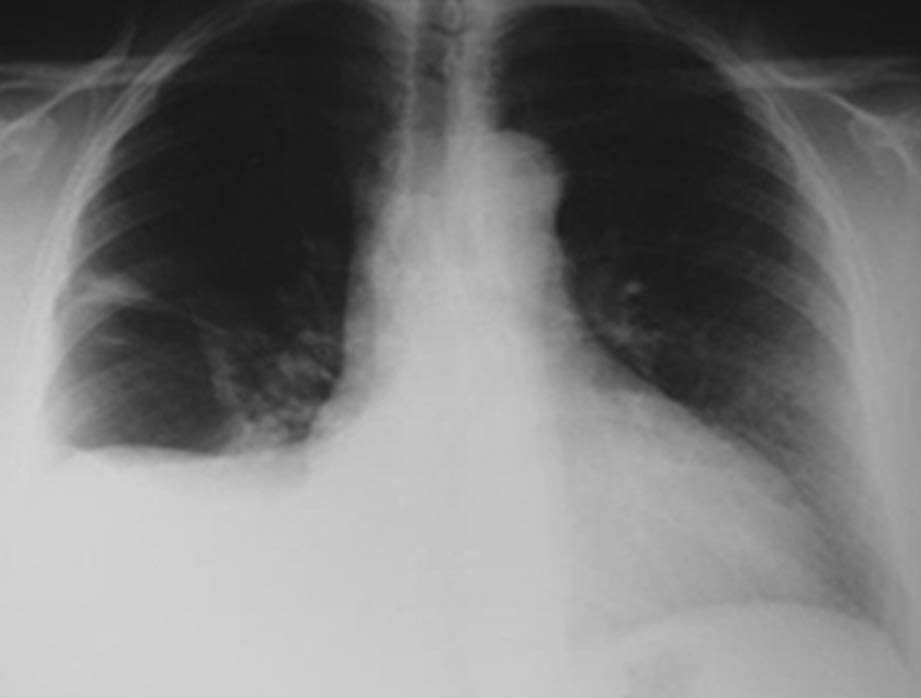
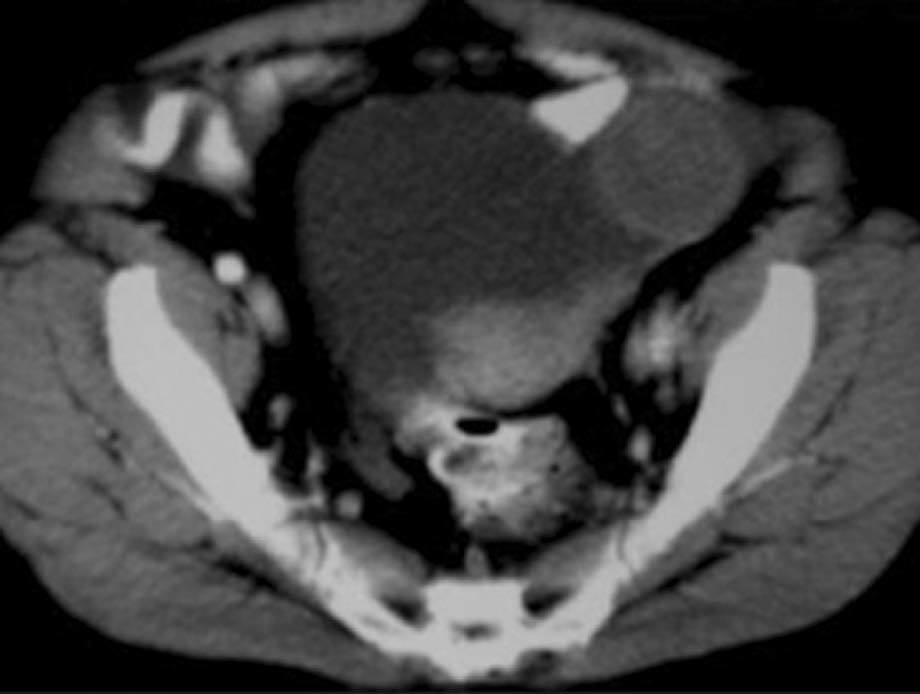
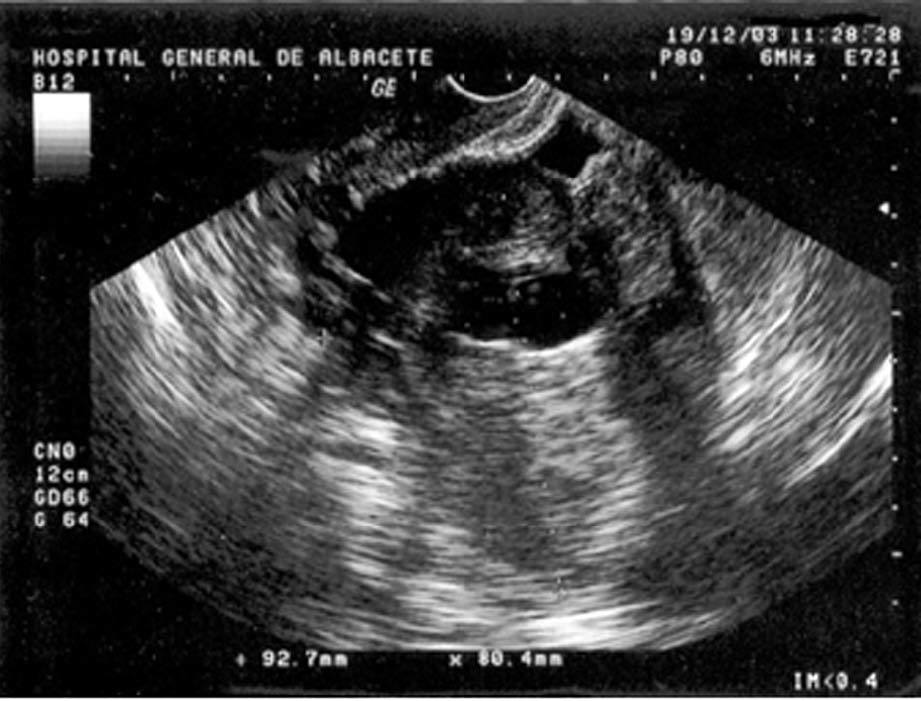
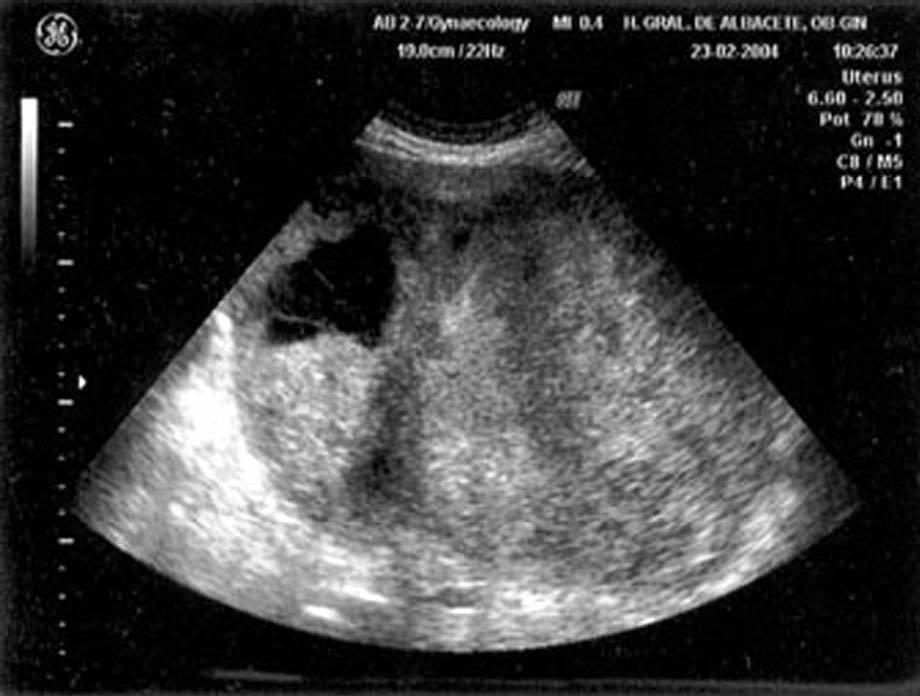
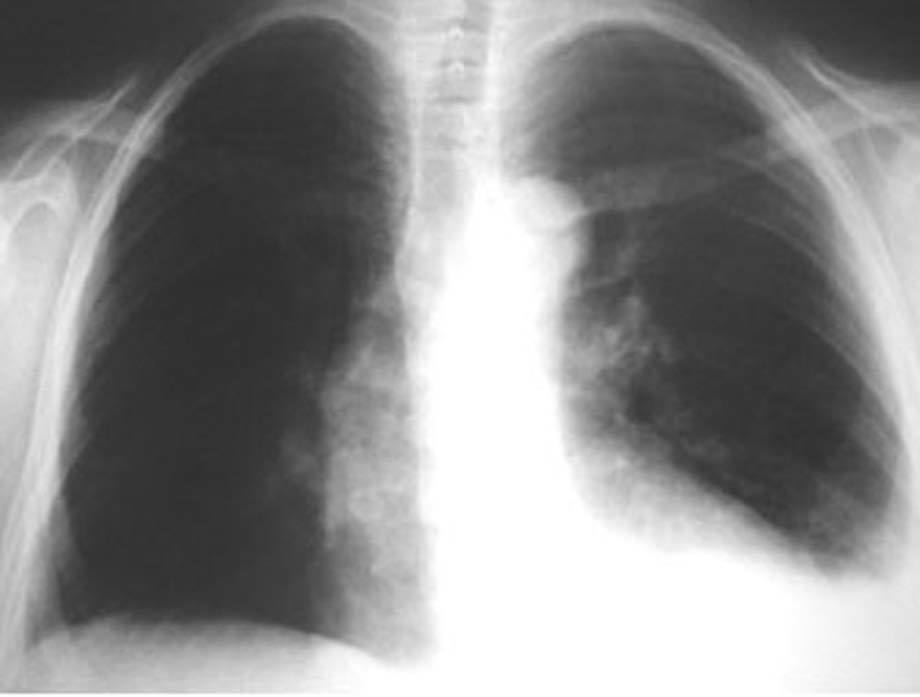
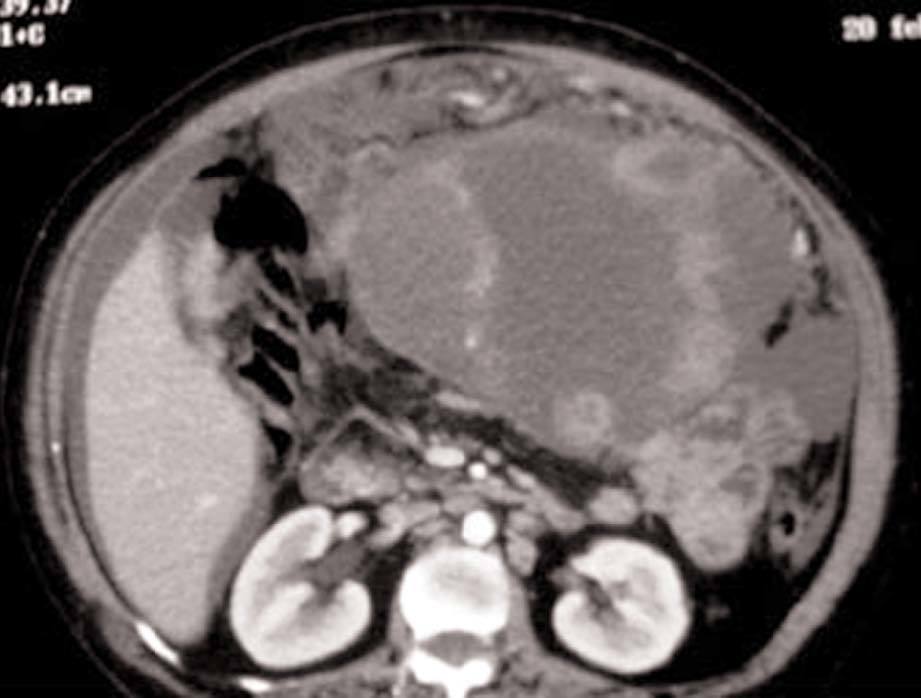
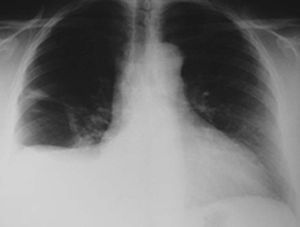
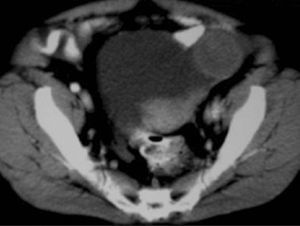
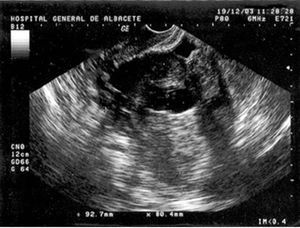
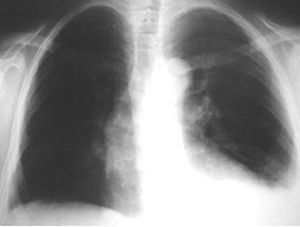
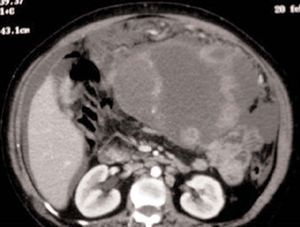
En la exploración física presentaba buen estado general, con presión arterial de 150/95 mmHg y apirética; en la auscultación pulmonar destacaba una disminución del murmullo vesicular en la base derecha. El hemograma, la bioquímica y las pruebas de coagulación fueron normales, y la gasometría arterial mostró: pO2, 68 mmHg; pCO2, 42 mmHg; bicarbonato, 28 mEq/l, y pH, 7,44. En la radiografía de tórax se encontró derrame pleural derecho (fig. 1), que se diagnosticó mediante toracocentesis como exudado linfocitario, con cultivos microbiológicos negativos. Fue ingresada en el servicio de neumología y se solicitaron marcadores tumorales (AFP, CEA, CA 15,3, CA 19,9, SCC, ß2 microglobulina y CA 125), que fueron normales, salvo un CA 125 de 175 U/ml. En la tomografía computarizada (TC) se evidenció un importante derrame pleural derecho, una pequeña cantidad de líquido libre intraperitoneal y, en fosa ilíaca izquierda, tumoración de contornos polilobulados de 13 * 9 cm, heterogénea con áreas centrales hipodensas, dependiendo del ovario izquierdo, sospechoso de cistoadenocarcinoma (fig. 2). La paciente presentó mejoría clínica de la disnea y, ante la sospecha de carcinoma de ovario, se procedió al traslado a la planta de ginecología para continuar su estudio. Una nueva toracocentesis diagnóstica mostró citología negativa para células tumorales malignas y el estudio del tubo digestivo (gastroscopia y colonoscopia) no evidenció lesiones sospechosas. La ecografía ginecológica (fig. 3) demostró la presencia de una tumoración anexial izquierda de 114 * 93 * 80 mm, irregular, ecomixta, de aspecto sólido, con zonas anecoicas y sin aumento de vascularización, y líquido libre en cantidad moderada.
Fig. 1. Caso 1 (radiografía de tórax). Derrame pleural derecho.
Fig. 2. Caso 1 (tomografía computarizada). Tumoración pélvica heterogénea de 13*9 cm, dependiente del anejo izquierdo.
Fig. 3. Caso 1 (ecografía transvaginal). Tumoración anexial izquierda ecomixta de 114*93*80 mm.
En la laparotomía se encontró una tumoración sólida dependiente de ovario izquierdo de aproximadamente 10 cm de diámetro y escasa cantidad de ascitis cuyo estudio citológico resultó negativo para células malignas; el anejo derecho y el útero eran normales. Se realizó anexectomía izquierda con biopsia intraoperatoria que indicó que se trataba de un fibroma celular.
El postoperatorio evolucionó favorablemente y al cuarto día se procedió al alta, con CA 125 de 140,2 U/ml y radiografía de control que mostraba resolución del derrame pleural. El CA 125 se normalizó al mes de la intervención (9,4 U/ml).
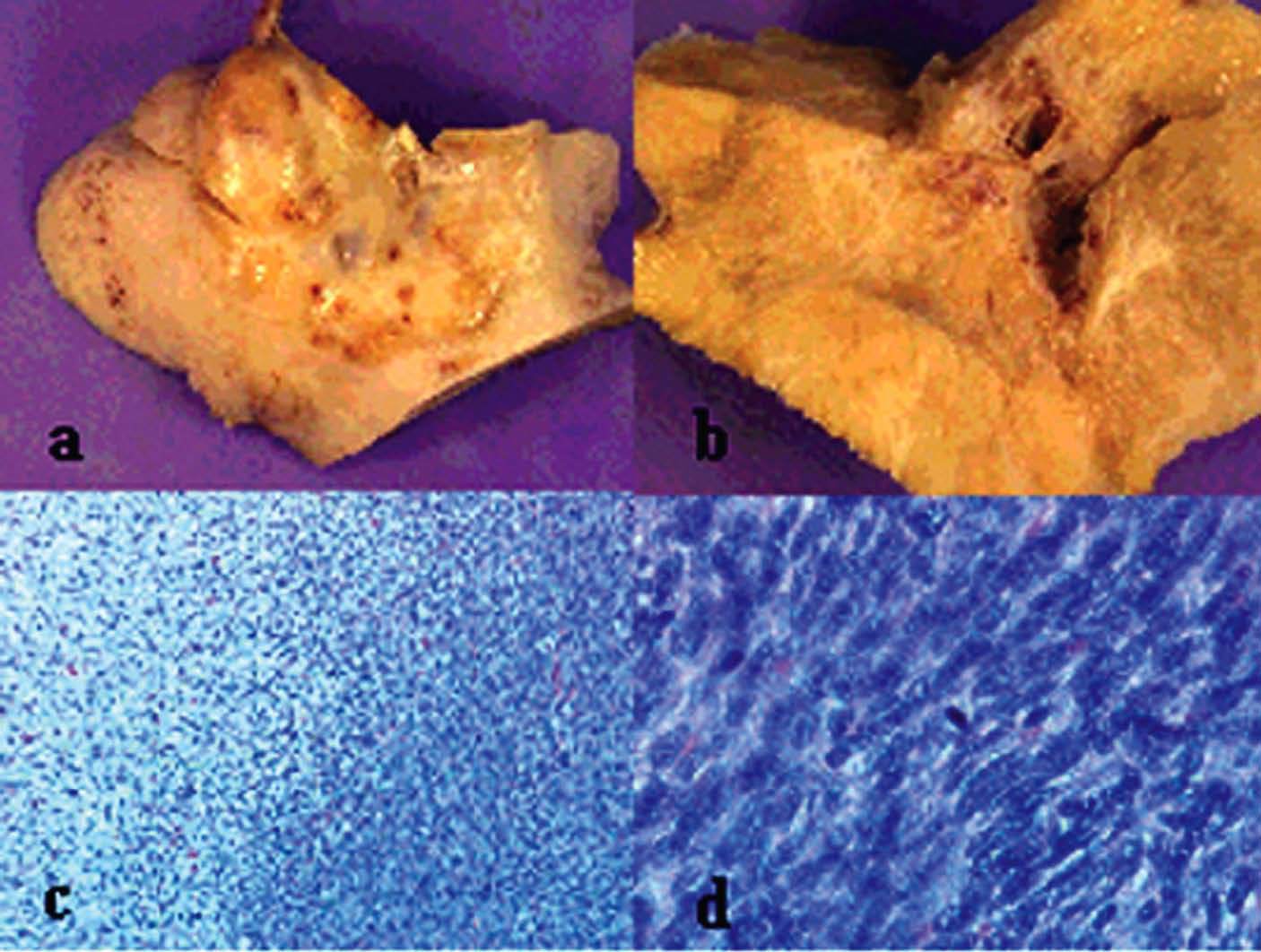
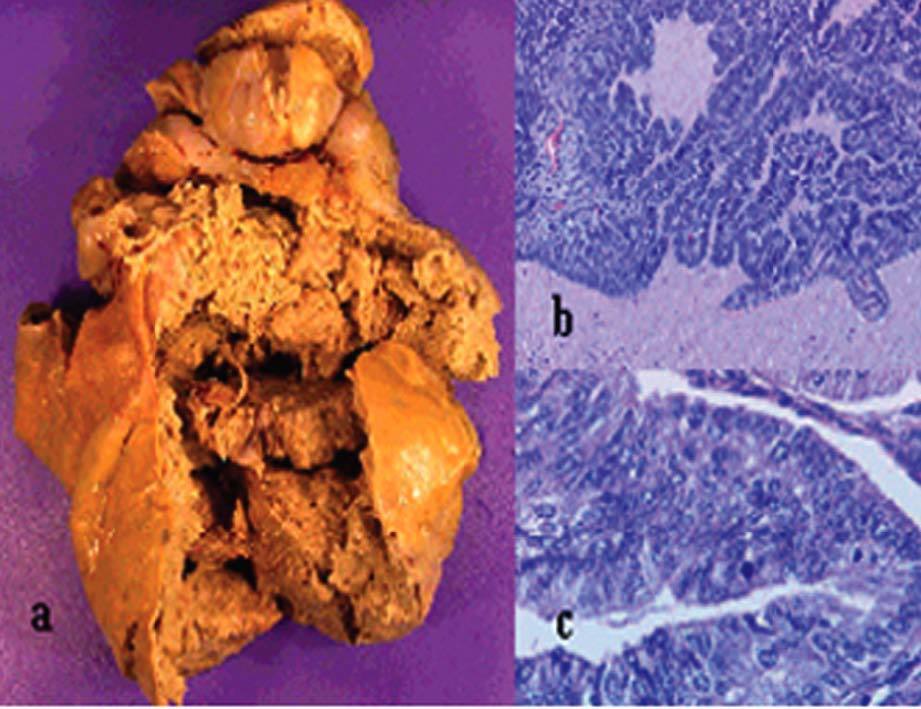
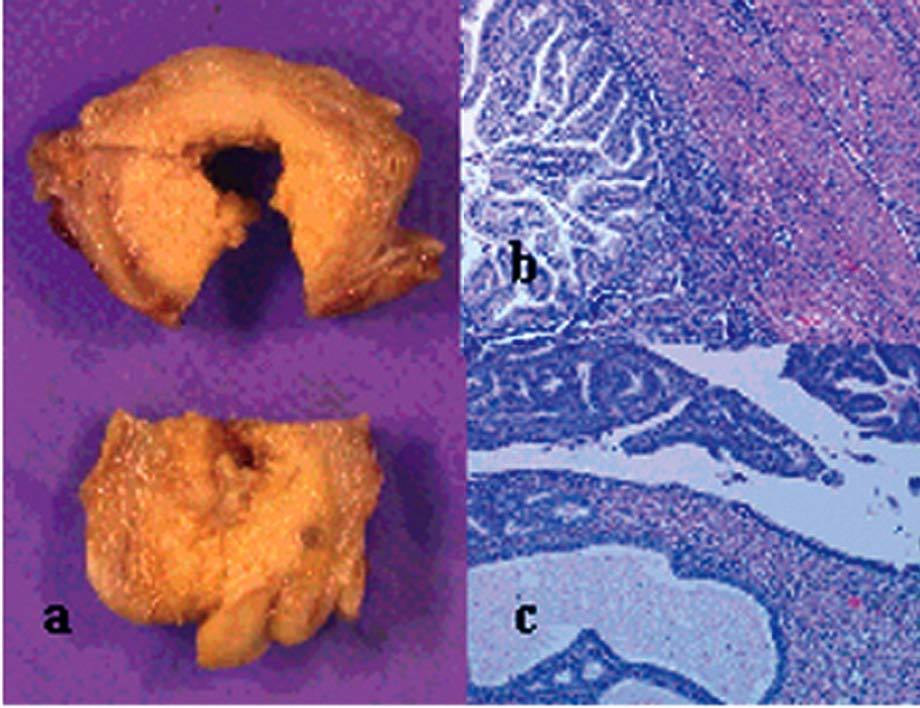
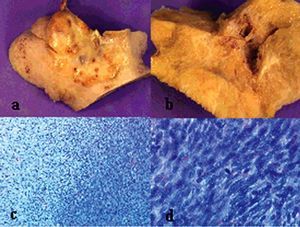
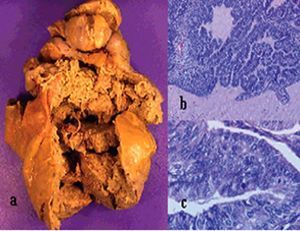
La anatomía patológica (fig. 4) definitiva describía una tumoración de 418 g de peso y 11 * 11 * 7 cm de diámetro, de superficie abollonada y coloración blanquecina, que presentaba al corte áreas sólidas con pequeños focos de degeneración quística. En el estudio microscópico se observaba proliferación de células fusiformes dispuestas en haces entrelazados, con leve atipia celular y hasta 3 mitosis por 10 campos de gran aumento.
Fig. 4. Caso 1 (anatomía patológica). Tumoración ovárica con superficie externa (a) abollonada y superficie de corte (b) con áreas sólidas y focos de degeneración quística. Proliferación fusocelular (c) con áreas de menor celularidad y edema intersticial (hematoxilina-eosina, aproximadamente*100) y zonas más densamente celulares con presencia de mitosis (d) (hematoxilina-eosina, aproximadamente* 400).
Caso 2: falso síndrome de Meigs
Mujer de 50 años remitida por el servicio de aparato digestivo por cuadro de 2 semanas de evolución de anorexia, pérdida de peso, palidez mucocutánea y dolor abdominal, y hallazgo en la ecografía abdominal de masa pélvica heterogénea y ascitis; además presentaba tos seca y molestias en costado izquierdo desde hacía 1 mes. Como antecedentes personales destacaba esquizofrenia en tratamiento, y estaba intervenida de cataratas. La paciente era nuligesta y sin relaciones sexuales.
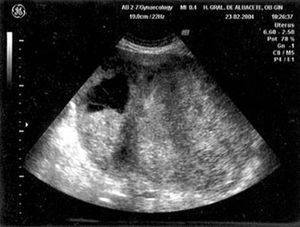
En la exploración el abdomen era globuloso y estaba a tensión; los genitales externos eran normales y no fue posible visualizar el cérvix ni realizar un tacto vaginal. La ecografía ginecológica mostraba útero de tamaño normal, regular y homogéneo, con endometrio no valorable. Se visualizaba tumoración como de 8 meses de gestación, de paredes gruesas e irregulares, multitabicada y de estructura mixta, con zonas anecoicas y otras sólidas e hiperecogénicas, sin que se comprobara aumento significativo del mapa color (fig. 5). En la radiografía de tórax aparecía un pequeño derrame pleural izquierdo (fig. 6) y en la TC éste era bilateral, aunque más llamativo en el hemitórax izquierdo. Destacaba una masa quística que ocupaba el hemiabdomen inferior y desplazaba estructuras intestinales de aparente origen ovárico (fig. 7). El epiplón mayor presentaba infiltración por la tumoración y se visualizaba ascitis en las zonas perihepática y periesplénica y en fondo de saco de Douglas. La mamografía revelaba una imagen nodular en la axila derecha y una adenopatía inespecífica en la axila izquierda. La colonoscopia no pudo completarse por dificultades técnicas, sin que se observaran lesiones hasta la porción media de sigma, y en la gastroscopia el único hallazgo era una hernia de hiato. En la analítica presentaba anemia moderada (hemoglobina de 8,7 mg/dl y hematocrito del 29,6%) y leucocitosis (13,270/µl, con 75,4% de neutrófilos), con pruebas de coagulación normales. En la bioquímica la gammaglutamiltransferasa era de 95 U/l, la fosfatasa alcalina de 363 U/l, la lactatodeshidrogenasa de 1,037 U/l y el resto, normal. Los marcadores tumorales CEA, CA 19,9, AFP y ß-HCG eran normales, y el CA 125 fue de 6.910 U/ml y ascendió hasta 16.064 a los 14 días. Se realizó toracocentesis diagnóstica extrayendo 50 ml de líquido pleural serohemático, que se catalogó de exudado de predominio mononuclear con cultivos microbiológicos negativos, incluyendo micobacterias; la citología del mismo fue negativa para células malignas, al igual que la del líquido ascítico.
Fig. 5. Caso 2 (ecografía ginecológica). Gran tumoración pélvica ecomixta y de paredes gruesas e irregulares.
Fig. 6. Caso 2 (radiografía de tórax). Derrame pleural izquierdo.
Fig. 7. Caso 2 (tomografía computarizada). Masa quística abdominal, con áreas sólidas y tabiques gruesos, que desplaza las asas intestinales e infiltra el epiplón, junto con la presencia de ascitis.
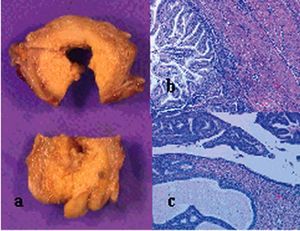
Ante la sospecha de carcinomatosis peritoneal pero con 2 citologías negativas (líquido pleural y ascítico), se realizó laparotomía exploradora, hallándose una gran tumoración dependiente del ovario izquierdo que ocupaba toda la cavidad abdominal y estaba adherida a las asas del intestino delgado y al ovario derecho con formaciones papilares de aspecto tumoral, ascitis serosa abundante, epiplón mayor con apariencia de infiltración, útero, trompas, peritoneo, recto, sigma e hígado de aspecto normal; se efectuó la disección de la tumoración del epiplón y las asas, produciéndose el desgarro parcial del asa del delgado, infiltrada por tumoración, por lo cual se realizó resección de fragmento de 10 cm con anastomosis terminoterminal. Tras la anexectomía izquierda, cuya biopsia intraoperatoria informó de carcinoma mucinoso de ovario, se procedió a completar la cirugía con histerectomía y anexectomía restante, linfadenectomía pélvica bilateral y paraaórtica, apendicectomía, omentectomía y biopsias peritoneales de canaleras cólicas. La anatomía patológica informó de carcinoma mucinoso bilateral de ovario (fig. 8), estadio FIGO I C y carcinoma mucinoso de endometrio (fig. 9), estadio FIGO II B, con citología peritoneal con infiltrado de neutrófilos y negativa para células malignas, y resto de biopsias sin infiltración tumoral.
Fig. 8. Caso 2 (anatomía patológica 1). Tumoración ovárica de 3.471 g de peso y 30*25 *11 cm, sólido-quística, con crecimientos papilares, extensas áreas de necrosis y consistencia deleznable (a). Proliferación neoplásica epitelial, con formación de estructuras glandulares revestidas de células cilíndricas con material mucoide en el citoplasma y en las áreas quísticas (b) (hematoxilina-eosina, aproximadamente *100). Zona moderadamente diferenciada con atipias nucleares y frecuentes mitosis (c) (hematoxilina-eosina, aproximadamente*400).
Fig. 9. Caso 2 (anatomía patológica 2). Neoplasia de cuerpo uterino con infiltración del tejido endocervical (a). Infiltración del miometrio (b) y del cérvix (c) por una proliferación neoplásica epitelial mucinosa (hematoxilina-eosina, aproximadamente *100).
El postoperatorio cursó sin complicaciones relevantes, salvo infección urinaria por enterobacteria, y se procedió al alta al decimocuarto día, con CA 125 de 151 U/ml y radiografía de tórax que mostraba resolución del derrame pleural. La ecografía al quinto día mostraba ascitis moderada, y en la TC de control efectuada a los 40 días, la ascitis aparecía en escasa cantidad. Tras interconsulta con el servicio de oncología se estableció el tratamiento adyuvante con quimioterapia (4 ciclos de carboplatino + taxol). Se consideró a la paciente no apta para radioterapia por agitación psicomotriz y movimientos estereotipados.
DISCUSIÓN
El síndrome de Meigs consiste en la asociación de tumor benigno de ovario (fibroma, tecoma, tumor de células de la granulosa o tumor de Brenner) con ascitis e hidrotórax, que se resuelven tras la extirpación del tumor2.
Tras la amplia revisión realizada por Meigs en 19542 (tabla I) han sido numerosas las publicaciones relacionadas con este síndrome4-36 (tabla II), al igual que para el falso síndrome de Meigs o seudo-Meigs37-77, que se ha descrito asociado a diversos tipos de tumores de ovario (tumor de células germinales, hemangioma, linfoma, tumor mucinoso, carcinoma, metástasis), fibromas de paraovario, leiomiomas uterinos, miomas intraligamentarios o adenocarcinomas de trompa (tabla III).
Nosotros presentamos un síndrome de Meigs con fibroma celular de ovario, del cual se han encontrado 4 casos en la bibliografía7,12,16, y un seudosíndrome de Meigs en el que la paciente presentaba un carcinoma mucinoso sincrónico en ovarios y endometrio, aspecto que no ha sido relatado hasta la fecha.
A pesar de que el síndrome de Meigs se conoce desde hace más de 60 años, su fisiopatología no está del todo clara; se han propuesto diversas teorías para explicar el origen de la ascitis y el hidrotórax, aunque ninguna ha sido investigada en profundidad.
Meigs2 sugirió que la causa de la ascitis podía ser la presión ejercida por el propio tumor sobre los linfáticos, que provocaría el escape de fluido a través de los mismos y que se acumularía en la cavidad peritoneal. Por otra parte, también podría suceder que debido al edema en el estroma tumoral se produjera trasudación del líquido al peritoneo. Meigs observó además que la cantidad de ascitis no dependía del tamaño tumoral. El hidrotórax, que puede se uni o bilateral y con más frecuencia en el lado derecho (62% sólo derecho, 24% bilateral, 11% izquierdo), se formaría por difusión del líquido ascítico al espacio pleural por el diafragma a través de los linfáticos o de los intersticios entre las células2. Esta teoría de la formación del hidrotórax a partir del líquido ascítico se basaba en el hecho de que los estudios de electroforesis habían mostrado que ambos fluidos eran similares y que, mediante la inyección de un colorante (India ink), se observaba el paso del líquido ascítico desde el abdomen al tórax, y no al revés2.
Posteriormente se han realizado estudios que sugieren la participación de diversas citocinas y factores de crecimiento en la patogenia del síndrome, los cuales, al aumentar la permeabilidad capilar, también contribuyen a la formación de la ascitis y al derrame pleural en otros procesos ginecológicos como son el síndrome de hiperestimulación ovárica y el cáncer de ovario18,78. Abramov observó que los valores de interleucina (IL) 1ß, IL 6, IL 8, el factor de crecimiento del endotelio vascular (VEGF) y de los fibroblastos (FGF), y el factor de necrosis tumoral * (TNF-*), estaban elevados en el plasma, en el líquido ascítico y en el pleural de una paciente de 62 años con fibroma ovárico y síndrome de Meigs antes de la cirugía, y que todos éstos, salvo el TNF-*, disminuían hasta valores normales en el plasma en el postoperatorio, coincidiendo con la desaparición de la ascitis y el hidrotórax18,78. Las concentraciones de los citados factores, además de resultar indetectables en 3 pacientes con fibromas benignos de ovario pero sin síndrome de Meigs, fueron más elevadas en el líquido ascítico que en el plasma, lo cual sugiere una secreción local, más que sistémica, por parte del tumor, mediando un aumento de la permeabilidad en la vascularización peritoneal y del tumor con la consecuente trasudación del fluido a la cavidad peritoneal y posteriormente, a través de los poros diafragmáticos, al espacio pleural; esto es apoyado por las menores concentraciones de esas sustancias vasoactivas en el líquido pleural en comparación con la ascitis18,78. También se ha comunicado que los valores de leptina se encuentran inversamente relacionados con el tamaño tumoral, la acumulación de fluidos en el tercer espacio y la situación clínica, ya que éstos aumentan en el plasma tras la cirugía, a la vez que se resuelven el derrame pleural y la ascitis79.
El síndrome de Meigs puede cursar con elevación del CA 125; en términos generales, un gran aumento en los valores de un marcador tumoral se corresponde con el diagnóstico de malignidad, aunque no debe olvidarse que determinadas patologías, no necesariamente malignas, que cursan con irritación mesotelial endometriosis, cirrosis hepática, ascitis, derrame pleural o pericárdico, tumor de ovario benigno torsionado, enfermedad inflamatoria pélvica también presentan marcadas elevaciones del CA 12580. Buamah y Skillen81 encontraron que en una serie de 115 pacientes con tumores benignos de ovario el CA 125 estaba elevado en 14 de ellos (12,2%), con cifras que oscilaban entre 46 y 891 U/ml. Por tanto, sabemos que una elevación del CA 125 no tiene por qué indicar malignidad. En nuestro primer caso el CA 125 era de 175 U/ml (normal, < 35 U/ml) y finalmente se trataba de un tumor benigno (fibroma celular); en el caso del falso síndrome de Meigs (carcinoma mucinoso de ovario y endometrio), el CA 125 aumentó hasta 16.064 U/ml.
Se han publicado muchos casos de síndrome de Meigs y seudo-Meigs que cursan con aumento del CA 125 (tablas II y III), con valores que varían entre 42,313 y 7.000 U/ml9. El primer caso fue recogido por Jones en 1989 y se trataba de un fibrotecoma con CA 125 de 226 U/ml29. Los 4 casos descritos de fibroma celular presentaban elevación de este marcador7,12,16.
La etiología de la elevación del CA 125 no está clara. Se ha comprobado por estudios de inmunohistoquímica que la expresión del marcador se localiza en el omento y el peritoneo más que en el propio tumor, y que por tanto las células mesoteliales serían las responsables de la producción de antígeno debido a irritación mecánica por el tumor o la ascitis9,13,36; también se ha sugerido que la ascitis y el aumento del CA 125 podrían ser resultado de un proceso común con origen en el peritoneo9.
La resolución del derrame pleural y de la ascitis se produce por lo general varios días después de la cirugía. Meigs observó que el derrame pleural desaparecía entre 3 y 14 días tras la intervención2, aunque puede tardar hasta 6 meses13; lo mismo sucede con el CA 12513, debido a la hiperplasia mesotelial producida.
En nuestro caso de síndrome de Meigs, el CA 125 se normalizó al mes de la cirugía y el derrame pleural se resolvió al tercer día. En el seudo-Meigs el CA 125 descendió a los 14 días hasta 151 U/ml (previo, 16.064 U/ml) y el hidrotórax desapareció a los 12 días.
La evaluación preoperatoria con el CA 125, la ecografía y la TC raramente sugerirá que se trate de un síndrome de Meigs. Meigs comprobó que el diagnóstico preoperatorio se daba aproximadamente en el 37% de los casos2. Hay que sospechar un síndrome de Meigs ante la presencia de un importante derrame pleural, elevación del CA 125, citología del líquido ascítico sin células malignas y ausencia de implantes peritoneales en la TC15.
Como conclusión, podemos decir que desde el punto de vista clínico y ante una paciente con ascitis, derrame pleural y masa pélvica, es importante tener en cuenta la posibilidad de que se trate de un síndrome de Meigs, puesto que, a pesar de la sospecha de una patología maligna, a veces incluso con elevación llamativa del CA 125, nos encontraremos ante un cuadro totalmente distinto que se resolverá simplemente con la extirpación del tumor.