El tumor de Brenner es una neoplasia ovárica infrecuente de origen incierto, generalmente asintomática. Su diagnóstico es complejo, sin presentar patrones ecográficos específicos. Se ha asociado a tumores mucinosos con distinto potencial de malignidad, pudiendo encontrar componentes malignos o borderline que determinarán el tratamiento. Para su diagnóstico diferencial es esencial la realización de un estudio inmunohistoquímico, para objetivar el origen clonal del tumor de Brenner y de la estirpe mucinosa. Presentamos el caso de una mujer diagnosticada intraoperatoriamente de un tumor de Brenner asociado a un tumor mucinoso borderline de ovario, en el estudio definitivo posterior.
Brenner tumour is an uncommon neoplasm of the ovary of uncertain origin and often asymptomatic. Diagnostic is complex, without specific ultrasound patterns. It has been associated with mucinous tumours with different potential for malignancy, and it is possible to find malignant or borderline components that determine the treatment. For its differential diagnosis immunohistochemical study is essential, which shows, according to various studies, a clonal origin of Brenner and mucinous tumour. This is a case report of a Brenner tumour associated with a mucinous tumour, which in a definitive study showed to be associated with a borderline ovarian tumour component.
El tumor de Brenner es una patología poco frecuente, descrita por primera vez por Fritz Brenner en 1907. Son tumores unilaterales, que se caracterizan por un revestimiento epitelial que contiene grupos de células de transición que asemejan al epitelio del tracto urinario1. Su origen no está claro, ya que tradicionalmente se asumía que surgían de la superficie del ovario, mediante metaplasia de células transicionales, sin embargo, recientemente se han propuesto otros orígenes del tumor, como los nidos de células de Walthard, teratomas o incluso el epitelio de las trompas de Falopio2. Diversos son los casos en la literatura que han puesto de manifiesto la asociación del tumor de Brenner con neoplasias mucinosas, demostrándose que ambos comparten un origen clonal común, lo que apoya la hipótesis de que algunos tipos de tumores mucinosos puedan derivarse de un tumor de Brenner3. El diagnóstico de este tipo de tumores por pruebas de imagen es complejo, ya que no se han podido determinar patrones ecográficos específicos para esta patología, por lo que el diagnóstico suele realizarse de forma accidental tras el análisis anatomopatológico de anexectomías1. Los tumores de Brenner generalmente tienen un comportamiento benigno, aunque un 2% de los casos reportados presentan características borderline o malignas4. Los tumores borderline, o también denominados tumores de bajo potencial maligno, suelen ser tumores de buen pronóstico, aunque este depende de la presencia de implantes peritoneales y de si estos son invasivos o no. El tratamiento es quirúrgico, de elección la anexectomía bilateral, aunque en pacientes con deseo genésico podría realizarse una cirugía más conservadora5.
A continuación presentamos el caso de una mujer postmenopáusica que es diagnosticada de forma accidental de un tumor de Brenner benigno asociado a un tumor mucinoso borderline de ovario. Nuestro objetivo es realizar una revisión bibliográfica de la literatura publicada sobre esta patología, con el fin de comprender el origen de esta asociación, así como analizar el manejo y pronóstico de este tipo de tumores.
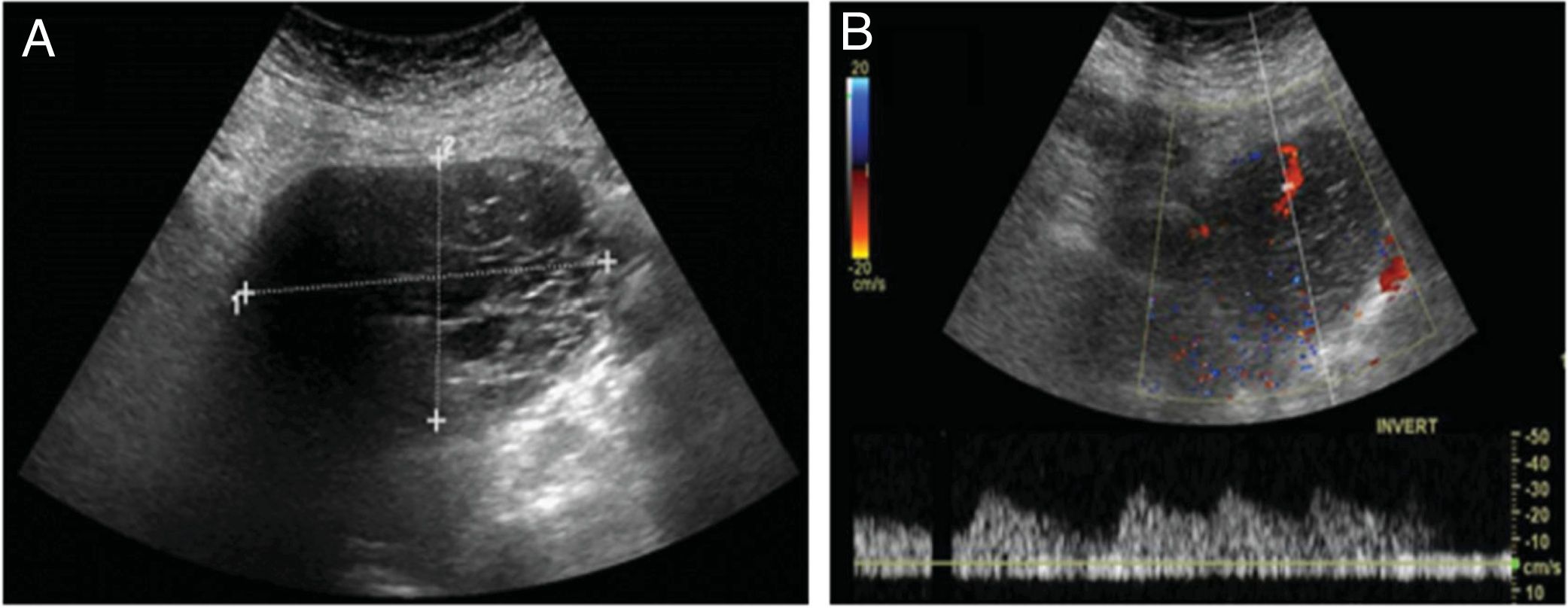
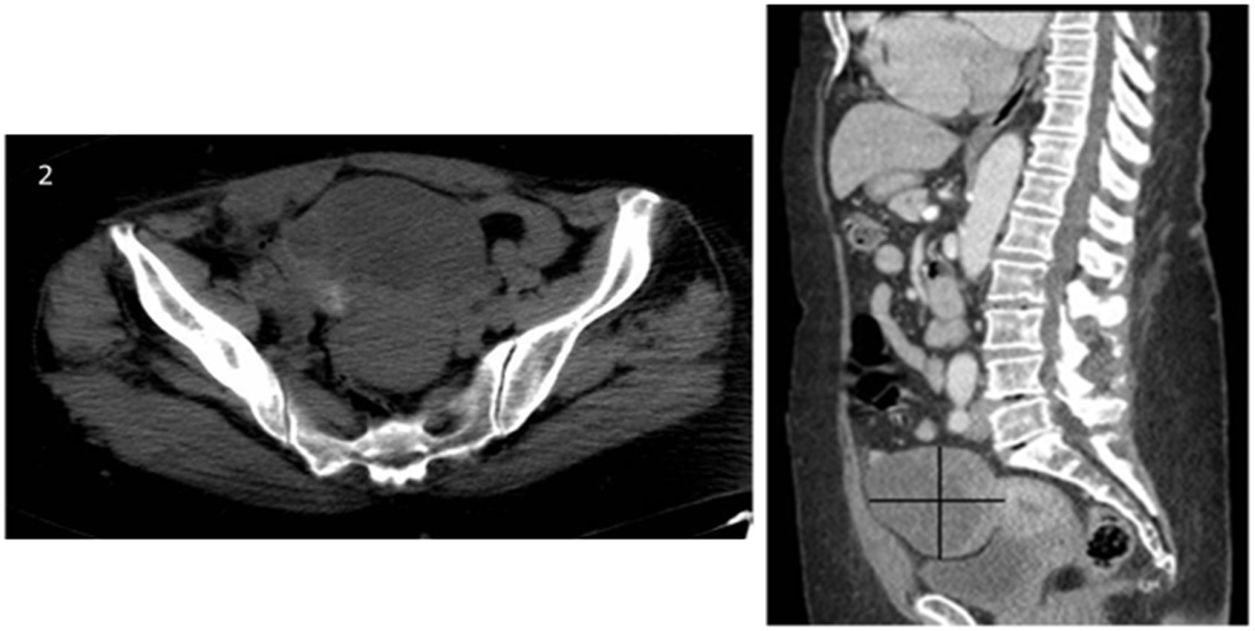
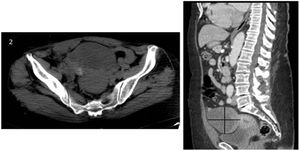
Caso clínicoSe expone el caso de una mujer de 68 años de edad, secundípara, postmenopáusica, sin antecedentes ginecológicos o personales de interés donde, durante un estudio por patología cardíaca, se objetivó la presencia de una masa pélvica mediante ecografía abdominal (fig. 1), sugestiva de malignidad, identificándose flujo arterial en la misma mediante estudio Doppler. Ante este hallazgo, se completó el estudio mediante tomografía axial computarizada (TAC) abdominopélvica con contraste (fig. 2). No se apreció líquido libre intraabdominal ni adenopatías sospechosas de malignidad. En la revisión ginecológica, la exploración se consideró dentro de la normalidad salvo por el estudio ecográfico transvaginal, el cual corroboró la presencia de dicha masa bien delimitada y heterogénea con áreas sólido-quísticas en la zona anexial derecha, sin encontrar patología subyacente en el anejo contralateral. Se solicitaron marcadores tumorales (CEA, CA 125, CA 19,9 y proteína HE-4) y algoritmo ROMA, con valores analíticos dentro de la normalidad (1,15 ng/mL, 15,4 U/mL, 6,1 U/mL y 77,5 pmol/L, 17,3% de riesgo, respectivamente). Ante los hallazgos se decidió intervenir a la paciente, indicando una laparotomía exploradora con biopsia intraoperatoria y cirugía de estadiaje en caso de malignidad. Durante la intervención, se encontró la tumoración ya conocida, que dependía del anejo derecho, considerándose útero, anejo izquierdo y el resto de la cavidad de características normales. Finalmente se realizó una anexectomía derecha, con estudio anatomopatológico intraoperatorio que obtuvo el resultado de tumor de Brenner con componente mucinoso de características benignas. Se completó la cirugía con la anexectomía contralateral, por edad y deseo de la paciente, junto con lavado peritoneal, que se enviaron para su análisis histológico en diferido. Tanto la intervención como el postoperatorio se desarrollaron sin complicaciones. El resultado definitivo del estudio anatomopatológico de las piezas quirúrgicas encontró la normalidad de ambas trompas de Falopio y del ovario izquierdo, filiando el origen de la pieza de anexectomía derecha como tumor mucinoso borderline asociado a tumor de Brenner benigno (fig. 3). Dicha pieza presentaba unas dimensiones máximas de 11 x 8 x 7 cm y una superficie blanco/pardusca sin áreas de disrupción. A los cortes seriados mostraba una superficie sólido-quística: el área sólida estaba constituida por un tejido blanquecino y firme, mientras que la región quística constaba de múltiples cavidades, la mayor de 3 cm de diámetro con contenido de aspecto mucoide. Por último, la muestra de líquido ascítico obtenida en el lavado peritoneal se categorizó como sospechosa de malignidad. Actualmente, los controles con marcadores tumorales permanecen dentro de la normalidad y la paciente continúa en seguimiento por parte de la Unidad de Ginecología Oncología, sin signos de recurrencia.
Estudio mediante ecografía transabdominal. A) Se aprecia en zona anexial derecha una masa de contenido heterogéneo compuesta por una zona de imágenes redondeadas anecoicas bien delimitadas de aspecto quístico y otro polo de aspecto sólido. B) Esta masa presenta flujo arterial en el estudio Doppler.
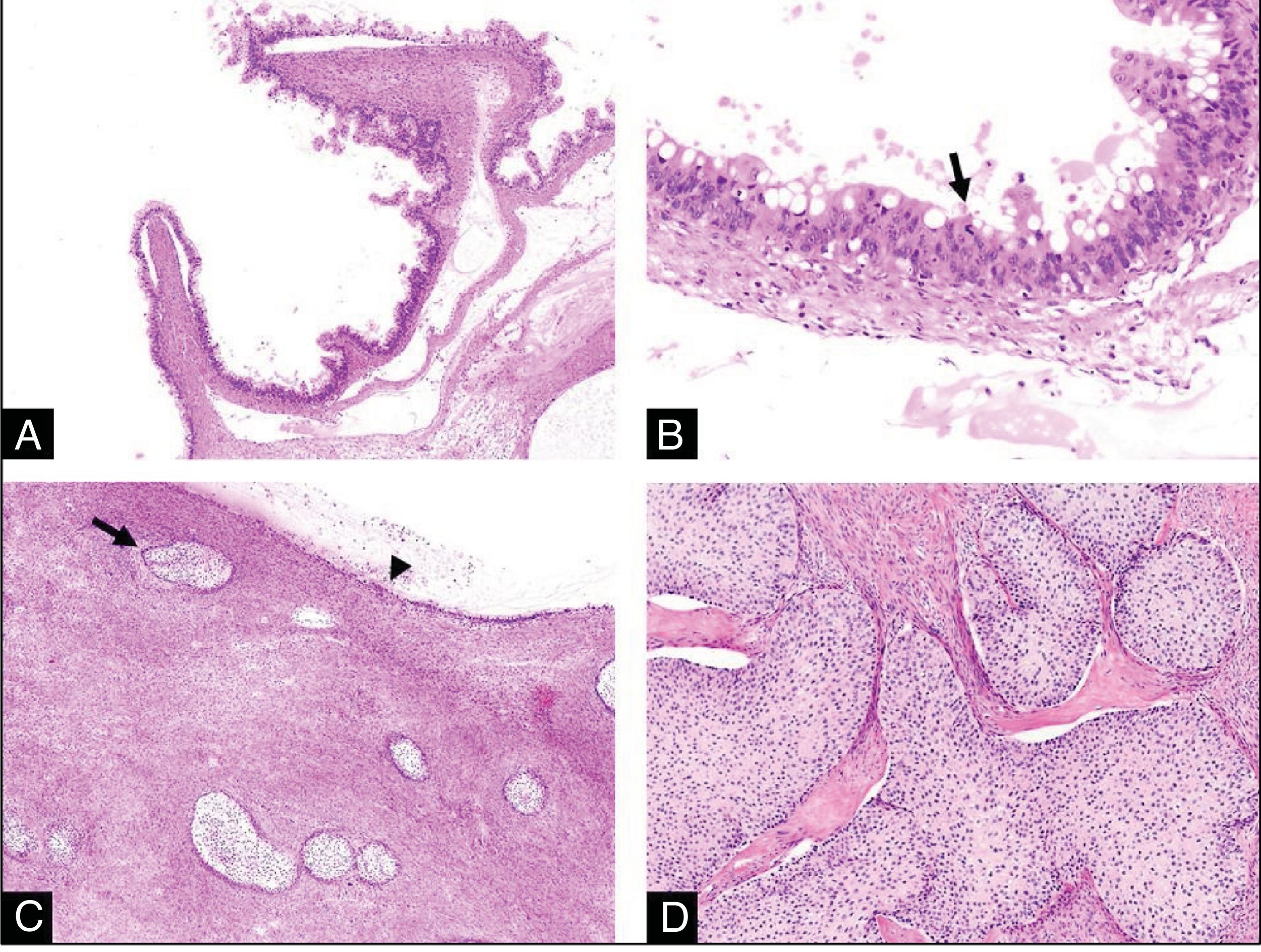
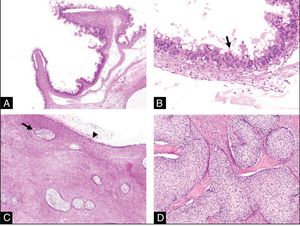
Estudio histológico. A) A poco aumento vemos que el tumor mucinoso presenta un aspecto quístico compuesto por formaciones papilares. No existen signos morfológicos de invasión estromal (HE,4x). B) A mayor aumento, vemos que dichas papilas se encuentran revestidas por un epitelio de tipo mucinoso con estratificación nuclear, atipia moderada y ocasional presencia de figuras de mitosis (flecha) sin invasión estromal (tumor mucinoso borderline) (HE,20x). C) En esta otra imagen, vemos la presencia de varios nidos sólidos de epitelio de tipo transicional (flecha) asociados al tumor mucinoso (cabeza de flecha) (HE,4x). D) Con mayor aumento vemos con más detalle este segundo componente tumoral: se trata de nidos celulares sólidos de tipo transicional que recuerdan al epitelio del tracto urinario, redondeados, con núcleos redondos y pequeños y citoplasmas claros. Esto es concordante con un tumor de Brenner benigno (HE,10x).
El tumor de Brenner es una neoplasia infrecuente con una incidencia del 1,4-3% dentro de los tumores de ovario4. En 2014 fue clasificado por la Organización Mundial de la Salud (OMS) como un subtipo de tumor ovárico epitelial de superficie4, encontrándose asociado a menudo en piezas quirúrgicas a focos de otras neoplasias como los cistoadenomas mucinosos o incluso a otros tipos de tejido, como el tiroideo (struma ovarii)6. Su diagnóstico suele ocurrir de forma accidental tras la realización de una anexectomía por otros motivos, presentando normalmente un comportamiento benigno. Sin embargo, hasta el 2% de los casos descritos tienen características borderline o malignas. Las variantes benignas suelen afectar a mujeres en la cuarta o quinta década de la vida, mientras que las borderline o malignas aparecen hasta 10 años más tarde4, lo que concuerda estadísticamente con el caso que presentamos. En la mayoría de las ocasiones son unilaterales4 y su tamaño puede oscilar desde menos de 1 cm7 hasta los 30 cm, según lo descrito1. El diagnóstico es difícil de determinar por pruebas de imagen, hallándose en estudios mediante TAC y resonancia magnética (RM) como hallazgo típico, pero no específico, masas quísticas con áreas extensas de calcificación y componente sólido1, tal y como figura en nuestro caso. Existe una gran variedad de hipótesis en cuanto a su patogénesis, la cual resulta aún controvertida. La hipótesis más defendida, aunque sin evidencia científica, era el origen a partir del epitelio de la superficie ovárica, encontrando otras posibilidades, como que provenga de un remanente del conducto mesofrénico, rete ovarii o incluso que se origine a partir de teratomas (3%)6,7. Sin embargo, actualmente se sugiere que los tumores de Brenner tienen un origen tubárico, surgiendo de las células de la unión tuboperitoneal (unión entre la fimbria tubárica y la serosa mesotelial). Se postula que en estas células tengan lugar fenómenos de metaplasia hacia células de transición, formando nidos de células transicionales de Walthard. Estas agrupaciones celulares se consideran el origen de quistes paratubáricos, que pueden adherirse e implantarse en el tejido ovárico evolucionando hacia los tumores de Brenner6,8. La relación entre estos nidos celulares y el componente epitelial del tumor de Brenner se establece mediante los estudios inmunohistoquímicos de dichas agrupaciones celulares, encontrando positividad para GATA3, AKR1C3 y p63, a la vez que no expresan tinción para PAX8 y PAX2 (marcadores müllerianos), calretinina e inhibina (componente estromal) y SALL4 (marcador de células germinales)3,8. Por otro lado, frecuentemente el tumor de Brenner se asocia a la presencia conjunta de un cistoadenoma mucinoso o de manera más infrecuente, con cistoadenocarcinoma, ambos considerados como una forma de cambio metaplásico de las células del tumor de Brenner4, puesto que el epitelio mucinoso no es propio del ovario8. El tumor de Brenner se compone por nidos de epitelio de transición dentro de un estroma denso fibrótico, pudiendo encontrarlos dilatados y asociados en su interior a células epiteliales mucinosas, así como a calcificaciones espiculadas8. Estas células de transición pueden sufrir metaplasia, dando lugar a células mucinosas que proliferan, comprimen y obliteran la neoplasia original, desarrollando el nuevo tumor de estirpe mucinosa1. Según estudios inmunohistoquímicos, la mayoría de los tumores mucinosos carecen de la expresión de PAX8, PAX2 y SLL4, respaldando que los tumores de Brenner y los mucinosos asociados, no son de origen mülleriano ni germinal. A diferencia del tumor de Brenner, el componente mucinoso carece de la expresión de GATA3 y hasta el 50% pueden expresar el marcador mülleriano PAX8. Esta incongruencia podría explicarse por la íntima relación existente en la unión tuboperitoneal entre los epitelios müllerianos (fimbrias de las trompas de Falopio) y epitelios no müllerianos (serosa tubárica y epitelio superficial ovárico), lo que provocaría la superposición de la expresión de dicho marcador en ambos tipos celulares6. Para demostrar la hipótesis de un origen clonal común, Wang et al., analizaron el patrón de inactivación del cromosoma X de los componentes de ambos tipos de tumores, concluyendo la existencia de dicha relación entre ellos3. Además, Tafe et al., demostraron la alta concordancia de estos dos tipos de tumores al encontrar la mutación KRAS y la amplificación MYC, en caso de ausencia de la anterior mutación, en ambos componentes, apoyando la hipótesis del origen compartido8. Así, de acuerdo con la presencia de los hallazgos antes descritos y en la existencia de otras mutaciones, como PIK3CA, se podría justificar la patogenia y progresión de los cistoadenomas y tumores borderline mucinosos a partir de los tumores benignos de Brenner8. Esta teoría puede explicar la fisiopatología del caso presentado, en el que el tumor mucinoso borderline de nuestra paciente pudo surgir a raíz de un tumor de Brenner benigno. Además, en nuestro caso el componente borderline no fue confirmado hasta el análisis histológico en diferido. Distintos estudios han demostrado que la precisión diagnóstica de la biopsia intraoperatoria para los tumores borderline oscila entre el 58-86%, informándose el 31% de los tumores como benignos9. Esta precisión se ve disminuida si el tumor es de tipo mucinoso o si el tamaño del mismo es mayor de 10 cm, características halladas en el caso de nuestra paciente. Sin embargo, es esencial que los patólogos examinen minuciosamente múltiples secciones de las piezas intraoperatorias de anexectomía, ya que el diagnóstico de tumor maligno o borderline cambia la radicalidad del abordaje quirúrgico10. Como ya hemos comentado, los tumores borderline han tomado distintas denominaciones desde su descubrimiento, adoptando términos como tumores de bajo potencial maligno, o más recientemente, tumores proliferativos atípicos9. Los subtipos más frecuentes son los serosos y mucinosos, siendo los tumores borderline de Brenner o células claras, subtipos menos comúnes11. Actualmente, se recomienda su clasificación en función de la existencia de implantes y de la naturaleza de estos (invasivos o no), lo que va a condicionar su pronóstico5. El tratamiento de elección de los tumores borderline es la cirugía anexial, combinada con el estadiaje peritoneal, que incluye lavado peritoneal con toma de muestras para citología, omentectomía infracólica y biopsias peritoneales, no recomendándose de rutina la realización de linfadenectomía11,12. Aunque en mujeres premenopáusicas, con deseo genésico, la cirugía a nivel anexial puede plantearse de forma más conservadora (quistectomía, ooforectomía unilateral, etc.), mientras que en pacientes postmenopáusicas o perimenopáusicas, el tratamiento de elección es la histerectomía total con doble anexectomía. Además, las guías han recomendado de forma tradicional la realización de apendicectomía en el caso de tumores de tipo mucinoso, con el fin de excluir un origen primario apendicular. Sin embargo, estudios y revisiones realizados recientemente han demostrado que su exéresis no es obligatoria y que en caso de diagnóstico del componente borderline de forma postoperatoria en mujeres en las que durante la cirugía no se encontraron alteraciones a nivel del apéndice, no sería necesario un «second look» para realizar la apendicectomía12. Por lo tanto, en el caso de nuestra paciente no sería necesario plantear una nueva intervención. En cuanto al uso de marcadores tumores en las neoplasias borderline, este es muy limitado. No hay marcadores tumorales que puedan predecir de forma fiable la evolución a tumores invasivos, ya que la tasa que progresan a formas malignas es únicamente del 0,7%13. Además, los beneficios del uso del CA 125 son muy pobres, ya que no es específico del tumor borderline, ni para su diagnóstico ni en su seguimiento, a diferencia del carcinoma epitelial de ovario, en el que sí se usa para la monitorización de las pacientes afectadas9. En nuestra paciente no se encontraba alterado ni en el diagnóstico ni en las revisiones realizadas posteriormente. Para finalizar, con relación al pronóstico, los tumores borderline siguen un curso indolente y su tasa de recurrencia es muy baja. Considerando todos los subtipos de tumores borderline, la tasa de supervivencia a 10 años es del 97%9. No obstante, este pronóstico depende del estadio al diagnóstico (presencia o no de implantes) y de la cirugía realizada, siendo la tasa de recaída mayor en aquellas pacientes en las que se realizó una cirugía conservadora del ovario5.
ConclusionesEl tumor de Brenner es una neoplasia ovárica poco frecuente, generalmente benigna, que se ha asociado tradicionalmente a tumores mucinosos. Las teorías sobre la etiopatogenia de esta asociación defienden la proliferación y progresión de cistoadenomas o tumores mucinosos borderline a partir de tumores de Brenner benignos. Ante un tumor de estirpe mixta, es el componente borderline o maligno el que va a marcar la radicalidad de la cirugía y el pronóstico, por lo que es de gran importancia el análisis histológico minucioso intraoperatorio de la pieza. En el caso de los tumores borderline, el pronóstico es bueno, aunque depende de la presencia al diagnóstico de implantes peritoneales (naturaleza invasiva o no de los mismos) y del tipo de cirugía realizada. La cirugía de elección de estos tumores es la anexectomía bilateral, combinada con el estadiaje peritoneal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.