Los tumores de ovario de células esteroideas constituyen una entidad infrecuente de virilización. Pueden originarse del estoma o de los cordones sexuales; en ocasiones el linaje tumoral es desconocido, denominándose tumor esteroide no especificado.
Presentamos el caso de una paciente con signos de virilización rápidamente progresiva, sugestivo de origen ovárico. Las pruebas de imágenes fueron negativas, y tras ser sometida a intervención quirúrgica se objetivó la presencia de un tumor microscópico con marcadores positivos para células esteroideas.
Ovarian steroid cell tumours are an uncommon cause of virilisation. They may originate from the stroma or sex cords; sometimes the tumour lineage is unknown, in which case the tumour is described as “not otherwise specified”. We report the case of a patient with signs of rapidly progressive virilisation, suggestive of ovarian origin. Imaging tests were negative. After surgical intervention, the presence of microscopic tumour markers positive for steroid cells was observed.
Los tumores ováricos virilizantes representan menos del 5% de todos los tumores del ovario. El tumor de células esteroideas es un subtipo clasificado dentro del grupo de tumores de los cordones sexuales o del estroma1. Son muy infrecuentes, representando el 0,1% de todos los tumores del ovario. Fueron previamente clasificados como tumores de células lipoideas o lipídicas. En 1979 Scully los denominó «tumor de células esteroideas» del ovario2. Este término describe más la estructura morfológica y funcional que las manifestaciones clínicas.
La detección de tumores de ovario productores de testosterona por técnicas de imagen puede ser difícil, sobre todo en niñas y adolescentes, debido a la estructura radiológica y a veces a su pequeño tamaño3. El curso clínico es desconocido debido a las pocas series descritas en la literatura.
Caso clínicoMujer sin antecedentes que destacar, que consulta por primera vez a los 51 años por alopecia androgénica severa e hirsutismo, que se inicia 5 años antes, con hirsutismo progresivo sin otras alteraciones hasta hace 3 años, cuando se hace evidente una alopecia rápidamente progresiva de predominio frontal y temporal junto con cambios en la voz, siendo esta más grave. Una ecografía ginecológica realizada 2 años antes fue normal.
En el momento que acude a nuestra consulta la paciente está perimenopáusica, refiriendo oligomenorrea.
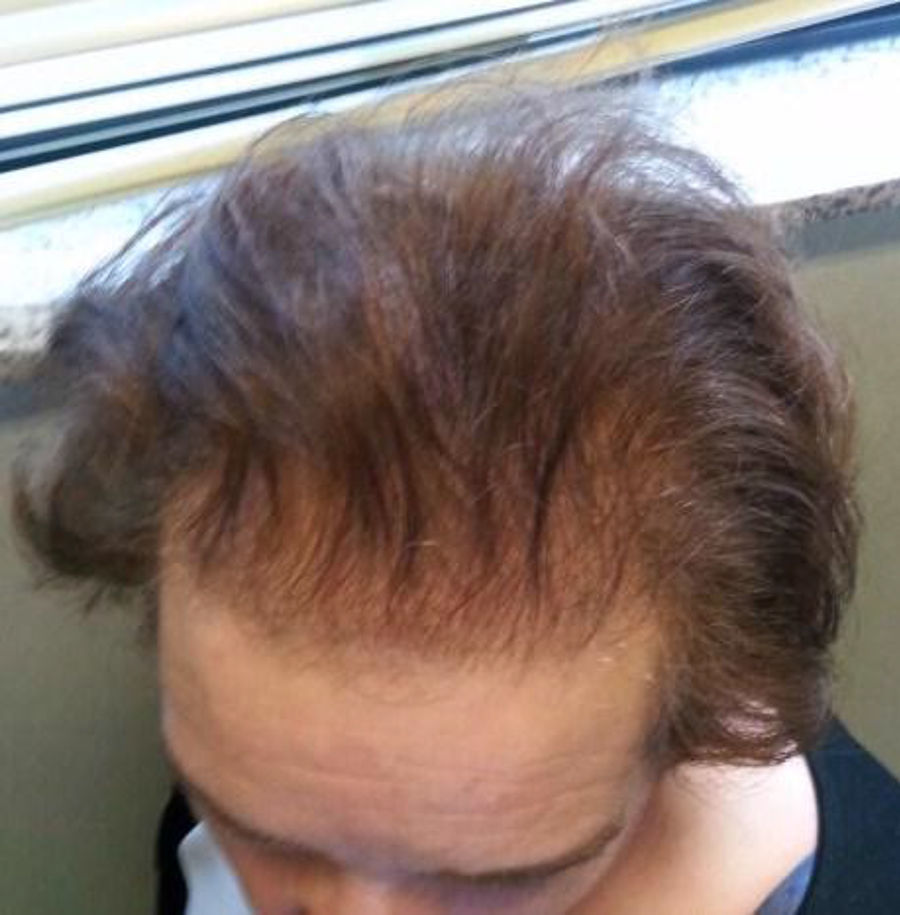
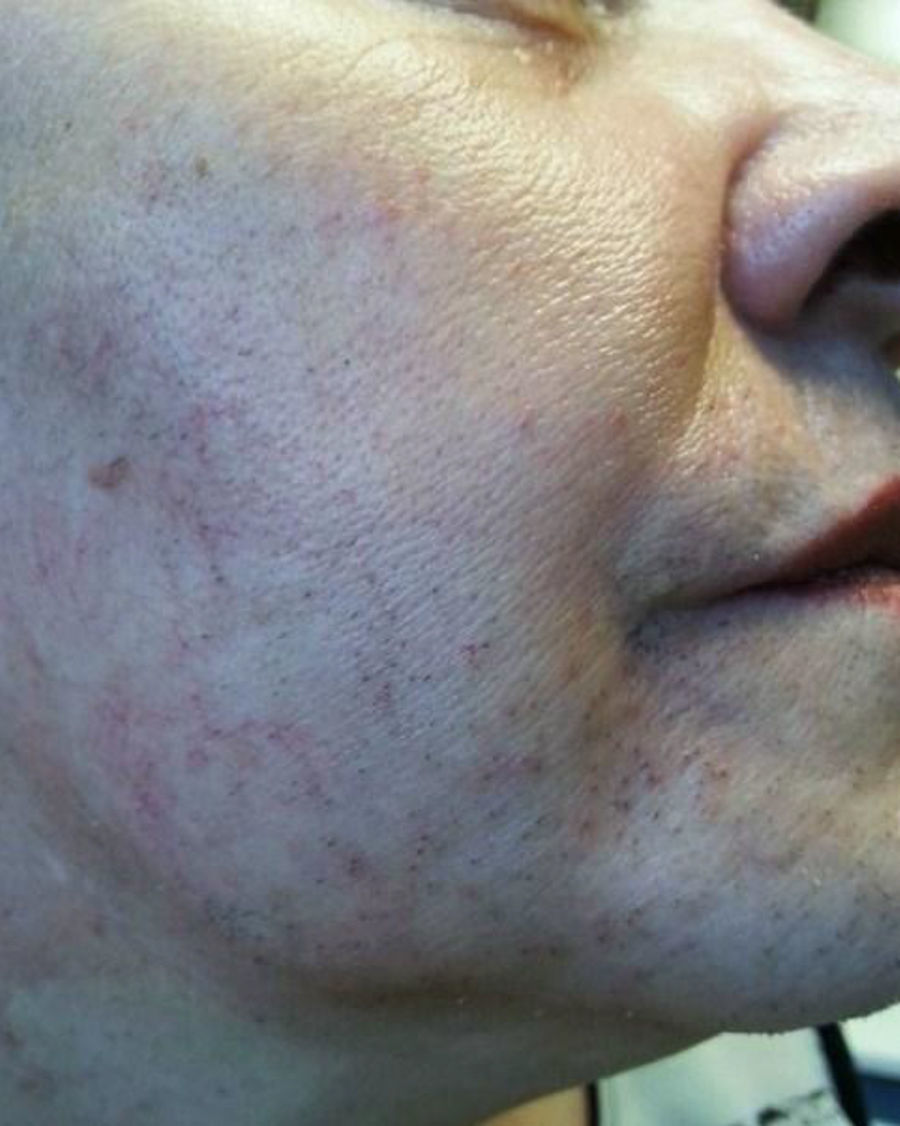
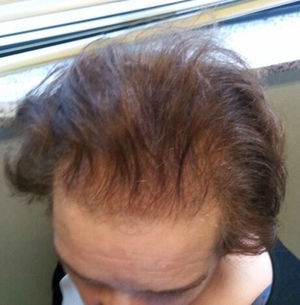
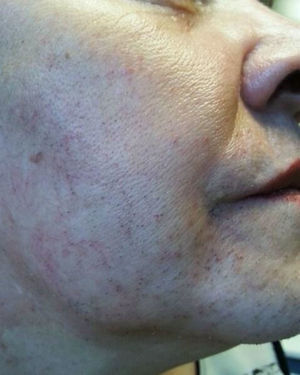
A la exploración física destacaba sobrepeso grado 1, con IMC de 27,5kg/m2, importante alopecia androgénica (fig. 1), hirsutismo principalmente en la cara, la espalda y el abdomen (fig. 2), sumando 20 puntos en la escala de Ferriman-Gallway. En la exploración los genitales eran adecuados para edad y el sexo.
Pruebas complementariasEn la analítica hormonal destacan valores de testosterona de 5,09ng/ml (límites de la normalidad: 0,1-1,1ng/ml) y D4 androstendiona 6,5ng/ml (límites de la normalidad: 0,40-3,40ng/ml) con dehidroepiandrosterona sulfato (DHEA-S) y 17-OH progesterona normales.
La tomografía computarizada abdominal muestra hiperplasia suprarrenal nodular bilateral con un nódulo dominante de 18mmen suprarrenal derecha y otro izquierdo de 1cm que se comportan radiológicamente como adenomas.
Ecografía ginecológica: útero miomatoso y ovarios normales.
Biomarcadores (alfafetoproteína, CEA-II, CA 19.9, Ca 125-II, CA 15.3, BR 27.29) negativos.
Se realizan cortisol basal, cortisoluria de 24h, catecolaminas y metanefrinas en orina, así como test de supresión con 1mg de dexametasona y se descarta funcionalidad de los nódulos suprarrenales observados en la tomografía computarizada.
EvoluciónInicialmente, y debido a la no visualización de masas ováricas, se decidió tratamiento médico con análogos de hormona liberadora de gonadotropinas (GnRH) en inyección mensual, con mejoría franca de la clínica y analítica hormonal, lográndose tras las primeras 2 inyecciones una testosterona total de 1,37ng/ml (VN: 0,1-1,1ng/ml) y una D4-androstendiona de 2,5ng/ml (VN: 0,40-3,40ng/ml). Esta buena respuesta terapéutica apoya el origen ovárico del hiperandrogenismo, a pesar de la negatividad en las pruebas de imagen.
Tras 3 años de tratamiento médico, y dada la alta sospecha de hiperandrogenismo de origen ovárico, se decide intervención quirúrgica, realizándose histerectomía y doble anexectomía en enero de 2014.
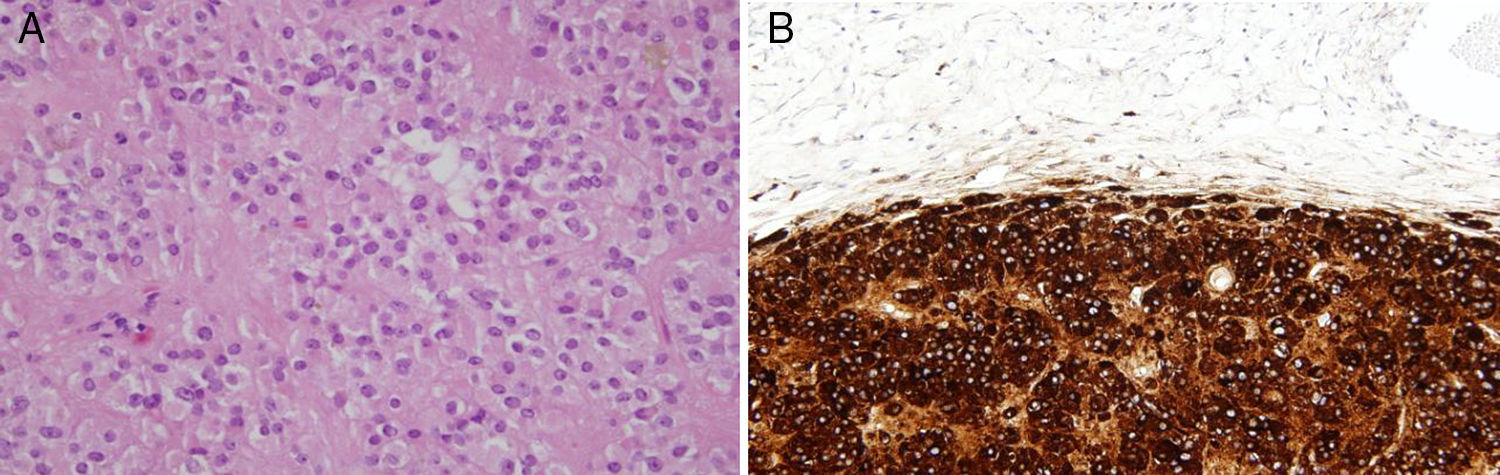
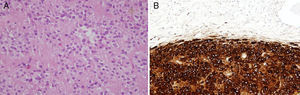
En el estudio anatomopatológico no se encontraron alteraciones macroscópicas, por otra parte en la microscopia se halló, en el seno del ovario derecho, una tumoración bien delimitada de células esteroideas de 0,9cm de diámetro, sin datos histológicos de malignidad (fig. 3A). El estudio inmunohistoquímico fue positivo para inhibina y calretinina (fig. 3B), 2 marcadores clave en los tumores de células esteroideas.
A. Tinción con hematoxilina eosina. Tumoración constituida por áreas sólidas de núcleo oval, monomorfo, con ocasional nucléolo visible y sin atipia ni figuras de mitosis. En el citoplasma eosinófilo y poligonal se observa lipofuscina. B. Análisis de inmunohistoquímica que muestra positividad para calretinina e inhibina.
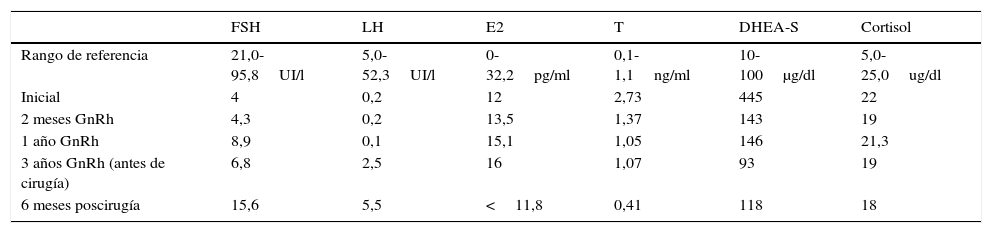
Tras 2 meses de la intervención quirúrgica las cifras de testosterona total y androstenediona se normalizaron, siendo los resultados en la analítica los siguientes: testosterona 0,33ng/ml (límites de la normalidad: 0,1-1,1ng/ml), D-4 androstendiona 1,8ng/ml (límites de la normalidad: 0,40-3,40ng/ml) (tabla 1); con lo que mejora ostensiblemente la alopecia y el hirsutismo.
Evolución hormonal con tratamiento médico y quirúrgico
| FSH | LH | E2 | T | DHEA-S | Cortisol | |
|---|---|---|---|---|---|---|
| Rango de referencia | 21,0-95,8UI/l | 5,0-52,3UI/l | 0-32,2pg/ml | 0,1-1,1ng/ml | 10-100μg/dl | 5,0-25,0ug/dl |
| Inicial | 4 | 0,2 | 12 | 2,73 | 445 | 22 |
| 2 meses GnRh | 4,3 | 0,2 | 13,5 | 1,37 | 143 | 19 |
| 1 año GnRh | 8,9 | 0,1 | 15,1 | 1,05 | 146 | 21,3 |
| 3 años GnRh (antes de cirugía) | 6,8 | 2,5 | 16 | 1,07 | 93 | 19 |
| 6 meses poscirugía | 15,6 | 5,5 | <11,8 | 0,41 | 118 | 18 |
Los tumores de células esteroideas se definen como neoplasias compuestas por células secretoras de hormona esteroidea1, de la cual existen 3 subtipos de tumor esteroideo según el origen celular: luteoma estromal que crece del estroma ovario, tumor de células de Leydig cuando se origina de las células de Leydig del hilio y tumor esteroide no especificado, cuando el linaje del tumor es desconocido1. Este último es el más común, representando el 60%, y está compuesto por células que se originan de restos celulares adrenales, células luteínicas estromales o células de Leydig.
Suelen aparecer en las mujeres posmenopáusicas, con una edad media de 47 años4 y que se comportan de forma maligna hasta en un 25%5. Las características de malignidad suelen ser: tamaño tumoral >7cm, 2 o más figuras mitóticas por 10 campos de alta resolución, presencia de necrosis, hemorragia o atipias nucleares grado 2 o 3. En pacientes jóvenes habitualmente presentan un comportamiento benigno.
Casi el 75% de los tumores de células esteroideas producen testosterona, pero a diferencia de los tumores de células de Leydig pueden también producir cantidades elevadas de androstenediona.
Respecto a los síntomas, en mujeres premenopáusicas lo primero que refieren es oligomenorrea o amenorrea con posterior aparición de los signos comunes de masculinización1, como es el caso de nuestra paciente. La presencia de estas manifestaciones clínicas, junto con niveles elevados de testosterona sérica superior a 2,0ng/ml, dehidroepiandrosterona y 17OH progesterona normal y sin evidencia de deficiencia de 21-hidroxilasa es sugestivo de tumor ovárico virilizante4.
El diagnóstico de tumores virilizantes del ovario es difícil de establecer preoperatoriamente mediante las técnicas de imagen6. Las técnicas de elección son la ecografía transvaginal (evalúa tamaño y morfología) y la RMN (para la estadificación)4. Las técnicas de imagen del ovario pueden ser de gran ayuda, pero su normalidad no descarta enfermedad, como ha ocurrido en nuestro caso. En los casos en los que la localización radiográfica sea incierta, sobre todo en la infancia y adolescencia, la determinación rápida de testosterona intraoperatoria en muestras de sangre venosa de ovario puede identificar la localización del tumor con una tasa de identificación del tumor afectado del 100% en el número limitado de casos reportados en la literatura3. Otra alternativa para conocer cuál es la fuente de testosterona sería el cateterismo preoperatorio de las venas ováricas.
Los tumores de células esteroideas pueden producir otro tipo de hormonas diferentes, produciendo cuadros como un síndrome de Cushing por producción de cortisol (6-10%), hipertensión e hipocaliemia por producción de prorrenina, menorragias y hemorragias en posmenopáusicas por producción de estrógenos (6-23%) y progesterona, entre otras. Un 25% no producen hormonas2,7–9.
Aunque la DHEA-S tiene una buena sensibilidad a la hora de detectar un origen adrenal del hiperandrogenismo (y por lo tanto, un buen valor predictivo negativo), no es específica (especificidad entre 85-98%)10. Sin embargo, ante la presencia de altos niveles de DHEA-S es recomendable la realización de un estudio de imagen de ambas adrenales para descartar la presencia de masas a dicho nivel; por otra parte, es posible encontrar incidentalomas adrenales sin funcionalidad. En nuestro caso los altos niveles de testosterona con niveles de DHEA-S normal y pruebas dinámicas para descartar el origen suprarrenal sugirieron la presencia de una fuente ovárica de andrógenos.
Los tumores esteroides no especificados son tumores sólidos y bien circunscritos, generalmente de color amarillento debido al contenido lipídico de sus células8. Histológicamente están compuestos por grandes células poligonales o redondeadas con citoplasma rico en lípidos, muy parecidas a las de la corteza suprarrenal9. Se diferencian de los tumores de células de Leydig por no poseer cristales citoplasmáticos de Reinke, y del luteoma estromal porque este último está asociado con hipertecosis estromal. El diagnóstico patológico es confirmado por medio de inmunohistoquímica. Aunque la inhibina no es específica de los tumores de células esteroideas, estos tumores expresan la alfa-inhibina. También se ha demostrado que los tumores de los cordones sexuales expresan la calretinina8. Para esto, se recomienda utilizar la alfa-inhibina y la calretinina, las cuales presentan una sensibilidad del 71% y 97% respectivamente, y una especificidad del 97% y 85% respectivamente11.
La inhibina puede ser usada como marcador postoperatorio para monitorizar el tratamiento y la recurrencia6.
En todos los casos el tratamiento de elección es la cirugía. En pacientes con deseos genésicos cumplidos está indicada la histerectomía total con doble anexectomía para una estratificación quirúrgica completa1,5,11, debido que hasta un 10% se asocia con carcinoma endometrial9. En aquellas mujeres con deseos de fertilidad la cirugía conservadora con ooforectomía unilateral con una adecuada estratificación estaría indicada.
Como alternativa se pueden emplear agonistas de los receptores de la GnRH, debido a que algunos de los tumores que secretan hormonas no son autónomos y aparentemente dependen de la secreción de gonadotropinas11,12. Tras la administración de una dosis única de agonistas de GnRH, la supresión de los niveles de testosterona suele presentarse en los 3 primeros meses13, y es además una prueba diagnóstica del origen ovárico del hiperandrogenismo, como en el caso clínico que presentamos. Estos análogos disminuyen los niveles de testosterona hasta valores normales, de forma paralela con la supresión de los niveles de LH y FSH, además de producir una mejoría de los síntomas de hiperandrogenismo. Algunos autores recomiendan su uso como terapia adyuvante postoperatoria para evitar recurrencias1.
Tras la cirugía la monitorización de los niveles de testosterona ayuda a verificar la curación del cuadro de hiperandrogenismo.
ConclusiónLos tumores de células esteroideas son poco frecuentes. Los tumores productores de andrógenos deberían ser excluidos en toda mujer posmenopáusica con evidencia de hirsutismo y virilización de curso rápidamente progresivo, con elevación de los niveles de testosterona. Las técnicas de imagen son una buena herramienta para el diagnóstico de un tumor de origen ovárico, aunque es importante tener en cuenta que la normalidad de las mismas no descarta la presencia de enfermedad a dicho nivel. El diagnóstico definitivo es anatomopatológico. El tratamiento ha de ser individualizado en función de la histología del tumor, estadio quirúrgico y futuros deseos de gestación de la paciente. El tratamiento quirúrgico por laparoscopia es el tratamiento de elección, fundamentalmente en mujeres con deseos genésicos cumplidos. Es muy importante el seguimiento posterior debido a su potencial maligno.
Conflicto de interesesLos autores confirman no tener ningún conflicto de intereses.