El trauma cráneo-encefálico (TEC) es uno de los desórdenes neurológicos más comunes actualmente. Presenta consecuencias tan devastadoras que el 39% de los pacientes mueren a causa del trauma. De los sobrevivientes, el 60% tendrán déficit en las competencias cognitivas o motoras.
ObjetivoAnalizar a través de la evidencia actual el manejo del TEC severo y el desenlace clínico logrado con el uso del lactato sódico hipertónico.
MetodologíaSe realizó una búsqueda en bases de datos de literatura científica como EMBASE, PubMed/Medline, OVID y Science Direct para elaborar un artículo de reflexión, usando las palabras «traumatic brain injury», «hypertonic sodium lactate», «metabolism in brain injury», «management of traumatic brain injury», haciendo hincapié en los beneficios potenciales del lactato sódico hipertónico, sin tener en cuenta la fecha de publicación.
ResultadosEl lactato sódico hipertónico ha demostrado impactar de forma exitosa el pronóstico sombrío del TEC, modulando la hipertensión endocraneana y disfunción metabólica oxidativa cerebral, lo cual se ha demostrado en modelos in vitro, en animales y en humanos.
ConclusiónLos esfuerzos por mejorar los desenlaces clínicos han llevado a buscar nuevas alternativas del manejo del TEC, derivadas del entendimiento de la fisiopatología. De allí surge el lactato como terapia prometedora en el manejo del TEC, dados sus múltiples efectos endocrino-metabólicos moduladores de la lesión secundaria.
Traumatic brain injury (TBI) is one of the most common neurological disorders at the present time. The consequences are so devastating that up to 39% of the patients die from trauma and 60% of the survivors will have cognitive and/or motor deficits.
ObjectiveTo analyse the current evidence on the management of severe TBI and the clinical outcome achieved with the use of hypertonic sodium lactate.
MethodologyA search of the scientific literature was conducted in the EMBASE, PubMed/Medline, OVID and Science Direct databases with the aim of preparing a reflection article, using the words «traumatic brain injury», «hypertonic sodium lactate», «metabolism in brain injury», «management of traumatic brain injury», focusing on the potential benefits of hypertonic sodium lactate, regardless of the date of publication.
ResultsThe use of hypertonic sodium lactate has been shown to have a successful impact on the dismal prognosis of TBI, modulating intracranial hypertension and cerebral oxidative metabolic dysfunction. This has been proven in vitro, in animal models, and in humans.
ConclusionEfforts to find better clinical outcomes in patients with TBI have confirmed the need for new management alternatives supported by the understanding of the pathophysiology. Given its multiple modulating endocrine-metabolic effects on secondary injury, lactate has been found to be a promising therapy in the management of TBI.
El trauma cráneo-encefálico (TEC) es una condición heterogénea en términos de etiología, severidad y resultados, que corresponde a uno de los desórdenes neurológicos más comunes que ocurren en la actualidad1. La OMS proyecta que para el 2020 el TEC y los accidentes de tránsito van a ser la tercera causa de morbilidad en el mundo2. Esta revisión de la literatura se ha enfocado en el TEC severo, definido como «aquella acción producida por fuerzas mecánicas externas que va a causar daño tisular macroscópico»3 que tiene una valoración en la escala de coma de Glasgow de entre 3 y 84.
El TEC severo constituye un problema de índole global, con un rango de incidencia de 108 a 332 nuevos casos ingresados a un hospital por cada 100.000 habitantes por año3.
De igual forma, aún con la terapia médico-farmacológica ofrecida, se presenta un promedio del 39% de mortalidad en el TEC5 y «aproximadamente el 60% de los sobrevivientes tienen déficit en las competencias cognitivas o motoras»6. En Colombia no se dispone de datos actualizados que involucren múltiples centros dirigidos a esta problemática.
Debido al impacto en morbimortalidad mencionado, se han explorado nuevas alternativas de manejo; entre ellas, el lactato sódico hipertónico como propuesta para mejorar los resultados a corto y largo plazo7-9. Este artículo tiene como objetivo citar los beneficios que genera la terapia con lactato sódico hipertónico en TEC y describir qué tan factible es que se convierta en la mejor alternativa de manejo.
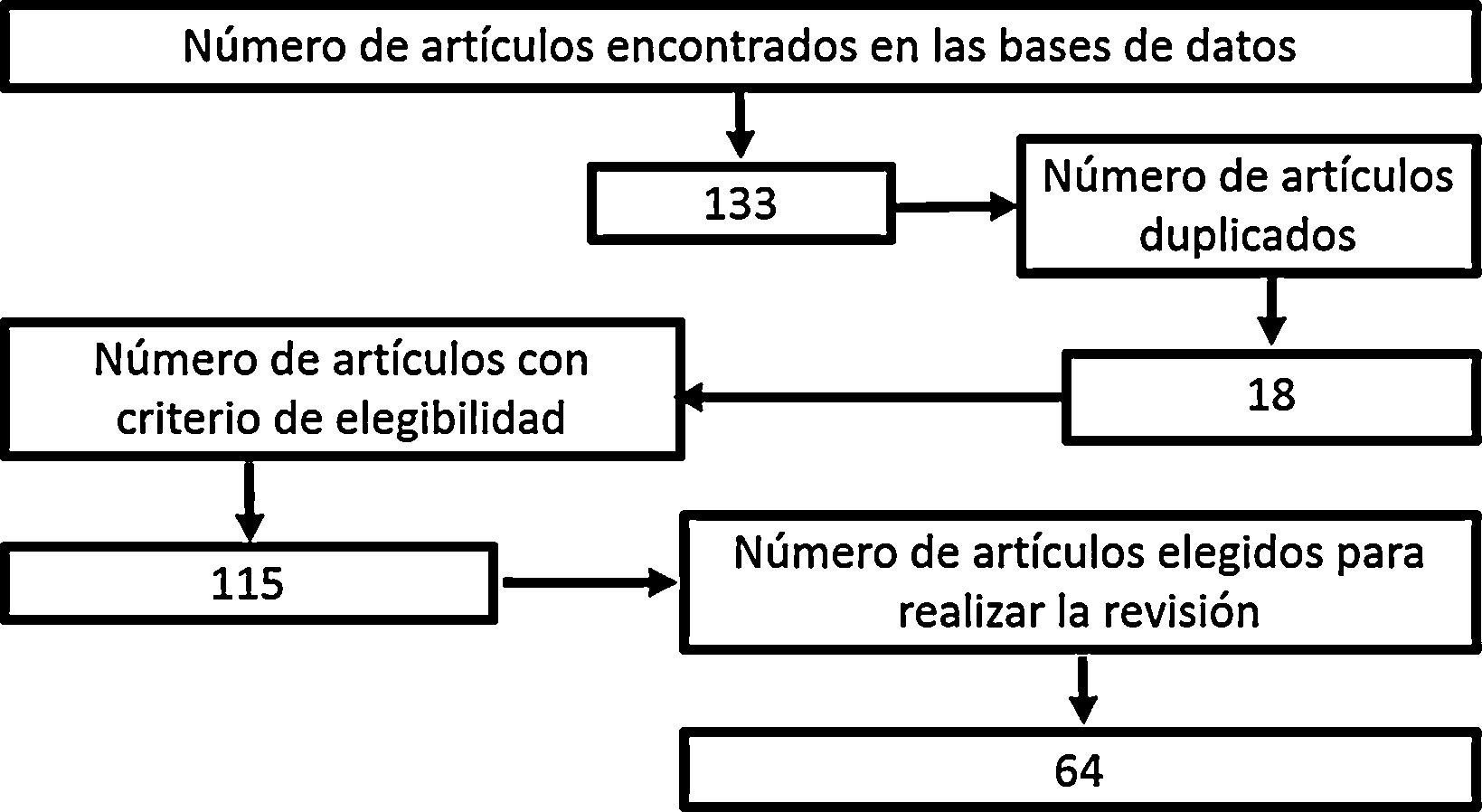
MetodologíaSe realizó una búsqueda de la literatura científica, en la que se incluyeron artículos publicados en PubMed/Medline, Science Direct, EMBASE y OVID, usando las palabras «hypertonic sodium lactate», «traumatic brain injury», «management of traumatic brain injury», «metabolism in brain injury», con «hypertonic sodium lactate» como referente para todas las búsquedas. No se consideró fecha límite de publicación. Los artículos seleccionados estaban publicados en idioma inglés, excepto aquellos concernientes a epidemiología local, que estaban en idioma español. En las bases bibliográficas se encontraron en total 133 documentos, de los cuales 18 de ellos estaban duplicados. Posteriormente se procedió a realizar una evaluación del abstract de 115 artículos, con elección de 65 documentos relevantes, entre ellos, revisiones sistemáticas, metaanálisis, ensayos clínicos y revisiones de la literatura pertinentes para desarrollar la fisiopatología posterior a un trauma cráneo-encefálico, conocer el objetivo de la terapia farmacológica en el TEC y dilucidar los resultados obtenidos con el manejo con lactato sódico hipertónico en pacientes con trauma cráneo-encefálico (fig. 1).
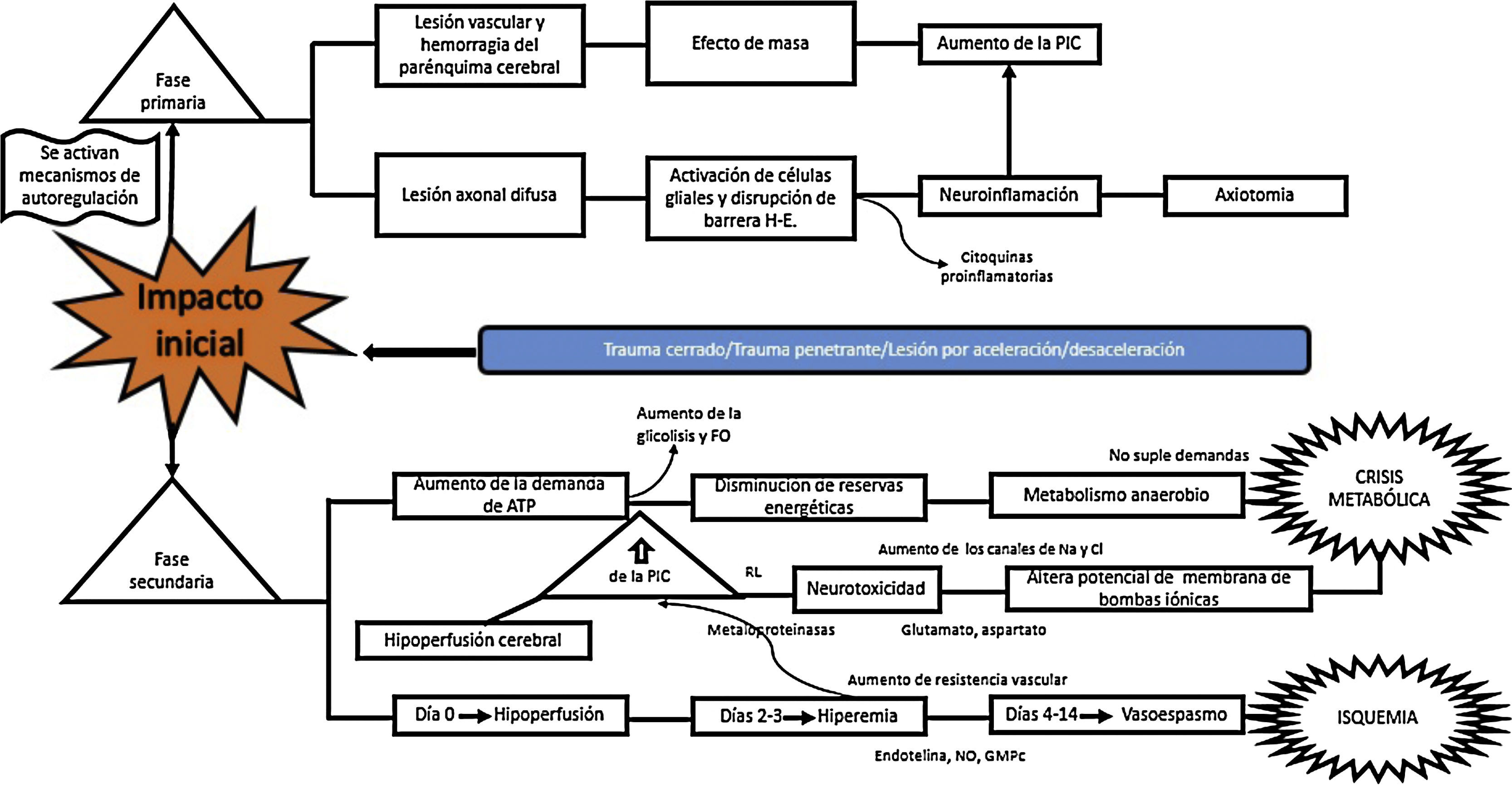
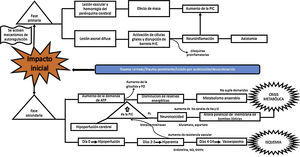
¿Cuál es el mecanismo fisiopatológico por el cual hay daño en el TEC?El TEC produce unas lesiones que se dividen en 2grandes fases, que son dependientes del tiempo de evolución de la lesión. La fase primaria es el insulto inmediato al impacto mecánico, que genera traumatismo vascular y hemorragia del parénquima cerebral, con subsecuente lesión neuronal por efecto de masa y aumento de la presión intracraneana (PIC). La lesión neuronal lleva a degeneración axonal, por disrupción del citoesqueleto, lo que produce daño axonal difuso, que lleva a desconexión axonal, activación de las células gliales quiescentes y que genera neuroinflamación masiva tanto axonal como del parénquima cerebral. Este proceso ocasiona activación glial y migración de citocinas proinflamatorias, derivada de una disrupción de la barrera hematoencefálica. Todo este proceso termina en disbalance en la homeostasis de neurotransmisores, degeneración axonal y muerte celular10-12 (fig. 2).
Patogénesis de la TBI11-21
Canales de Na y Cl: Canales de Sodio y Cloro; FO: Fosforilación oxidativa; NO: Óxido Nítrico; PIC: Presión Intra Craneal; RL: Radicales Libres.
Fuente: Autores.
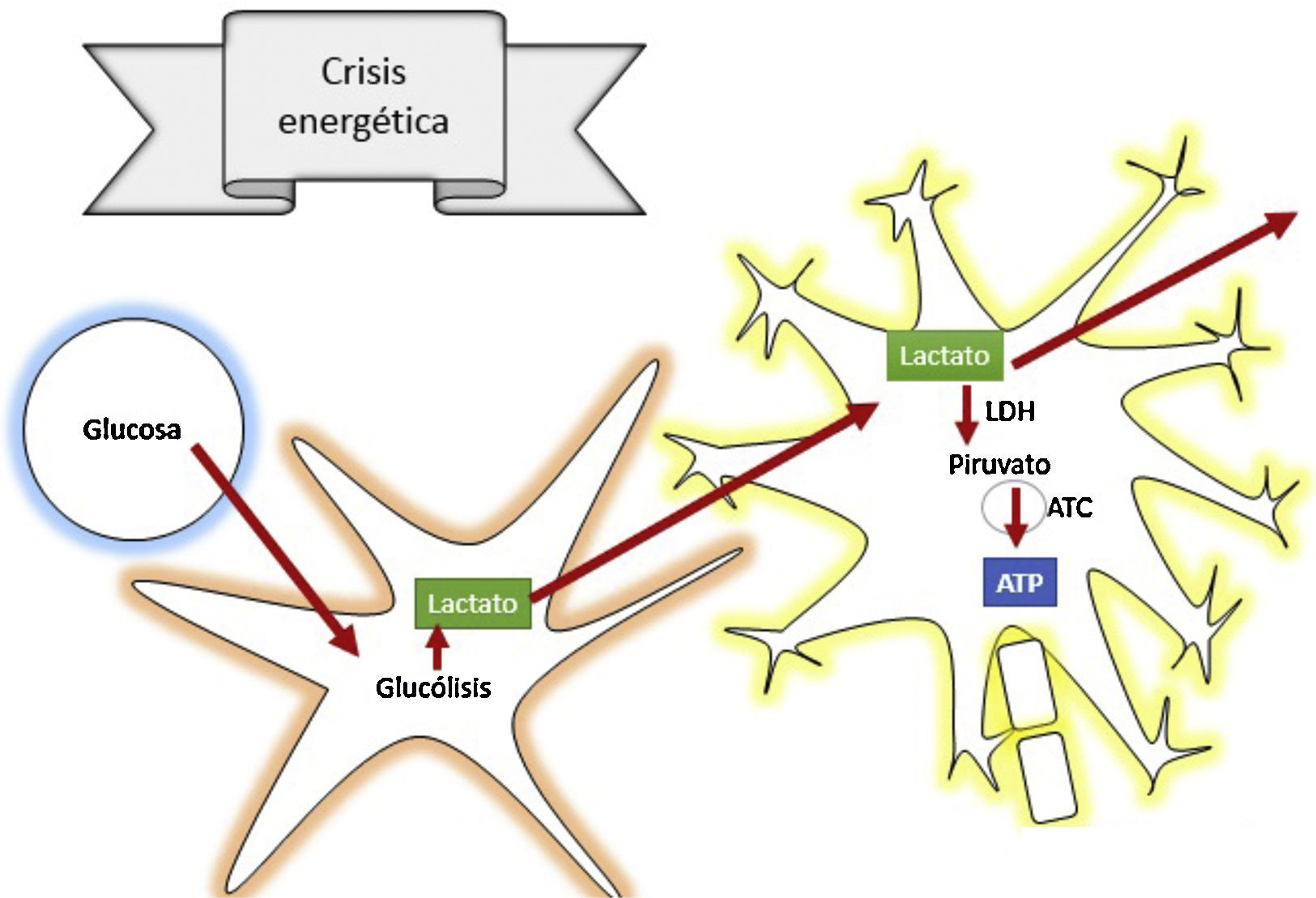
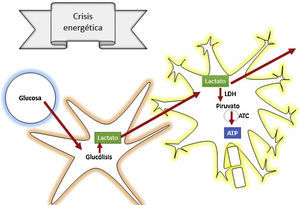
La fase secundaria consiste en alteración de la homeostasis de diversos mecanismos intrínsecos de autorregulación cerebral13. La falla energética es una de las principales alteraciones que surge posterior al TEC, ocasionada por los altos requerimientos de energía necesarios para suplir las demandas generadas en el trauma. Por tanto, inicialmente se incrementa la fosforilación oxidativa y la glucólisis, con el objetivo de compensar el déficit energético hasta consumir las reservas de ATP. Después se inicia la producción de metabolismo anaerobio hasta que este se torna insuficiente, lo que lleva a depleción de las reservas de energía y genera estrés metabólico y muerte celular14,15 (fig. 3).
La grave falla metabólica citada lleva a alteración de las bombas iónicas, con incremento de su permeabilidad y alteración en el potencial de membrana, lo que causa redistribución de iones y neurotransmisores, con liberación masiva de glutamato a nivel presináptico y alteración en el equilibrio iónico de la membrana postsináptica16. Como consecuencia de ello, se genera mayor neurotoxicidad, formación de edema cerebral, aumento de la PIC e hipoperfusión cerebral17-20.
En cuanto a la homeostasis sanguínea, se conocen 3 etapas de cambios: empieza con una etapa de «hipoperfusión cerebral» que ocurre el día de la lesión, por acumulación progresiva de edema celular, y lleva a un aumento de la PIC de leve a moderada. Entre los días 2 y 3 hay una etapa de «hiperemia» que desencadena edema celular mayor. En esta etapa, el 40% de los pacientes tiene aumento vertiginoso de la PIC, con inicio de un periodo de «vasoespasmo» que se desarrolla desde las 96 h post-TEC hasta los 14 días del traumatismo, con posterior aumento de la resistencia vascular distal y estrechamiento en la microcirculación, que conlleva isquemia y empeora el grado de la lesión21.
¿Dónde debe impactar el manejo médico-farmacológico?Las guías de manejo referentes al TEC exponen como piedra angular disminuir las grandes repercusiones clínicas que tiene la lesión secundaria, tales como hipertensión endocraneana e hipoperfusión cerebral22-24. Si estas 2condiciones médicas no se manejan adecuadamente, llevan a un pronóstico sombrío25.
Uno de los estudios más importantes al respecto fue el metaanálisis realizado por Stein et al.26, en el que se demostró que aquellos pacientes a los que se les monitorizó la PIC presentaron una tasa de mortalidad un 12% menor y un 6% de mejor pronóstico neurológico comparados con los que no fueron monitorizados. Farahvar et al. demostraron que, al tener como objetivo de tratamiento una terapia guiada a monitorizar la PIC y disminuir los episodios de hipertensión endocraneana (definida como aumento de la PIC que sobrepasa los 25mmHg), se logra disminuir un 64% el riesgo de morir a las 2 semanas de ocurrido el evento, frente a quienes no se les monitorizó la PIC, pero sí tuvieron manejo para disminuirla27.
Se ha visto que el factor independiente más importante en el pronóstico del paciente es la PIC mayor a 20mmHg28-30. Como lo demuestra un estudio de 846 casos en el que se evaluaron: el score de Glasgow, edad, hipoxia, respuesta pupilar, presencia de hipertermia e incremento de la PIC, y en el que la condición clínica que tuvo los datos más consistentes —en cuanto a mejor pronóstico, menor déficit severo y menor mortalidad— estaba dada por la PIC menor de 20mmHg31, lo que corrobora que el factor de mayor importancia en pacientes que han presentado un TEC es prevenir que haya ascensos de la PIC, lo que disminuye la morbimortalidad32,33.
¿De dónde surge el lactato hipertónico como mediador químico en el manejo del TEC?Múltiples revisiones se han realizado en los últimos años para investigar otras alternativas de manejo en el TEC, en las que se ha encontrado una dicotomía entre el uso de cristaloides vs. coloides. Al evaluar la mortalidad total en el manejo con líquidos intravenosos en pacientes con trauma, quemados o en estados posquirúrgicos, los coloides tienen un margen similar de mortalidad al de los cristaloides34. Además de ello, se ha encontrado que con la administración de coloides sintéticos (gelatinas, dextranes, hidroxietil almidón) se genera: alteración en la homeostasis de la coagulación, disminución del factor VII, V111, von Willebrand y fibrinógeno, lo que causa alteración en la agregación eritrocitaria y plaquetaria, además de diferentes grados de reacciones de hipersensibilidad y deterioro de la función renal, de mayor magnitud en aquellas personas que presentan enfermedades renales preexistentes35,36.
Las soluciones hipoosmolares e isoosmolares no garantizan efecto osmótico37 como sí lo ejerce la solución salina hipertónica (SSH), sin embargo, al comparar el uso de SSH con otras soluciones (incluyendo manitol, solución salina 0,9%, lactato de Ringer, sodio hipertónico y soluciones hipoosmolares) para el manejo del TEC, no hubo diferencias en la tasa de mortalidad ni en el control de la PIC según el metaanálisis de Pelletier et al.38. A la fecha no hay estudios que comparen el SSH con el lactato sódico hipertónico.
Un estudio en humanos demostró que posterior al TEC se origina atrofia cerebral, principalmente de los lóbulos frontotemporales. Dicho hallazgo se asoció a déficit de atención, alteración en las habilidades operativas y psicomotoras a los 12 meses post-TEC. La atrofia cortical citada se desencadena por el desequilibrio energético-metabólico que causa el TEC; tales hallazgos señalan que con terapia farmacológica que module el daño metabólico se produce mejoría de los resultados neuropsicológicos a corto y mediano plazo39,40.
Por lo citado anteriormente, no solo se requiere el efecto osmótico para evitar el daño secundario causado por el TEC: se requiere de una solución que ofrezca efecto modulador del daño10,16,41,42. En este intento de buscar nuevas alternativas en el manejo del TEC aparece el concepto de las lanzaderas de lactato introducido por Pellerin y Magistretti en 199443: es el evento cumbre en el conocimiento del lactato como compuesto químico fundamental para desempeñar coordinación del metabolismo en diferentes tejidos44. Esta hipótesis invitó a múltiples autores a estudiar sobre el tema y a evaluar la veracidad de este postulado.
Uno de los hallazgos que motivó el estudio de este compuesto orgánico, como vía metabólica, fue el entendimiento de la fisiopatología del TEC, debido a que el lactato disminuye las repercusiones en el desequilibrio metabólico-oxidativo45-47 y origina atenuación del inicio de la cascada de daños41. Uno de los grandes aportes del lactato en el TEC es que se convierte en fuente de energía dinámica al desempeñarse como principal alternativa a la glucosa durante los periodos de estrés del metabolismo celular cerebral48.
¿Cómo actúa el lactato para prevenir la lesión cerebral secundaria?De acuerdo con la teoría de las lanzaderas astrocito-neuronales, se propone que los astrocitos utilizan la glucólisis para producir lactato, el cual ingresa a las neuronas a través de transportadores de monocarboxilato, y allí se convierte en piruvato a través de la enzima lactato deshidrogenasa para entrar al metabolismo oxidativo y producir energía42. Es el lactato un precursor fundamental del metabolismo anaerobio, como también del aerobio.
Uno de los primeros intentos de evaluar la eficacia del lactato para el manejo del TEC se efectuó en modelos animales, en los que se demostró menor muerte celular, menor atrofia hemisférica, así como disminución en la extensión de la lesión cerebral y mejoría en los resultados neurológicos en aquellos tratados con lactato49-51.
En el cerebro humano, el incremento del lactato (dentro de un rango fisiológico) disminuyó sustancialmente la concentración de catecolaminas, hormona del crecimiento, cortisol, respuestas sintomáticas a la hipoglucemia y bajó el nivel de glucosa en el que inició la hipoglucemia52, al usarse como fuente de energía alternativa.
El lactato es oxidado en el cerebro, aporta el 8% de los requerimientos de energía53 y, en situaciones suprafisiológicas, puede aportar más del 60%54, evitando así el daño cerebral inducido por bajos niveles de glucosa y el incremento del área de penumbra cerebral55. También se estableció que el lactato actúa inhibiendo las vías excitatorias dependientes del glutamato, lo que amplía el efecto de neuroprotección en la cascada de daño propuesta en la fisiopatología del TEC56.
«El transporte de lactato del astrocito a la neurona es esencial para la plasticidad sináptica y la memoria a largo plazo, así como para atenuar los cambios moleculares y sinápticos subyacentes»57,58, por ejemplo, durante periodos de estrés, la caída del O2, el aumento del lactato extracelular y la adenosina promueven vasodilatación mediada por astrocitos y mejoran los resultados a largo plazo59,60. Los beneficios citados no solo son un postulado, pues se vieron representados en modelos animales en los que se aplicó terapia con lactato hipertónico posterior a un TEC, y en los que se observó que hubo una mejoría significativa en las habilidades cognitivas y en la plasticidad neuronal comparados con aquellos modelos a escala que fueron manejados con solución salina61,62.
El lactato sódico hipertónico también ejerce potencial terapéutico al generar «disminución de la inflamación cerebral y restauración de la barrera hematoencefálica gracias a su propiedad de reducir la activación endotelial y ser equivalente a un anión metabolizable (que produce egreso de cloro de las células endoteliales hacia la vasculatura). Con base en su acción hipertónica produce un balance neutro de líquidos, un requerimiento menor de hemoderivados y, así, un menor riesgo de coagulopatía inducida»45.
¿Que beneficios ha otorgado el lactato sódico hipertónico?En un estudio desarrollado en humanos de carácter multicéntrico que involucró a 60 pacientes, se encontró que aquellos tratados por 48 h con terapia de lactato sódico hipertónico tuvieron menor número en ascensos de la PIC, comparados con los pacientes tratados con solución salina al 0,9% (36 vs. 66% de ascensos en la PIC, respectivamente). También se observó que los pacientes tratados con lactato sódico hipertónico tuvieron mejor gasto urinario y también un mejor balance de líquidos. Este estudio no encontró mejoría neurológica a los 6 meses del TEC63, pero muestra su efecto promisorio en el control del número de ascensos de la PIC, que por sí sola es marcador independiente de pronóstico sombrío, después de un TEC.
Otro estudio, que involucró a 17 pacientes tratados con lactato sódico hipertónico y a otros 17 tratados con manitol, estadificó la disminución de la PIC mediante técnicas invasivas, con una disminución de la PIC a la cuarta hora del inicio de los líquidos intravenosos de −5,9±1mmHg en aquellos tratados con lactato sódico hipertónico, versus −3,2±0,9mmHg en los pacientes tratados con manitol64, lo que indica una disminución más prolongada y pronunciada en el primer grupo. Otra ventaja encontrada con el uso del lactato sódico hipertónico es que la presión de perfusión es mayor que la de los pacientes manejados con manitol.
Un hallazgo importante ofrecido por el lactato sódico hipertónico es el efecto terapéutico dependiente de la dosis. Esto fue evidenciado con modelos animales, en los que se demostró que con una dosis excesiva se creaba daño celular por inflamación y, a bajas dosis, se producía modulación del daño celular. Sin embargo, es necesario que se estudie más este tema en humanos para corroborar los potenciales beneficios encontrados a la fecha en modelos in vitro y en animales65, ya que los únicos ensayos clínicos en humanos son los ya mencionados en el artículo.
ConclusiónAl ser el TEC un gran problema de salud pública, los esfuerzos por hallar mejores desenlaces clínicos han llevado a buscar nuevas alternativas en el manejo, derivadas del entendimiento de la fisiopatología. De allí surge el lactato sódico hipertónico como terapia prometedora en el manejo del TEC, pues se logró demostrar su potencial benéfico en los efectos endocrino-metabólicos moduladores del daño cerebral secundario. Igualmente se demostró la efectividad del lactato en la modulación del tono vascular cerebral al actuar como vasodilatador, estabilizador de membrana, regulador del transporte activo, balance de líquidos y reserva funcional energética, y convertirse en fuente de carbono alternativa. También se encontraron beneficios en las repercusiones cognitivas posteriores al TEC, lo cual indica que podría ser una terapia efectiva para mejorar los resultados a corto y largo plazo e impactar en la morbimortalidad. Son necesarios estudios a mayor escala realizados en humanos que utilicen lactato sódico hipertónico, que corroboren los resultados promisorios encontrados en animales. De la misma forma, se requiere de ensayos clínicos que comparen mortalidad y resultados neurológicos a largo plazo con respecto a solución salina hipertónica, dado que no existen estudios que comparen estos 2modelos de tratamiento.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.