Los teratomas cardiacos son tumores benignos aunque la mitad de los fetos afectos por ellos mueren intraútero debido a taponamiento cardiaco e hidropesía fetal. En algunos casos se ha documentado una mejoría del pronóstico fetal tras el drenaje intrauterino de la efusión pericárdica.
Exponemos un caso de teratoma cardiaco diagnosticado en la semana 30 de embarazo con signos de taponamiento cardiaco que fue tratado intraútero de forma percutánea mediante ablación láser de la lesión bajo control ecográfico y pericardiocentesis. El feto nació mediante cesárea electiva en la semana 35 realizándose cirugía resectiva tumoral postnatalmente.
La ablación láser de la lesión puede enlentecer el crecimiento tumoral y la re- acumulación de líquido pericárdico.
Cardiac teratomas are benign tumors, but in about half of affected fetuses there is intrauterine death due to cardiac tamponade and hydrops. In some cases there have been apparent improvements in prognosis after intrauterine drainage of the pericardial effusion.
We report a case of cardiac teratoma presenting at 30 weeks gestation with cardiac tamponade, treated by ultrasound-guided laser ablation of the teratoma and pericardiocentesis. The infant was born at 35 weeks gestation and survived after post-natal tumor resection.
Laser ablation of the tumor might slow down the growth and the re-accumulation of pericardial effusion.
Los teratomas son los tumores más comunes en el feto y recién nacido. Son tumores embrionarios que proceden de al menos 2 de las 3 capas germinales en un estadio precoz del desarrollo1. Las zonas de localización más comunes son el área sacrococcígea, ovarios o testículos, y menos frecuentemente pueden encontrarse en retroperitoneo, mediastino, paladar, cráneo u otras partes fetales2.
El teratoma cardiaco tiene una prevalencia al nacimiento de 1 en 40.000 casos, se origina del miocardio o pericardio atrial o ventricular y crece en la cavidad pericárdica3.
La mayoría de los teratomas cardiacos son benignos y no se asocian a otras anomalías cardiacas o extracardiacas, pero debido a su localización intrapericárdica y a su crecimiento rápido, pueden producir compresión y alteración de la función cardiaca causando taponamiento cardiaco, hidropesía o muerte fetal. Además puede causar compresión intratorácica e hipoplasia pulmonar4.
El diagnóstico frecuentemente suele ser en el periodo prenatal, durante la ecografía de rutina o por referencia a un centro especializado debido a hidropesía fetal5. El diagnóstico ecográfico prenatal se basa en la demostración de la masa intratorácica bien definida y generalmente con componente quístico y crecimiento pericárdico, asociada a un importante derrame pericárdico6.
El diagnóstico diferencial incluye la malformación adenomatoidea quística del pulmón, el secuestro pulmonar, quiste broncogénico, teratoma mediastínico, aneurisma ventricular y otros tumores cardiacos incluyendo el rabdomioma, linfangioma, fibroma, mixoma y hemangioma7. La presencia de derrame pericárdico se ha asociado más comúnmente con teratomas que con otro tipo de tumores cardiacos6.
Preferiblemente el parto debería ser mediante cesárea electiva, ya que un aumento rápido de presión por compresión en el parto vaginal podría causar un taponamiento cardiaco y muerte fetal. Estaría indicada una resección quirúrgica postnatal temprana para evitar el desarrollo de fallo cardiaco5,8 y para evitar aparición de metástasis en una posible lesión tumoral maligna. La resección es curativa en ausencia de complicaciones quirúrgicas.
Caso clínicoEmbarazada de 22 años, primigrávida, referida en semana 30+4 de embarazo con el diagnóstico de tumor cardiaco.
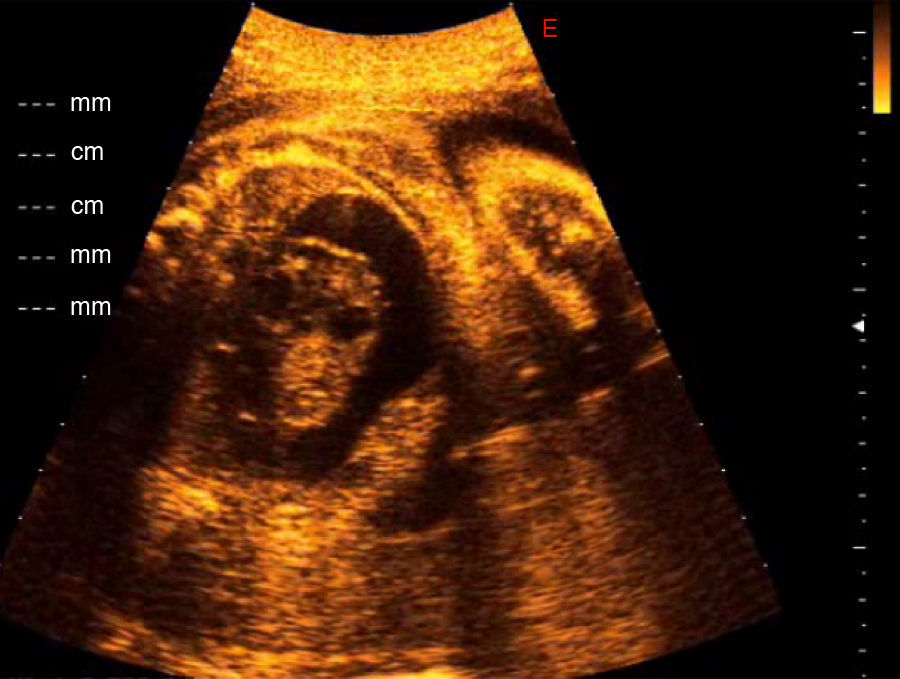
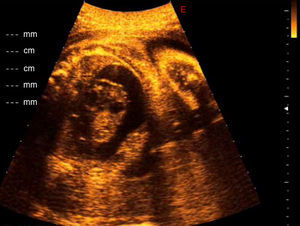
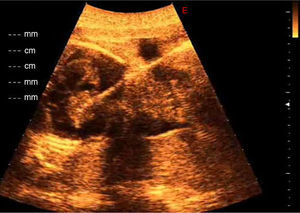
En la ecografía se confirmó el posible diagnóstico de teratoma cardiaco al observar una masa de crecimiento pericárdico de 25×30mm con múltiples componentes quísticos y calcificaciones en su interior, creciendo hacia el pericardio desde la parte externa de la aurícula derecha y asociada a derrame pericárdico severo con 15mm de diámetro máximo de líquido pericárdico y signos de taponamiento cardiaco por colapso diastólico de las paredes de la aurícula derecha (fig. 1).
El crecimiento fetal era acorde, la placenta normalmente inserta, el líquido amniótico normal y no había otras malformaciones fetales asociadas.
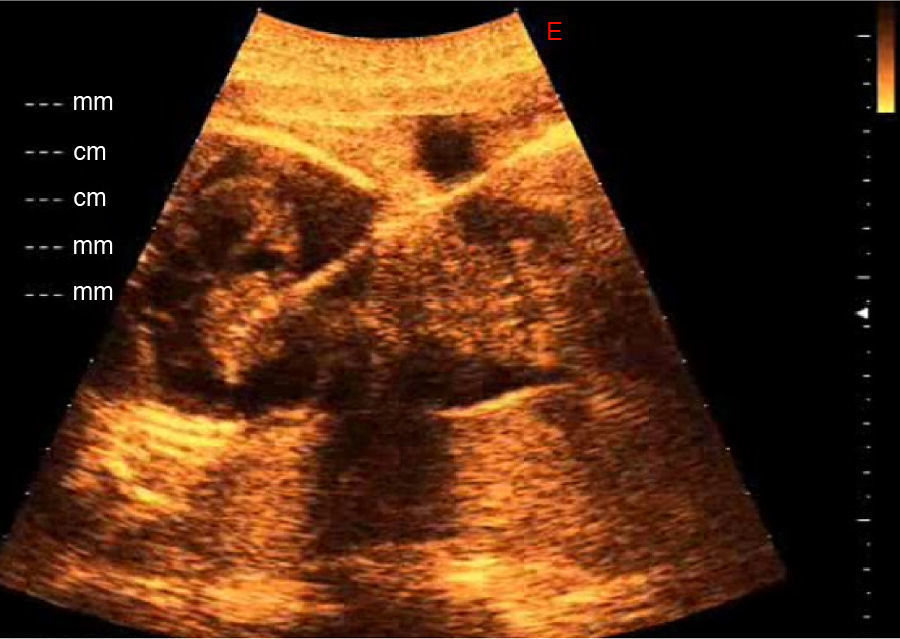
Tras consentimiento informado, se realizó una ablación láser percutánea de la lesión tumoral mediante control ecográfico y una pericardiocentesis. El procedimiento se realizó bajo anestesia local materna con lidocaína y anestesia fetal tras inyección intramuscular de atropina, vencuronio y fentanilo. Mediante control ecográfico guiamos una aguja de 18 Gauge a través del abdomen materno hasta la lesión tumoral y a través de ella pasamos una fibra de láser diodo de 400nm (Intermedic, Barcelona, España) y realizamos ablación tumoral de un área de tumor de 20mm en la base de su inserción en el atrio derecho usando una potencia de 25 W de energía, mediante 4 pulsos de 4 s cada uno. En el mismo procedimiento realizamos una pericardiocentesis de 80ml de líquido con aspecto seroso (fig. 2).
El cariotipo fetal fue normal y el análisis del líquido pericárdico fue negativo para células malignas.
A la semana el tamaño tumoral se redujo a 20×25mm, principalmente debido a la ablación de los quistes tumorales, no había derrame pericárdico y la función cardiaca era normal.
En una ecografía de seguimiento se comprobó la aparición del líquido pericárdico 3 semanas tras el procedimiento y se repitió la pericardiocentesis extrayendo 60ml de líquido seroso.
En la semana 35 de gestación el tumor medía 41×42mm, el derrame pericárdico reapareció y se decidió cesárea electiva naciendo una niña de 2.540g y Apgar 5-8. En la ecocardiografía postnatal las medidas tumorales eran similares y se realizó una nueva pericardiocentesis de 75ml. La cirugía de resección tumoral se realizó con éxito tras 6 días de vida.
El estudio de anatomía patológica confirmó la presencia de un teratoma pericárdico inmaduro con componentes sólidos y quísticos, sin invasión a estructuras adyacentes.
Al año de vida la niña presentaba un desarrollo neuromotor y una función cardiaca dentro de la normalidad y no presentaba evidencias de recurrencia tumoral.
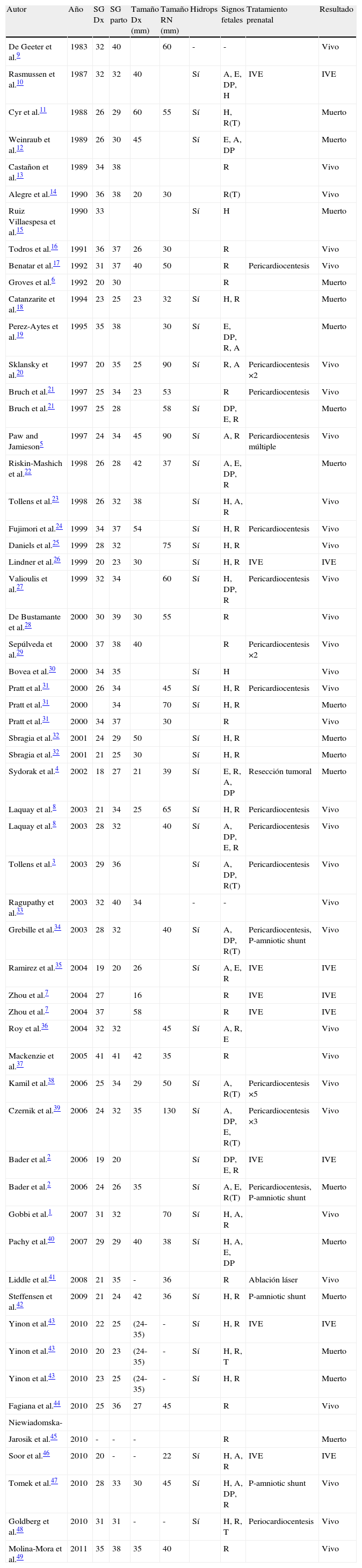
Discusión y revisión de la literaturaMediante una búsqueda en Pubmed, hemos detectado 58 casos de teratoma cardiaco diagnosticados prenatalmente y publicados en lengua inglesa desde el primer caso reportado por De Geeter et al.9 en el año 1983. La edad gestacional media al diagnóstico fue de 27,5 semanas con rango entre las 18 y 41 semanas y la edad media al parto de 32 semanas con rango entre la 25 y 42 semanas, 13 de los casos parieron a término.
En 20 de los casos se realizaron intervenciones intrauterinas (34,5%), incluyendo 14 casos de pericardiocentesis, 4 casos de colocación de drenajes pericárdico-amnióticos, uno de resección tumoral intraútero mediante cirugía fetal abierta y toracotomía fetal y otro publicado tras nuestra intervención que realizó de igual forma ablación láser tumoral percutánea (tabla 1).
Revisión de la literatura inglesa sobre los casos de teratoma cardiaco diagnosticados prenatalmente. Características clínicas y resultado del embarazo
| Autor | Año | SG Dx | SG parto | Tamaño Dx (mm) | Tamaño RN (mm) | Hidrops | Signos fetales | Tratamiento prenatal | Resultado |
| De Geeter et al.9 | 1983 | 32 | 40 | 60 | - | - | Vivo | ||
| Rasmussen et al.10 | 1987 | 32 | 32 | 40 | Sí | A, E, DP, H | IVE | IVE | |
| Cyr et al.11 | 1988 | 26 | 29 | 60 | 55 | Sí | H, R(T) | Muerto | |
| Weinraub et al.12 | 1989 | 26 | 30 | 45 | Sí | E, A, DP | Muerto | ||
| Castañon et al.13 | 1989 | 34 | 38 | R | Vivo | ||||
| Alegre et al.14 | 1990 | 36 | 38 | 20 | 30 | R(T) | Vivo | ||
| Ruiz Villaespesa et al.15 | 1990 | 33 | Sí | H | Muerto | ||||
| Todros et al.16 | 1991 | 36 | 37 | 26 | 30 | R | Vivo | ||
| Benatar et al.17 | 1992 | 31 | 37 | 40 | 50 | R | Pericardiocentesis | Vivo | |
| Groves et al.6 | 1992 | 20 | 30 | R | Muerto | ||||
| Catanzarite et al.18 | 1994 | 23 | 25 | 23 | 32 | Sí | H, R | Muerto | |
| Perez-Aytes et al.19 | 1995 | 35 | 38 | 30 | Sí | E, DP, R, A | Muerto | ||
| Sklansky et al.20 | 1997 | 20 | 35 | 25 | 90 | Sí | R, A | Pericardiocentesis ×2 | Vivo |
| Bruch et al.21 | 1997 | 25 | 34 | 23 | 53 | R | Pericardiocentesis | Vivo | |
| Bruch et al.21 | 1997 | 25 | 28 | 58 | Sí | DP, E, R | Muerto | ||
| Paw and Jamieson5 | 1997 | 24 | 34 | 45 | 90 | Sí | A, R | Pericardiocentesis múltiple | Vivo |
| Riskin-Mashich et al.22 | 1998 | 26 | 28 | 42 | 37 | Sí | A, E, DP, R | Muerto | |
| Tollens et al.23 | 1998 | 26 | 32 | 38 | Sí | H, A, R | Vivo | ||
| Fujimori et al.24 | 1999 | 34 | 37 | 54 | Sí | H, R | Pericardiocentesis | Vivo | |
| Daniels et al.25 | 1999 | 28 | 32 | 75 | Sí | H, R | Vivo | ||
| Lindner et al.26 | 1999 | 20 | 23 | 30 | Sí | H, R | IVE | IVE | |
| Valioulis et al.27 | 1999 | 32 | 34 | 60 | Sí | H, DP, R | Pericardiocentesis | Vivo | |
| De Bustamante et al.28 | 2000 | 30 | 39 | 30 | 55 | R | Vivo | ||
| Sepúlveda et al.29 | 2000 | 37 | 38 | 40 | R | Pericardiocentesis ×2 | Vivo | ||
| Bovea et al.30 | 2000 | 34 | 35 | Sí | H | Vivo | |||
| Pratt et al.31 | 2000 | 26 | 34 | 45 | Sí | H, R | Pericardiocentesis | Vivo | |
| Pratt et al.31 | 2000 | 34 | 70 | Sí | H, R | Muerto | |||
| Pratt et al.31 | 2000 | 34 | 37 | 30 | R | Vivo | |||
| Sbragia et al.32 | 2001 | 24 | 29 | 50 | Sí | H, R | Muerto | ||
| Sbragia et al.32 | 2001 | 21 | 25 | 30 | Sí | H, R | Muerto | ||
| Sydorak et al.4 | 2002 | 18 | 27 | 21 | 39 | Sí | E, R, A, DP | Resección tumoral | Muerto |
| Laquay et al.8 | 2003 | 21 | 34 | 25 | 65 | Sí | H, R | Pericardiocentesis | Vivo |
| Laquay et al.8 | 2003 | 28 | 32 | 40 | Sí | A, DP, E, R | Pericardiocentesis | Vivo | |
| Tollens et al.3 | 2003 | 29 | 36 | Sí | A, DP, R(T) | Pericardiocentesis | Vivo | ||
| Ragupathy et al.33 | 2003 | 32 | 40 | 34 | - | - | Vivo | ||
| Grebille et al.34 | 2003 | 28 | 32 | 40 | Sí | A, DP, R(T) | Pericardiocentesis, P-amniotic shunt | Vivo | |
| Ramirez et al.35 | 2004 | 19 | 20 | 26 | Sí | A, E, R | IVE | IVE | |
| Zhou et al.7 | 2004 | 27 | 16 | R | IVE | IVE | |||
| Zhou et al.7 | 2004 | 37 | 58 | R | IVE | IVE | |||
| Roy et al.36 | 2004 | 32 | 32 | 45 | Sí | A, R, E | Vivo | ||
| Mackenzie et al.37 | 2005 | 41 | 41 | 42 | 35 | R | Vivo | ||
| Kamil et al.38 | 2006 | 25 | 34 | 29 | 50 | Sí | A, R(T) | Pericardiocentesis ×5 | Vivo |
| Czernik et al.39 | 2006 | 24 | 32 | 35 | 130 | Sí | A, DP, E, R(T) | Pericardiocentesis ×3 | Vivo |
| Bader et al.2 | 2006 | 19 | 20 | Sí | DP, E, R | IVE | IVE | ||
| Bader et al.2 | 2006 | 24 | 26 | 35 | Sí | A, E, R(T) | Pericardiocentesis, P-amniotic shunt | Muerto | |
| Gobbi et al.1 | 2007 | 31 | 32 | 70 | Sí | H, A, R | Vivo | ||
| Pachy et al.40 | 2007 | 29 | 29 | 40 | 38 | Sí | H, A, E, DP | Muerto | |
| Liddle et al.41 | 2008 | 21 | 35 | - | 36 | R | Ablación láser | Vivo | |
| Steffensen et al.42 | 2009 | 21 | 24 | 42 | 36 | Sí | H, R | P-amniotic shunt | Muerto |
| Yinon et al.43 | 2010 | 22 | 25 | (24-35) | - | Sí | H, R | IVE | IVE |
| Yinon et al.43 | 2010 | 20 | 23 | (24-35) | - | Sí | H, R, T | Muerto | |
| Yinon et al.43 | 2010 | 23 | 25 | (24-35) | - | Sí | H, R | Muerto | |
| Fagiana et al.44 | 2010 | 25 | 36 | 27 | 45 | R | Vivo | ||
| Niewiadomska- | |||||||||
| Jarosik et al.45 | 2010 | - | - | - | R | Muerto | |||
| Soor et al.46 | 2010 | 20 | - | - | 22 | Sí | H, A, R | IVE | IVE |
| Tomek et al.47 | 2010 | 28 | 33 | 30 | 45 | Sí | H, A, DP, R | P-amniotic shunt | Vivo |
| Goldberg et al.48 | 2010 | 31 | 31 | - | - | Sí | H, R, T | Periocardiocentesis | Vivo |
| Molina-Mora et al.49 | 2011 | 35 | 38 | 35 | 40 | R | Vivo |
A: ascitis; DP: derrame pleural; Dx: diagnóstico; E: edema; H: hidrops; P-amniotic shunt: shunt pericárdico-amniótico; Pn: postnatal; R: derrame pericárdico; T: taponamiento cardiaco.
En 40 de los 56 casos (71,4%) donde se comentan con detalle los hallazgos fetales, el teratoma se asoció con hidropesía fetal. En estos casos, las opciones de manejo fueron: 6 interrupciones voluntarias del embarazo, 16 tratamientos prenatales y 18 casos fueron manejados de forma expectante. En el grupo con intervención prenatal, sobrevivieron 13 fetos (81,3%) y solo 5 casos (27,8%) de los manejados de forma expectante.
De los 16 casos donde se reporta con detalle la ecografía fetal y no especificaron hidrops fetal, hubo 2 interrupciones voluntarias del embarazo, 4 casos con terapia prenatal en los que hubo una supervivencia de los 4 casos (100%) y 10 casos manejados de forma expectante donde la supervivencia fue de 8 casos (80%).
El manejo del teratoma pericárdico se basa según la literatura en la edad gestacional al diagnóstico y en la presencia de hidrops fetal37,39. Cuando el derrame pericárdico es severo, las opciones son parto mediante cesárea si el feto es maduro o pericardiocentesis seriadas como estrategia para prolongar el embarazo y conseguir maduración fetal antes del parto16,17.
Benatar et al.17 fue el primero en señalar la importancia del derrame pericárdico para prevenir la muerte intrauterina. Debido a la rápida reaparición de la efusión tras el drenaje, Paw et al.5 propusieron pericardiocentesis múltiples, y Sepúlveda et al.29 sugirieron pericardiocentesis sistemáticas para prevenir complicaciones neonatales cardiorrespiratorias, permitiendo una cirugía cardiotorácica postnatal planeada en lugar de urgente. Para evitar pericardiocentesis seriadas, Grebille34 and Bader2 propusieron la colocación de un drenaje pericárdico-amniótico.
Aunque un 75% de los teratomas son maduros en el estudio histológico33, en nuestro caso la histología confirmó que se trataba de un teratoma inmaduro.
Las ecografías seriadas de control en los casos publicados han demostrado que los tumores pericárdicos crecen rápidamente desde la semana 20 hasta la 40 de embarazo5,39 y en particular cuando las células son inmaduras como en nuestro caso. La tasa de crecimiento promedio del tumor en los casos publicados con todos los detalles fue de 3,7mm/semana y tras la ablación láser en nuestro caso el crecimiento fue de 2mm a la semana.
La ablación láser percutánea intrauterina mediante control ecográfico es un tratamiento que ha demostrado tener éxito en ciertos casos de malformación adenomatoidea quística o secuestro pulmonar reduciendo el tamaño de la lesión tumoral y el derrame pleural asociado50.
Basados en esas experiencias previas, realizamos la ablación láser del teratoma cardiaco en este feto de 30 semanas junto con una pericardiocentesis con aguja guiada por ecografía. La intención era enlentecer el crecimiento tumoral, prevenir la aparición de hidropesía fetal y prevenir la rápida reacumulación del líquido pericárdico mediante la ablación y colapso de los quistes, cuya ruptura al pericardio es una de las causas de reacumulación del líquido tras pericardiocentesis. En nuestro caso observamos una menor tasa de crecimiento tumoral en comparación con los casos publicados en la literatura, que en histología son mayoritariamente benignos, al contrario que el nuestro, y la disminución en la recidiva del derrame pericárdico que tras la ablación láser tardó 3 semanas en reaparecer.
La terapia láser percutánea eco-guiada es un procedimiento experimental que merece ser considerado como tratamiento fetal en casos de teratomas pericárdicos ya que puede retrasar el crecimiento tumoral y prevenir las recidivas del derrame pericárdico.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.