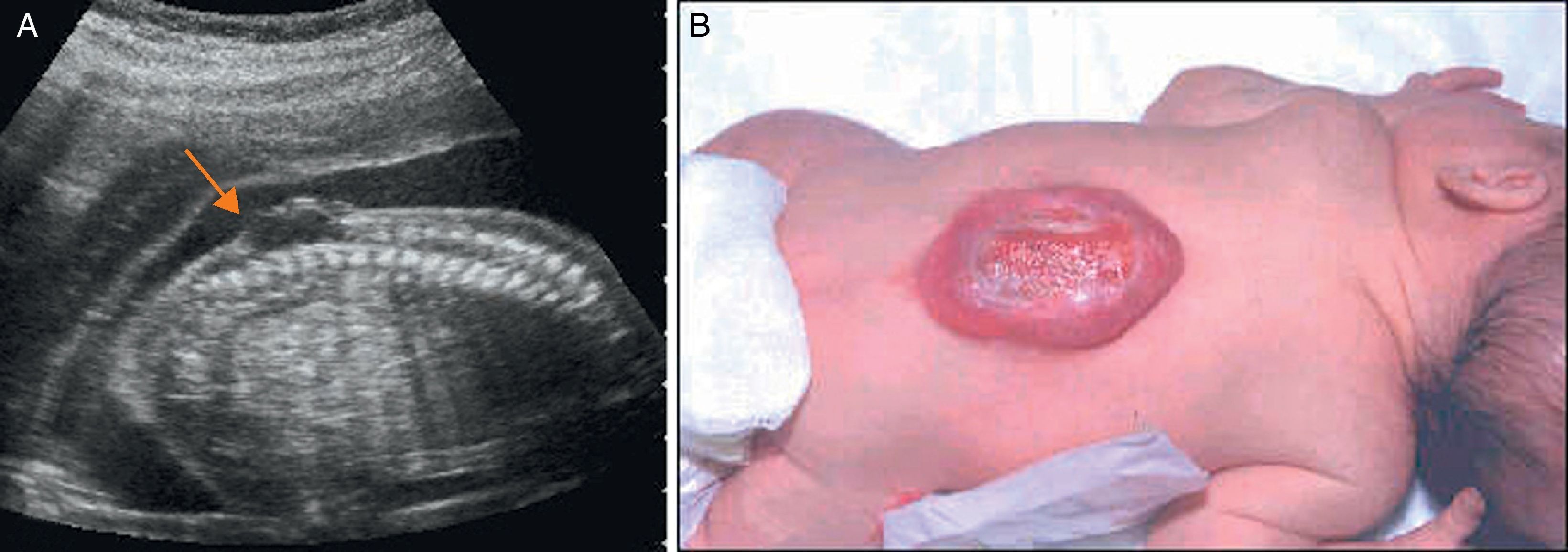
El mielomeningocele es la malformación congénita, dentro de los defectos del tubo neural, más grave compatible con la vida. El diagnóstico prenatal suele realizarse en la ecografía morfológica aunque recientemente se han descrito marcadores precoces de primer trimestre. En 2011 se publicó el estudio Management of Mielomeningocele Study (MOMS), estudio aleatorizado comparando los fetos operados prenatalmente con los operados postnatalmente. Los resultados mostraron la reducción de la necesidad de derivaciones ventrículo-peritoneales y una mejoría de la función motora con la intervención prenatal sin reportar una importante morbilidad materna.
Desde hace años, en el Hospital Universitari Vall d’Hebron se está trabajando en experimentación animal, inicialmente mediante la creación de un modelo animal de mielomeningocele y posteriormente de diferentes técnicas de reparación. Esta investigación traslacional ha sido aplicada a la práctica clínica. Desde el año 2010 se ofrece un programa multidisciplinar de cirugía prenatal del mielomeningocele.
Myelomeningocele is the most severe congenital malformation among neural tube defects that are compatible with life. Although prenatal diagnosis is usually performed with the 20-22nd week scan, early first trimester markers have been recently described. Management of Myelomeningocele Study (MOMS), a randomized study that compares the prenatally operated fetuses with those that were operated on post-natally, was published in 2011.The results showed a reduction in the need for peritoneal shunts and improved motor function with the prenatal intervention without reporting any significant maternal morbidity.
The Hospital Universitari Vall d’Hebron has been working on animal experimentation for many years. Initially, they created an animal model of myelomeningocele, and later on developed several repair techniques. This translational research has been applied to clinical practice. Since 2010, we have offered a multidisciplinary program of prenatal myelomeningocele surgery.
El mielomeningocele (MMC) es la malformación congénita, dentro de los defectos del tubo neural (DTN), más grave compatible con la vida. Su etiología es desconocida pero es reconocido su carácter multifactorial con una predisposición genética de tipo poligénico y en relación con déficit de ácido fólico. Se caracteriza por falta de cierre del arco posterior vertebral y exposición de la médula espinal que durante el embarazo contacta con el líquido amniótico y mantiene roce mecánico con las paredes uterinas. Afecta fundamentalmente al sistema nervioso central (SNC) con hidrocefalia y alteraciones cognitivas, malformación de Chiari II que no suele producir manifestaciones clínicas pero cuando éstas se presentan son devastadoras (disartria, alteraciones en la deglución, alteraciones respiratorias, etc.), vejiga e intestino neurógeno con incontinencia de esfínteres y al aparato locomotor con paraplejia sensitivo-motora de mayor o menor grado, en función del nivel neurológico de la lesión.
Desde hace unos 20 años se trabaja en su reparación intrauterina, para prevenir la hidrocefalia y la malformación de Chiari II y preservar la funcionalidad de las raíces nerviosas desprotegidas. La primera cirugía intrauterina en un MMC se realizó en 1997 en los Estados Unidos de América (EUA). Las primeras publicaciones1 ya comprobaban una disminución en la tasa de hidrocefalia y malformación de Chiari pero sin conseguir disminuir completamente las secuelas2–5. Este hecho unido a un grado no despreciable de morbilidad materna (rotura prematura de membranas, dehiscencia de sutura uterina, etc.) hizo que la cirugía prenatal fuera cuestionada. Por este motivo, desde 2002 se trabajó en el diseño de un ensayo clínico aleatorizado (Management of Mielomeningocele Study [MOMS])6 circunscrito a solo 4 hospitales en EUA, para comparar la evolución postnatal de fetos afectos de MMC: unos sometidos a corrección quirúrgica prenatal y otros a corrección quirúrgica postnatal. Se aleatorizaron 100 gestantes con feto afecto de MMC en cada grupo, con la idea inicial de realizar un seguimiento hasta los 5 años de vida. Sin embargo, un análisis interno realizado a los 30 meses fue tan favorable a la corrección quirúrgica prenatal, que obligó a la finalización del estudio antes de lo previsto. Fue publicado en el New England Journal of Medicine en marzo de 2011. Los resultados mostraron que los recién nacidos operados prenatalmente necesitaban menos derivaciones ventrículo-peritoneales sin reportar una importante morbilidad materna.
¿Qué influencia tuvo la corrección intraútero del MMC sobre la capacidad de deambulación? En los casos de cirugía prenatal la valoración motora postnatal de las extremidades inferiores fue mejor que la esperada según el nivel anatómico de falta de fusión del arcos posterior vertebral, mientras que en los casos de reparación postnatal, el nivel neurológico fue peor que el nivel de lesión anatómico. Este hecho unido a que el grupo de corrección postnatal presentaba niveles anatómicos de lesión más bajos (porcentaje significativamente superior de casos inferiores o iguales a L3) permitió a los autores concluir que la cirugía prenatal mejoraba los resultados motores a los 30 meses de vida.
Diagnóstico prenatalEl diagnóstico prenatal suele realizarse en la ecografía morfológica (alrededor de las 20 semanas).
En el segundo trimestre, el screening para la detección de un DTN es facilitado por la presencia de los signos del «limón» y de la «banana». El signo del «limón» se objetiva en el corte del diámetro biparietal y es debido al aplanamiento de los huesos frontales. El signo de la «banana» hace referencia a una forma anómala de los hemisferios cerebelosos que presentan una forma cóncava anteriormente y la cisterna magna se encuentra obliterada. Ambos signos son debidos a la herniación del cerebelo debida a la hipotensión a nivel del espacio subaracnoideo como consecuencia de la fuga de líquido cefalorraquídeo (LCR) a la cavidad amniótica.
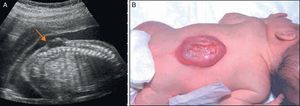
Cuando se sospecha un DTN debe realizarse un estudio pormenorizado de la columna. El defecto de la columna se visualiza por la falta de osificación posterior dando una forma de U, en un corte axial, a las vértebras afectas. En un plano medio sagital, se puede observar la falta de arcos posteriores pudiéndose visualizar la protusión de una imagen quística en los casos de MMC con saco (fig. 1). La primera vértebra afecta es la que establece el nivel anatómico de la lesión.
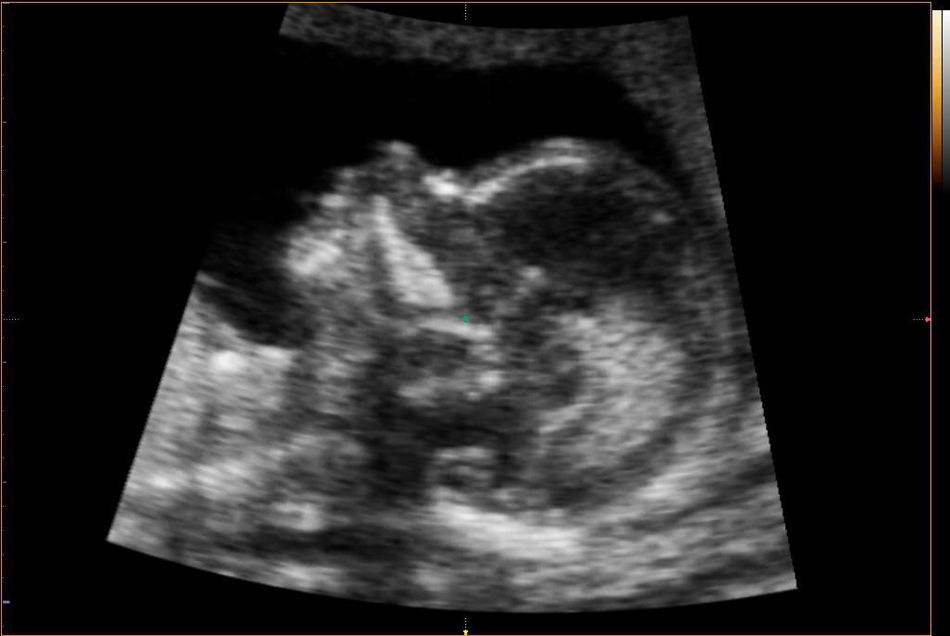
Recientemente se han descrito algunos marcadores precoces en la ecografía de las 11-13 semanas. Las alteraciones descritas a nivel de la fosa posterior en el segundo trimestre podrían manifestarse ya en el primer trimestre con la pérdida de la translucencia intracraneal (IT) en el corte medio-sagital utilizado para la medición de la translucencia nucal en el cribado de aneuploidías (Chaoui et al., 2010)7. Asimismo, se ha descrito el aumento del diámetro del tronco cerebral, la disminución de la distancia entre el tronco cerebral y el hueso occipital (correspondiente a la combinación del cuarto ventrículo y la cisterna magna) y el aumento de la fracción entre ambos (Lachmann et al., 2011)8 (fig. 2). Finalmente, a nivel del ángulo facial frontomaxilar (entre la parte superior del paladar y el hueso frontal en un corte medio-sagital) se ha observado una posible reducción debida al desplazamiento caudal de la frente respecto a la posición del final del maxilar (Lachmann et al., 2010)9.
La presencia de alguno de estos signos permite alertar de la posibilidad de existencia de un DTN pero si la visualización de la columna se ve limitada, deberá completarse el estudio en una edad gestacional más avanzada.
Experimentación animal en el Hospital Universitari Vall d’HebronDesde hace años, en el Hospital Universitari Vall d’Hebron se está trabajando en experimentación animal. Inicialmente mediante la creación de un modelo animal de MMC y posteriormente en su reparación. Se ha comprobado que modelos animales con MMC creado quirúrgicamente reproducen las malformaciones cerebrales que hallamos en el feto humano con espina bífida aperta10. Las malformaciones corticales y la hidrocefalia, además de la malformación de Chiari tipo II del cerebelo, son trastornos causados por la pérdida de líquido LCR fetal y se corrigen con la técnica de cierre prenatal del MMC11.
En un estudio experimental12 que hemos realizado en 15 fetos de ovejas con MMC lumbar creado quirúrgicamente en el día 75 de gestación, hemos evaluado la efectividad de una técnica de cobertura del defecto sin manipulación fetal mediante colocación de un parche fijado y sellado con un pegamento quirúrgico reabsorbible y biocompatible (técnica patch & sealant). Cinco fetos no fueron tratados. Diez se sometieron a la cobertura en el día 95 mediante esta técnica, sin sutura ni colgajos cutáneos o musculares. Todos los animales no tratados presentaron imposibilidad de caminar, incontinencia esfinteriana, defecto lumbar abierto, daño histológico de la médula espinal y una gran malformación de Chiari. Todos los animales tratados fueron capaces de caminar, tenían la continencia del esfínter, cierre casi total del defecto con regeneración de varias capas de tejidos en la zona lumbar y una mínima de malformación de Chiari. Así, este método de cobertura simple, rápido y poco invasivo con un parche sellado evita la manipulación del tejido fetal y permite el cierre adecuado de los DTN, proporcionando la regeneración de varias capas de tejido que protegen la médula espinal, y de manera significativa la reducción de malformación de Chiari II.
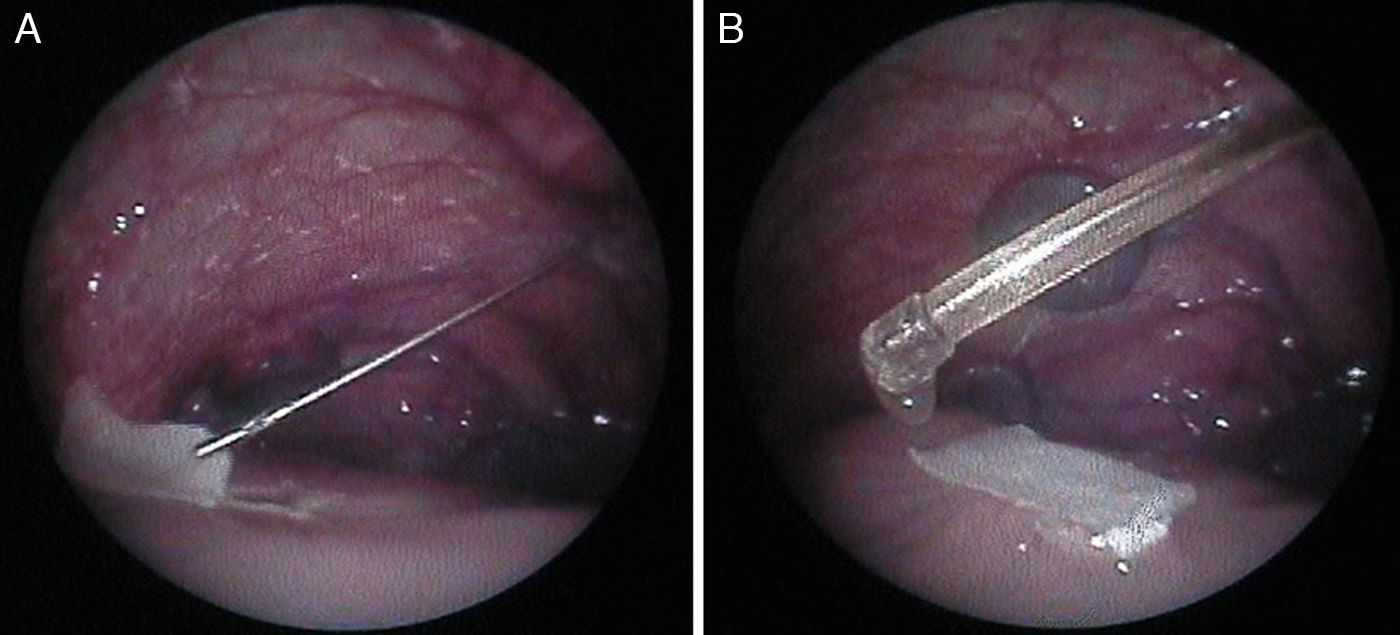
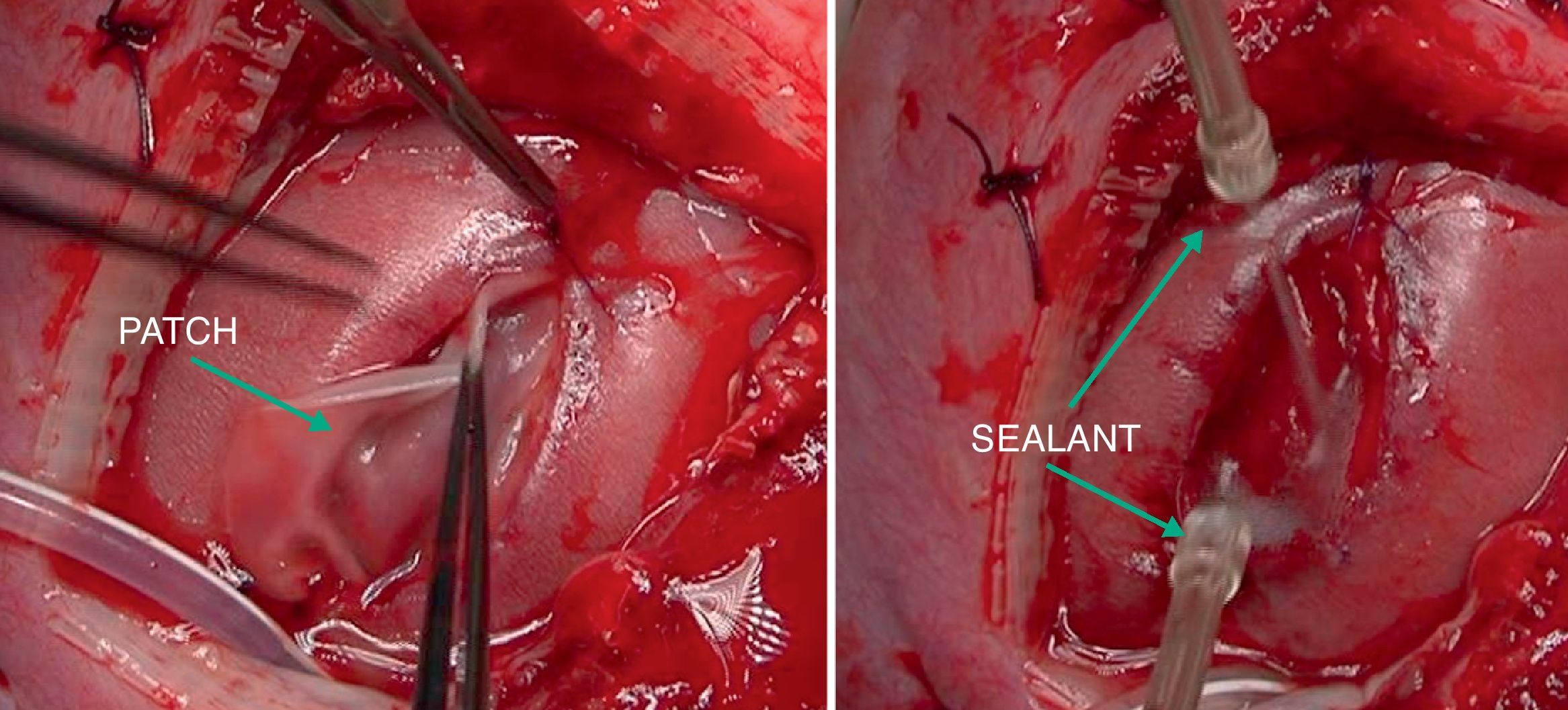
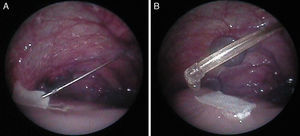
Posteriormente, en otro estudio experimental13, hemos evaluado la viabilidad de la cobertura fetoscópica para la reparación de MMC en este modelo de oveja utilizando la técnica patch & sealant (fig. 3). Hemos podido comprobar que con el uso de 2 cánulas de 3mm, la reparación fetoscópica usando un parche sellado resulta sencilla, ofreciendo un cierre rápido y satisfactorio del tubo neural, con lo que se evita el daño neurológico medular y la malformación de Chiari.
Reparación quirúrgica prenatalActualmente, según la experiencia acumulada en el estudio MOMS, se está realizando la reparación intrauterina del MMC, entre las 19 y 25 semanas de gestación, mediante cirugía fetal abierta.
Tras la histerotomía, se expone la espalda fetal y la lesión, que se repara de igual forma que en el periodo neonatal. Cuando el tamaño del defecto es tan grande que no permite su cierre primario, se cubre con una lámina de Alloderm® (implante dérmico acelular, obtenido a partir de piel donada y procesada). El colágeno que lo forma crea una capa que se integrará gradualmente en la piel normal del paciente.
Tras la reparación, se procura mantener la gestación con una pauta de tocolisis, con controles semanales hasta el parto.
Por la experiencia acumulada hasta el momento, al nacer, se encuentra una ausencia o atenuación de las secuelas neurológicas. En la mayoría de los casos, se resuelve la malformación de Chiari tipo II y no se desarrolla hidrocefalia14. Se reduce sustancialmente la necesidad de colocar válvulas de derivación ventrículo-peritoneal15,16.
Desde un punto de vista materno, no se describen complicaciones severas. Las complicaciones obstétricas más frecuentes en el embarazo son la rotura prematura de membranas, la dehiscencia de la sutura y el grado de prematuridad. En todos los casos debe evitarse la dinámica uterina y la finalización de la gestación deberá realizarse mediante cesárea6.
Programa de reparación prenatal del mielomeningocele en el Hospital Universitari Vall d’HebronEl programa de cirugía fetal del MMC requiere un abordaje multidisciplinar. La exploración ecográfica se realiza en la Unidad de Medicina Fetal y es evaluada conjuntamente por un experto en medicina fetal y un médico rehabilitador especialista en espina bífida.
Ante el diagnóstico ecográfico de MMC, se practica una amniocentesis para realizar el estudio cromosómico fetal, así como la determinación de alfa-fetoproteína y acetilcolinesterasa, cuyos valores estarán aumentados ante la presencia de un defecto abierto. El diagnóstico se completa mediante la realización de una resonancia magnética que revalora las posibles anomalías asociadas, principalmente a nivel del SNC.
La paciente es informada del diagnóstico, del pronóstico fetal de forma individualizada y de las opciones de seguimiento. Los casos que deciden optar por la reparación prenatal son visitados por el equipo de cirugía pediátrica y anestesia previamente a la intervención.
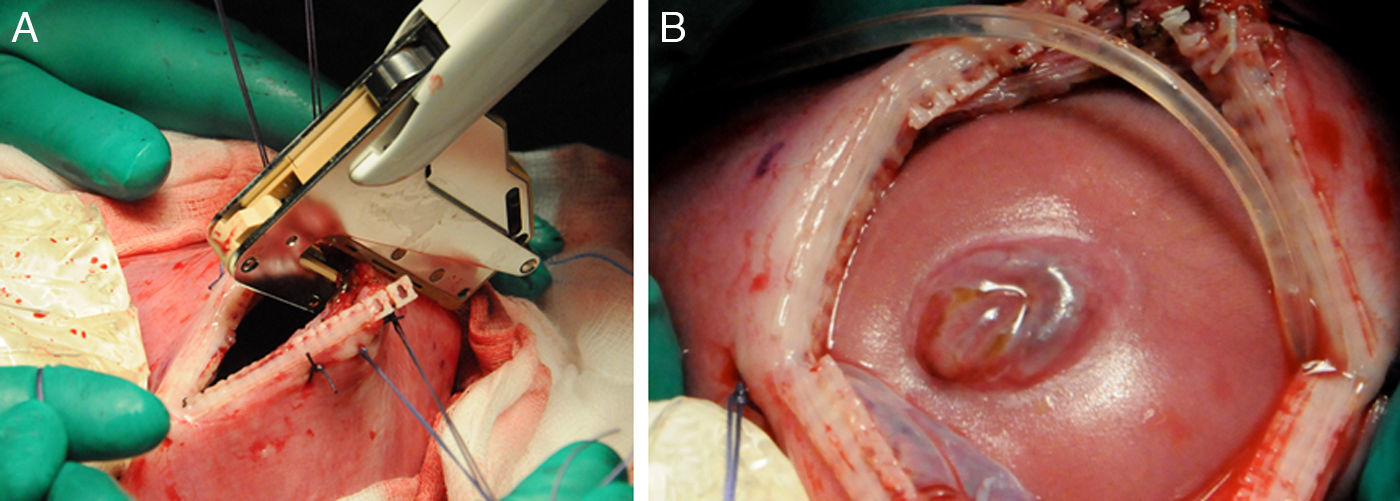
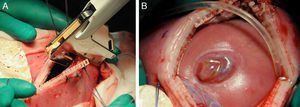
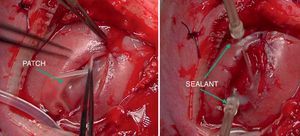
En caso de intervención y de manera preoperatoria se administra profilaxis antibiótica con cefazolina y tocolisis con indometacina rectal o nifedipino vía oral. La cirugía se realiza con anestesia general y peridural. La perfusión de la anestesia peridural se inicia con el cierre uterino y se mantiene 48 h después de la intervención. La cirugía es abierta con histerotomía y aplicación de una nueva técnica fast-track (fig. 4). Posteriormente a la exposición del defecto, se coloca un parche de colágeno-elastina fijado mediante un polímero sellante sobre el defecto lumbar (fig. 5). Con ello se obtienen muy buenos resultados, consiguiéndose el cierre completo del defecto, sin necesidad de cirugía postnatal.
Tras la reparación, la paciente es trasladada a la Unidad de Curas Obstétricas Intermedias. Es necesario un control estricto de la dinámica uterina con una pauta de tocolisis con sulfato de magnesio, atosiban e indometacina o nifedipino de rescate. Además, el catéter peridural permite el control tanto del dolor como de la dinámica uterina.
Una vez estabilizada y controlados el dolor y la dinámica uterina, la paciente es trasladada a la planta de hospitalización. Ante una correcta evolución, es dada de alta hospitalaria con pauta de nifedipino 20mg cada 8h con controles semanales en la Unidad de Medicina Fetal.
En ausencia de complicaciones, la finalización de la gestación será a las 37 semanas mediante cesárea.
El seguimiento postnatal se establece mediante la coordinación de los Servicios de Rehabilitación (en la Unidad de Espina Bífida), Neonatología, Cirugía Pediátrica y Neurocirugía.
El programa multidisciplinar de diagnóstico y tratamiento prenatal del MMC funciona desde el año 2010. Hasta la actualidad, se ha evaluado a 35 pacientes con fetos afectos de MMC. De estas, 25 optaron por interrupción legal del embarazo, 4 por seguimiento con cirugía correctora postnatal y 6 por cirugía correctora prenatal.
Ética de la corrección prenatalDesde la publicación de los resultados del estudio MOMS, la perspectiva del manejo clínico del MMC ha cambiado de forma sustancial. Los resultados muestran que la cirugía prenatal del MMC realizada antes de 26 semanas de gestación disminuye la necesidad de derivación ventrículo-peritoneal a los 12 meses de vida y mejora la función motora a los 30 meses de edad. La cirugía prenatal también ha demostrado un grado superior de corrección de la hernia cerebelosa asociada con la malformación Chiari tipo II y un aumento de la capacidad de deambulación autónoma, superior a la alcanzada con la cirugía postnatal.
Resultados publicados por los mismos autores sobre el seguimiento en el Children's Hospital of Philadelphia17 muestran que el 69% de los niños operados prenatalmente son independientes para la deambulación, sin necesidad de ortesis, a los 5 años y 6 meses.
Por lo tanto, la cirugía prenatal es una excelente intervención para minimizar el grado de secuela neurológica y motora que puedan presentar los recién nacidos afectos de MMC.
Ante el diagnóstico de MMC y teniendo en cuenta los conocimientos actuales, la cirugía prenatal debe ser ofrecida y realizada en un centro con experiencia en este tipo de intervenciones por un equipo multidisciplinar especializado.
Guía de práctica clínicaLa selección de pacientes para la realización de cirugía prenatal del MMC está sujeta a una serie de criterios.
Los criterios de inclusión son: un nivel anatómico entre T1 y S1, edad gestacional entre 19 y 25,6 semanas, evidencia de herniación del cerebelo con ecografía y resonancia magnética fetal y el cariotipo normal.
Los criterios de exclusión incluyen la gestación múltiple, la presencia de anomalías no relacionadas con el MMC, cifosis severa (≥30°), placenta previa, cérvix corta e infección materna por VIH, hepatitis B o C.
El pronóstico de los fetos afectos de MMC depende del nivel neurológico de la lesión18,19 y, por lo tanto, deberá ser individualizado.
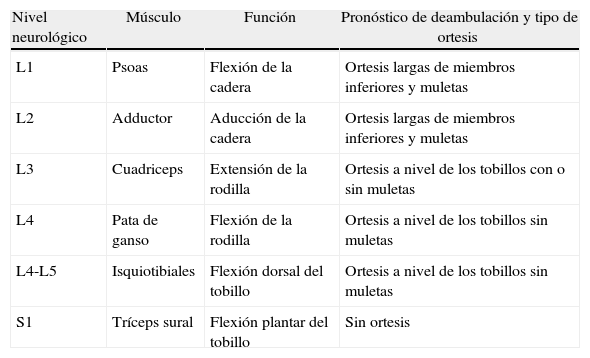
El nivel neurológico, definido como el último músculo con fuerza superior a 3 en la escala MCR (y no el anatómico), es el factor determinante de la capacidad de deambulación del paciente y también del tipo de ayuda ortésica que pueda precisar: knee ankle foot orthosis ([KAFO], ortesis por encima de la rodilla para pacientes sin función en el cuadriceps), ankle foot orthosi ([AFO] ortesis por debajo de la rodilla en pacientes con cuadriceps competente) o silla de ruedas para pacientes con nivel neurológico por encima de L1 sin capacidad de marcha. Partiendo de la base que la inervación de los músculos a nivel medular no depende de una única metámera, en la exploración neurológica se utiliza la clasificación mediante los músculos guía, aceptada internacionalmente que nos permite establecer el nivel de lesión neurológica. A cada nivel le corresponde un músculo determinado que es el que va a posibilitar un determinado movimiento20. Siguiendo estos criterios se establecen los siguientes niveles neurológicos de lesión: L1: el músculo guía es el psoas y su función es la flexión de la cadera; L2: el músculo guía es el adductor y su función es la aproximación de las extremidades inferiores a la línea media; L3: el músculo guía es el cuadriceps y su función es la extensión de la rodilla; L4: conjunto muscular de la pata de ganso cuya función es la flexión de la rodilla; L5: el músculo guía es el tibial anterior cuya función es la flexión dorsal del tobillo y S1: el músculo guía es el tríceps cuya función es la flexión plantar del tobillo (tabla 1).
Nivel neurológico
| Nivel neurológico | Músculo | Función | Pronóstico de deambulación y tipo de ortesis |
| L1 | Psoas | Flexión de la cadera | Ortesis largas de miembros inferiores y muletas |
| L2 | Adductor | Aducción de la cadera | Ortesis largas de miembros inferiores y muletas |
| L3 | Cuadriceps | Extensión de la rodilla | Ortesis a nivel de los tobillos con o sin muletas |
| L4 | Pata de ganso | Flexión de la rodilla | Ortesis a nivel de los tobillos sin muletas |
| L4-L5 | Isquiotibiales | Flexión dorsal del tobillo | Ortesis a nivel de los tobillos sin muletas |
| S1 | Tríceps sural | Flexión plantar del tobillo | Sin ortesis |
La valoración prenatal individualizada del nivel neurológico de lesión se realizará mediante ecografía y permitirá establecer el pronóstico deambulatorio que es, en definitiva, lo que condicionará el grado de autonomía de los pacientes afectos de MMC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.