El intervencionismo cardiaco fetal se ha consolidado como una opción para ciertas cardiopatías congénitas cuya evolución intraútero conduce a escenarios que implican una elevada morbimortalidad. La valvuloplastia aórtica y pulmonar para las obstrucciones severas de las válvulas sigmoideas así como la atrioseptostomía en casos de hipoplasia ventricular izquierda con restricción al flujo interatrial pueden permitir modificar la historia natural de estas cardiopatías y ofrecer una mejora en su pronóstico postnatal. A pesar de contar con más de 20 años de historia, la experiencia acumulada en este campo todavía es limitada. El aumento en el número y en la precocidad de los diagnósticos prenatales, el perfeccionamiento de los métodos de selección de candidatos y la concentración de procedimientos en centros con experiencia son piezas básicas en la consolidación de estas técnicas.
Fetal cardiac intervention has become an option for certain congenital heart defects in which prenatal progression may lead to scenarios associated with high morbidity and mortality. Aortic and pulmonary valvuloplasty for severe obstruction of sigmoid valves, and atrial septostomy in cases of left ventricular hypoplasia with restrictive foramen ovale may modify the natural history of these heart defects and improve their postnatal outcome. However, after 20 years, experience in this field is still limited. Increasing the number of prenatal diagnosis, decreasing the gestational age at diagnosis, improving the selection criteria of potential candidates, and centralization of procedures are fundamental for the consolidation of these techniques.
El intervencionismo cardiaco fetal (ICF) se sustenta en la concepción dinámica de la historia natural de las cardiopatías congénitas (CC), muchas de las cuales progresan prenatalmente1. Si bien cualquier alteración en el proceso de organogénesis puede originar un defecto cardiaco congénito, la forma y la función cardiaca definitivas dependerán del efecto del flujo circulatorio sobre el modelado cardiaco. Dicha influencia de «la función sobre la estructura» resulta más evidente en aquellas CC en las que existe una obstrucción severa de las válvulas semilunares y en las que cursan con una restricción del flujo interatrial2. Así, 1) el ventrículo afecto por la obstrucción al flujo de salida puede evolucionar hacia una situación de hipoplasia extrema que impida el desarrollo de una circulación biventricular (CBV) al nacimiento, y que condicione la necesidad de adoptar soluciones quirúrgicas paliativas basadas en una circulación univentricular (CUV); 2) el aumento de la postcarga sobre el ventrículo derecho (VD) puede desembocar en una incompetencia tricúspide que culmine en la aparición de fracaso cardiaco derecho e hidrops fetal; 3) el cierre prematuro del foramen oval puede condicionar el desarrollo de hipertensión pulmonar e hipoxia extrema en el periodo neonatal.
En estos casos, la intervención prenatal puede modificar la historia natural de estas CC, y tanto la valvuloplastia como la atrioseptostomía intrauterina con balón resultan ser técnicas conceptualmente válidas para este objetivo3. Desde la primera descripción de un procedimiento cerrado de ICF en 19894, un número limitado de centros han puesto en marcha un programa de ICF. Sin embargo, los centros que acumulan mayor experiencia apenas superan el centenar de casos. Esto se debe a varios factores: las CC candidatas a ICF apenas representan el 7-10% de todas las CC, la ausencia o tardanza en el diagnóstico prenatal de las mismas y/o de remisión del paciente a las unidades de referencia, los restrictivos criterios de selección de los candidatos a ICF, el rechazo de los padres, que con frecuencia optan por la interrupción legal del embarazo (ILE) ante su diagnóstico, y las dificultades técnicas del propio procedimiento.
Justificación para el intervencionismo cardiaco fetalActualmente es posible ofrecer un tratamiento postnatal para todo tipo de CC. La mayor parte pueden ser corregidas con resultados excelentes tanto en términos de mortalidad como de evolución a largo plazo. Sin embargo, todavía existen CC muy severas para las cuales, postnatalmente, solamente se pueden ofrecer soluciones paliativas con resultados subóptimos5,6. El objetivo del ICF no es la corrección intraútero de estas CC de peor pronóstico, ni su curación definitiva, ni tampoco reemplazar el tratamiento postnatal, sino mejorar su historia natural para que también mejoren las opciones quirúrgicas postnatales que, en el mejor de los casos, en lugar de ir dirigidas a la reconstrucción paliativa univentricular conducirán a la consolidación de la CBV.
El ICF, como cualquier procedimiento invasivo, no está exento de riesgo, de modo que al ofrecerlo se habrá de constatar que7,8:
- 1.
La CC, en su evolución natural, debe tener un mal pronóstico postnatal, con una elevada morbimortalidad.
- 2.
La historia natural de la CC debe ser bien conocida y razonablemente predecible.
- 3.
Existe suficiente evidencia que acredite que es posible detener la evolución de la CC en vida intrauterina.
- 4.
El procedimiento propuesto tenga como objetivo modificar la historia natural del defecto y, de este modo, mejorar el pronóstico de la terapia postnatal convencional.
- 5.
La CC sea identificable precozmente y la intervención se realice a una edad gestacional lo suficientemente temprana como para poder alterar el curso de los cambios morfológicos y hemodinámicos antes del desarrollo de un daño irreversible.
- 6.
La lesión cardiaca sea anatómicamente «simple» y se pueda realizar un abordaje mínimamente invasivo. Es decir, el cambio en la evolución ha de ser consecuencia de la actuación sobre una única estructura con un daño mínimo para los tejidos.
- 7.
La madre no sea sometida a riesgos indebidos derivados del ICF. El riesgo materno, al someter al feto a este tipo de procedimientos, debe aproximarse a cero.
Los principales argumentos que respaldan la realización de ICF son:
- -
La normalización de los flujos a través de las válvulas semilunares supone una disminución de la presión intraventricular, favoreciendo así el crecimiento y función del ventrículo. Si como resultado del ICF se consigue una CBV, se logrará mejorar la calidad de vida del paciente respecto a la que tendría con una CUV, y cuanto mejor sea la situación funcional mejor será el desarrollo cognitivo.
- -
La normalización de los flujos intracardiacos supone una disminución del riesgo de aparición de lesiones secundarias en otros órganos (sistema nervioso central, pulmón) y del desarrollo de hidrops, que con frecuencia se observan en estos pacientes.
- -
La normalización hemodinámica puede suponer una mejora en la perfusión miocárdica y neurológica y, por tanto, de las expectativas del paciente a largo plazo.
Tres son las anomalías cardiacas que reúnen estas características:
- -
Estenosis aórtica crítica (EAC)
- -
Estenosis pulmonar crítica/atresia pulmonar membranosa con septo interventricular íntegro (EPC/AP-SI)
- -
Foramen oval restrictivo en el contexto de un síndrome de ventrículo izquierdo hipoplásico (FOR-SVIH).
La complejidad del ICF y la deseable continuidad asistencial sobre el paciente exigen que la realización de estos procedimientos esté en manos de equipos multidisciplinares que dominen el diagnóstico prenatal de las CC y las técnicas invasivas prenatales, el intervencionismo pre- y postnatal sobre las CC y el tratamiento quirúrgico de las mismas9. La realización de este tipo de procedimientos no suele llevarse a cabo antes de la semana 20 de gestación como consecuencia de las limitaciones derivadas del tamaño de las estructuras cardiacas y de la ausencia de material específicamente diseñado para terapia cardiaca fetal10.
El éxito del ICF está condicionado fundamentalmente por la calidad de la imagen y la posición fetal10. Si bien la mayoría de los procedimientos han sido realizados mediante acceso directo percutáneo guiado bajo control ecográfico, también se ha descrito la realización de una mini-laparotomía cuando la calidad de la imagen debida al hábito materno es tan pobre que no cabe otra opción que la aplicación directa del transductor sobre la pared uterina. El procedimiento no debería llevarse a cabo hasta conseguir una posición fetal que permita un abordaje cardiaco cómodo. Para ello se recomienda que exista una cantidad adecuada de líquido amniótico entre la pared uterina y el tórax fetal que permita una correcta orientación de la aguja. El feto ha de estar colocado preferiblemente en dorso-posterior, apoyado en la pared uterina y sin interposición de extremidades. Una vez conseguida la posición adecuada, y con objeto de mantenerla, se anestesia al feto mediante la inyección intramuscular de relajantes musculares, analgésicos opiáceos y atropina, en dosis adecuadas al peso fetal estimado. Asimismo, la madre recibe sedación y anestesia local en el lugar de la punción.
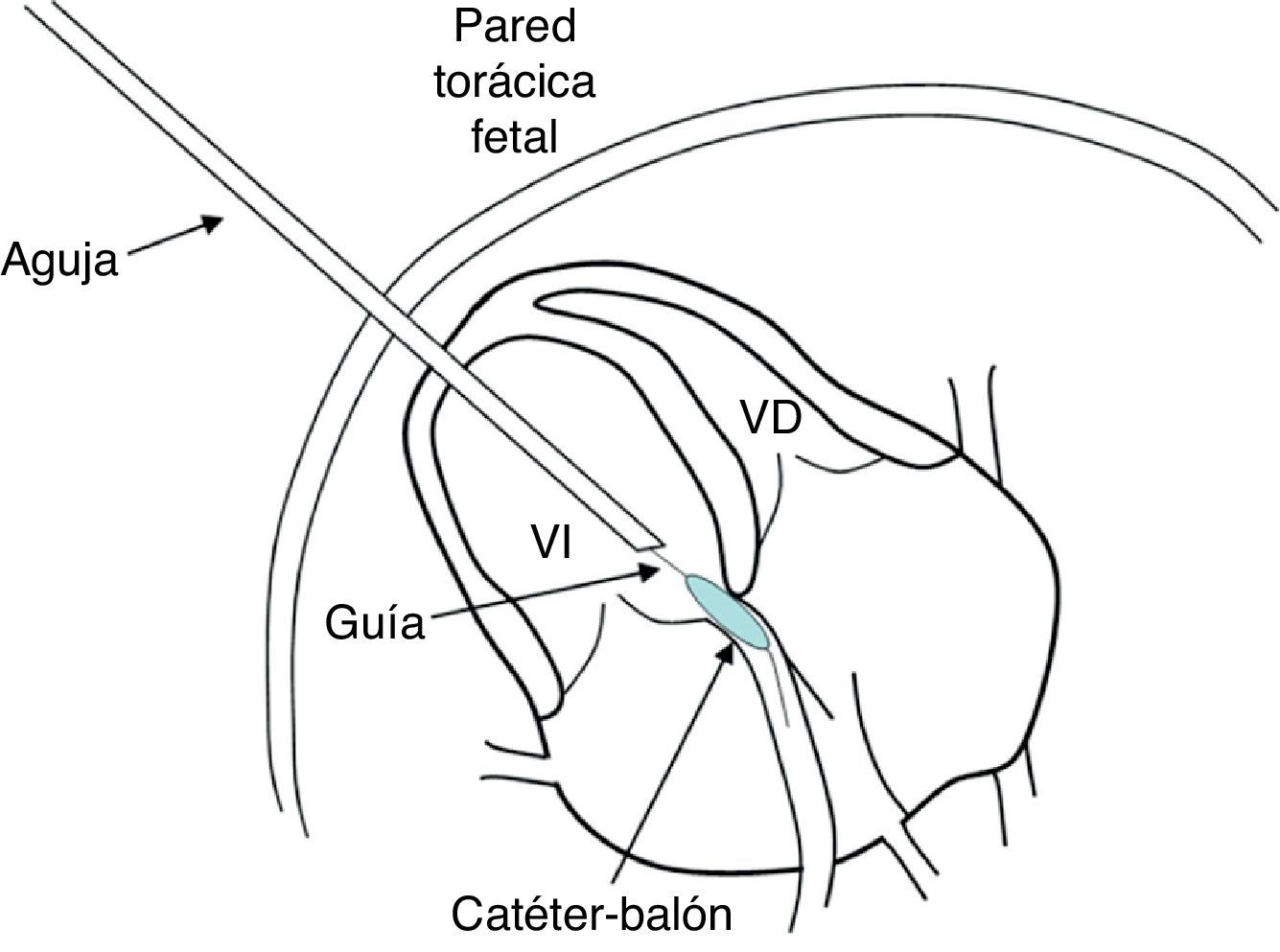
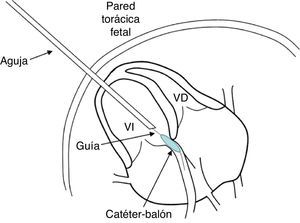
La inserción de la aguja hasta el corazón fetal se controla mediante ecografía bidimensional. Tras atravesar el abdomen materno, la pared uterina, la cavidad amniótica y el tórax fetal se introduce la aguja en la «diana». La trayectoria es dependiente del objetivo: para la valvuloplastia aórtica, el acceso ha de realizarse a través del ápex del ventrículo izquierdo (VI), en un corte apical de 4 cámaras, y dirigir la aguja hacia la válvula aórtica. Si el objetivo es la válvula pulmonar, el acceso ha de realizarse preferiblemente a través del infundíbulo del VD con el fin de lograr una mejor alineación con la válvula. Por último, si se pretende perforar el tabique interauricular, la vía de entrada ideal es la pared libre de la aurícula derecha, aunque también puede entrarse por la izquierda. Una vez alcanzada la región cardiaca de interés, se retira el trocar y se introducen a través de la aguja los dispositivos necesarios para la intervención (guía de punta flexible y catéter-balón) hacia la estructura afecta (figs. 1 y 2). El control de la técnica y la correcta identificación de las estructuras del corazón pueden verse comprometidas en el momento de situar todos estos elementos en la correspondiente cavidad cardiaca. Con el fin de minimizar las complicaciones por disminución en la calidad de la imagen, todos los dispositivos han de ser medidos y marcados para conocer su posición en el corazón fetal y asegurar que el balón es situado correctamente. Para garantizar la dilatación de la estructura estenosada, se realizan entre 2 y 4 inflados del balón. Su duración debe ser especialmente breve en el caso de la valvuloplastia aórtica, con el fin de no producir una isquemia por limitación del flujo coronario. Durante el procedimiento es posible que se produzca de manera accidental la rotura del balón al contactar con los bordes de la aguja durante su inflado. Este riesgo puede reducirse mediante el empleo de agujas cuya vaina externa no tenga bisel o bien retirando mínimamente (2-3mm) la aguja antes de realizar el inflado del balón. La aguja debe ser de al menos 15cm de longitud, y su calibre de 18 o 19G. La guía metálica suele ser de 0,014 pulgadas y el ratio entre el diámetro del balón y el anillo de la válvula estenosada ha de estar en torno a 1,1-1,2, con el fin de demorar al máximo la aparición de re-estenosis aun a expensas de provocar una regurgitación valvular residual, que suele desaparecer en pocas semanas (fig. 3). Es frecuente la aparición de algún episodio autolimitado de bradicardia durante la intervención, aunque si esta es mantenida puede ser necesaria la administración de atropina o adrenalina intracardiaca o intramuscular para revertirla, e incluso se ha propuesto su administración profiláctica tras realizar la punción cardiaca11. Tras comprobar la mejoría en el flujo anterógrado a través de la válvula estenosada se retiran el dispositivo y la aguja.
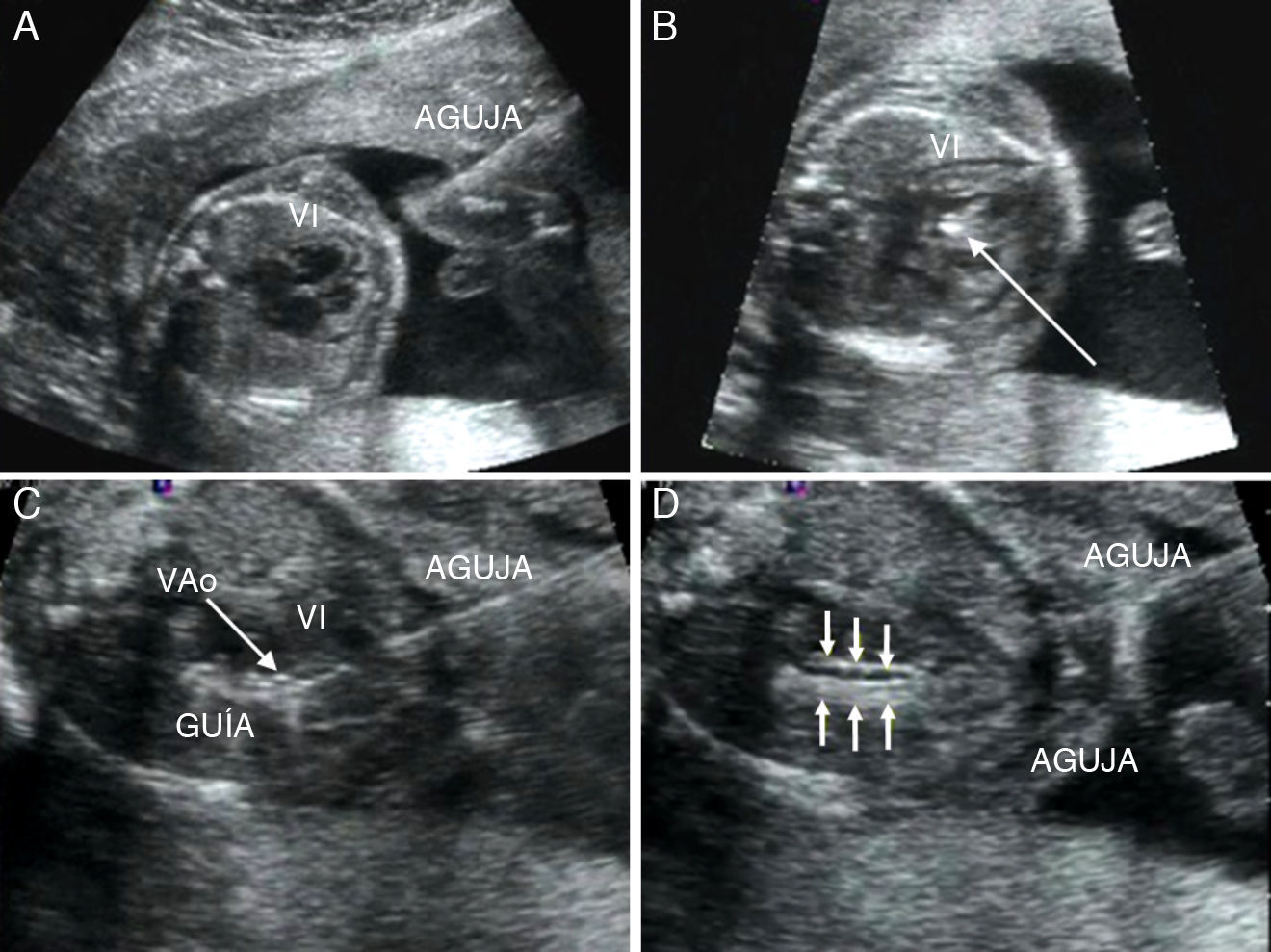
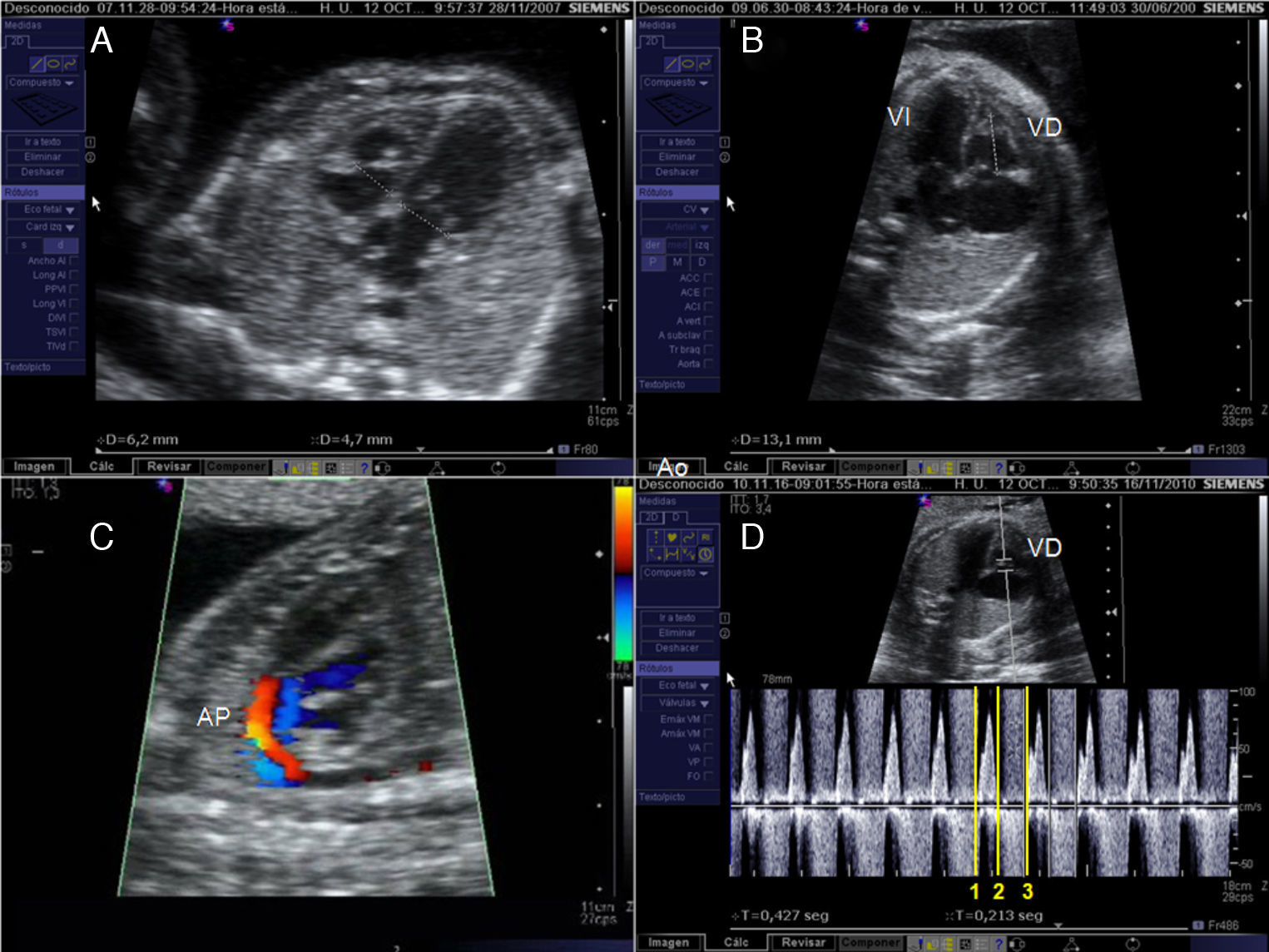
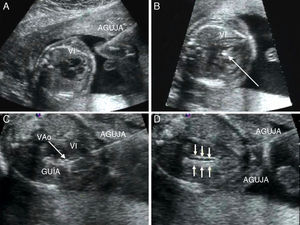
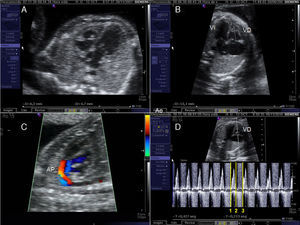
Valvuloplastia aórtica fetal. A) La aguja se orienta hacia el ápex cardiaco tras haber atravesado la pared abdominal materna, el miometrio y la cavidad amniótica. B) Tras atravesar la pared torácica fetal y el miocardio, la punta de la aguja (flecha), se sitúa inmediatamente debajo de la válvula aórtica. C) La guía se hace avanzar a través de la válvula aórtica (VAo) estenosada hacia la aorta ascendente. D) El catéter-balón (flechas) es inflado, consiguiendo la dilatación de la válvula aórtica. VI: ventrículo izquierdo.
Las complicaciones más frecuentemente asociadas al procedimiento son la bradicardia (16-37%), el hemopericardio (12-14%), la trombosis intraventricular (15-20%) y la muerte fetal (12-20%)11,12. En relación con el hemopericardio, si está ya presente en el momento de retirar la aguja, ha de aspirarse su contenido antes de la retirada definitiva, y si inicialmente no lo hay, es prudente permanecer algunos segundos con la aguja en la zona del saco pericárdico al retirar la aguja de la cavidad ventricular por si se produce el hemopericardio al retirar aquella.
Se considera un éxito técnico de la valvuloplastia cuando la válvula es atravesada y el balón es inflado con evidencia de aumento del flujo anterógrado y/o aparición de regurgitación valvular. Las principales variables que favorecen dicho éxito técnico son la dimensión del eje largo del ventrículo (z-score>-2) y su índice de esfericidad12. En la atrioseptostomía, el éxito técnico queda definido por la aparición de flujo a través del nuevo defecto creado en el septo interauricular, preferiblemente de más de 3mm13.
Tras la valvuloplastia ha de realizarse un estrecho control de las posibles complicaciones maternas y fetales. Ha de monitorizarse el flujo a través de la válvula así como el estado hemodinámico fetal. Las 3 o 4 primeras semanas postprocedimiento se consideran esenciales para juzgar la eficacia del mismo según cómo evolucione la función y tamaño del ventrículo afecto. Se considera éxito biológico cuando se consigue rescatar el ventrículo afecto logrando una CBV postnatal o, en el caso de la valvuloplastia pulmonar, al menos una situación de «ventrículo y medio». Para la atrioseptostomía se considera éxito biológico si se consigue aumentar el flujo interauricular y reducir los signos de hipertensión pulmonar14.
Selección de candidatosUna vez diagnosticadas prenatalmente las entidades que sabemos que pueden ser candidatas a ser intervenidas antes del nacimiento hemos de identificar:
- 1.
Qué pacientes presentan una enfermedad suficientemente grave como para plantear ICF, es decir que, dejadas a su libre evolución, van a acompañarse de un deterioro progresivo que condicione hipoplasia ventricular severa, fracaso cardiaco o hipertensión pulmonar grave.
- 2.
Qué pacientes están en una fase en la que podamos considerar que el ventrículo es aún «rescatable», es decir que, realizando el ICF y cursando este con éxito, puede mejorar el crecimiento y la función ventricular o la hemodinámica cardio-vascular, aumentando con ello las posibilidades de CBV y/o minimizando las lesiones secundarias asociadas a la CC.
En este sentido, y aun siendo cierto que se ha avanzado mucho en los últimos años en la identificación de los mejores candidatos a ICF, todavía desconocemos en gran medida cuál va a ser la respuesta del ventrículo al procedimiento y cuál va ser la tolerancia del feto al mismo. En los próximos años habremos de intentar responder a ambos interrogantes.
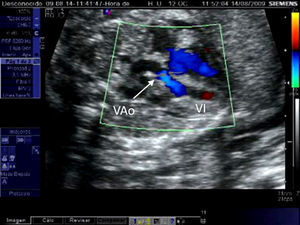
Estenosis aórtica críticaLa EAC supone el 15% de las estenosis aórticas. En ella la obstrucción valvular es casi completa y la perfusión del arco aórtico es dependiente del ductus arterioso. Es fundamental diferenciar la EAC de la atresia aórtica ya que, si bien el aspecto ecográfico es muy similar en ambas entidades, solamente en la EAC es posible atravesar el anillo valvular con el catéter-balón. La aplicación del Doppler color y/o pulsado permitirá comprobar la existencia de flujo anterógrado transvalvular en el caso de la EAC.
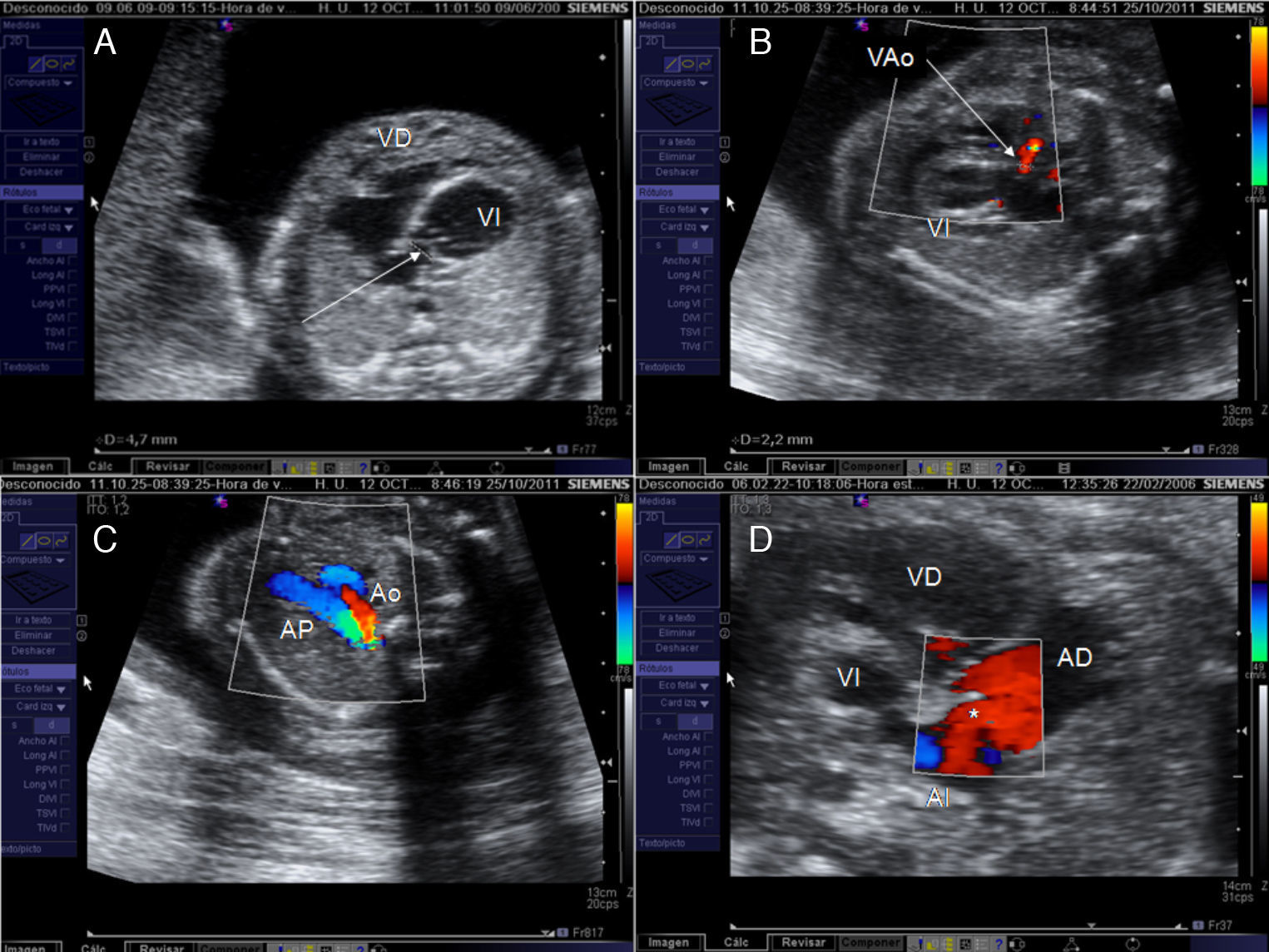
La selección de fetos con EAC candidatos a ICF ha de hacerse preferiblemente en el segundo trimestre. Si se detecta más allá de la ecografía morfológica de la semana 20, el VI puede no ser ya rescatable. Para considerar viable el VI, este no debe ser hipoplásico y su tamaño ha de ser al menos el 80% del tamaño del VD. Para comprobarlo se miden las distancias existentes entre el anillo valvular aurículo-ventricular y el endocardio apical correspondiente, en sístole y en un corte de 4 cámaras apical. El resto de parámetros utilizados para la selección de candidatos son hemodinámicos10,12 (tabla 1, fig. 4). El grupo de Linz añade a estos criterios la presencia de un z-score>-2 para el eje largo del VI y un ratio VI/VD>0,815. En presencia de estos signos, la evolución natural de la EAC es hacia un VI hipoplásico de forma prácticamente inequívoca, lo que conduce postnatalmente hacia una CUV tipo Fontan, tras ser sometido el paciente al menos a 3 intervenciones quirúrgicas paliativas y varios cateterismos diagnósticos y terapéuticos durante sus primeros años de vida. La supervivencia se sitúa por debajo del 50% en series fetales5 y la morbilidad es prácticamente una constante16.
Criterios de selección de fetos con estenosis aórtica crítica para intervención cardiaca fetal
| 1. Anatomía cardiaca: estenosis aórtica crítica valvular, sin obstrucción subvalvular |
| 2. Flujo anterógrado en la válvula aórtica |
| 3. Función del VI cualitativamente deprimida y: |
| - flujo reverso arco aórtico o |
| - 2 de los siguientes: flujo mitral monofásico, inversión del flujo interatrial, foramen oval restrictivo o flujo bidireccional en venas pulmonares |
| 4. Z-score eje largo ventrículo izquierdo≥-2 |
| 5. Z-score anillo mitral≥-3 |
| 6. Gradiente de presión transaórtico de al menos 10mmHg o de insuficiencia mitral de al menos 15mmHg |
Modificada de McElhinney et al.12.
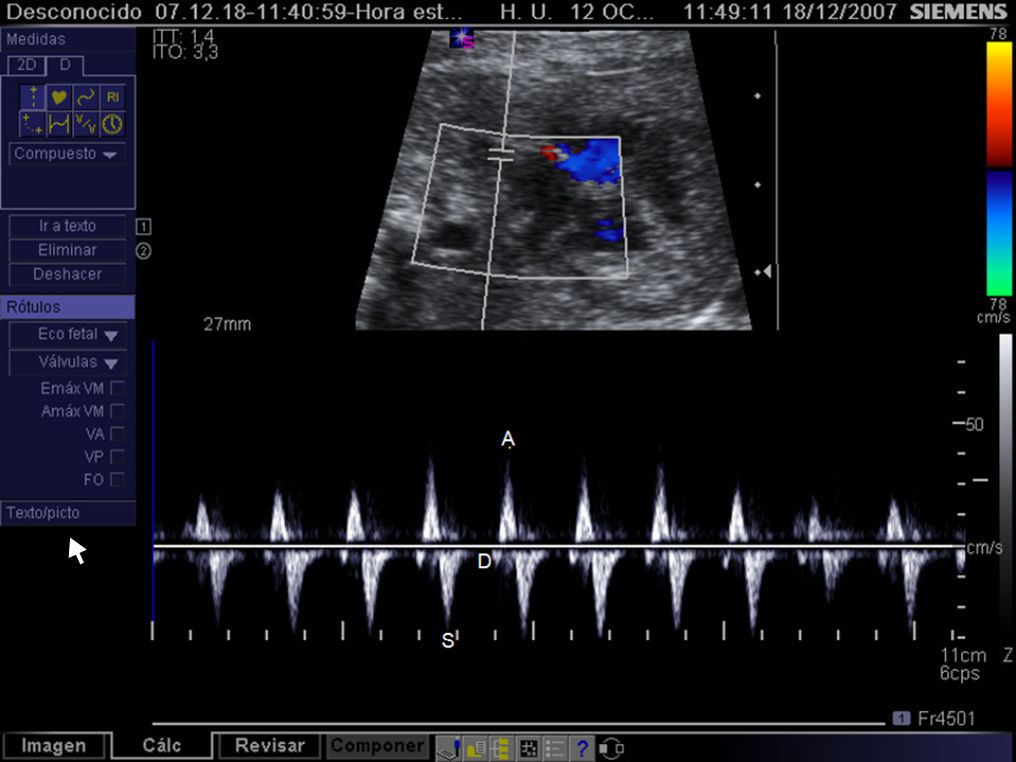
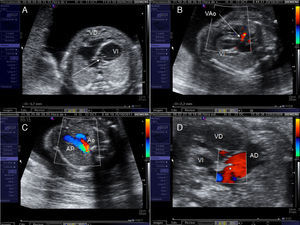
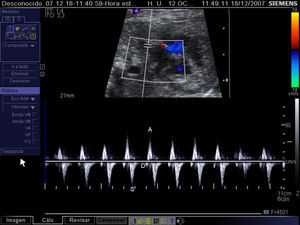
Criterios de selección para intervencionismo cardiaco fetal en la estenosis aórtica crítica. A) Z-score del anillo mitral≥-3. B) Flujo anterógrado a través de la válvula aórtica (VAo). C) Relleno retrógrado del arco transverso desde el ductus arerioso. D) Flujo invertido a través del foramen oval de la aurícula izquierda (AI) a la aurícula derecha (AD). Ao: arco aórtico; AP: arteria pulmonar; VI: ventrículo izquierdo.
Desde el punto de vista predictivo se ha observado que cuanto mayor sean las estructuras del corazón izquierdo y mejor sea la función del VI, más probable es alcanzar el éxito biológico de la valvuloplastia con la consecución de una CBV. El grupo de Boston ha descrito un sistema de puntuación pronóstico (tabla 2) que otorga 1 punto a cada variable. Una puntuación ≥4 asciende la tasa de CBV al 42% mientras que si es <4 dicha tasa es de 0%12.
Criterios predictivos de circulación biventricular en fetos con estenosis aórtica crítica al someterse a valvuloplastia aórtica intrauterina técnicamente exitosa
| 1. Z-score eje largo VI>0 |
| 2. Z-score eje corto VI>0 |
| 3. Z-score anillo aórtico>-3,5 |
| 4. Z-score anillo mitral>-2 |
| 5. Gradiente sistólico máximo en ventrículo izquierdo>20mmHg |
Modificada de McElhinney et al.12.
Entidad contralateral a la anteriormente descrita, admitiéndose en este caso la realización del ICF cuando existe atresia si esta es membranosa (75% de las AP-SI), tipo que con frecuencia representa el estadio final de una EPC. En la atresia membranosa los velos valvulares son móviles aunque no llegue a producirse su separación en sístole, y el desarrollo del infundíbulo, anillo valvular y tronco pulmonar es mayor que en la atresia muscular.
En la EPC/AP-SI se contemplan 2 situaciones principales: en la primera, la válvula tricúspide es competente sin apenas insuficiencia y existe riesgo de evolución hacia hipoplasia del VD, con connotaciones similares a las anteriormente descritas para la EAC. En la segunda, la válvula es incompetente con insuficiencia tricúspide severa y sus complicaciones se asemejan a las que padecen algunos fetos con anomalía de Ebstein o displasia tricúspide que evolucionan hacia el fracaso cardiaco derecho e hidrops secundario al aumento de la presión venosa.
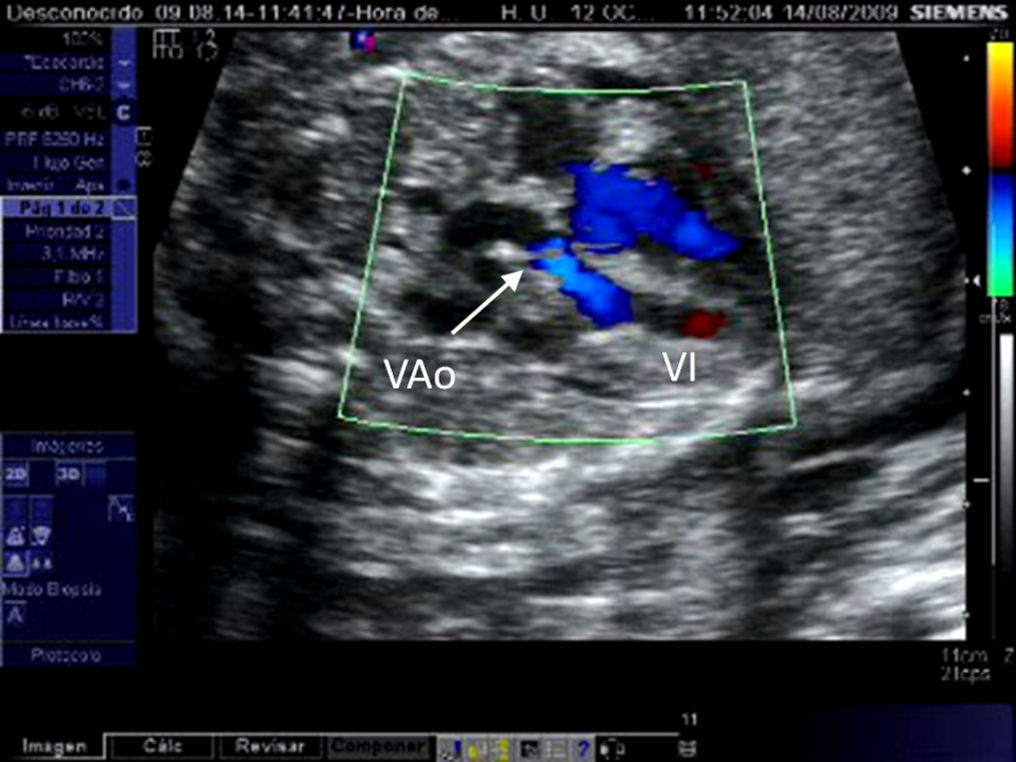
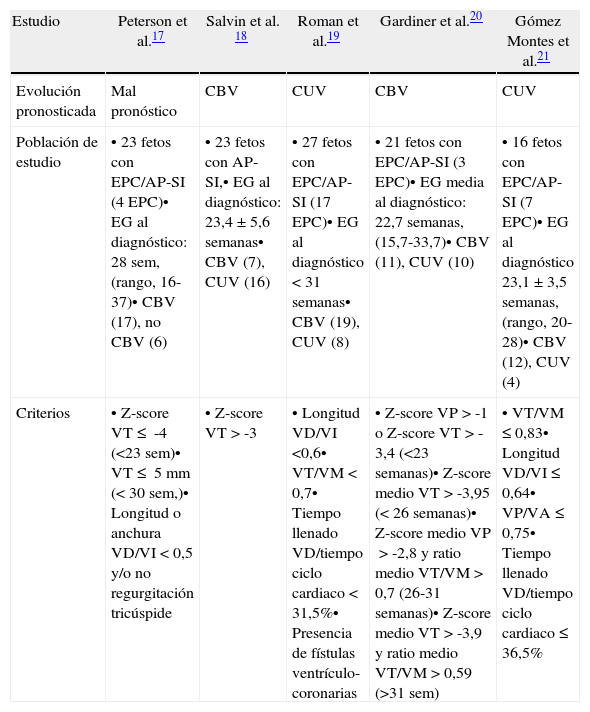
En el primer escenario, la selección de candidatos para intervencionismo fetal se hace en base a diversos sistemas de puntuación multiparamétricos que incluyen datos cardiométricos y funcionales que se basan fundamentalmente en la comparación entre el tamaño de las estructuras «derechas» e «izquierdas» y en la relación entre el tiempo de llenado ventricular derecho y la duración del ciclo cardiaco, respectivamente (tabla 3, fig. 5)17–21. El más utilizado es el descrito por Roman et al.19 en el que la presencia de 3 de los 4 criterios permite predecir la evolución a CUV con una sensibilidad del 100% y una especificidad del 75%. El propuesto por nuestro grupo21 es similar, aunque no contempla la valoración de fístulas ventrículo-coronarias (fig. 6), que no siempre son fáciles de apreciar prenatalmente, y añade la evaluación de otro parámetro más sencillo como es el cociente anillo pulmonar/anillo aórtico. Mediante su aplicación en el segundo trimestre pudimos predecir la evolución a CUV con una sensibilidad y especificidad del 100% en presencia de los 4 criterios, y con una especificidad del 92% manteniendo la sensibilidad de 100% en presencia de 3 criterios.
Resumen de los criterios predictivos publicados del tipo de circulación postnatal en fetos diagnosticados de estenosis pulmonar crítica/atresia pulmonar con septo íntegro
| Estudio | Peterson et al.17 | Salvin et al. 18 | Roman et al.19 | Gardiner et al.20 | Gómez Montes et al.21 |
| Evolución pronosticada | Mal pronóstico | CBV | CUV | CBV | CUV |
| Población de estudio | • 23 fetos con EPC/AP-SI (4 EPC)• EG al diagnóstico: 28 sem, (rango, 16-37)• CBV (17), no CBV (6) | • 23 fetos con AP-SI,• EG al diagnóstico: 23,4±5,6 semanas• CBV (7), CUV (16) | • 27 fetos con EPC/AP-SI (17 EPC)• EG al diagnóstico <31 semanas• CBV (19), CUV (8) | • 21 fetos con EPC/AP-SI (3 EPC)• EG media al diagnóstico: 22,7 semanas, (15,7-33,7)• CBV (11), CUV (10) | • 16 fetos con EPC/AP-SI (7 EPC)• EG al diagnóstico 23,1±3,5 semanas, (rango, 20-28)• CBV (12), CUV (4) |
| Criterios | • Z-score VT≤ -4 (<23 sem)• VT≤ 5mm (<30 sem,)• Longitud o anchura VD/VI <0,5 y/o no regurgitación tricúspide | • Z-score VT>-3 | • Longitud VD/VI <0,6• VT/VM <0,7• Tiempo llenado VD/tiempo ciclo cardiaco <31,5%• Presencia de fístulas ventrículo-coronarias | • Z-score VP>-1 o Z-score VT>-3,4 (<23 semanas)• Z-score medio VT>-3,95 (<26 semanas)• Z-score medio VP>-2,8 y ratio medio VT/VM>0,7 (26-31 semanas)• Z-score medio VT>-3,9 y ratio medio VT/VM>0,59 (>31 sem) | • VT/VM≤0,83• Longitud VD/VI≤0,64• VP/VA≤0,75• Tiempo llenado VD/tiempo ciclo cardiaco≤36,5% |
AP-SI: atresia pulmonar con septo íntegro; CBV: circulación biventricular; CUV: circulación univentricular; EPC: estenosis pulmonar crítica; VA: válvula aórtica; VD: ventrículo derecho; VI: ventrículo izquierdo; VM: válvula mitral; VP: válvula pulmonar; VT: válvula tricúspide.
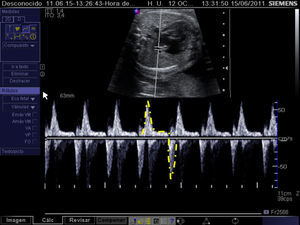
Criterios de selección para intervencionismo cardiaco fetal en la estenosis pulmonar crítica/atresia pulmonar con septo íntegro. A) Cociente entre los anillos tricúspide y mitral≤0,75. B) Cociente entre las longitudes del ventrículo derecho (VD) e izquierdo (VI)≤0,64. C) Relleno retrógrado ductus-dependiente del tronco pulmonar en feto con atresia membranosa de la válvula pulmonar y septo íntegro. D) Cálculo del cociente tiempo de llenado del ventrículo derecho (1-2)/tiempo del ciclo cardiaco (1-3) mediante Doppler pulsado.
En el segundo escenario, la selección de candidatos a ICF puede hacerse en base a la apreciación directa del hidrops o, en casos más dudosos, utilizando el sistema de puntuación descrito por Huhta y que incluye la valoración de: presencia de edema subcutáneo o derrame en cavidades serosas, Doppler venoso, Doppler en la arteria umbilical, tamaño cardiaco y función cardiaca22. Una puntuación≤7 indica que existe fracaso cardiaco o un alto riesgo de que aparezca y, por tanto, puede haber indicación de ICF.
Foramen oval restrictivoEl cierre del foramen oval es una complicación que aparece en el 6% de fetos con VI hipoplásico aunque hasta el 15-20% presentan un componente importante de restricción al flujo con repercusión clínica5. Esta situación empeora considerablemente su pronóstico de manera que la mortalidad perioperatoria inicial de estos pacientes se sitúa por encima del 60%23, incluso con un diagnóstico prenatal y manejo perinatal óptimos. Esta elevada mortalidad es producto de la imposibilidad que tiene la sangre procedente de las venas pulmonares para acceder al territorio sistémico y constituye una urgencia quirúrgica extrema. Además, se acompaña de una serie de fenómenos histológicos, como la arterialización de las venas pulmonares, que condicionan una hipertensión pulmonar severa y con frecuencia refractaria a cualquier tratamiento. En estos casos, la descompresión auricular izquierda mediante una atrioseptostomía realizada en vida fetal puede favorecer la correcta oxigenación fetal y detener los cambios responsables de la hipertensión pulmonar.
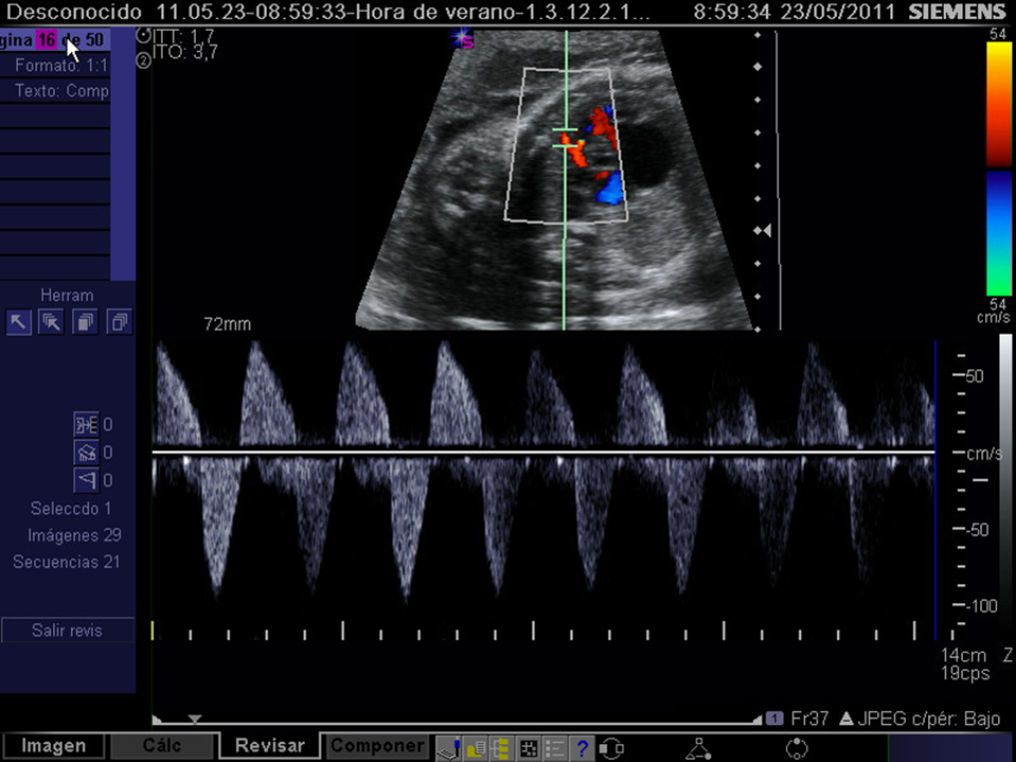
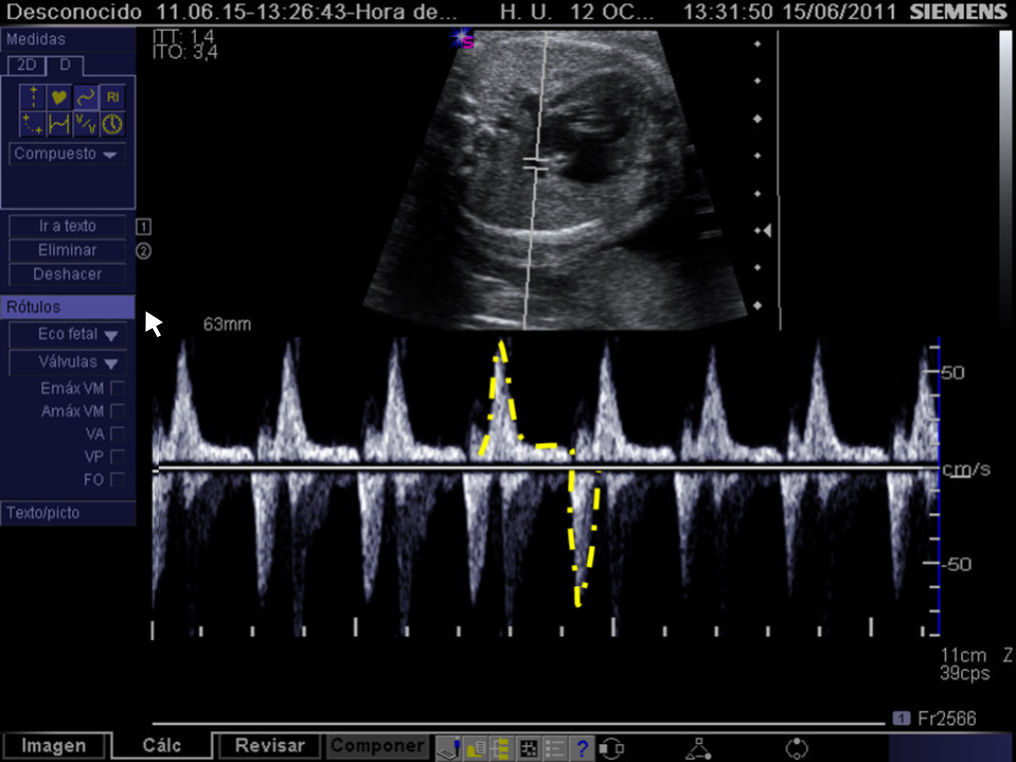
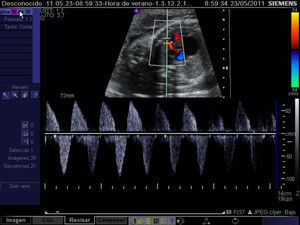
El diagnóstico de esta complicación y, por ende, la selección de candidatos a atrioseptostomía fetal se realiza mediante el análisis de la onda de flujo en las venas pulmonares. El perfil Doppler de estas es similar al del ductus venoso en condiciones normales, mientras que la observación de una onda de flujo constituida por un componente anterógrado coincidiendo con la sístole ventricular, seguido de una ausencia de flujo coincidente con la primera fase de la diástole y finalmente una onda retrógrada durante la contracción atrial es indicativa de foramen oval sellado24 (fig. 7). Adicionalmente, con el fin de detectar restricciones severas al flujo interatrial, puede recurrirse al análisis de la onda Doppler de las venas pulmonares y así se ha podido constatar que el mejor parámetro para predecir esta complicación es el cociente entre las integrales velocidad-tiempo de la onda anterógrada y de la onda reversa, de modo que cuando es <5 convierte una probabilidad pretest del 10% en una postest del 74%25 (fig. 8).
Registro mediante Doppler pulsado del flujo en una vena pulmonar en un feto con ventrículo izquierdo hipoplásico y foramen oval sellado. Obsérvese la ausencia de flujo durante la primera fase de la diástole (onda D) y el pico revertido coincidiendo con la contracción atrial (onda A). Onda S: flujo durante la sístole.
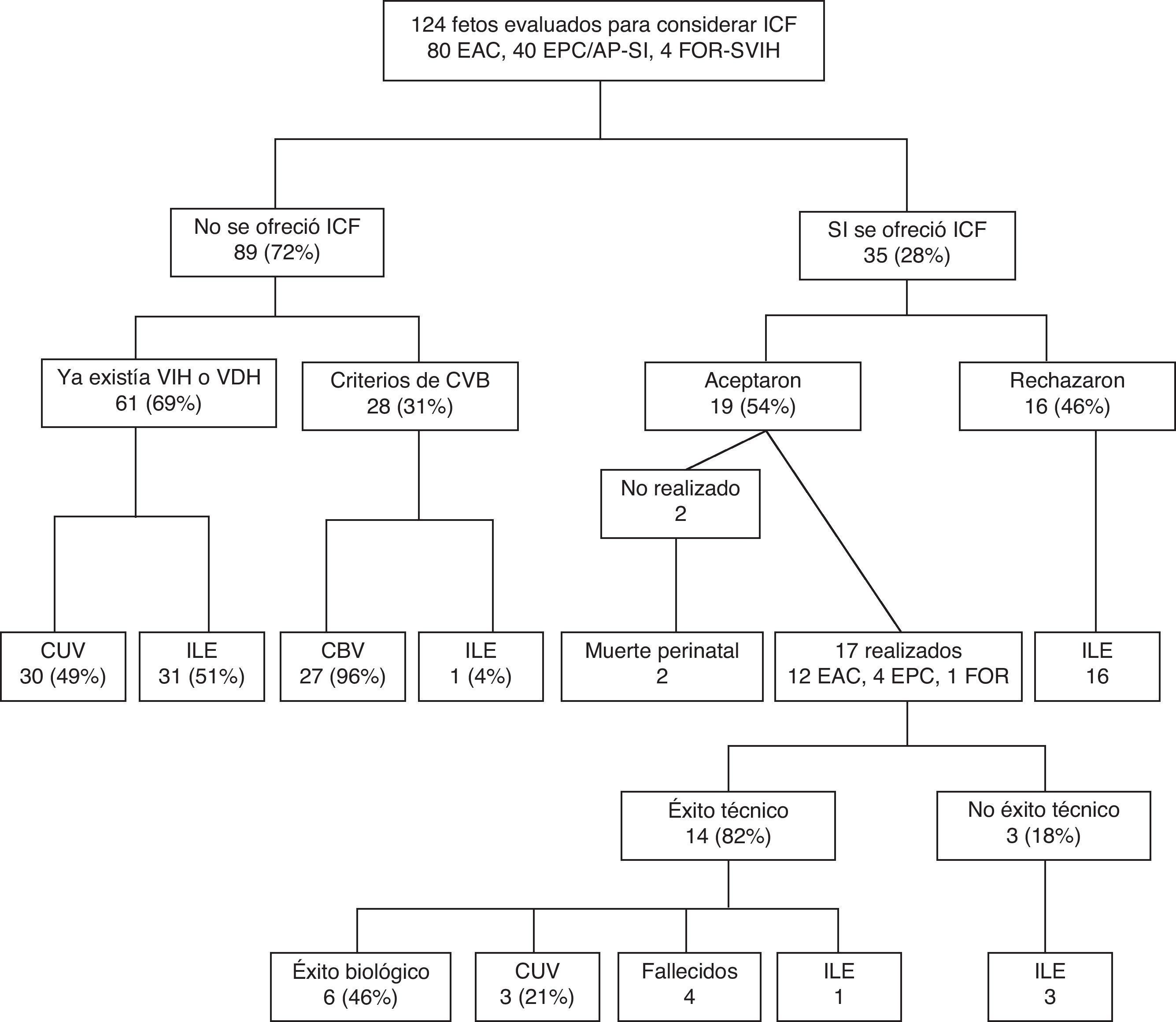
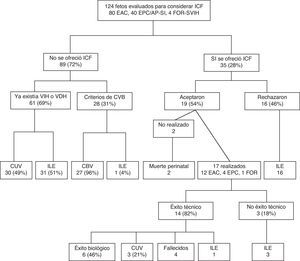
Los resultados del ICF, como sucede con otros muchos procedimientos, son muy dependientes de la experiencia del grupo y de la consabida curva de aprendizaje. Desde la puesta en marcha a finales del año 2003 del programa de ICF en el Hospital 12 de Octubre se han evaluado un total de 124 fetos con CC a priori candidatas a ICF, siendo la mayoría (96%) referidos desde otros. La figura 9 muestra el diagrama de flujo de estos pacientes. La mayoría (72%) no reunieron los criterios necesarios para considerar la realización del intervencionismo, bien porque la cavidad ventricular era extremadamente hipoplásica y, por tanto, irrecuperable en el momento del diagnóstico o bien por la presencia de criterios de evolución a CBV simplemente con el manejo postnatal convencional. Los resultados postnatales de estos fetos confirman la elevada precisión de los criterios predictivos prenatales, que permiten realizar una adecuada selección de los candidatos a ICF.
Diagrama de flujo de los pacientes evaluados en nuestra Unidad con cardiopatías congénitas a priori candidatas para intervencionismo cardiaco fetal entre 2003 y 2011.
CBV: circulación biventricular; CUV: circulación univentricular; EAC: estenosis aórtica crítica; EPC/AP-SI: estenosis pulmonar crítica/atresia pulmonar con septo interventricular íntegro; FOR-SVIH: foramen oval restrictivo en el contexto de síndrome de ventrículo izquierdo hipoplásico; ICF: intervencionismo cardiaco fetal; ILE: interrupción legal del embarazo; VDH: ventrículo derecho hipoplásico; VIH: ventrículo izquierdo hipoplásico.
Por otro lado, el ICF no llegó a realizarse en todos los fetos que cumplieron los criterios de selección. Cerca de la mitad de los padres optaron por la ILE (46%) y una pequeña proporción de fetos fallecieron antes de la realización de la técnica. En nuestra serie tan solo en un 14% (17/113) de los fetos evaluados se llevó a cabo un procedimiento de ICF (15% EAC, 10% EPC/AP-SI, 25% FOR-SVIH).
Los 17 ICF realizados se llevaron a cabo a una edad gestacional media de 23 semanas. El éxito técnico se logró en la mayoría (14/17, 82%). Los 3 restantes corresponden a un caso con un VI de tamaño límite en el que se produjo la muerte fetal durante la técnica antes de conseguir atravesar la válvula aórtica con el catéter y 2 casos en los que la necropsia demostró la existencia de una atresia aórtica. El éxito biológico se logró en 6 casos (46%). El resto corresponde a 4 muertes debidas al procedimiento, una ILE 2 semanas después de una valvuloplastia aórtica que había cursado con éxito técnico y 3 casos que evolucionaron a CUV.
Las complicaciones presentadas fueron similares en tipo y porcentaje a las publicadas en la literatura11–13, siendo especialmente frecuentes los episodios de bradicardia que precisaron medidas farmacológicas para su resolución (53%) y la aparición de hemopericardio tras la punción cardiaca (47%). En un 23% se constató la presencia de pequeños trombos intracardiacos y en el 12% se produjo la rotura accidental del balón.
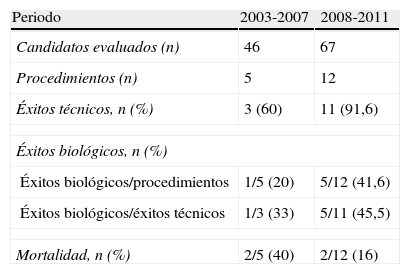
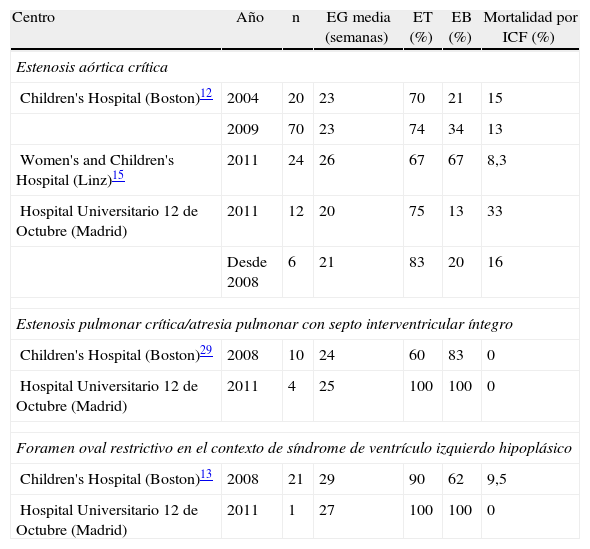
Con el fin de valorar la evolución de los resultados con la experiencia acumulada, se dividió el periodo de estudio en 2 cuatrienios observando un aumento del número de CC evaluadas e intervenidas en el segundo periodo. Esto se tradujo en una mejoría en nuestros resultados, tanto en la consecución del éxito técnico como del biológico, junto con una reducción de la mortalidad atribuible al procedimiento (tabla 4). La tabla 5 muestra nuestros resultados estratificados por el tipo de CC y comparados con los publicados por los centros de mayor experiencia.
Resultados del programa de intervencionismo cardiaco fetal en nuestra Unidad, divididos en 2 períodos similares de tiempo
| Periodo | 2003-2007 | 2008-2011 |
| Candidatos evaluados (n) | 46 | 67 |
| Procedimientos (n) | 5 | 12 |
| Éxitos técnicos, n (%) | 3 (60) | 11 (91,6) |
| Éxitos biológicos, n (%) | ||
| Éxitos biológicos/procedimientos | 1/5 (20) | 5/12 (41,6) |
| Éxitos biológicos/éxitos técnicos | 1/3 (33) | 5/11 (45,5) |
| Mortalidad, n (%) | 2/5 (40) | 2/12 (16) |
Resultados del intervencionismo cardiaco fetal en las diferentes entidades
| Centro | Año | n | EG media (semanas) | ET (%) | EB (%) | Mortalidad por ICF (%) |
| Estenosis aórtica crítica | ||||||
| Children's Hospital (Boston)12 | 2004 | 20 | 23 | 70 | 21 | 15 |
| 2009 | 70 | 23 | 74 | 34 | 13 | |
| Women's and Children's Hospital (Linz)15 | 2011 | 24 | 26 | 67 | 67 | 8,3 |
| Hospital Universitario 12 de Octubre (Madrid) | 2011 | 12 | 20 | 75 | 13 | 33 |
| Desde 2008 | 6 | 21 | 83 | 20 | 16 | |
| Estenosis pulmonar crítica/atresia pulmonar con septo interventricular íntegro | ||||||
| Children's Hospital (Boston)29 | 2008 | 10 | 24 | 60 | 83 | 0 |
| Hospital Universitario 12 de Octubre (Madrid) | 2011 | 4 | 25 | 100 | 100 | 0 |
| Foramen oval restrictivo en el contexto de síndrome de ventrículo izquierdo hipoplásico | ||||||
| Children's Hospital (Boston)13 | 2008 | 21 | 29 | 90 | 62 | 9,5 |
| Hospital Universitario 12 de Octubre (Madrid) | 2011 | 1 | 27 | 100 | 100 | 0 |
EB: éxito biológico; EG: edad gestacional; ET: éxito técnico; ICF: intervencionismo cardiaco fetal.
Con respecto a la EAC, la tasa de éxitos técnicos es similar en todas las series (75%). La tasa de éxitos biológicos, sin embargo, muestra una clara dependencia de factores como la experiencia del grupo y la edad gestacional a la que se realiza el procedimiento. Nuestra tasa de éxitos biológicos fue del 13%, alcanzando el 20% en el último cuatrienio. Del mismo modo, la mortalidad descendió de un 33 a un 16%. Estos resultados son similares a los que fueron descritos inicialmente por el grupo de Boston26 y que posteriormente, con la adquisición de una mayor experiencia, han ido mejorando12. Las elevadas tasas de éxito biológico obtenidas por el grupo de Linz pueden justificarse por la mayor edad gestacional de sus pacientes que se relaciona con una menor gravedad de los casos, el empleo de catéteres-balón más grandes y las diferencias en el tratamiento postnatal15. Aunque los resultados descritos pueden ser valorados con escepticismo, se debe tener en cuenta que, dados los estrictos criterios de selección seguidos, de no haberse realizado el ICF todos los pacientes habrían nacido con un VI hipoplásico.
La experiencia acumulada con la valvuloplastia pulmonar fetal es menor que con la aórtica y se reduce a casos aislados o pequeñas series27,28. La mayor corresponde al grupo de Boston, con 10 pacientes y éxito técnico en los 6 últimos casos realizados. En la mayoría se alcanza el éxito biológico29.
Con respecto al FOR-SVIH, los resultados actuales muestran que la atrioseptostomía intrauterina es técnicamente posible en el 90% de los casos, a lo cual sin duda contribuye su realización a una edad gestacional más tardía (29 semanas por término medio). Es efectiva en la mayoría de los casos (62%) aunque también en la mayoría (63%) es necesario repetir el procedimiento tras el nacimiento13. En cuanto a la supervivencia global tras la cirugía de Norwood, esta alcanza el 69% en los casos de FOR-SVIH intervenidos prenatalmente frente al 38% de los intervenidos postnatalmente según la experiencia del grupo de Boston, lo que demuestra la eficacia del ICF en esta indicación30.
ConclusiónEl desarrollo de la ecocardiografía fetal, los avances en el cribado de CC y la evolución técnica de la ecografía permiten una mejor identificación y remisión de los pacientes candidatos a ICF a las unidades de referencia. Una vez en ellas, el proceso de selección de candidatos es esencial para optimizar los resultados de un programa de ICF. Aunque actualmente somos capaces de predecir la evolución natural de los pacientes con CC susceptibles de ICF, todavía estamos lejos de conocer las causas que conducen o no al éxito biológico del ICF. Finalmente, el aumento en el número de diagnósticos prenatales de CC vía cribado morfológico en la primera mitad de la gestación y la concentración de los procedimientos de ICF permitirían acumular la experiencia suficiente para aproximar los resultados a los publicados por los centros con mayor volumen de pacientes y así entre todos dar los pasos suficientes para que este tipo de procedimientos abandonen la esfera de las terapias experimentales y se consoliden dentro del campo de la terapia fetal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de la información del manuscrito fue presentada en el XXVII Congreso Nacional de Ecografía Obstétrico-Ginecológica SESEGO, celebrado en Madrid los días 17 a 19 de mayo de 2012.