La preeclampsia continúa siendo una de las principales causas de morbilidad y mortalidad materna y perinatal. A pesar de su repercusión, hasta ahora no ha habido métodos adecuados para detectarla de forma temprana y prevenir complicaciones. Las estrategias de selección basadas en la presencia de factores de riesgo maternos no resultan eficientes. El empleo del Doppler de arterias uterinas no se ha conseguido imponer en la práctica habitual, pero en combinación con los nuevos marcadores angiogénicos sFlt-1 y PlGF se convierte en una herramienta con gran potencial para la predicción y el diagnóstico temprano de la preeclampsia.
En este artículo se discutirá la oportunidad de trasladar a la clínica diaria el estudio Doppler de arterias uterinas y los marcadores angiogénicos sFlt-1 y PlGF en función de los datos conocidos a través los estudios realizados recientemente.
Pre-eclampsia remains a principal cause of maternal and perinatal morbidity and mortality. Despite its repercussions, so far there have been no methods for early diagnosis and prevention of complications. Selection strategies based on the presence of maternal risk factors are not efficient. The use of uterine artery Doppler has not been accepted in routine practice, but in combination with new angiogenic markers sFlt-1 and PlGF it becomes a very powerful tool for the prediction and early diagnosis of pre-eclampsia.
This article will discuss the challenge of transferring the study of uterine artery Doppler and angiogenic markers sFlt-1 and PlGF to daily clinical practice in the light of the available data from recent studies.
La preeclampsia (PE) es un síndrome específico de la gestación que afecta al 2-5% de los embarazos y está involucrada en el 15% de las muertes maternas1. En mujeres con factores de riesgo muy alto, como hipertensión crónica, diabetes mellitus, obesidad, nefropatía o antecedente de PE en un embarazo previo, la probabilidad de tener una PE se eleva al 10-30%2.
La PE se caracteriza por un trastorno hipertensivo gestacional asociado a un daño vascular sistémico materno con particular afectación de los endotelios fenestrados presentes en el riñón, el hígado y el cerebro. Actualmente, la PE se define por consenso como la nueva aparición de hipertensión y proteinuria significativa a partir de la semana 20 de gestación, aunque se debe sospechar ante la presencia de hipertensión asociada a la alteración de cualquiera de sus órganos diana durante la segunda mitad del embarazo3.
El espectro clínico de la PE es muy amplio. El 80-90% de los casos son de presentación tardía (más allá de la semana 34 de gestación) y cursan habitualmente como formas leves sin repercusión en el pronóstico materno y/o fetal. El 10-20% restante aparecen de forma temprana (antes de la semana 34) y se asocian con más frecuencia a complicaciones maternas, como insuficiencia renal, fallo hepático, trastornos de la coagulación, hemorragia hepática, edema de pulmón, convulsiones (eclampsia) e ictus, así como con complicaciones fetales: retraso del crecimiento intrauterino y abruptio placentae4.
Por tanto, la PE es un trastorno complejo, que presenta varias dificultades para su control en la práctica clínica3,5,6 (tabla 1).
Limitaciones para el control médico de la preeclampsia
| 1. Predicción: no se dispone de métodos fiables en la práctica clínica para cribar adecuadamente a las gestantes con más riesgo de desarrollar una PE |
| 2. Definición y diagnóstico: los criterios vigentes presentan algunas limitaciones. |
| a. PE injertada: en gestantes con hipertensión y/o proteinuria previa resulta complejo establecer un diagnóstico de certeza |
| b. Diagnósticos tardíos: la presencia conjunta de hipertensión y proteinuria puede ser precedida de otras complicaciones. El 10-15% de los síndromes de HELLP y el 35-40% de las eclampsias debutan antes de que aparezca la hipertensión o la proteinuria |
| 3. Seguimiento: los principales dilemas en cuanto al tratamiento clínico se plantean en los casos tempranos, cuando la terminación del embarazo actúa en detrimento del pronóstico fetal y su continuación puede poner en riesgo la salud materna. |
| 4. Tratamiento: el único tratamiento eficaz conocido para detener el curso natural de la PE es la finalización del embarazo con la expulsión de la placenta. Los tratamientos profilácticos (ácido fólico, antioxidantes, calcio, aspirina) no han obtenido los resultados deseados para la prevención de la PE. Únicamente la aspirina y el calcio han mostrado algún beneficio en grupos de riesgo alto |
HELLP: hemólisis, elevación de enzimas hepáticas y plaquetopenia; PE: preeclampsia.
A pesar de estas limitaciones, se ha demostrado que la mejora de la actitud médica ante la PE, a partir de la evidencia científica y las guías de actuación, disminuye sustancialmente sus complicaciones maternas respecto a un tratamiento no estandarizado (de un 5,1% a un 0,7%; p<0,001; odds ratio [OR]=0,14; intervalo de confianza [IC] del 95%, 0,04-0,49)7. La mejora del pronóstico fetal puede conseguirse mediante el manejo expectante de los casos de PE grave que se inician antes de la semana 34 de gestación, para lo cual se precisa seleccionar de forma adecuada a las pacientes, evitando poner en riesgo la seguridad materna8.
Dado que la calidad de la atención médica resulta ser el único factor pronóstico modificable de la PE (tabla 2), se hace necesario incorporar nuevas herramientas que permitan sospechar de forma temprana su aparición y controlar su evolución. El estudio Doppler de las arterias uterinas se ha postulado durante las últimas 2 décadas como el método más prometedor para predecir la aparición de la PE, pero no se ha logrado introducir entre los controles obstétricos habituales, debido a su limitado valor predictivo positivo9. Recientemente se han producido grandes avances en la investigación sobre la PE, entre los que destaca el descubrimiento de la existencia de un desequilibrio en la producción y la liberación a la circulación materna de factores reguladores de la angiogénesis desde las placentas en situación de isquemia10. El empleo de estos factores angiogénicos puede complementar en varios aspectos al Doppler de arterias uterinas, lo que permitiría la introducción de ambos en la práctica habitual.
Principales determinantes del pronóstico materno y fetal en la preeclampsia5
| Edad gestacional en el momento del diagnóstico |
| Presencia o ausencia de criterios de gravedad |
| Presencia o ausencia de enfermedades predisponentes |
| Calidad de la atención médica |
El propósito fundamental de esta revisión es plantear, a partir de los conocimientos más actuales, cuáles pueden ser las futuras aplicaciones clínicas derivadas del estudio Doppler de las arterias uterinas en combinación con los marcadores angiogénicos involucrados en la patogenia de la PE.
MetodologíaLos artículos escogidos para esta revisión fueron identificados mediante una búsqueda de información a través de internet en la base de datos PubMed, utilizando los términos siguientes: «preeclampsia»; «angiogenesis»; «uterine artery Doppler»; «placental growth factor»; «soluble fms-like tyrosine kinase-1»; «sFlt-1»; «sVEGFR-1». Se seleccionaron los artículos originales y de revisión de mayor interés, especialmente aquellos en los que se alude al papel del Doppler de las arterias uterinas y/o los factores angiogénicos forma soluble de la proteína fms-like tyrosine kinase 1 (sFlt-1, también conocida como soluble vascular endotelial growth factor receptor 1 o sVEGFR-1) y placental growth factor (PlGF) para la predicción o el diagnóstico temprano de la PE.
Restricción del flujo placentario y desequilibrio angiogénico en la patogénesis de la preeclampsiaLa principal dificultad que hasta el momento se ha interpuesto en la mejora de la actitud clínica ante la PE es el desconocimiento acerca de aspectos fundamentales relacionados con su patogénesis. Se cree que si bien la PE se manifiesta clínicamente a partir de la segunda mitad del embarazo, su sustrato patogénico se establece durante la primera mitad y se debe a una placentación anómala. Los primeros cambios fisiopatológicos conocidos que conducen a la PE acontecen en la circulación uteroplacentaria, a consecuencia de un fallo en la invasión trofoblástica de los segmentos miometriales de las arterias espirales. Esto da lugar a un aumento de las resistencias vasculares que acaba produciendo una insuficiencia e isquemia placentaria. Estas resistencias pueden evaluarse de forma indirecta mediante el estudio Doppler de las arterias uterinas, puesto que a través de ellas pasa todo el flujo uteroplacentario, por lo que las resistencias en estos puntos reflejan los cambios ocurridos en el árbol vascular distal. De este modo, las arterias uterinas nos ofrecen un resumen global de las resistencias de la vascularización uterina.
Sin embargo, el fallo en la placentación no es suficiente para explicar el daño endotelial que origina el síndrome materno en la PE, ya que también se han encontrado alteraciones placentarias similares en casos de crecimiento intrauterino fetal restringido, e incluso en embarazos de curso normal11. Debe existir, por tanto, una relación entre una placentación insuficiente y la inducción de una lesión vascular materna, que podría estar mediada por factores liberados a la circulación general desde una placenta hipóxica.
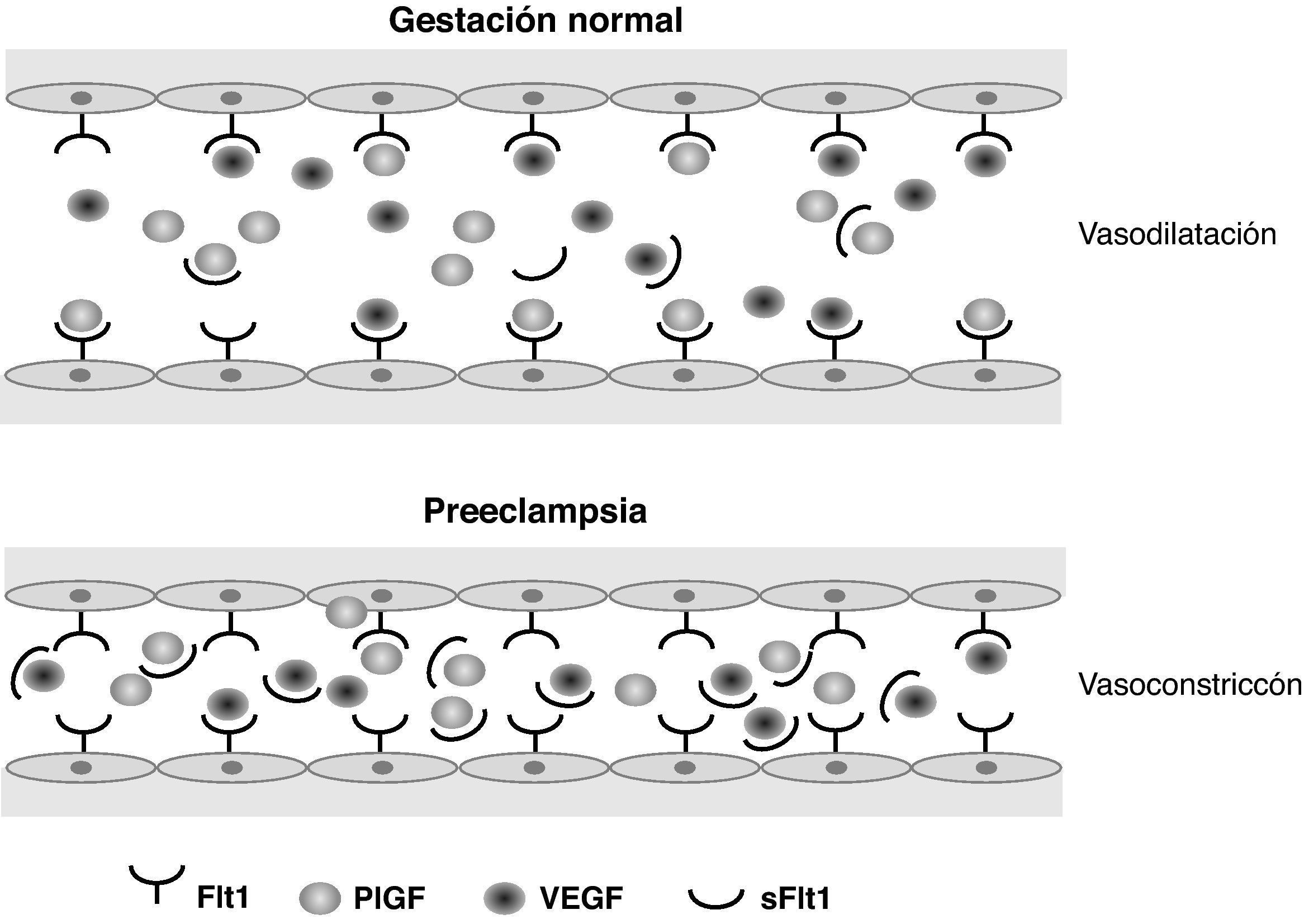
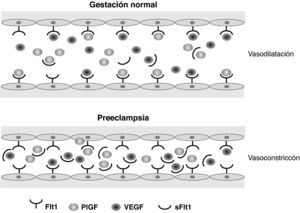
Los estudios sobre perfiles de expresión génica, iniciados hace ya más de 10 años, permitieron diferenciar algunas sustancias cuya formación se encontraba regulada al alza en tejidos placentarios de embarazos complicados con PE. De este modo, algunos grupos de investigación familiarizados con el estudio de la angiogénesis comenzaron a interrogarse acerca del aumento de la expresión en estos tejidos de la sFlt-1, que reconocieron como un importante factor implicado en la angiogénesis y la vasculogénesis en enfermedades oncológicas y nefrológicas. Esto dio lugar a la realización de estudios sobre sueros de gestantes que padecieron PE. En ellos se encontraron también valores elevados de sFlt-1. Esta proteína actúa como un potente factor antiangiogénico endógeno antagonista de dos factores proangiogénicos conocidos como vascular endotelial growth factor (VEGF) y PlGF. La sFlt-1 se adhiere a los dominios de unión de PlGF y VEGF, variando la configuración de estas proteínas. Esto impide su interacción con los receptores endoteliales de superficie y, por tanto, induce la disfunción endotelial12 (fig. 1).
Esquema representativo del equilibrio normal entre factores angiogénicos circulantes, comparado con la disfunción endotelial inducida en la preeclampsia. Flt1: fms-like tyrosine kinase 1; PlGF: placental growth factor; sFlt1: soluble fms-like tyrosine kinase; VEGF: vascular endothelial growth factor.
Actualmente se cree que la sFlt-1 es un péptido involucrado de forma clave en el desarrollo de la PE. Se ha demostrado in vitro que las placentas hipóxicas expresan en mucha mayor cantidad la sFlt-1. De forma interesante, se han encontrado concentraciones aumentadas del ratio sFlt-1/PlGF en sueros de madres que desarrollan PE hasta 5 semanas antes de su establecimiento clínico. Dicho ratio también se encuentra aumentado en la PE injertada en enfermedades como la hipertensión crónica, el lupus eritematoso sistémico y la glomerulonefritis. Además, la gravedad de la PE se ha correlacionado positivamente con las concentraciones circulantes del ratio sFlt-1/PlGF. Por último, también se ha observado que los valores de sFlt-1/PlGF de las mujeres que han presentado una PE se normalizan tras el parto. En modelos animales, la administración exógena de sFlt-1 en ratas gestantes induce hipertensión, proteinuria y endoteliosis glomerular, que son hallazgos similares a los encontrados en la PE humana13.
Predicción de la preeclampsiaEn la práctica clínica actual, no hay un método óptimo para seleccionar a las gestantes con un riesgo mayor de desarrollar una PE. Se ha propuesto el estudio Doppler ecográfico de las arterias uterinas maternas, con el fin de valorar de forma indirecta las resistencias al flujo uteroplacentario, como una forma de detectar a las gestantes con riesgo mayor de desarrollar una PE. Se trata de un método que, empleado entre las semanas 11-14 y 18-22 de gestación, alcanza una sensibilidad del 40-50 y del 60-70%, respectivamente, para predecir los casos de PE temprana y/o grave14,15. En embarazadas de riesgo alto los resultados alcanzados son más discretos15,16. Sin embargo, su empleo habitual no se ha extendido, ya que presenta un bajo valor predictivo positivo (situado alrededor del 20%) y hacen falta ecografistas experimentados para su medición17.
La consecución de un método de cribado para la PE más eficiente podría servir para mejorar nuestra capacidad de diferenciación, de manera que se pudiesen concentrar los esfuerzos en las gestantes en las que el cribado resultase positivo y disminuir la ansiedad en el grupo de embarazadas con factores de riesgo en el que resultara negativo. La inexistencia de un tratamiento efectivo disponible es la principal limitación para considerar necesaria la implantación de un cribado de la PE en la actualidad. Sin embargo, la correcta selección puede ser la clave para identificar a las mujeres que más se puedan beneficiar de medidas profilácticas18. En un reciente metanálisis se demuestra que la administración de ácido acetilsalicílico en dosis bajas (75-150mg/día) puede evitar aproximadamente un 10% de los casos de PE, siempre que se comience a administrar durante la primera mitad del embarazo y en gestantes de riesgo alto19. Por tanto, se cree que esta modesta acción preventiva de la aspirina podría potenciarse con la implantación de un cribado de la PE al final del primer trimestre. Aunque en esta etapa no se ha completado aún la implantación placentaria, algunos marcadores de PE ya se encuentran alterados. Uno de los marcadores que mejores resultados predictivos ha demostrado en esta edad gestacional es la PlGF. En combinación con otros marcadores bioquímicos, como la proteína placentaria A asociada al embarazo (PAPP-A), y ecográficos, como el estudio Doppler de las arterias uterinas, ha demostrado alcanzar una sensibilidad y una especificidad cercanas al 90% para la detección de la PE temprana según los resultados publicados por el grupo de Nicolaides, que todavía no han sido validados por otros grupos20. Esta estrategia de cribado resulta fácilmente implementable al cribado combinado de cromosomopatías, que ya se realiza de forma diaria en la mayoría de centros entre las semanas 11-14, sin la necesidad de añadir nuevas pruebas. Su principal desventaja es que algunos de estos marcadores no son independientes entre sí21,22.
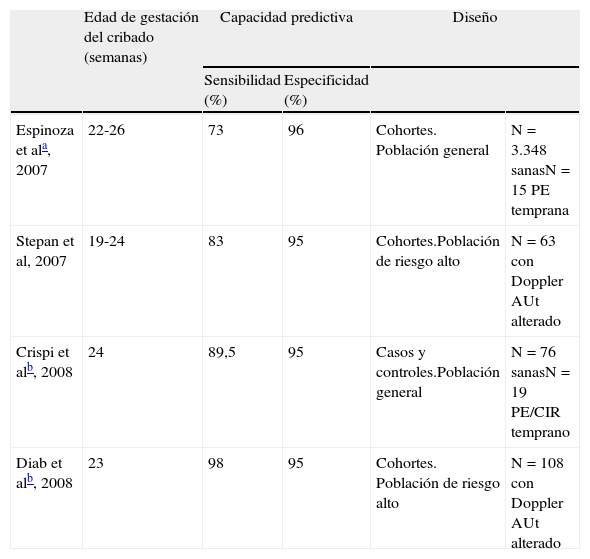
El sFlt-1 no ha demostrado su eficacia en el primer trimestre, pero sí en la segunda mitad del embarazo23. Entre las 20 y las 26 semanas de gestación, el empleo combinado de sFlt-1, PlGF y Doppler de las arterias uterinas ha demostrado, en diferentes estudios, un excelente rendimiento como prueba de cribado para la PE temprana (< 34 semanas), pero no para la tardía (tabla 3)24–27.
Rendimiento de la combinación del Doppler de arterias uterinas y los marcadores angiogénicos sFlt-1 y PlGF para la predicción de la preeclampsia temprana (< 34 semanas) en el segundo trimestre. Resumen de los estudios publicados
| Edad de gestación del cribado (semanas) | Capacidad predictiva | Diseño | |||
| Sensibilidad (%) | Especificidad (%) | ||||
| Espinoza et ala, 2007 | 22-26 | 73 | 96 | Cohortes. Población general | N=3.348 sanasN=15 PE temprana |
| Stepan et al, 2007 | 19-24 | 83 | 95 | Cohortes.Población de riesgo alto | N=63 con Doppler AUt alterado |
| Crispi et alb, 2008 | 24 | 89,5 | 95 | Casos y controles.Población general | N=76 sanasN=19 PE/CIR temprano |
| Diab et alb, 2008 | 23 | 98 | 95 | Cohortes. Población de riesgo alto | N=108 con Doppler AUt alterado |
CIR: crecimiento intrauterino restringido; Doppler AUt: estudio Doppler de arterias uterinas; PE: preeclampsia.
Por tanto, la aplicación de los nuevos marcadores angiogénicos en combinación con otros marcadores de PE ya conocidos, como el estudio Doppler de las arterias uterinas, ha puesto a nuestro alcance la posibilidad inimaginable hace tan solo pocos años de realizar un cribado eficiente de la PE al comienzo de la segunda mitad del embarazo.
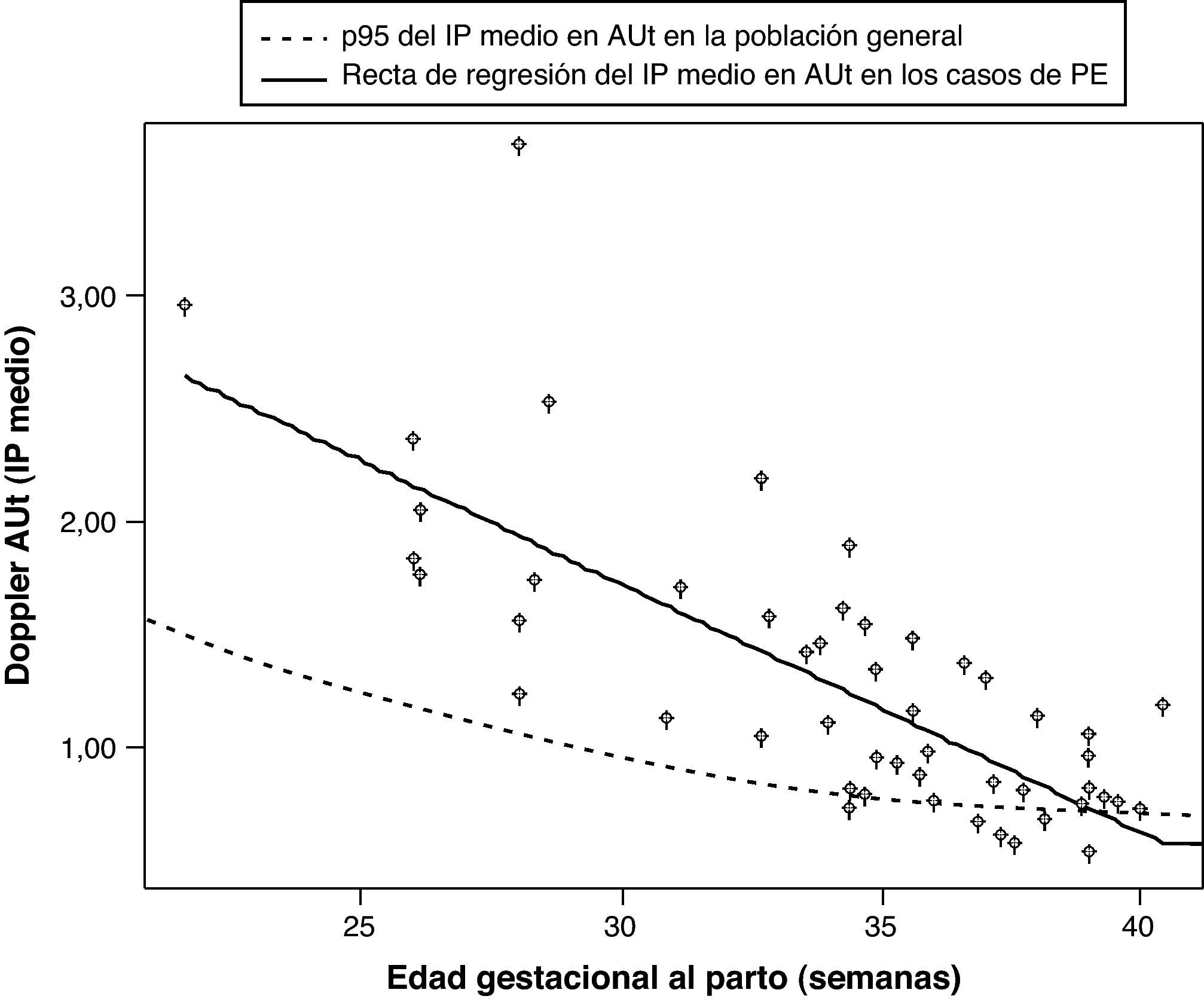
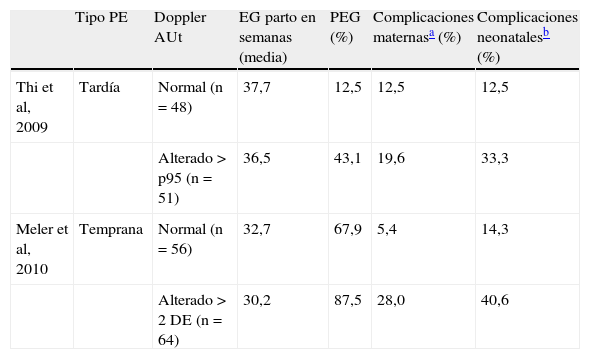
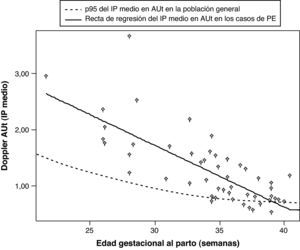
Ayuda al diagnósticoEn comparación con la gran cantidad de estudios que han investigado el valor predictivo del Doppler de arterias uterinas, hay muy pocos estudios que lo hayan evaluado tras el diagnóstico de PE, si bien recientemente se han publicado dos trabajos al respecto, que se resumen en la tabla 4. En ellos se concluye que la presencia de un Doppler alterado en las arterias uterinas se asocia de forma significativa con un peor pronóstico neonatal, tanto en la PE temprana28, como en la tardía29, y con un peor pronóstico materno en el caso de la PE temprana. En un tercer estudio se observó que las resistencias en las arterias uterinas se encontraban aumentadas en el 27% de las PE tardías y en el 62% de las tempranas, y que la alteración del Doppler en las arterias uterinas es un mejor predictor del pronóstico adverso fetal y materno que el estudio Doppler fetal de la arteria umbilical y cerebral media30. Estos resultados son similares a los obtenidos por nosotros (fig. 2).
Utilidad pronóstica del estudio Doppler de las arterias uterinas en gestantes con preeclampsia tardía (≥ 34 semanas) y temprana (< 34 semanas)
| Tipo PE | Doppler AUt | EG parto en semanas (media) | PEG (%) | Complicaciones maternasa (%) | Complicaciones neonatalesb (%) | |
| Thi et al, 2009 | Tardía | Normal (n=48) | 37,7 | 12,5 | 12,5 | 12,5 |
| Alterado>p95 (n=51) | 36,5 | 43,1 | 19,6 | 33,3 | ||
| Meler et al, 2010 | Temprana | Normal (n=56) | 32,7 | 67,9 | 5,4 | 14,3 |
| Alterado>2 DE (n=64) | 30,2 | 87,5 | 28,0 | 40,6 |
Doppler AUt: estudio Doppler de arterias uterinas; EG: edad gestacional; PE: preeclampsia; PEG: pequeño para la edad gestacional; > p95, mayor del percentil 95; > 2 DE, mayor de 2 desviaciones estándar.
Definido por Thi et al como la aparición de hipertensión grave o síndrome de HELLP, y por Meler et al, como la aparición de síndrome de HELLP, manifestaciones neurológicas, fallo renal agudo o edema de pulmón.
Definido por Thi et al como necesidad de ingreso en unidad de cuidados intensivos neonatal, y por Meler et al, como acidosis al nacimiento (pH<7,10 y exceso de base>12 mEq/l), Apgar < 7 a los 5 minutos, morbilidad neonatal significativa (convulsiones, hemorragia intraventricular ≥ Grado III, leucomalacia periventricular, encefalopatía hipóxico-isquémica) o mortalidad perinatal.
En cuanto a la utilidad de los marcadores angiogénicos, y en concreto del ratio sFlt-1/PlGF, para el diagnóstico de la PE, ésta se muestra incluso superior a su capacidad predictiva. Dos estudios recientes han demostrado que el ratio sFlt-1/PlGF tiene una sensibilidad y especificidad superior al 95% para el diagnóstico de la PE temprana31,32.
La certeza diagnóstica que aporta la elevación del ratio sFlt-1/PlGF puede resultar de gran utilidad para el manejo de algunas situaciones clínicas. Por ejemplo, en los casos de síndrome de HELLP que pueden cursar inicialmente sin hipertensión y/o proteinuria, el ratio sFlt-1/PlGF se muestra muy elevado. También ayuda a confirmar el difícil diagnóstico de PE injertada en gestantes con hipertensión y/o proteinuria previa, ya que el ratio sFlt-1/PlGF obtiene una concordancia casi perfecta con el diagnóstico clínico final20. Por último, el ratio sFlt-1/PlGF también ha mostrado utilidad para realizar el diagnóstico diferencial entre la PE y la agudización de otros trastornos que pueden simular el mismo cuadro clínico, como el síndrome nefrótico33, la crisis lúpica34 o la trombocitopenia35. En estos casos es de vital importancia realizar el diagnóstico diferencial para decidir si se continúa o no con la gestación, ya que si se trata de alguno de estos diagnósticos diferenciales puede intentarse un tratamiento curativo que prolongue el embarazo. Por tanto, la normalidad del ratio sFlt-1/PlGF en cuadros susceptibles de ser confundidos con una PE nos puede ayudar a evitar prematuridades iatrogénicas. La reciente automatización de los métodos para cuantificar la sFlt-1 y la PlGF permite su rápida obtención (< 20 minutos) y han sido aprobados en Europa para su uso clínico como ayuda al diagnóstico de la PE36,37.
Otra posible utilidad del ratio sFlt-1/PlGF es la predicción de complicaciones. En la actualidad se recomienda el manejo expectante de la PE temprana siempre que no haya una complicación que suponga un riesgo inminente para la salud de la madre y/o el feto38. Esta actitud permite la prolongación del embarazo y la consiguiente mejora del pronóstico del recién nacido, pero siempre se ve amenazada por la posible instauración de una complicación grave de la PE que en ocasiones se presenta de forma súbita e impredecible. De hecho, en uno de cada tres casos de PE temprana fracasa esta actitud expectante y es necesario finalizar la gestación de forma inmediata. Nuestra experiencia inicial indica que el ratio sFlt-1/PlGF se eleva especialmente antes de la aparición de las complicaciones más graves de PE39. Por tanto, el control de los valores de sFlt-1/PlGF en las mujeres que experimentan casos de PE temprana podría ayudar a decidir cuánto prolongar el manejo expectante, sin someterlas al riesgo de una complicación grave.
Por último, el descubrimiento de la implicación de los factores angiogénicos en el desencadenamiento de los mecanismos patogénicos de la PE ha dado lugar a la búsqueda de tratamientos dirigidos hacia estos factores. Por el momento, estos tratamientos se encuentran en fase experimental con animales, y se han obtenido resultados preliminares exitosos con el empleo de factores proangiogénicos recombinantes40. Si estos tratamientos se aplican en humanos en el futuro, será imprescindible determinar previamente los marcadores angiogénicos para conocer qué gestantes son susceptibles de beneficiarse con su empleo (tabla 5).
Posibles aplicaciones del Doppler de arterias uterinas y los marcadores angiogénicos en la práctica clínica
| 1. Predicción de la PE en la primera mitad del embarazo: |
| 1.1. Primer trimestre (11-14 semanas): selección de gestantes que se pueden beneficiar de medidas profilácticas como el AAS en dosis baja |
| 1.2. Segundo trimestre (20-24 semanas): selección de gestantes que se pueden beneficiar de un seguimiento intensivo |
| 2. Diagnóstico temprano: el ratio sFlt1/PlGF permite el diagnóstico de la PE hasta 5 semanas antes de la aparición de los signos y los síntomas clínicos |
| 3. Diagnóstico diferencial: |
| 3.1. Casos dudosos |
| 3.2. Casos atípicos |
| 4. Identificación de los casos favorables para el tratamiento conservador |
| 5. Selección de candidatas para futuros tratamientos preventivos y curativos |
AAS: ácido acetilsalicílico; PE: preeclampsia; PlGF: placental growth factor; sFlt1: soluble fms-like tyrosine kinase 1.
El empleo de estas herramientas de predicción y diagnóstico temprano puede suponer el mayor avance ocurrido en los últimos 30 años para el manejo de la PE. Sin embargo, es previsible que su disponibilidad se encuentre limitada tanto por su coste económico para la determinación del ratio sFlt-1/PlGF, como por la necesidad de especialistas para la medición del Doppler en las arterias uterinas. Por tanto, se hace necesaria la racionalización de su uso.
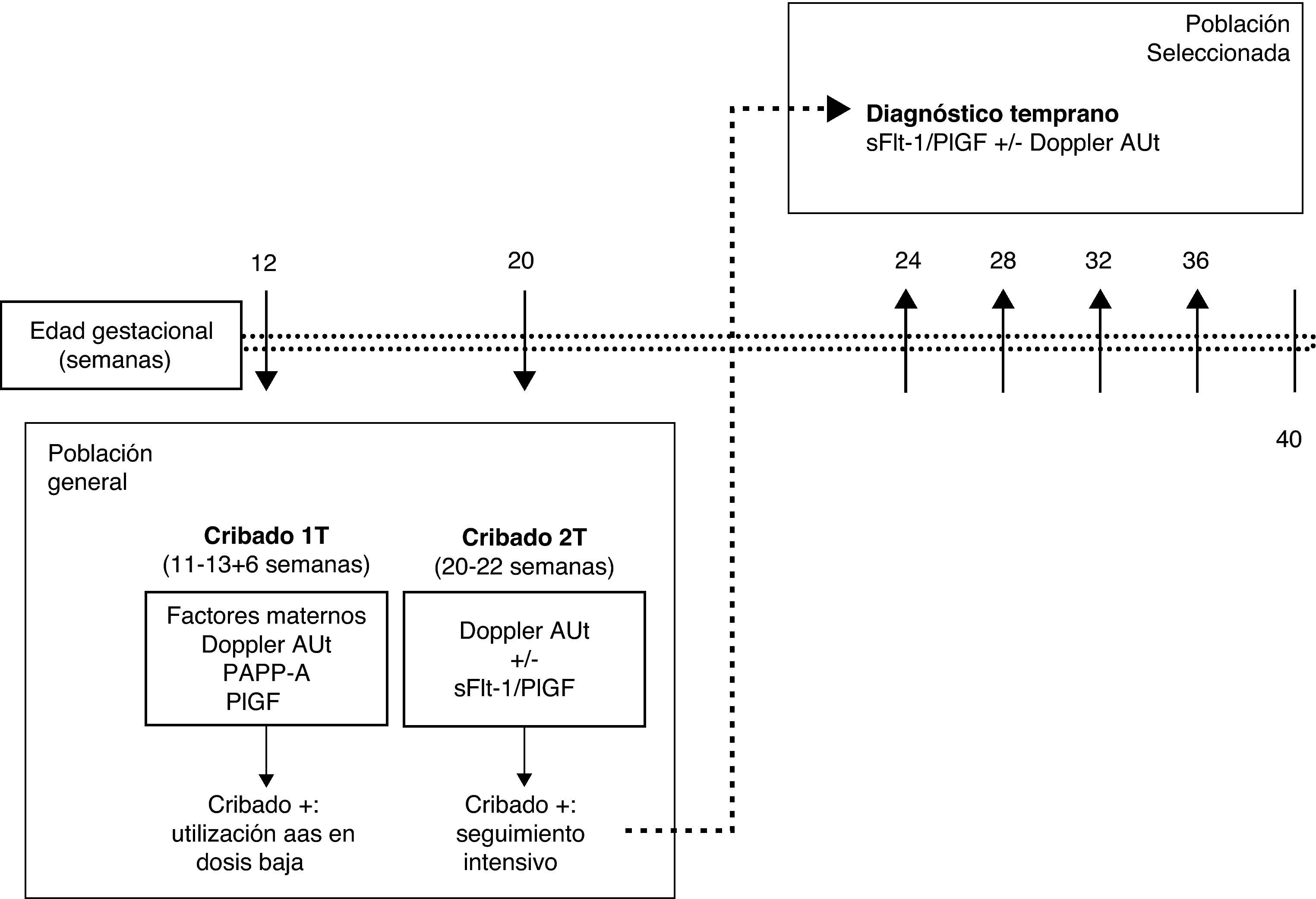
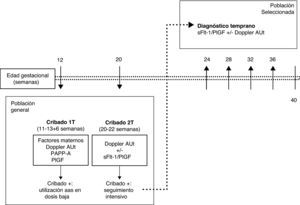
La realización de un cribado de la PE en el primer trimestre únicamente supone añadir la medición del Doppler de arterias uterinas y la PlGF a la ecografía y analítica, que ya se realizan habitualmente para el cribado de cromosomopatías del primer trimestre. Las gestantes con un cribado positivo podrían beneficiarse del uso de aspirina en dosis baja desde edades gestacionales tempranas. El riesgo de PE puede reevaluarse en la ecografía del segundo trimestre mediante una nueva medición del Doppler de arterias uterinas. Las gestantes en las que persista un riesgo alto de desarrollar PE podrían ser seleccionadas para su seguimiento durante la segunda mitad del embarazo mediante la determinación seriada del ratio sFlt-1/PlGF. Si el valor del ratio es normal, se puede diferir el siguiente control hasta 4-5 semanas. Si el ratio aumenta, se debe intensificar el seguimiento, ya que es muy probable que se inicie una PE en los días o semanas siguientes (fig. 3).
Estrategia para la aplicación clínica racional del Doppler de arterias uterinas y el ratio sFlt-1/PlGF para la predicción y diagnóstico temprano de la preeclampsia.; AAS, ácido acetilsalicílico; Cribado 1T: cribado del primer trimestre; Cribado 2T: cribado del segundo trimestre; Doppler AUt: estudio Doppler de arterias uterinas; PAPP-A: pregnancy-associated plasma protein-A; PlGF: placental growth factor; s-Flt-1: soluble fms-like tyrosine kinase-1.
En los últimos años se ha producido un gran avance en la comprensión de la PE con el descubrimiento del papel que desempeñan en este trastorno varios factores reguladores de la angiogénesis, como la sFlt-1 y PlGF. En Europa ya disponemos de la posibilidad de obtener el ratio sFlt-1/PlGF y aplicarlo con propósitos clínicos para la ayuda al diagnóstico de PE. Su empleo en combinación con la información aportada por el estudio Doppler de las arterias uterinas resulta muy prometedor para la predicción y el diagnóstico temprano de la PE. Esto puede suponer un paso adelante trascendental para optimizar el tratamiento de la PE. Es el momento de comenzar a aplicar estos conocimientos en la práctica clínica a partir de los datos obtenidos por los estudios existentes, para poder demostrar si estas herramientas diagnósticas nos ayudan a disminuir la importante morbilidad y mortalidad que todavía ocasiona la PE en nuestros tiempos.
Conflicto de interesesLos autores I.H. y A.G. han participado como investigadores (sin percibir remuneración directa) en un estudio multicéntrico europeo para la validación de un método automatizado de medición del ratio sFlt1/PlGF patrocinado por Roche Diagnostics, Penzberg, Alemania.