Comparar las concentraciones de endostatina sérica en eclámpticas, preeclámpticas y embarazadas normotensas.
Materiales y métodoSe incluyó a 30 pacientes con preeclampsia leve (grupo A), a 30 pacientes con preeclampsia grave (grupo B) y a 30 pacientes con eclampsia (grupo C). El grupo control fue seleccionado por tener edad e índice de masa corporal similares a los de los grupos en estudio y consistió en 30 embarazadas sanas (grupo D). Solo se incluyó a pacientes nulíparas. Las muestras de sangre se recolectaron antes del parto y, en los grupos en estudio, inmediatamente después del diagnóstico para la determinación de endostatina sérica.
ResultadosLos valores más altos de endostatina se observaron en el grupo de pacientes eclámpticas junto con las preeclámpticas graves. Se encontraron valores más bajos en las preeclámpticas leves. Los grupos en estudio presentaron valores de endostatina significativamente superiores a los controles (p<0,05). El análisis de regresión lineal mostró que los factores que afectaban significativamente la concentración plasmática de endostatina fueron el ácido úrico y la proteinuria en 24 h (p<0,05).
ConclusiónLas pacientes eclámpticas y preeclámpticas presentan concentraciones de endostatina sérica más altas que las embarazadas normotensas.
To compare serum endostatin concentrations in eclamptic, pre-eclamptic and normotensive pregnant women.
Materials and methodThe study included 30 patients with mild preeclampsia (group A), 30 patients with severe pre-eclampsia (group B), and 30 patients with eclampsia (group C). A control group, consisting of 30 healthy pregnant women of similar age and body mass index to the studiy groups, was selected (group D). Only nuliparous patients were included. Blood samples were collected for serum endostatin determination from all patients before delivery, and from the study groups immediately after diagnosis.
ResultsHigher values of endostatin were observed in eclamptic patients together with severe pre-eclamptic patients. Lower values were found in mild pre-eclamptic patients. The study groups had significantly higher values of endostatin compared with the control group (P<.05). Linear regression analysis, found that factors that significantly affected plasma endostatin concentrations were uric acid and 24-hour proteinuria.
ConclusionThe findings of this study showed that eclamptic and pre-eclamptic patients had higher serum endostatin concentrations than normotensive pregnant women.
La preeclampsia es una causa importante de morbimortalidad materna y perinatal. Las complicaciones maternas incluyen coagulopatía, insuficiencia renal y enfermedad cerebrovascular hemorrágica1. La disfunción endotelial provoca vasoconstricción generalizada, activación plaquetaria, trombosis y disminución del volumen plasmático, con posterior reducción del flujo sanguíneo a múltiples órganos2. El principal hallazgo fisiopatológico de la preeclampsia es la alteración de la vasodilatación de los vasos maternos, mediada por diferentes compuestos que se producen en el endotelio3.
La endostatina, una proteína de 20 Kd, es un fragmento de unión de la región terminal C del colágeno xviii4, el cual está localizado en la membrana basal de los vasos sanguíneos5. Es una molécula de la matriz extracelular con un potente factor antiangiogénico6,7. Ejerce sus efectos al inhibir la proliferación, migración y formación de túbulos mientras induce directamente la apoptosis de las células endoteliales8. Estas células y los pericitos microvasculares humanos producen endostatina7, la cual es regulada por la hipoxia. Además, se ha demostrado que la administración exógena de endostatina causa una marcada reducción en las concentraciones de las proteínas antiapoptoicas bcl-2 y bcl-xl, sin afectar las concentraciones de la proteína proapoptoica bax.
Se conocen 4 estudios previos del potencial papel de la endostatina en la preeclampsia y ninguno de ellos ha manejado los diferentes estadios de la enfermedad o las concentraciones en las pacientes con eclampsia. Dos de los estudios9,10 demostraron concentraciones más altas de endostatina en preeclámpticas que en embarazadas controles sanas. En el tercer estudio11, se demostró que las concentraciones séricas de endostatina estaban elevadas a las 16-20 semanas en mujeres que posteriormente desarrollaban preeclampsia. Un estudio más reciente12 demostró que las mujeres con aparición de preeclampsia en etapas más tempranas (antes de las 32 semanas) tienen concentraciones más elevadas de endostatina que las pacientes en las que la enfermedad aparece en forma más tardía (después de las 35 semanas)9–11.
El objetivo de la investigación fue comparar las concentraciones séricas de endostatina en eclámpticas, preeclámpticas y embarazadas normotensas.
MétodosEste estudio de casos y controles se realizó en el Servicio de Obstetricia del Hospital Central Dr. Urquinaona en Maracaibo, Venezuela, de enero del 2006 a febrero del 2012. El Comité de Ética del hospital aprobó el estudio. Se incluyó a 30 pacientes con preeclampsia leve (grupo A), a 30 pacientes con preeclampsia grave (grupo B) y a 30 pacientes con eclampsia (grupo C). El grupo control fue seleccionado por tener edad materna e índice de masa corporal similares a los de los grupos en estudio y consistió en 30 embarazadas sanas sin enfermedades obstétricas o sistémicas (grupo D). Solo se incluyó a pacientes nulíparas en la investigación.
La preeclampsia leve se definió como la presión arterial sistólica de 140mm de Hg o más o presión arterial diastólica de 90mm de Hg o más confirmada por 6 o más horas de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24 h, o 1 a 2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación. La preeclampsia grave se definió si la presión arterial diastólica estaba por encima de 110mm de Hg o la presión arterial sistólica era de 160mm de Hg o más, junto con 3 cruces de proteinuria en un examen cualitativo o 5g en una muestra de orina de 24 h, con presencia de cefalea, alteraciones visuales, dolor abdominal, oliguria (menos de 500ml/24 h), hiperbilirrubinemia, elevación de las concentraciones séricas de creatinina (mayor de 1,0mg/dl), trombocitopenia (menos de 150.000 mm3) y elevación de las concentraciones de las transaminasas después de las 20 semanas de gestación. La eclampsia se definió como la aparición de convulsiones o coma en pacientes con signos y síntomas de preeclampsia. La presión sanguínea se midió en posición sentada después de 15 min de descanso.
Se excluyó a las embarazadas polihidramnios, con hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), con sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor al percentil 10 de referencia), con síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), en tratamiento con antihipertensivos, con enfermedad cardiaca, hepática, renal o sistémica crónica, diabetes mellitus pre- o gestacional, hábito tabáquico. También se excluyó a las pacientes que se negaron a participar en la investigación.
Las muestras de sangre se recolectaron en un tubo libre de pirógenos en todas las pacientes antes del parto y, en los grupos en estudio, inmediatamente después del diagnóstico y antes de cualquier intervención. Las muestras fueron centrifugadas inmediatamente después de que se produjera la coagulación a temperatura ambiente y el sobrenadante del suero fue separado y almacenado a -20°C. La determinación de las concentraciones de endostatina fue realizada utilizando una prueba de ELISA (R&D Systems, Inc., EE. UU.). Todas las mediciones fueron hechas por duplicado y el promedio fue utilizado como resultado final. La sensibilidad fue de 2 ng/ml. El coeficiente de variación intra- e interensayo fue menor del 10%.
Los datos se presentan como valores promedios ± desviación estándar. El análisis estadístico entre los grupos se realizó con la prueba de ANOVA con posprueba de Dunnett para comparar las características demográficas, el promedio de presión arterial y las concentraciones de endostatina entre los grupos, tomando como controles a las normotensas sanas (grupo D). Los coeficientes de correlación entre la endostatina y los parámetros de laboratorio en las preeclámpticas y eclámpticas se evaluaron usando la prueba de Pearson. Se consideró un valor p<0,05 como estadísticamente significativo.
ResultadosLas características generales de las pacientes de los 4 grupos se muestran en la tabla 1. No hubo diferencias significativas en la edad materna ni en el índice de masa corporal entre los controles y los grupos en estudio. Se encontraron diferencias estadísticamente significativas en la edad gestacional al momento del parto entre los grupos B y C comparada con los controles (p<0,05). También se encontraron diferencias estadísticamente significativas entre los controles y los 3 grupos de estudio con respecto al peso de los recién nacidos (p<0,05). Se observaron diferencias estadísticas en los valores promedio de presión arterial sistólica, presión arterial diastólica y proteinuria de los 3 grupos en estudio comparados con los controles (p<0,05).
Características generales de los grupos de estudio y control
| Grupo A Preeclampsia leve (n = 30) | Grupo B Preeclampsia grave (n = 30) | Grupo C Eclampsia (n = 30) | Grupo D Controles (n = 30) | |
| Edad materna, años | 20,4 ± 2,2 | 20,1 ± 2,5 | 21,6 ± 3,2 | 21,3 ± 1,8 |
| Edad gestacional al momento del parto, semanas | 37,0 ± 1,7 | 34,1 ± 1,3* | 34,7 ± 1,9* | 37,6 ± 1,78 |
| Índice de masa corporal, kg/m2 | 27,9 ± 1,1 | 27,4 ± 1,2 | 27,1 ± 0,8 | 27,6 ± 0,8 |
| Peso del recién nacido, gramos | 2.845 ± 295* | 2.319 ± 357* | 2.041 ± 301* | 3.251 ± 469 |
| Presión arterial sistólica, mm de Hg | 136,0 ± 6,7* | 152,3 ± 7,7* | 142,3 ± 13,3* | 104,9 ± 6,59 |
| Presión arterial diastólica, mm de Hg | 97,6 ± 5,0* | 110,3 ± 6,1* | 112,3 ± 6,9* | 73,9 ± 7,7 |
| Proteinuria, g/24 h | 1,7 ± 0,6* | 5,6 ± 0,8* | 6,2 ± 1,1* | 0,2 ± 0,1 |
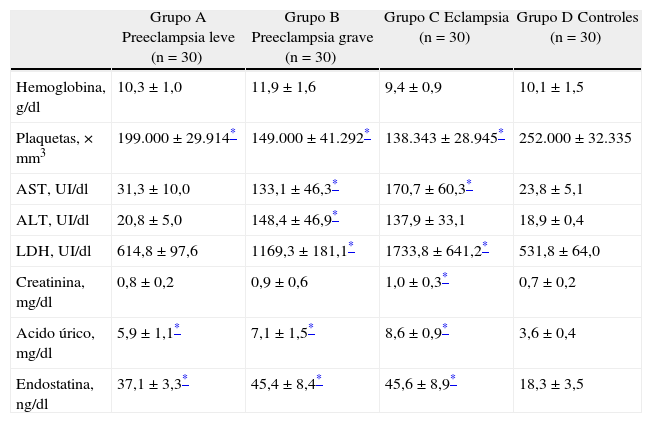
Las pacientes con preeclampsia grave presentaron las mayores concentraciones de hemoglobina de los 4 grupos estudiados, siendo esta diferencia estadísticamente significativa comparada con los controles (p<0,05). Las preeclámpticas graves y las eclámpticas presentaron valores más altos de transaminasas, deshidrogenasa láctica y ácido úrico comparados con los controles (p<0,05) (tabla 2). Los niveles promedio de plaquetas fueron significativamente menores en los 3 grupos de estudio comparados con los controles (p<0,05).
Parámetros de laboratorio grupos estudio y control
| Grupo A Preeclampsia leve (n = 30) | Grupo B Preeclampsia grave (n = 30) | Grupo C Eclampsia (n = 30) | Grupo D Controles (n = 30) | |
| Hemoglobina, g/dl | 10,3 ± 1,0 | 11,9 ± 1,6 | 9,4 ± 0,9 | 10,1 ± 1,5 |
| Plaquetas, × mm3 | 199.000 ± 29.914* | 149.000 ± 41.292* | 138.343 ± 28.945* | 252.000 ± 32.335 |
| AST, UI/dl | 31,3 ± 10,0 | 133,1 ± 46,3* | 170,7 ± 60,3* | 23,8 ± 5,1 |
| ALT, UI/dl | 20,8 ± 5,0 | 148,4 ± 46,9* | 137,9 ± 33,1 | 18,9 ± 0,4 |
| LDH, UI/dl | 614,8 ± 97,6 | 1169,3 ± 181,1* | 1733,8 ± 641,2* | 531,8 ± 64,0 |
| Creatinina, mg/dl | 0,8 ± 0,2 | 0,9 ± 0,6 | 1,0 ± 0,3* | 0,7 ± 0,2 |
| Acido úrico, mg/dl | 5,9 ± 1,1* | 7,1 ± 1,5* | 8,6 ± 0,9* | 3,6 ± 0,4 |
| Endostatina, ng/dl | 37,1 ± 3,3* | 45,4 ± 8,4* | 45,6 ± 8,9* | 18,3 ± 3,5 |
Las concentraciones de endostatina en cada uno de los grupos se muestran en la tabla 2. Los valores más elevados se observaron en el grupo de pacientes eclámpticas (45,6 ± 8,9 ng/ml) junto con las preeclámpticas graves (45,4 ± 8,4 ng/ml). También se encontraron valores elevados en las preeclámpticas leves (37,1 ± 3,3 ng/ml). Los grupos en estudio presentaron valores de endostatina significativamente superiores a los controles (18,3 ± 3,5 ng/ml; p<0,05).
Al correlacionar las concentraciones de endostatina con los diferentes parámetros de laboratorio, se observó una correlación positiva y significativa con los valores de proteinuria en 24 h (r = 0,440; p<0,05), ALT (r = 0,406; p<0,05), AST (r = 0,401; p<0,05) y LDH (r = 0,372; p<0,05) y correlación negativa y significativa con el número de plaquetas (r = -0,214; p<0,05). El análisis de regresión lineal mostró que los factores que modificaban significativamente la concentración plasmática de endostatina eran: el valor de la proteinuria en 24 h y las concentraciones de ácido úrico (p<0,05).
DiscusiónLos resultados de esta investigación demuestran que las pacientes eclámpticas y preeclámpticas tienen concentraciones plasmáticas de endostatina más altas comparadas con las pacientes normotensas. También se demostró que las concentraciones de endostatina se correlacionan en forma positiva con la proteinuria en 24 h, las aminotransaminasas y la deshidrogenasa láctica, y en forma negativa con el número de plaquetas.
En la preeclampsia, las células mononucleares sanguíneas aumentan la respuesta Th1 y disminuyen la actividad Th2, reflejando el hecho de que las citocinas que son benéficas para el embarazo disminuyen sus concentraciones en las preeclámpticas13. Las citocinas Th1 (como el factor de necrosis tumoral alfa) están aumentadas en la preeclampsia y disminuyen potencialmente la vasodilatación dependiente del endotelio14. Por lo tanto, un cambio hacia la respuesta proinflamatoria puede llevar a la activación de las células endoteliales, lo cual resultaría en un aumento en las concentraciones de endostatina.
La endostatina endógena afecta negativamente diferentes vías de señalización celular en el endotelio microvascular humano asociado a la actividad proangiogénica y, simultáneamente, aumenta la expresión de varios de los genes antiangiogénicos15. Se ha sugerido que las altas concentraciones representan en parte un mecanismo de defensa para proteger al organismo de la angiogénesis tumoral debido a que el sistema inmunológico materno reacciona a la invasión del trofoblasto como si este fuera una condición maligna, ya que el desarrollo placentario humano combina elementos de tumorogénesis y vasculogénesis16. En pacientes con linfoma no Hodgkin, las concentraciones de endostatina se asociaron en forma significativa con las concentraciones de factor de crecimiento vascular endotelial (VEGF), sugiriendo que esta asociación entre los factores de promoción e inhibición de la angiogénesis controlan la tasa de crecimiento del tumor17. Las alteraciones en la producción de endostatina no solo han sido detectadas en pacientes con varios tipos de cáncer sino también en pacientes con asma bronquial, lupus eritematoso o artritis reumatoidea18,19.
El incremento en las concentraciones de endostatina sérica, reportado en otra investigación previa y apoyado por los hallazgos de esta investigación, puede originarse de diferentes fuentes maternas, como las plaquetas o los vasos sanguíneos que tienen la capacidad de producir factores pro- y antiangiogénicos en ciertas condiciones. La potencial condición hipóxica e inflamatoria de la preeclampsia podría también inducir la liberación de este inhibidor por la placenta20. La endostatina bloquea la fosforilización inducida por el VEGF del receptor 2 del VEGF, disminuyendo la capacidad de señalización, induciendo la apoptosis, e inhibiendo la proliferación y migración de las células endoteliales a través de la señalización de la ciclina D1 y Wnt, respectivamente8,21. El efecto de inhibición afecta las interacciones de la matriz-células, ya que interactúa con la integrina en la superficie de las células endoteliales22. También bloquea la síntesis de óxido nítrico inducida por el VEGF. Todos estos efectos producen inhibición de la angiogénesis23. Además, puede agravar los efectos perniciosos del balance desfavorable del VEGF y sus antagonistas. Más aún, se puede unir a la quinasa de tirosina soluble similar al FMS y bloquear la interacción con el VEGF21.
Las altas concentraciones de endostatina en las preeclámpticas y eclámpticas podrían ser explicadas por la hipoxia que acompaña a las manifestaciones del síndrome, que modifica la producción7. En la placenta humana, el colágeno xviii está localizado en la membrana basal y en las células miofibroblásticas24, lo cual sugiere que este órgano puede ser una fuente de endostatina. Además, por una parte, la hipoxia puede afectar la síntesis o la degradación del colágeno xviii7. Sin embargo, a diferencia de los resultados de la presente investigación, Hirtenlehner et al.10 no reportaron aumento en las concentraciones de endostatina en embarazadas sanas comparadas con no embarazadas, sugiriendo que la placenta no contribuye a las concentraciones de endostatina sérica. Se ha documentado que, en condiciones de hipoxia, la producción de VEGF es inducida en las células endoteliales y pericitos, resultando en la promoción del crecimiento de las células endoteliales y la formación de túbulos25. En condiciones de bajas concentraciones de oxígeno, se produce una disminución en las sustancias estimulantes de la angiogénesis, favoreciendo la inhibición de esta7.
La preeclampsia está asociada a un incremento de la apoptosis del citotrofoblasto placentario, lo cual incrementa la cantidad de los desechos del sincicio celular observados en la preeclampsia26,27. Los desechos del sincicio celular son la causa de la disfunción de las células endoteliales in vivo y en vasos aislados y podría ser importante en la patogénesis y el mantenimiento del síndrome materno en la preeclampsia28. El hallazgo de altas concentraciones de endostatina podría ser la causa de la apoptosis placentaria.
Hasta donde se conoce, este estudio es el primero de pocas investigaciones sobre endostatina que reporta una correlación significativa entre las concentraciones séricas de endostatina y algunos de los parámetros de funcionalismo renal (proteinuria y ácido úrico) en preeclámpticas. Futrakul et al.29 describieron concentraciones elevadas de endostatina en pacientes con enfermedad renal crónica y alteraciones de la tasa de filtración glomerular. Sin embargo, en esa investigación no se reportaron los valores de proteinuria. Por otra parte, Chen y et al.30 encontraron una asociación positiva entre las concentraciones de endostatina y los valores de proteinuria (r = 0,663) en pacientes con enfermedad renal crónica. Estos datos sugieren que la endostatina puede llevar a alteración de la función renal, ya que se han reportado efectos inhibitorios de la endostatina sobre el mantenimiento de la estructura de los capilares glomerulares y en el proceso de reparación posterior a la lesión de las células endoteliales glomerulares y capilares peritubulares, expresión de sustancias y células angiogénicas endoteliales25. No se conoce ninguna investigación que aporte información sobre la relación con el ácido úrico, aunque una reducción del flujo sanguíneo hacia el riñón, lo que causa daño y alteración de la función, produce aumento de las concentraciones de este producto final del metabolismo de las purinas.
Las concentraciones elevadas de endostatina observadas en esta investigación pueden ser un componente mayor del plasma de las preeclámpticas, alterando el crecimiento y la función de las células endoteliales y contribuyendo a la aparición de las lesiones endoteliales observadas en la preeclampsia. También podrían producir efectos adversos en el proceso de desarrollo placentario como la angiogénesis, las ramificaciones de las vellosidades y la diferenciación del trofoblasto.
ConclusionesLos hallazgos de esta investigación demuestran que las pacientes eclámpticas y preeclámpticas presentan concentraciones de endostatina plasmática más altas que las embarazadas normotensas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.