Establecer las concentraciones de interleucina 6 en preeclámpsicas y embarazadas normotensas y relacionar los valores de los parámetros de velocimetría doppler de las arterias uterinas con las concentraciones séricas.
Material y métodosSe seleccionó a 160 sujetos. Se incluyó a 47 preeclámpsicas graves (grupo A), 33 preeclámpsicas leves (grupo B) y un grupo control con edades similares a los grupos de estudio de 80 embarazadas sanas (grupo C). Las muestras de sangre para la determinación de interleucina 6 y las mediciones de los índices de pulsatilidad, índice de resistencia y relación de flujo sistólico/diastólico de las arterias uterinas se realizaron en todas las pacientes antes del parto, e inmediatamente después del diagnóstico en las preeclámpsicas.
ResultadosLas pacientes de los grupos A y B presentaron concentraciones significativamente más elevadas de interleucina 6 que las embarazadas del grupo C (p < 0,05). Las mediciones del índice de pulsatilidad, índice de resistencia y relación de flujo sístole/diástole de las arterias uterinas mostraron valores significativamente más altos en ambos grupos de las preeclámpsicas (p < 0,05). Al correlacionar las concentraciones de interleucina 6 plasmáticas con los valores de velocimetría doppler de las arterias uterinas, se observó que esta era significativa con los 3 parámetros evaluados (p < 0,05).
ConclusionesLas preeclámpsicas presentan concentraciones plasmáticas de interleucina 6 más altas que las embarazadas normotensas y existe correlación significativa entre las concentraciones plasmáticas y los parámetros de velocimetría doppler de las arterias uterinas.
To determine interleukin-6 concentrations and analyse their relationship with doppler velocimetry in patients with preeclampsia and healthy normotensive pregnant women.
Material and methodsA total of 160 patients were selected, of whom 47 were patients with severe preeclampsia (group A), 33 with mild preeclampsia (group B), and 80 healthy pregnant women with ages similar to patients in the two study groups selected as controls (group C). Blood samples for interleukin-6 and measurements of pulsatility index, resistance index and systolic/diastolic blood flow ratio of uterine arteries were performed before labour on all patients, and immediately after diagnosis in the preeclampsia groups.
ResultsPatients in groups A and B (preeclampsia) had higher interleukin-6 concentrations than group C (P<.05). Measurements of pulsatility index, resistance index and systolic/diastolic blood flow ratio of uterine arteries were higher in both groups of preeclampsia patients (P<.05). There was a significant relationship between the plasma interleukin-6 concentrations and all three evaluated doppler velocimetry parameters (P<.05).
ConclusionPreeclampsia patients had higher plasma interleukin-6 concentrations than normotensive pregnant women, and there was a significant correlation between plasma concentrations and parameters of doppler velocimetry of uterine arteries.
Las células endoteliales han sido propuestas como el mayor contribuyente a la patogénesis de la preeclampsia1. La enfermedad hipertensiva del embarazo está caracterizada por los cambios en la placenta, vasculatura uteroplacentaria, riñones e hígado, consistentes con el daño endotelial. Se ha demostrado que en la preeclampsia existe hipertensión, hipersensibilidad vascular a los agentes presores, activación de los neutrófilos y de las plaquetas que son precursoras del daño endotelial2.
Las citocinas inflamatorias son conocidas como potentes activadores del endotelio vascular y han sido propuestas como las mediadoras de la disfunción endotelial en la preeclampsia2. Las citocinas proinflamatorias pueden inducir alteraciones estructurales y funcionales, incluyendo daño oxidativo o interferencia en los mecanismos de contracción/relajación vascular, llevando a alteraciones en la integridad y tono vascular y a la activación de los componentes de la coagulación3.
La interleucina-6 (IL-6) es producida por los linfocitos CD4 Th2 y los B, los macrófagos, células endoteliales y fibroblastos. Es una citocina multifuncional que regula las respuestas inmunes, reacciones inflamatorias de fase aguda, hematopoyesis y puede desempeñar un papel central en los mecanismos de defensa del huésped4. Se produce en los sitios de inflamación local y actúa sobre el hepatocito para estimular o suprimir la síntesis de reactantes de fase aguda. Tiene receptores de membrana que constan de una cadena alfa y otra beta, y se expresan en líneas celulares de macrófagos, hepatocitos y células B5. También parece que es uno de los más confiables y útiles marcadores circulantes de disfunción endotelial6.
El uso obstétrico de la ecografía doppler para la monitorización de los embarazos de alto riesgo es en la actualidad un procedimiento indispensable. Los resultados de los metaanálisis demuestran que se puede lograr una disminución significativa en la mortalidad materna y perinatal utilizando la ecografía doppler en comparación con el uso rutinario de la cardiotocografía fetal y la biometría por ultrasonido7.
En casos de hipertensión durante el embarazo y de preeclampsia, se han descrito los cambios patológicos específicos en el espectro del flujo doppler y se han correlacionado con los hallazgos histopatológicos como alteraciones en el desarrollo de las vellosidades, grandes áreas de infarto y disminución de las áreas de fijación decidual8. El número de pequeñas arterias en las vellosidades fetales está significativamente disminuido en los hallazgos patológicos doppler9. La dilatación insuficiente de las arterias espirales, la cual puede ser detectada por la ecografía doppler como resultado de una invasión trofoblástica deficiente, es actualmente considerada la base patogénica de la preeclampsia10.
Los estudios sobre los cambios en las concentraciones de citocinas en plasma y la posible relación con la velocimetría doppler son escasos y las posibles asociaciones no han sido confirmadas en forma consistente, por lo que el objetivo de la investigación fue establecer las concentraciones de IL-6 en preeclámpsicas y embarazadas normotensas, y comparar los valores de los parámetros de velocimetría doppler de las arterias uterinas de acuerdo con las concentraciones séricas.
Materiales y métodosEste estudio de casos y controles se realizó con embarazos de más de 32 semanas que acudieron a la urgencia obstétrica del Servicio de Obstetricia del Hospital Central Dr. Urquinaona de Maracaibo (Venezuela) en los que se obtuvieron las concentraciones plasmáticas de IL-6 y la velocimetría doppler del flujo sanguíneo de las arterias uterinas. La investigación fue aprobada por el Comité de Ética e Investigación del hospital y se obtuvo consentimiento por escrito de todas las pacientes.
Se incluyó a 80 mujeres con preeclampsia, de las cuales 47 pacientes tenían preeclampsia grave (grupo A) y 33 pacientes, preeclampsia leve (grupo B). El grupo control fue seleccionado por tener edad e índice de masa corporal similar a los grupos en estudio y consistió en 30 embarazadas sanas (grupo C). Solo se incluyó a pacientes nulíparas.
Se excluyó a las embarazadas con polihidramnios, hemorragia del tercer trimestre (desprendimiento prematuro de placenta, placenta previa), sospecha de restricción del crecimiento intrauterino del feto (circunferencia cefálica, circunferencia abdominal y longitud del fémur menor del percentil 10 de referencia con confirmación posnatal de peso menor al percentil 10 de referencia), síndrome de HELLP, alteraciones de la frecuencia cardiaca fetal, gestaciones múltiples, presencia de infección intrauterina (por ejemplo, corioamnionitis) o materna activa, enfermedad hipertensiva crónica (antes de las 20 semanas de embarazo), tratamiento con antihipertensivos, enfermedad cardiaca, hepática, renal o sistémica crónica, diabetes mellitus pre- o gestacional, hábito tabáquico. También se excluyó a las pacientes que se negaron a participar en la investigación.
La preeclampsia leve se definió como la presión arterial sistólica de 140mm de Hg o más o presión arterial diastólica de 90mm de Hg o más confirmada por 6 o más horas de diferencia, mientras que la proteinuria se definió como 300mg o más de proteína en una muestra de 24 h, o 1-2 cruces de proteinuria en un examen cualitativo después de las 20 semanas de gestación. La preeclampsia grave se definió si la presión arterial diastólica estaba por encima de 110mm de Hg o la presión arterial sistólica era de 160mm de Hg o más, junto con 3 cruces de proteinuria en un examen cualitativo o por lo menos 5g en una muestra de orina de 24 h, presencia de cefalea, alteraciones visuales, dolor abdominal, oliguria (menos de 500ml/24 h), hiperbilirrubinemia, elevación de las concentraciones séricas de creatinina (mayor de 1,0mg/dl), trombocitopenia (menos de 150.000 mm3) y elevación de las concentraciones de las transaminasas después de las 20 semanas de gestación.
En todas las pacientes se realizó la ecografía antes del uso de cualquier intervención. Se midieron el índice de pulsatilidad, el índice de resistencia y la relación del flujo sanguíneo sístole/diástole de las arterias uterinas. Las arterias uterinas fueron identificadas en una visualización longitudinal de las caras laterales del útero con la paciente reclinada y por vía abdominal. En esa posición se buscó la bifurcación de la arteria ilíaca común. La medición se realizó en el punto donde la arteria uterina y la ilíaca externa parecen cruzarse. En ese punto se midieron los parámetros de velocimetría doppler de ambas arterias uterinas y se calculó el promedio de ambos vasos.
Las muestras de sangre de la vena antecubital para la determinación de IL-6 se recolectaron en el momento de la realización de la evaluación doppler en ambos grupos de pacientes y antes de cualquier intervención en las preeclámpsicas. A todas las muestras se las dejó coagular a temperatura ambiente y se almacenaron a -70°C hasta el momento de procesarlas. Posteriormente, fueron centrifugadas a 1.000g por 15 min después de 60 min de la toma la muestra, y almacenadas con posterioridad a -80°C. Se utilizó una prueba de ELISA (R&D Systems, Minneapolis, EE. UU.) para la medición cuantitativa en cada muestra. Todas las mediciones fueron hechas por duplicado y el promedio fue el resultado final. La sensibilidad fue de 10 pg/ml. El coeficiente de variación intra- e interensayo fue menor del 10%.
Los datos se presentan como valores promedios ± desviación estándar. El análisis estadístico entre los grupos se realizó con la prueba de ANOVA con posprueba de Dunnett para comparar los datos sobre edad materna, edad gestacional, presión arterial sistólica y diastólica, concentraciones de IL-6, índice de pulsatilidad, índice de resistencia y relación del flujo sanguíneo sístole/diástole de las arterias uterinas entre las preeclámpsicas graves (grupo A), las preeclámpsicas leves (grupo B) y las embarazadas controles (grupo C). Posteriormente, las concentraciones de IL-6 se dividieron por cuartiles (concentración baja, media, alta y muy alta) y se compararon los valores promedio de los parámetros de velocimetría doppler de los cuartiles medio, alto y muy alto con el cuartil de concentraciones bajas utilizando la prueba de análisis de varianza con postest de Dunett. Los coeficientes de correlación entre la interleucina y los valores promedio de los parámetros de velocimetría doppler de las arterias uterinas se evaluaron mediante la prueba de Pearson. Se consideró p < 0,05 como estadísticamente significativa.
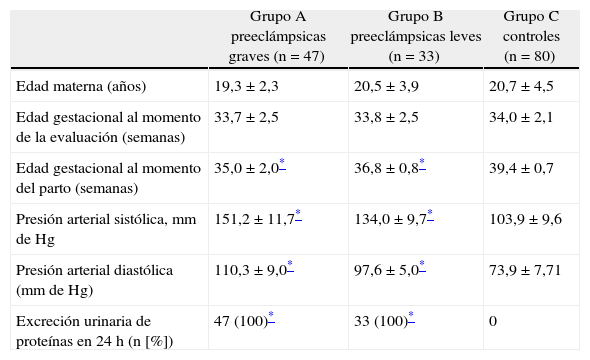
ResultadosLas características de las embarazadas de ambos grupos se muestran en la tabla 1. No se encontraron diferencias estadísticamente significativas en la edad materna y la edad gestacional al momento de la evaluación entre los 3 grupos de embarazadas (p = ns). Se encontraron diferencias estadísticamente significativas en la edad gestacional al momento de parto, promedio de presión arterial sistólica, presión arterial diastólica y el número de pacientes con excreción urinaria de proteínas en 24 h en las pacientes del grupo A y del grupo B con las embarazadas del grupo control (p < 0,05).
Características generales de las preeclámpsicas y controles normotensas sanas
| Grupo A preeclámpsicas graves (n = 47) | Grupo B preeclámpsicas leves (n = 33) | Grupo C controles (n = 80) | |
| Edad materna (años) | 19,3 ± 2,3 | 20,5 ± 3,9 | 20,7 ± 4,5 |
| Edad gestacional al momento de la evaluación (semanas) | 33,7 ± 2,5 | 33,8 ± 2,5 | 34,0 ± 2,1 |
| Edad gestacional al momento del parto (semanas) | 35,0 ± 2,0* | 36,8 ± 0,8* | 39,4 ± 0,7 |
| Presión arterial sistólica, mm de Hg | 151,2 ± 11,7* | 134,0 ± 9,7* | 103,9 ± 9,6 |
| Presión arterial diastólica (mm de Hg) | 110,3 ± 9,0* | 97,6 ± 5,0* | 73,9 ± 7,71 |
| Excreción urinaria de proteínas en 24 h (n [%]) | 47 (100)* | 33 (100)* | 0 |
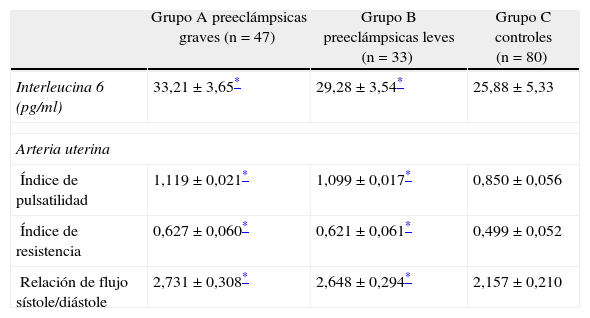
En la tabla 2 se muestran las concentraciones plasmáticas de IL-6 y los valores de la velocimetría doppler de los 2 grupos de estudio. Las pacientes del grupo A (33,21 ± 3,65 pg/ml) y del grupo B (29,28 ± 3,54 pg/ml) presentaron concentraciones significativamente más elevadas de IL-6 que las mujeres del grupo C (25,28 ± 5,73 pg/ml; p < 0,05). Las mediciones del índice de pulsatilidad, índice de resistencia y relación de flujo sístole/diástole de las arterias uterinas también demostraron valores significativamente más altos en las pacientes del grupo A y en las pacientes del grupo B comparadas con las embarazadas del grupo C (p < 0,05).
Concentraciones de interleucina 6 y determinaciones hemodinámicas doppler de la arteria uterina de las preeclámpsicas y controles normotensas sanas
| Grupo A preeclámpsicas graves (n = 47) | Grupo B preeclámpsicas leves (n = 33) | Grupo C controles (n = 80) | |
| Interleucina 6 (pg/ml) | 33,21 ± 3,65* | 29,28 ± 3,54* | 25,88 ± 5,33 |
| Arteria uterina | |||
| Índice de pulsatilidad | 1,119 ± 0,021* | 1,099 ± 0,017* | 0,850 ± 0,056 |
| Índice de resistencia | 0,627 ± 0,060* | 0,621 ± 0,061* | 0,499 ± 0,052 |
| Relación de flujo sístole/diástole | 2,731 ± 0,308* | 2,648 ± 0,294* | 2,157 ± 0,210 |
Al correlacionar las concentraciones de IL-6 plasmáticas con los valores de velocimetría doppler de las arterias uterinas, se observó que esta era moderada, positiva y significativa con los valores del índice de pulsatilidad (r = 0,600; p < 0,05), con el índice de resistencia (r = 0,474; p < 0,05) y con la relación de flujo sístole/diástole (r = 0,466; p < 0,05).
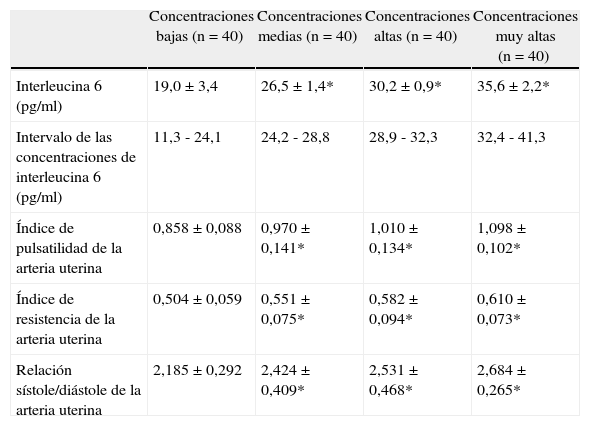
Los valores promedio de los diferentes parámetros de velocimetría doppler por cada cuartil de concentración de IL-6 se muestran en la tabla 3. Los valores promedio del índice de pulsatilidad, índice de resistencia y relación de flujo sanguíneo sístole/diástole fueron significativamente mas altos en los grupos con concentraciones moderadas, altas y muy altas de IL-6 al compararlas con aquellas pacientes con concentraciones bajas (p < 0,05).
Valores promedio de la velocimetría doppler de la arteria uterina de acuerdo a la concentración de interleucina 6 por cuartiles
| Concentraciones bajas (n = 40) | Concentraciones medias (n = 40) | Concentraciones altas (n = 40) | Concentraciones muy altas (n = 40) | |
| Interleucina 6 (pg/ml) | 19,0 ± 3,4 | 26,5 ± 1,4* | 30,2 ± 0,9* | 35,6 ± 2,2* |
| Intervalo de las concentraciones de interleucina 6 (pg/ml) | 11,3 - 24,1 | 24,2 - 28,8 | 28,9 - 32,3 | 32,4 - 41,3 |
| Índice de pulsatilidad de la arteria uterina | 0,858 ± 0,088 | 0,970 ± 0,141* | 1,010 ± 0,134* | 1,098 ± 0,102* |
| Índice de resistencia de la arteria uterina | 0,504 ± 0,059 | 0,551 ± 0,075* | 0,582 ± 0,094* | 0,610 ± 0,073* |
| Relación sístole/diástole de la arteria uterina | 2,185 ± 0,292 | 2,424 ± 0,409* | 2,531 ± 0,468* | 2,684 ± 0,265* |
Los resultados de esta investigación demuestran que las preeclámpsicas tienen concentraciones plasmáticas de IL-6 más altas que las embarazadas normotensas. También demuestran que las concentraciones de IL-6 presentan una correlación positiva con los valores de los parámetros de velocimetría doppler de la arteria uterina.
Aunque la patogénesis de la preeclampsia aún es desconocida, las causas inmunológicas e inflamatorias desempeñan un papel importante para la aparición de esta. La IL-6 y otras citocinas son componentes importantes de la respuesta inmune y, por lo tanto, pueden participar en los aspectos inmunes de la fisiopatología. Las citocinas proinflamatorias parecen estar involucradas en los eventos celulares para establecer y mantener el embarazo11; sin embargo, su papel no ha sido bien definido.
Greer et al.12 reportaron concentraciones plasmáticas altas de IL-6 y los valores se correlacionaron positivamente con los de la molécula de adhesión de células vasculares. Esto último, junto a otros datos, puede interpretarse como testimonio del daño endotelial, en el que estaría involucrada la citocina. Vince et al.13 han encontrado valores plasmáticos altos, al igual que los del receptor soluble del factor de necrosis tumoral, con correlación positiva entre estos, y entre la IL-6 y el factor de necrosis tumoral alfa.
La disfunción endotelial y el aumento de la permeabilidad son características de la fisiopatología de la preeclampsia. La IL-6 puede incrementar la permeabilidad de las células endoteliales cambiando la forma de las células y reordenando las fibras de actina intracelulares11,14. Puede disminuir la síntesis de prostaciclina inhibiendo la enzima cicloxigenasa15 e incrementa la relación tromboxano A2/prostaciclina, alteraciones descritas en la preeclampsia. También se puede observar estimulación del factor de crecimiento derivado de las plaquetas11. Los radicales libres pueden inducir la síntesis de IL-6 en el endotelio, los cuales están implicados en la patogénesis de la preeclampsia, ya que causan daño endotelial, lo cual lleva a la reducción de las síntesis de óxido nítrico y a la alteración del balance de las prostaglandinas16.
En la patogénesis de la aterosclerosis, los peróxidos lipídicos y el estrés oxidativo activan las células endoteliales a través de un mecanismo mediado por la NF-kappaB que lleva al incremento en la producción de IL-6, la cual está elevada en pacientes con enfermedad vascular aterosclerótica17. En el sistema de ese modelo, la IL-6 incrementa la producción de proteína C reactiva, la cual es un marcador de riesgo de enfermedad cardiaca coronaria, que se ha demostrado que se eleva en las preeclámpsicas18.
Las citocinas pueden tener un efecto tóxico que aumenta la producción de sintetasa de óxido nítrico, cicloxigenasa y liberación de radicales libres19. Estos hechos confirman la relación entre el aumento de las concentraciones de IL-6 y la inflamación o destrucción tisular y apoya los hallazgos encontrados en la presente investigación sobre la relación entre las modificaciones de la circulación sanguínea en las arterias uterinas y las concentraciones de IL-6.
El aumento de la resistencia de los vasos uterinos sugerido por la comparación de los hallazgos en las mediciones doppler (aumento del índice de pulsatilidad y resistencia y de la relación de flujo sístole/diástole) entre las preeclámpsicas y las embarazadas controles normotensas, demostrado por los datos de esta investigación, puede ser el resultado directo de un incremento inapropiado de la vasoconstricción acompañado de una disminución de la relajación dependiente del endotelio como previamente reportaron Giles et al.20.
Las variaciones en la resistencia de las arterias maternas, y en especial las miometriales, durante el embarazo demuestran ser importantes para la función placentaria normal, debido a que las arterias espirales se transforman en vasos de conducción por la invasión trofoblástica durante la placentación. Se ha sugerido que la relajación dependiente del endotelio en la preeclampsia está disminuida y que esto puede alterar la perfusión placentaria21,22. Sin embargo, se ha indicado que la disminución de la reactividad vascular en las arterias maternas no es completamente responsable de la reducción del flujo placentario23.
Las complicaciones maternas y fetales observadas en la preeclampsia pueden ser el resultado de la hipoxia tisular o infección de los tejidos, o puede ser secundaria a la respuesta inflamatoria. La circulación en el circuito materno y fetal está controlada por mediadores metabólicos, neurales y químicos, pero ambas son capaces de autorregularse. Se observa vasodilatación en casos de disminución en la perfusión, y vasoconstricción en presencia de un aumento de la presión de perfusión24. La autorregulación produce flujos sanguíneos relativamente constantes a pesar de la variación moderada de la presión del flujo. La autorregulación podría, además, ser un mecanismo de protección del feto de la hipoxia y las fluctuaciones de presión. Varios autores han reportado que estos signos pueden ser transitorios y que pueden desaparecer de forma secundaria a la aparición de alguna complicación de la preeclampsia25–27.
Las citocinas también pueden influir en la adhesión celular intravascular, coagulación y trombosis28. Pueden activar el endotelio y estimular sus propiedades procoagulantes mientras inhiben la anticoagulación y los efectos fibrinolíticos29. Esto podría explicar por qué los cambios en los parámetros doppler de las arterias uterinas se relacionan con las altas concentraciones de IL-6. Por lo que el incremento de las concentraciones podría no solo ser un reflejo de las alteraciones endoteliales o vasculares, sino también del daño tisular de la placenta a través de la trombosis que caracteriza las complicaciones de la preeclampsia. Si la placenta es la principal fuente de IL-6, las muestras de sangre de los vasos umbilicales podrían aportar el mismo resultado, debido a que la IL-6 de la placenta se encontraría tanto en la circulación materna como en la fetal.
Los resultados de la investigación promueven la realización de investigaciones más extensas, particularmente en la evaluación de marcadores de inflamación tisular en relación con las mediciones de los parámetros de velocimetría doppler, lo que podría ser de gran valor en situaciones clínicas complejas en el manejo de las preeclámpsicas.
En conclusión, los hallazgos de esta investigación demuestran que las preeclámpsicas presentan concentraciones plasmáticas de IL-6 más altas que las embarazadas normotensas y existe una correlación significativa entre las concentraciones plasmáticas y los parámetros de velocimetría doppler de las arterias uterinas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.