Las mutaciones del gen HNF1β se han empezado a relacionar últimamente con la enfermedad renal, dentro de un espectro muy amplio de posibles afectaciones. En diagnóstico prenatal se ha visto que dichas mutaciones son una causa principal de riñones fetales hiperecogénicos. Típicamente, estos riñones son normales en tamaño y mantienen un volumen de líquido amniótico también normal. Se pretende, en primer lugar, aportar un caso bien documentado de riñones fetales hiperecogénicos asociado a la mutación en HNF1β (con imágenes ecográficas, estudio genético y patológico correspondiente). En segundo lugar, se pretende dar a conocer el hallazgo de la variante de secuencia en el exón 2 c.443C>T (p.Ser148Leu) de HNF1β asociada a riñones fetales hiperecogénicos en nuestro caso.
Mutations of the HNF1β gene have recently begun to be associated with renal disease, within a wide spectrum of possible impacts. In prenatal diagnosis, it has been observed that these mutations are a principal cause of hyperechogenic foetal kidneys. Typically, these kidneys are of normal size, and also maintain a normal volume of amniotic fluid.
Firstly, a well-documented case is presented of hyperechogenic foetal kidneys associated to a mutation in HNF1β, with echographic images, and a genetic and corresponding pathology study. Secondly, to present the finding of the sequence variant in exon 2 c.443C>T (p.Ser148Leu) of HNF1β associated with the hyperechogenic foetal kidneys in our case.
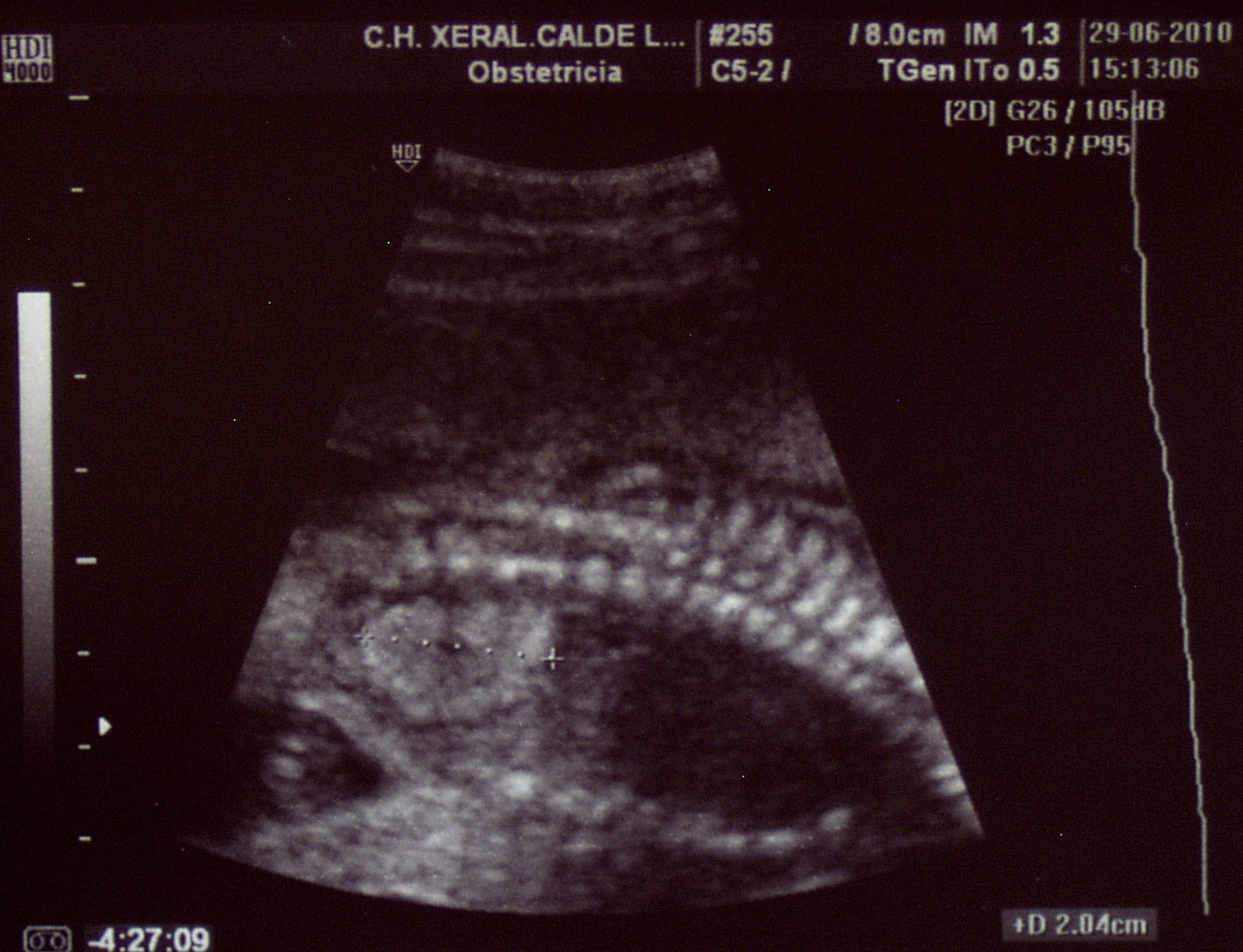
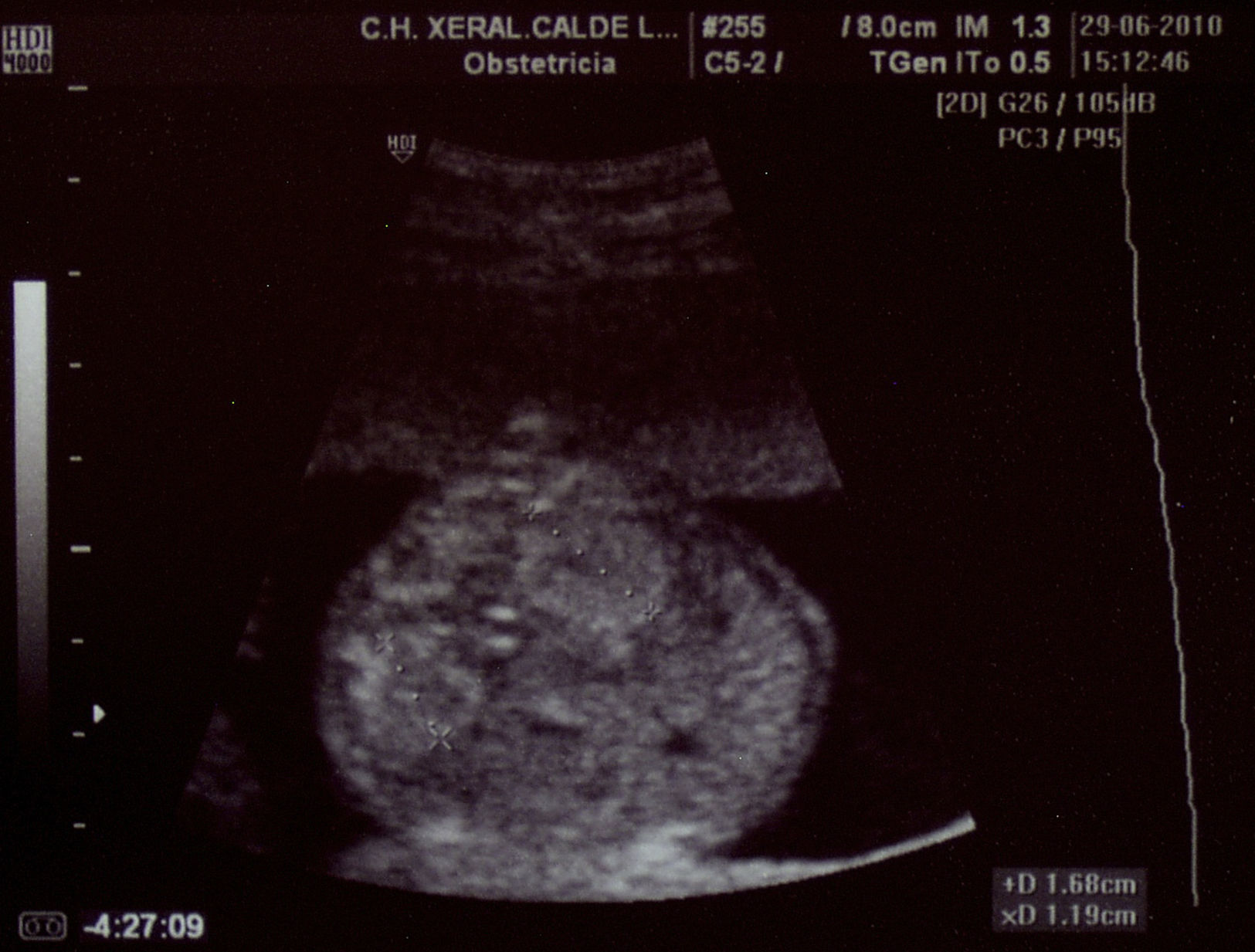
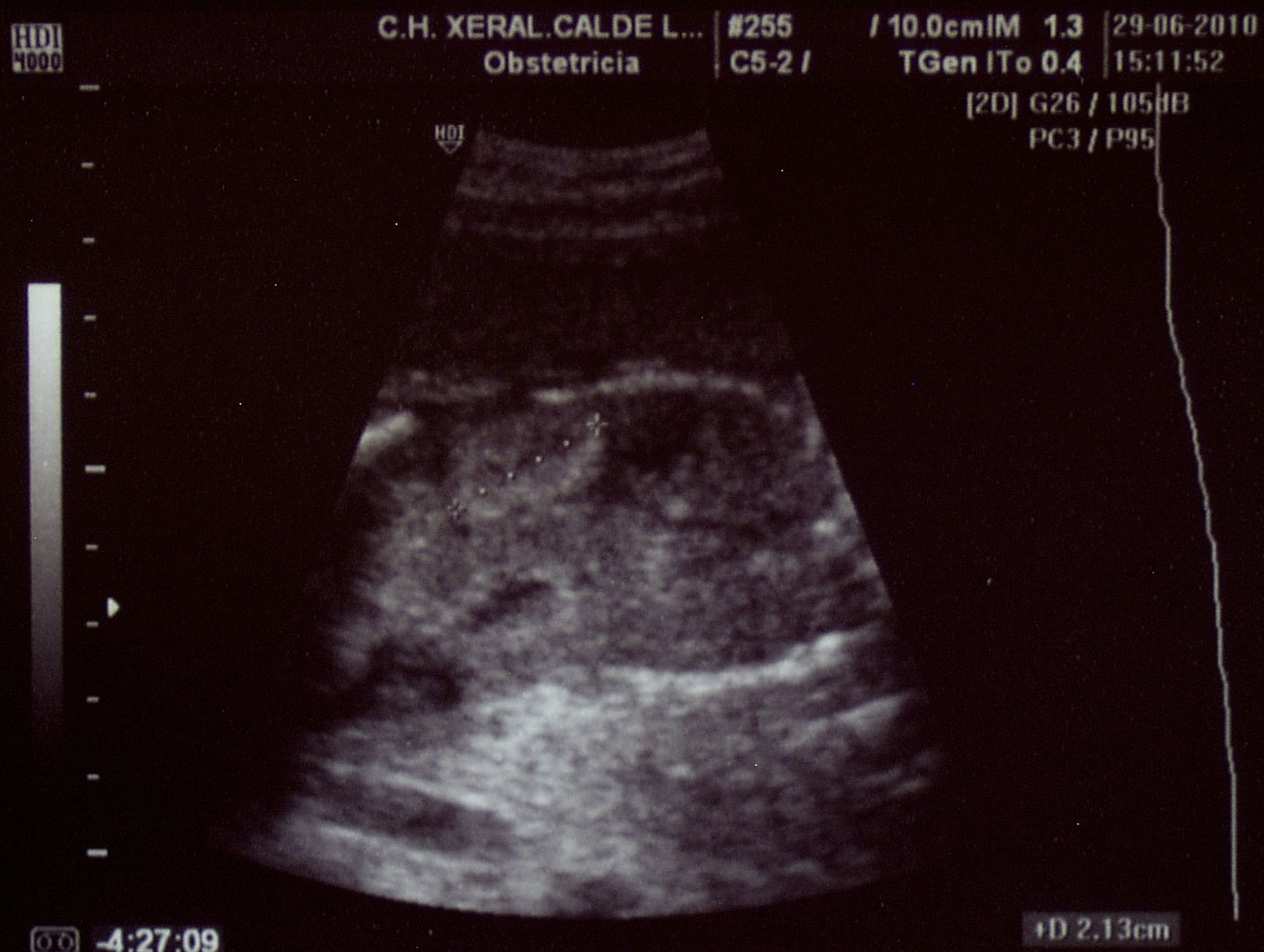
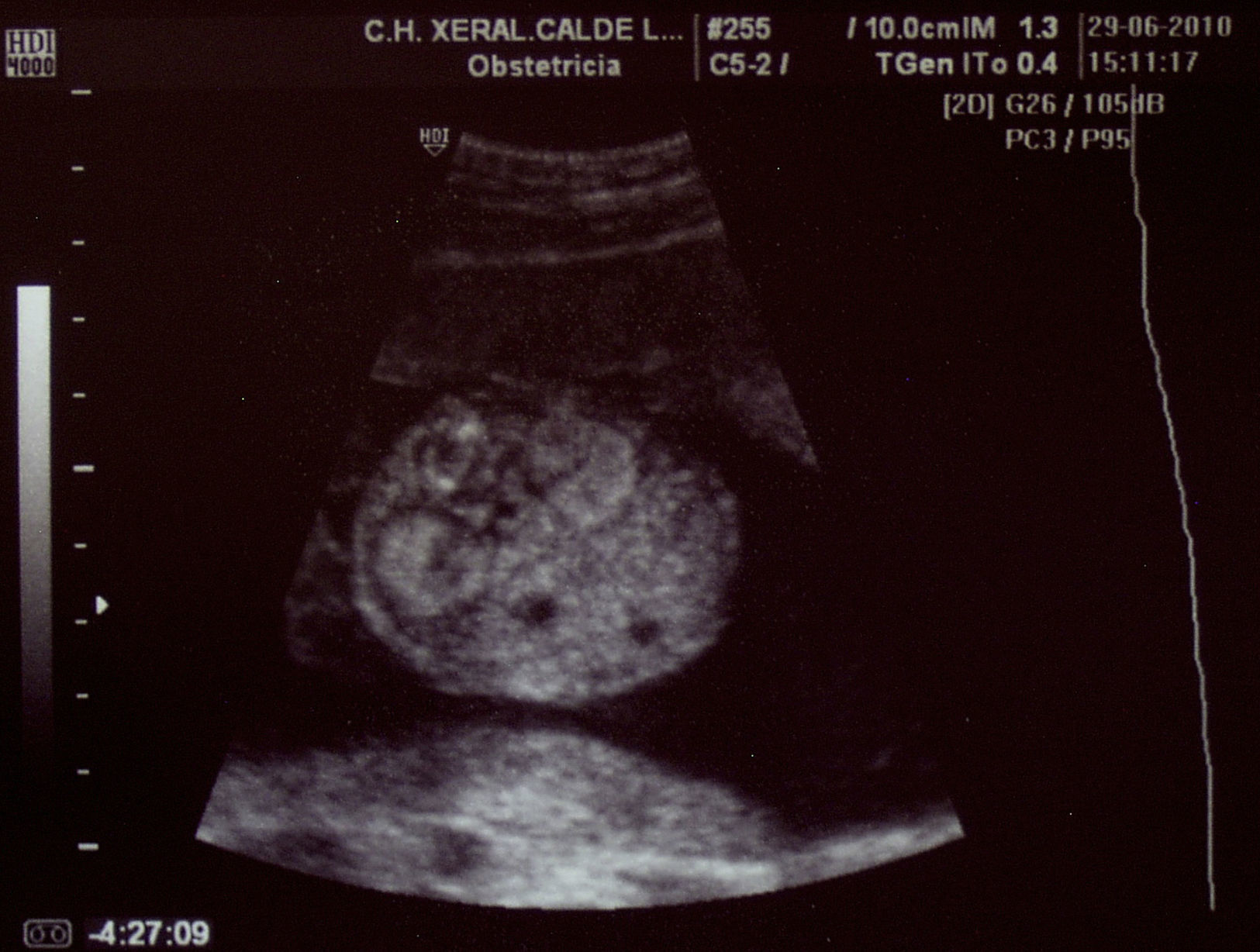
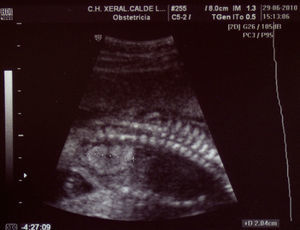
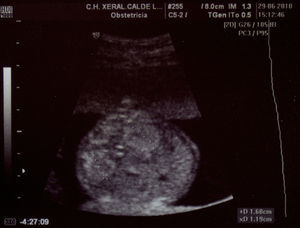
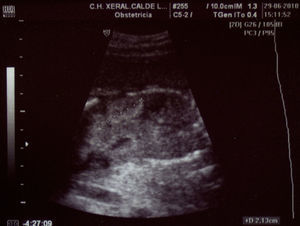
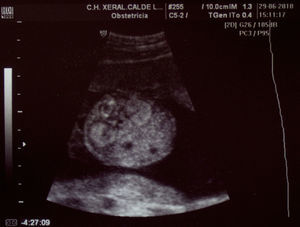
Paciente de 32 años, sana, sin antecedentes médicos de interés. Amigdalectomizada. Primigesta. Su madre es diabética. Tiene una prima en segundo grado con retraso psicomotor no filiado. El marido tiene 36 años y no tiene antecedentes medicoquirúrgicos de interés. La paciente no toma tratamientos fuera de los habituales en el embarazo, no fuma y no tiene hábitos tóxicos. Presenta una primera gestación de curso normal hasta la ecografía de la semana 20. Podemos observar una hiperecogenicidad renal fetal muy acentuada sin otros hallazgos patológicos. (figs. 1–4). Se aprecian ambos riñones anatómicamente bien situados. Tienen un diámetro longitudinal máximo de 23mm, que se considera normal, con acentuada diferenciación corticomedular. No se aprecian ectasias urinarias. La vejiga fetal tiene un aspecto normal. La cantidad de líquido amniótico es rigurosamente normal. El doppler color no aporta información de interés. Existe ausencia de flujo diastólico en ambas arterias renales. Tras estos hallazgos, la paciente decide finalizar la gestación en la semana 21. También se obtiene consentimiento para realizar una cordocentesis fetal. Se pretende estudio genético de enfermedades renales que nos pudiese dar información para un diagnóstico certero de la patología renal y para poder dar consejo genético a los padres. Se realiza funiculocentesis, obteniendo sangre fetal sin incidencias, previamente a la interrupción de la gestación. También se aspira líquido amniótico para obtener el cariotipo fetal, que resultaría normal con fórmula 46XX.
La anatomía patológica del feto informa de una enfermedad renal quística bilateral y simétrica. Los riñones presentan un peso combinado de 5,4 g (normal 5,4±2,1 g). Presentan adecuada lobulación en superficie externa. Se observan quistes relativamente uniformes en tamaño y distribuidos por todo el parénquima renal, afectando tanto a corteza como a médula. No se observa tejido heterotópico. Los quistes consisten en túbulos y ductos dilatados que típicamente están revestidos por un epitelio aplanado o cúbico formado por una sola capa de células. Finaliza el informe sugiriendo la existencia de afectación quística renal bilateral que histológicamente favorece una displasia renal. No se señalan alteraciones a nivel del hígado fetal.
DiscusiónCuando diagnosticamos un caso de riñones fetales hiperecogénicos, como el que nos ocupa, se nos plantean muchos interrogantes que no siempre podremos responder con rotundidad ante unos padres deseosos de respuestas. Así, la ecografía por sí sola no nos va a diagnosticar el origen del problema, pues existe un amplio rango de afectación posible y tenemos pocas posibilidades de predecir la función renal posnatal1. De hecho, solo podemos dar un pronóstico certero en las formas más severas, es decir, en aquellos riñones hiperecogénicos de gran tamaño acompañados de oligoamnios. Aquí el pronóstico es malo. Valores anormales en sangre fetal de β2 microglobulina y cistatina C están asociados a peor pronóstico posnatal. Sin embargo, valores normales no excluyen la posibilidad de fallo renal posnatal2. La precocidad en el diagnóstico también se ha relacionado con pobre función renal.
Clásicamente se señalan como las causas más frecuentes de riñones fetales hiperecogénicos, entre otras: la enfermedad renal poliquística autonómica recesiva, la enfermedad renal poliquística autonómica dominante, displasia quística y otras menos frecuentes como tubulopatías, esclerosis tuberosa, disgenesia tubular y otras3.
En nuestro caso no existen antecedentes familiares de enfermedad renal poliquística. El estudio ecográfico de los riñones maternos es normal. Por ello presumiblemente no estaríamos ante una forma dominante o adulta de enfermedad poliquística renal fetal o, por lo menos, hasta donde se sabe. Tampoco el cuadro parecería muy compatible con la forma recesiva o infantil de enfermedad renal poliquística pues los riñones fetales en estos casos suelen estar agrandados, suele existir oligoamnios severo y tienen alterada su ecoestructura (hallazgos que no teníamos) además de la hiperecogenicidad renal4 manifiestamente presente en nuestro feto. Al principio, pensamos que podría ser una forma parcial o incompleta de enfermedad poliquística infantil. Así, se solicitó un estudio del gen PKHD1 de la poliquistosis renal autonómica recesiva en sangre fetal obtenida por cordocentesis. En el estudio de este gen se realizó un análisis mutacional de exones (amplificación por PCR y secuenciación de 32 de los 67 exones del gen a partir de ADN genómico del probando). Este estudio se calcula que es capaz de identificar entre el 80 y el 90% de las mutaciones de PKHD1 responsables de esta enfermedad en Europa5. Tras unos meses de trabajo, no se pudo identificar ninguna mutación del gen en cuestión. Existía también la posibilidad de análisis de ligamiento al locus PKHD1 con microsatélites intragénicos y flanqueantes, aunque solo es útil si encontramos una de las 2 mutaciones que debe tener el feto si está afectado de enfermedad renal poliquística autonómica recesiva. En nuestro caso no era precisa.
Sin embargo, tras revisar la última bibliografía sobre riñones fetales hiperecogénicos1,4,6,7 nos fijamos en una nueva posibilidad: las alteraciones en el gen del factor nuclear del hepatocito 1β (HNF1β). Este es un factor de transcripción fundamental para el riñón, el hígado, el intestino, los órganos genitales y el páncreas. El factor en cuestión está codificado por el gen TCF21. Decramer et al.1 demostraron en una gran cohorte que las alteraciones en el gen TCF2 son la causa principal de riñones hiperecogénicos en el feto. De manera que, tras realizar el examen genético correspondiente, descubrimos que nuestro caso era positivo para mutación en HNF1β. El feto presenta una variante de secuencia en el exón 2 del gen HNF1β, c.443C>T (p.Ser148Leu), en heterocigosis. Es una variante de cambio de sentido (missense) que da lugar al cambio del aminoácido serina 148 (Ser148) a leucina. El aminoácido serina 148 está totalmente conservado en las proteínas ortólogas (de otras especies: gorila, chimpancé, perro, vaca, ratón, rata, gallo, pez, cebra), lo que indica que es importante para la función de la proteína codificada por dicho gen (factor nuclear hepatocitario 1β). Esta variante ha sido previamente descrita en la literatura como causante de displasia renal8. Lejos de poder dar una orientación certera, ahora tenemos otro problema, pues el tipo y la gravedad de la enfermedad renal asociada a esta mutación son muy variables4. Puede manifestarse en época prenatal como riñones hiperecogénicos, agenesia renal, ectasia renal… Puede aparecer en la edad infantil9 como displasia renal con quistes o sin ellos. Podemos verla en adultos como insuficiencia renal lentamente progresiva, asociada a diabetes o no. No existe tampoco correlación entre el tipo de mutación y la severidad de la enfermedad renal4. La falta de correlación genotipo-fenotipo y la amplia variabilidad observada dentro de una misma familia hacen que el consejo genético sea particularmente difícil en estas familias. La base patológica de la hipodisplasia renal sería la alteración de la nefrogénesis, posiblemente debido a la mutación de los genes que dirigen el proceso4,10,11. Para el consejo genético de los padres sería necesario comprobar si esta mutación es una mutación de novo en el feto (así lo son entre el 30 y el 50%)12 o, por el contrario, es una mutación heredada de alguno de los progenitores. Para ello estudiamos la alteración en sangre de ambos padres. En nuestro caso, el estudio parental en sangre periférica, de la mutación fetal conocida, resultó negativo. Por ello el riesgo de tener otro hijo afecto es muy bajo, pero no nulo. Esto se justifica porque no se podría excluir absolutamente la existencia de un mosaico a nivel germinal, es decir, que una parte se sus células germinales presentase la mutación y otra no. Las mutaciones de HNF1β se heredan con un patrón autosómico dominante, por lo que el portador tiene una probabilidad del 50% de transmitir la mutación a cada uno de sus hijos4. Así, ante una mutación de novo en el feto, el riesgo de que los padres tengan otro hijo afecto es muy bajo. Si la mutación es de origen parental, cabría esperar la afectación en el 50% de la descendencia, aunque como se ha explicado, la gravedad de la alteración renal es impredecible.
Las mutaciones de HNF1β en su inicio se reconocieron como una rara causa de diabetes de tipo juvenil de inicio en la edad adulta (MODY5). Hoy sabemos que HNF1β es un miembro de la superfamilia de los factores de transcripción. Codifica la transcripción del factor 2 (TCF2) y funciona como un homodímero o heterodímero con HNF1α. Así, estamos ante un gen regulador que controla la transcripción de múltiples genes relacionados con la enfermedad quística: PKHD1, PKD2, UMOD y Tg737/polaris. El gen del HNF1β se ubica en el cromosoma 17q124. El pleomorfismo en las mutaciones HNF1β puede ser explicado por su papel en el desarrollo del páncreas, riñones, hígado, pulmón e intestino y por su expresión en el tubo neural y en el tracto genital. Muchos estudios no han encontrado una clara correlación genotipo-fenotipo entre el tipo de mutación y la severidad o tipo de enfermedad renal. Existe una fuerte variación intrafamiliar, lo que sugiere que los factores del medio ambiente o no alélicos pueden ser importantes. En cuanto a la naturaleza de las mutaciones, estas pueden ser deleciones heterocigotas de todo el gen o pequeñas mutaciones puntuales. Las mutaciones de novo ocurren entre un tercio y la mitad de los casos. Los quistes renales están presentes en la mayoría de los portadores de mutaciones HNF1β, incluyendo algunos con enfermedad renal glomeruloquística. Las malformaciones renales son también comunes. No todos los afectados padecen diabetes, pero la existencia de quistes renales y diabetes es un fenotipo común. Prenatalmente, el hallazgo de riñones hiperecogénicos de tamaño normal o ligeramente aumentado es el hallazgo más común (como en nuestro caso). Otros fenotipos reconocibles prenatalmente incluyen: enfermedad renal multiquística bilateral, enfermedad renal multiquística unilateral, agenesia renal unilateral, hipoplasia renal unilateral, macroquistes renales y dilatación urinaria alta aislada. Todos los pacientes con enfermedad renal multiquística unilateral desarrollan posnatalmente alteraciones en el otro riñón. El grado de afectación funcional renal varía desde insuficiencia renal prenatal o en la infancia, hasta adultos que conservan su función renal. Otros hallazgos posibles en las mutaciones HNF1β incluyen: gota de aparición precoz o hiperuricemia, malformaciones genitales, atrofia de páncreas, anomalías en la función hepática e hipomagnesemia4.
Responsabiliades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Elisabet Ars de la Fundació Puigvert responsable del estudio de laboratorio.