Los procesos infecciosos son unas de las complicaciones más frecuentes en la insuficiencia renal crónica, sin menospreciar otras afecciones no menos importantes como las cardiovasculares, anemia y osteodistrofia. En la vida de cualquier persona la infección, sea cual fuere su origen o localización, acostumbra tener un protagonismo fundamental por su repercusión en la vida diaria, dada la limitación que condiciona la fiebre, frecuente en la infección microbiana o en ausencia de ella, y la percepción de un estado físico con evidente decaimiento. Ésta es una de las principales razones por las que la población, desde la infancia hasta la vejez, se ve obligada a acudir a la consulta de un facultativo o centro clínico hospitalario. La razón de esta guía es poder revisar, de forma práctica y en apartados concretos, lo que se ha considerado como patologías más prevalentes, o bien aquellas que por su repercusión, aunque con menor incidencia, conllevan preocupación ante la toma de decisiones médicas. Es en el área de la insuficiencia renal crónica de los pacientes en diálisis donde nos hemos centrado, por la especial característica de ellos y las adecuaciones de dosis o inconvenientes farmacológicos que son inherentes a su estado y que no son aplicables al resto de la población. Ellos presentan complicaciones infecciosas (respiratorias, renales, abdominales, cutáneas) semejantes al resto del público general, aunque a diferencia de ellos tienen ya una base o sustrato distinto, como es la insuficiencia renal crónica, que condiciona la respuesta a la agresión infecciosa, porque es menor la capacidad de defensa al tener reducida su inmunidad y ser por eso más vulnerables. Los problemas infecciosos causan una importante morbilidad en el conjunto de personas que deben realizar tratamiento sustitutivo, ya que, según las estadísticas, 2 de cada 5 ingresos hospitalarios son por infecciones. Revisada una muestra de 275 pacientes en un corte transversal del año 2003, arrojó una media de 0,6 ingresos/paciente/año, de los que el 40 % fue por infección, y en diabéticos este coeficiente debe multiplicarse por 2,5. Estos datos indican la importancia de la incidencia de esta enfermedad en cuanto a su morbilidad y cuya mortalidad fue del 13 % (en la literatura revisada oscila del 10 al 40 %), sólo superada por las afecciones cardiovasculares.
Sin duda habrá posibles discrepancias en función de las experiencias personales o protocolos que se utilicen, pero en nuestra labor diaria es frecuente disponer de más de una opción terapéutica para cada patología, por lo que de entre las diversas que consensuadamente están publicadas debemos escoger la más idónea al caso. Los futuros conocimientos habrán de modificar, si procede, las determinaciones expuestas en cada uno de los apartados o guías.
HemodiálisisGuía 1Las medidas de profilaxis son efectivas para la prevención de infecciones espontáneas o transmitidas. La higiene corporal, y particularmente del área de acceso, es indispensable. Las barreras para evitar la transmisión horizontal, como guantes, mascarilla y apósitos cutáneos estancos, son de aplicación obligada. Cualquier manipulación sobre el paciente impone el uso de material estéril y antisépticos adecuados. Los profesionales han de extremar sus medidas de profilaxis y prevención en las actuaciones sobre las vías de acceso para la diálisis y mantener un entrenamiento adecuado. Se debe realizar un cribado de colonización nasal a todos los pacientes, pero especialmente aquellos con catéteres. Los portadores de estafilococo nasal, pacientes y sanitarios, deben recibir tratamiento con mupirocina, 2 aplicaciones diarias durante 5 días. Los pacientes portadores de lesiones cutáneas infectadas realizarán el tratamiento indicado, pero llevarán la zona de lesión ocluida.
Bases documentalesArgüello C, Demetrio AM, Chacon M. Manual de Infecciones Intrahospitalarias, medidas generales de prevención y control. Hospital Santiago Oriente-Dr. Luis Tisné Bronsse; 2004.
Assotiation for Professionals in Infection Control and Epidemiology. Guideline for handwashing and hand antisepsis in health care settings. Am J Infect Control. 1995;23:251-69.
Bloom S, et al. Clinical and economic effects of mupirocina calcium on preventing Staph. aureus infection in hemodialysis patients. Am J Kidney Dis. 1996;27:687-94.
Chow JW, Yu VL. Staphylococcus aureus nasal carriage in hemodialysis patients. Its role in infection and approaches to prophylaxis. Arch Intern Med. 1989;149:1258-62.
Corbella X, Dominguez MA, Pujol M, Ayats J, Sendra M, Pallares R, et al. Staphylococcus aureus nasal carriage as a marker for subsequent staphylococcal infections in intensive care unit patients. Em J Clin Micro Infect Dis. 1997;16:351-7.
Davison AM, Kessler M. European Best Practice Guidelines for Hemodialysis. Part I. Nephrol Dial Transplant. 2002;17:72-8.
Gaspar MC, Uribe P, Sánchez P, Coello R, Cruzet F. Personal hospitalario portador nasal de Stafilococo resistente a meticilina. Utilidad del tratamiento con mupirocina. Enf Infec Microb Clin. 1992;10:109-10.
Guidelines for environmental infection control in health-care facilities. Recommendations of CDC and the Health-care Infections Control Practices Advisory Committee. Centers for Disease control and Prevention – Federal Government Agency (US); 2003. p. 1-42.
Guideline: Recommendations for preventing transmissión of infections amoung chronic hemodialysis patients. MMWR Recomm Rep. 2001;50(RR-5):1-43.
Marjolein F, Vandenbergh Q, Yzerman F, Belkman A, Boelens H, Sijmons M, et al. Follow-up of Staphylococcus aureus nasal carriage after 8 years: redefining the persistent carrier state. J Clin Microbiol. 1999;37:3133-40.
NFK/DOQI. National Kidney Foundation. Clinical practice guidelines for chronic kidney disease. Am J Kidney Dis. 2002;39: 51-246.
Asociación Nefrológica de la ciudad de Buenos Aires. Normas de bioseguridad universales para su aplicación en los servicios de hemodiálisis. Conclusiones de las primeras jornadas de Bioseguridad en Diálisis: Consejo de Hemodiálisis. Nephrol Dial Transplant. 1994;35:1-18.
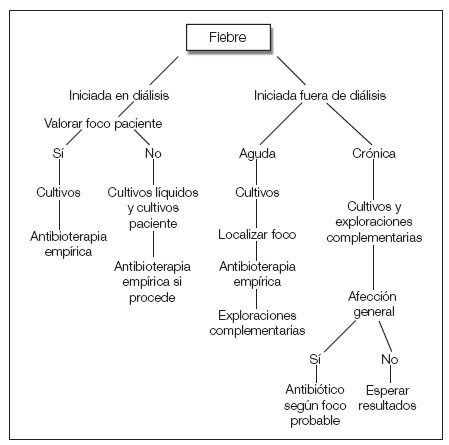
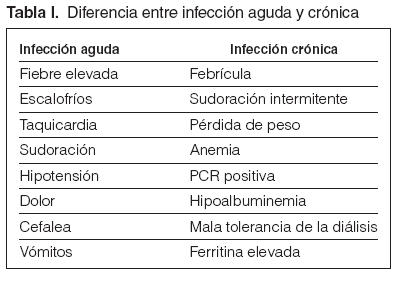
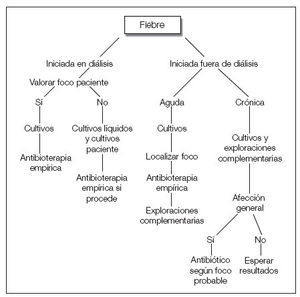
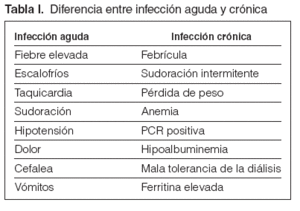
Guía 2La fiebre es el síntoma principal de la infección. La fiebre aparecida en el inicio o en el curso de la diálisis obligará a descartar infección del acceso, contaminación del dializado o material fungible, síndrome del primer uso, reacción de hipersensibilidad, pirógenos, hemólisis o temperatura inadecuada del monitor. La fiebre originada en el período de la diálisis obliga a aplicar el procedimiento médico de diagnóstico usual de localización e identificación. En las personas de edad avanzada, puede presentarse un cuadro infeccioso sin apenas temperatura, por lo que, ante síntomas de toxicidad, debe descartarse un foco infeccioso como motivo del problema. Los tratamientos concomitantes con antiinflamatorios no esteroideos (AINE) o analgésicos pueden enmascarar este síntoma. La fiebre puede presentarse sola o acompañada de bacteriemia, con síntomas localizados en alguna área corporal o tras manipulaciones instrumentales (sondajes, cateterizaciones, extracciones), intervenciones quirúrgicas, heridas, infecciones cutáneas o de los vasos. La fiebre alta acompañada de escalofríos, aumento de la frecuencia cardíaca, sudoración, hipotensión, dolor, cefalea y vómitos es síntoma de bacteriemia aguda, por lo que obligará a realizar, siempre que sea posible y antes de otros tratamientos, cultivo de los líquidos biológicos para conocer el foco y la posible extensión sistémica. Posteriormente, se actuará de forma precoz para evitar un posible shock séptico. Hay que sospechar infección crónica ante síntomas que se percibe que progresan con el tiempo, en los que, aunque no aparezca la clínica tal como la explicada para los procesos agudos, se observa (aunque no necesariamente estén todos) febrícula, sudoración intermitente (diurna o nocturna), pérdida de peso, anemia (pobre respuesta a la eritropoyetina [EPO]), PCR positivo, hipoalbuminemia (desnutrición) y mala tolerancia a la diálisis (fig. 1 y tabla I).
Figura 1. Esquema de actuación ante fiebre.
Tabla I. Diferencia entre infección aguda y crónica
Bases documentalesAbbott KC, Agodoa LY. Etiology of bacterial septicemia in chronic dialysis patients in the United States. Clin Nephrol. 2001;56:124-31.
Canaud BJ, Bosc JY, Leray H, Morena M, Stec F. Microbiologic purity of dialysate: rationale and technical aspects. Blood Purif. 2000;18: 200-13.
Canaud BJ, Mion CM. Water treatment for contemporary haemodialysis. En: Jacobs C, Kjellstrand CM, Koch KM, Wincester JF, editores. Replacement of renal function by dialysis. 4.ª ed. Dondrecht: Kluwer Academic; 1996. p. 231-55.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Hoen B, Kessler M, Hestin D, Mayeux D. Risk factors for bacterial infections in chronic haemodialysis adult patients: A multicentre prospective survey. Nephrol Dial Transplant. 1995;10:377-81.
Morin P. Identification of the bacteriological contamination of a water treatmet line used for haemodialysis and its desinfection. J Hosp Infect. 2000;45:218-24.
NKF/DOQI Clinical Practice Guidelines for vascular Acces. Am J Kidney Dis. 2001;37 Suppl 1:137-81.
Pérez-García R. Complicaciones agudas en hemodiálisis. En: Lorenzo V, Torres A, Hernández D, Ayus JC, editores. Manual de Nefrología. 2.ª ed. Madrid: Harcourt; 2002. p. 427.
Perez-Garcia R, Rodriguez-Benitez PO. Why and how to monitor bacterial contamination of dialysis? Nephrol Dial Transplant. 2000;15: 760-4.
Protocols de malalties infeccioses. Servei de Malalties Infeccioses. Hospital Vall d’Hebron. Barcelona. Servei Català de la Salut; 2003.
Roth VR, Jarvis WR. Outbreaks of infection and/or pyrogenic reactions in dialysis patients. Semin Dial. 2000;13:92-6.
Swartz RD, et al. Hypothermia in the uremic patient. Dial Transplant. 1983;12:584.
Tielemans C, Husson C, Shurmans T, et al. Effects of ultrapure and non-sterile dialysate on the inflammatory response during in vitro haemodialysis. Kidney Int. 1996;49:236-43.
Tokars JI. Blood stream infections in hemodialysis patiens: Getting some deserved attention. Infect Control Hosp Epidemiol. 2002;23:713-5.
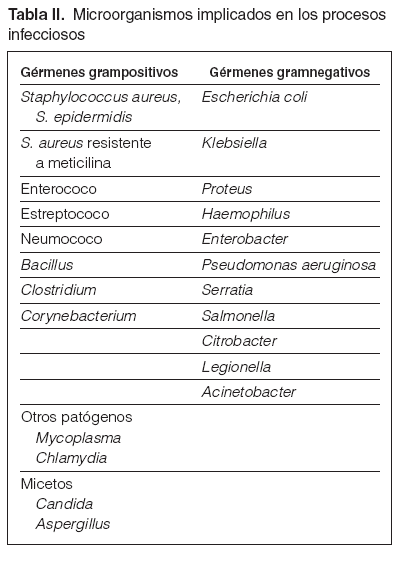
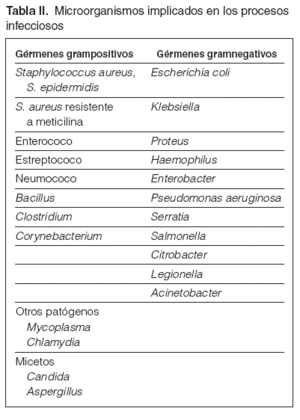
Guía 3Los microorganismos implicados con más frecuencia en los procesos de infección son: bacilos gramnegativos (50 %), cocos grampositivos (40 %), anaerobios (5 %) y otros (5 %). En los casos de infección intrahospitalaria se observa una mayor prevalencia de gérmenes gramnegativos, con mayor resistencia a los antibióticos (tabla II). La localización más frecuente de las infecciones en pacientes en diálisis es por este orden: acceso de diálisis (38 %), en que el 75 % son por el catéter; renourológicas (20 %); vías respiratorias (18 %); abdomen (9 %); otras localizaciones (15 %). De los múltiples gérmenes, detallamos aquellos que por su frecuencia son los más habituales en los cultivos de nuestros pacientes y otros que, aunque más esporádicamente, condicionan decisiones de posible tratamiento específico o aislamiento.
Tabla II. Microorganismos implicados en los procesos infecciosos
Si hay sospecha de infección por el aspecto local (signos de inflamación o secreción) o el general (fiebre, etc.), se establecerán criterios clínicos de confirmación y localización y será precisa una hipótesis etiológica basada en la clínica, la localización y los antecedentes. Después se iniciará tratamiento empírico que, si se supone un grampositivo, podrá basarse en un betalactámico o una cefalosporina de primera generación, o bien, en caso de un gramnegativo, una cefalosporina de tercera generación o un aminoglucósido, reservando la vancomicina para los casos en que se sospeche infección estafilocócica resistente, por la constancia de un antecedente infeccioso estafilocócico reciente, potencialmente recidivado o intolerancia a los betalactámicos.
Bases documentalesBaj W, Molina M, Rosenthal AF, DiDominic V, Bander SJ. Incidence of bacteremia in hemodialysis patiens, 1993-1994. J Am Soc Nephrol. 1995;6:657.
Barcenas CG, Fuller TJ, Elms J, Cohen R, White MG. Staphylococcal sepsis in patients on chronic hemodialysis regimens. Intravenous treatment with vancomycin given once weekly. Arch Intern Med. 1976;136:1131-4.
Barth RH, de Vinzenzo N. Use of vancomycin in high-flux hemodialysis: Experience with 130 courses of therapy. Kidney Int. 1996;50; 929-36.
Bloom S, et al. Clinical and economic effects of mupirocina calcium on preventing S. aureus infection in hemodialysis patients. Am J Kidney Dis. 1996;27:687-94.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Haijar J, Girard R, Marc JM, Ducruet L, Bernard M, Fadel B, et al. Surveillance of infections in chronic hemodialysis patients. Nephrologie. 2004;25:133-40.
Hamory BH. Nosocomial bloodstream and intravascular device related infections. En: Wenzel RP, editor. Prevention and control of nosocomial infections. Baltimore: Williams & Wilkins; 1987. p. 283-319.
Henderson DK. Bacteremia due to percutaneous intravascular devices. En: Mandell GL, Douglas RG, Bennett JE, editores. Principles and Practice of Infectious Disease. New York: John Wiley & Sons; 1990. p. 2189-99.
Hoen B, Paul Dauphin A, Hestin D, Kessel M (EPIBACDIAL). Multicenter prospective study of risk factor bacteremia in chronic hemodialysis patients. J Am Soc Nephrol. 1998;9:869-76.
Keane WF, Shapuro FL, Raij L. Incidence and type of infections occurring in 445 chronic hemodialysis patiens. Trans Am Soc Artif Intern Organs. 1977;23:41-7.
Kessler M, Hoen B, Mayeux D, Hestin D, Fontenaille C. Bacteremia in patiens on chronic hemodialysis. A multicenter prospective survey. Nephron. 1993;64:95-100.
Mensa J, Gatell JM, Martínez JA, Torres A, Vidal F, Serrano R, et al. Terapéutica antimicrobiana (infecciones en urgencias). 5.ª ed. Antares; 2005.
Nsouli KA, Lazarus M, Schoenbaum SC, Gottlier MN, Lowrie EG, Shocair M. Bacteriemic infection in hemodialysis. Arch Intern Med. 1979;139:1255-8.
Protocols de malalties infeccioses. Servei de Malalties Infeccioses. Hospital Vall d’Hebron. Barcelona: Servei Català de la Salut; 2003.
Trimarchi H, Lafuente P, Suki WN. Ceftriaxone is an efficient component of antimicrobial regimens in the prevention and initial management of infections in end-stage renal disease. Am J Nephrol. 2000;20:391-5.
Guía 4De manera más concreta, se puede proponer el uso de betalactámico y/o vancomicina o quinolona a nivel empírico o en primer nivel cuando se sospecha o se ha demostrado un grampositivo sensible. En situación de resistencia a los betalactámicos se recomienda la asociación de vancomicina-aminoglucósidos. En el caso de sospechar infección por un gramnegativo se aconsejará una cefalosporina junto con aminoglucósido y, en el caso de no tener respuesta, se aplicará cefalosporina con aztreonam. En el caso de sospechar una infección por hongos (usualmente Candida albicans), se recomienda el uso de fluconazol junto con 5-fluocitosina a dosis ajustadas.
Bases documentalesBaj W, Molina M, Rosenthal AF, DiDominic V, Bander SJ. Incidence of bacteremia in hemodialysis patiens, 1993-1994. J Am Soc Nephrol. 1995;6:657.
Barcenas CG, Fuller TJ, Elms J, Cohen R, White MG. Staphylococcal sepsis in patients on chronic hemodialysis regimens. Intravenous treatment with vancomycin given once weekly. Arch Intern Med. 1976;136:1131-4.
Barth RH, de Vinzenzo N. Use of vancomycin in high-flux hemodiálisis: Experience with 130 courses of therapy. Kidney Int. 1996;50: 929-36.
Bloom S, et al. Clinical and economic effects of mupirocina calcium on preventing S. aureus infection in hemodialysis patients. Am J Kidney Dis. 1996;27:687-94.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Haijar J, Girard R, Marc JM, Ducruet L, Bernard M, Fadel B, et al. Surveillance of infections in chronic hemodialysis patients. Nephrologie. 2004;25:133-40.
Hamory BH. Nosocomial bloodstream and intravascular device related infections. En: Wenzel RP, editor. Prevention and control of nosocomial infections. Baltimore: Williams & Wilkins; 1987. p. 283-319.
Henderson DK. Bacteremia due to percutaneous intravascular devices. En: Mandell GL, Douglas RG, Bennett JE, editores. Principles and Practice of Infectious Disease. New York: John Wiley & Sons; 1990. p. 2189-99.
Hoen B, Paul Dauphin A, Hestin D, Kessel M (EPIBACDIAL). Multicenter prospective study of risk factor bacteremia in chronic hemodialysis patients. J Am Soc Nephrol. 1998;9:869-76.
Keane WF, Shapuro FL, Raij L. Incidence and type of infections occurring in 445 chronic hemodialysis patiens. Trans Am Soc Artif Intern Organs. 1977;23:41-7.
Kessler M, Hoen B, Mayeux D, Hestin D, Fontenaille C. Bacteremia in patiens on chronic hemodialysis. A multicenter prospective survey. Nephron. 1993;64:95-100.
Mensa J, Gatell JM, Martínez JA, Torres A, Vidal F, Serrano R, et al. Terapéutica antimicrobiana (infecciones en urgencias). 5.ª ed. Antares; 2005.
Nsouli KA, Lazarus M, Schoenbaum SC, Gottlier MN, Lowrie EG, Shocair M. Bacteriemic infection in hemodialysis. Arch Intern Med. 1979;139:1255-8.
Protocols de malalties infeccioses. Servei de malalties infeccioses. Hospital Vall d’Hebron. Barcelona: Servei Català de la Salut; 2003.
Trimarchi H, Lafuente P, Suki WN. Ceftriaxone is an efficient component of antimicrobial regimens in the prevention and initial management of infections in end-stage renal disease. Am J Nephrol. 2000;20:391-5.
Zarate MS, Jorda-Vargas L, Lanza A, et al. Estudio microbiológico de bacteriemias y funguemias en pacientes en hemodiálisis crónica. Rev Argent Microbiología. 2005;37:145-9.
Guía 5Con la confirmación del germen y de su sensibilidad se aplicará el tratamiento definitivo que, básicamente, mantendrá el esquema previo. En el caso de alergia a betalactámicos, como pauta general se indicará vancomicina + aminoglucósido.
Bases documentalesBarcenas CG, Fuller TJ, Elms J, Cohen R, White MG. Staphylococcal sepsis in patients on chronic hemodialysis regimens. Intravenous treatment with vancomycin given once weekly. Arch Intern Med. 1976;136:1131-4.
Bloom S, et al. Clinical and economic effects of mupirocina calcium on preventing S. aureus infection in hemodialysis patients. Am J Kidney Dis. 1996;27:687-94.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Haijar J, Girard R, Marc JM, Ducruet L, Bernard M, Fadel B, et al. Surveillance of infections in chronic hemodialysis patients. Nephrologie. 2004;25:133-40.
Hamory BH. Nosocomial bloodstream and intravascular device related infections. En: Wenzel RP, editor. Prevention and control of nosocomial infections. Baltimore: Williams & Wilkins; 1987. p. 283-319.
Henderson DK. Bacteremia due to percutaneous intravascular devices. En: Mandell GL, Douglas RG, Bennett JE, editores. Principles and Practice of Infectious Disease. New York: John Wiley & Sons; 1990. p. 2189-99.
Hoen B, Paul Dauphin A, Hestin D, Kessel M (EPIBACDIAL). Multicenter prospective study of risk factor bacteremia in chronic hemodialysis patients. J Am Soc Nephrol. 1998;9:869-76.
Keane WF, Shapuro FL, Raij L. Incidence and type of infections occurring in 445 chronic hemodialysis patiens. Trans Am Soc Artif Intern Organs. 1977;23:41-7.
Kessler M, Hoen B, Mayeux D, Hestin D, Fontenaille C. Bacteremia in patiens on chronic hemodialysis. A multicenter prospective survey. Nephron. 1993;64:95-100.
Mensa J, Gatell JM, Martínez JA, Torres A, Vidal F, Serrano R, et al. Terapéutica antimicrobiana (infecciones en urgencias). 5.ª ed. Antares; 2005.
Nsouli KA, Lazarus M, Schoenbaum SC, Gottlier MN, Lowrie EG, Shocair M. Bacteriemic infection in hemodialysis. Arch Intern Med. 1979;139:1255-8.
Protocols de malalties infeccioses. Servei de Malalties Infeccioses. Hospital Vall d’Hebron. Barcelona: Servei Català de la Salut; 2003.
Barth RH, de Vinzenzo N. Use of vancomycin in high-flux hemodialysis: Experience with 130 courses of therapy. Kidney Int. 1996;50: 929-36.
Trimarchi H, Lafuente P, Suki WN. Ceftriaxone is an efficient component of antimicrobial regimens in the prevention and initial management of infections in end-stage renal disease. Am J Nephrol. 2000;20:391-5.
Baj W, Molina M, Rosenthal AF, DiDominic V, Bander SJ. Incidence of bacteremia in hemodialysis patiens, 1993-1994. J Am Soc Nephrol. 1995;6:657.
Guía 6Si se sospecha infección de fístula arteriovenosa interna autóloga o de prótesis, debemos prever un tratamiento de 2-3 semanas, por vía intravenosa, y tras la diálisis. Para el caso de los catéteres tunelizados, se propone el mismo tratamiento antes comentado, en ausencia de condición clínica grave o falta de respuesta a las 72 horas de aplicar el tratamiento.
Se propone la retirada del acceso si hay shock séptico y en caso de antecedente de valvulopatía o de sospecha clínica de infección fúngica. En circunstancias de estabilidad clínica, la retirada estará condicionada a la falta de respuesta al término de 2-3 semanas.
Bases documentalesBailey E, Berry N, Cheesbrough JS. Antimicrobial lock therapy for catheter related bacteremia amog patients on maintenance haemodialysis. J Antimicrob Chemother. 2002;50:615-7.
Berrington A, Kate Gould F. Use of antibiotic loks to treat colonized central venous catheters. J Antimicrob Chemother. 2001;48: 597-603.
Capdevila JA, Segarra A, Planes AM, Ramirez-Arellano M, Pahisa A, Piera L, et al. Successful treatment of haemodialysis catheterrelated sepsis without catheter removal. Nephrol Dial Transplant. 1993;8:231-4.
Cercenado E, Ena J, Rodriguez-Creixems M, Romero J, Bouza E. A conservative procedure for the diagnosis of catheter related infections. Arch Intern Med. 1990;150:1417-20.
Chatzinikolaou I, Finkel K, Hanna H, Boktour M, Foringer J, Ho T, et al. Antibiotic-coated hemodialysis catheters for the prevention of vascular catheter-related infections: A prospective, randomized study. Am J Med. 2003;115:352-7.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Droga GK, Herson H, Hutchison B, Irish AB, Heath CH, Golledge C, et al. Prevention of tunneled hemodialysis catheter-related infections using catheter-restricted filling with gentamicin and citrate: a randomized controlled study. J Am Soc Nephrol. 2002;13:2133-9.
García-Rebollo S, Hernández D, Díaz F. Accesos vasculares percutáneos. En: Lorenzo V, Torres A, Hernández D, Ayus JC, editores. Manual de Nefrología. 2.ª ed. Madrid: Harcourt; 2002. p. 362-70.
Hamory BH. Nosocomial bloodstream and intravascular device related infections. En: Wenzel RP, editor. Prevention and control of nosocomial infections. Baltimore: Williams & Wilkins; 1987. p. 283-319.
Hoen B, Paul Dauphin A, Hestin D, Kessel M (EPIBACDIAL). Multicenter prospective study of risk factor bacteremia in chronic hemodialysis patients. J Am Soc Nephrol. 1998;9:869-76.
Jernigan JA, Farr BM. Short-course therapy of catheter-related Staphylococcus aureus bacteremia: A meta-analysis. Ann Intern Med. 1993;119:304-11.
Lentino JR, Leehey DJ. Infections. En: Dauguirdas JT, Blake PG, Ing TS, editores. Handbook of Dialysis. 3.ª ed. Philadelphia: Lippincott Williams and Wilkins; 2001. p. 495-521.
León C, Castro P. Infección relacionada con catéteres y otros dispositivos intravasculares. Rev Clin Esp. 1994;194:853-61.
Levy J, Robson M, Rosenfeld JB. Septicemia and pulmonary embolism complicating use of arteriovenous fistula in maintenance haemodialysis. Lancet. 1970;2:288.
Liñares J, Pulido MA, Bouza E. Infección asociada a catéteres. Medicine. 1995;76:3395-404.
Martínez M, Maldonado, Rodicio JL, Herrera J. Tratado de Nefrología. Norma: 1993. p. 1124-5.
Pearson ML. Guideline for prevention of intravascular device-related infections. Part I. Intravascular device-related infections an overview. The Hospital Infection Control Practices Advisory Committee. Am J Infec Control. 1996;24:262-7.
Reed CR, Sessler CN, Glauser FL, Phelan BA. Central venous catheter infections: Concepts and controversies. Intensive Care Med. 1985;21:177-83.
Rello J, Campistol JM, Almirall J, Revert L. Complicaciones mecánicas e infecciosas asociadas a la cateterización venosa central como acceso vascular para hemodiálisis. Rev Clin Esp. 1988;183:455-8.
Rodriguez-Jornet A, Garcia-Garcia M, Mariscal D, Fontanals D, Cortes P, Coll P, et al. And outbreak of gram negative bacteremia especially Enterobacter cloacae, in patients with long term tunnelled haemodialysis catheter. Nefrologia. 2003;23:333-43.
Sánchez Sancho M, Ridao N, Valderrabano F. Complicaciones de la hemodiálisis. En: Valderrabano F, editor. Tratado de Hemodiálisis. Barcelona: Médica JIMS; 1999.
Sitges-Serra A, Liñares J, Perez JL, Capell S. Catheter sepsis: The fourth mechanism. J Antimicrob Chemother. 1985;15:641-2.
Thiele Umali A, Lorry GR. Stability of antibiotics used for antibio-tic-lock treatment of infections of implantable venous devices. Antimicrob Agents Chemother. 1999;43:2074-6.
Vardhan A, Davies J, Daryanani I, Crowe A, McClelland P. Treatment of haemodialysis catheter related infections. Nephrol Dial Transplant. 2002;17:1149-50.
Guía 7Las infecciones broncopulmonares son de elevada incidencia como complicación frecuente en los pacientes en hemodiálisis, favorecidas porque muchos de ellos tienen afecciones broncopulmonares previas concomitantes con su insuficiencia renal, las más habituales están producidas por grampositivos, pero es necesario pensar en Haemophilus, Pseudomonas y Legionella. El tratamiento empírico deberá contemplar estas posibilidades. El tratamiento se mantendrá entre 10 y 20 días. Es recomendable indicar a todos los pacientes la administración de la vacuna antineumocócica.
Bases documentalesDauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Índex Farmacològic, 2000. 5.ª ed. Fundació Institut Català de Farmacologia. Acadèmia de Ciències Mèdiques de Catalunya i Balears.
Levy J, Robson M, Rosenfeld JB. Septicemia and pulmonary embolism complicating use of arteriovenous fistula in maintenance haemodialysis. Lancet. 1970;2:288.
Martínez M, Maldonado Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
Mensa J, Gatell JM, Martínez JA, Torres A, Vidal F, Serrano R, et al. Terapéutica antimicrobiana (infecciones en urgencias). 5.ª ed. Antares; 2005.
Protocols de malalties infeccioses. Servei de Malalties Infeccioses. Hospital Vall d’Hebron. Barcelona: Servei Català de la Salut; 2003. Samak MJ, Jaber BL. Pulmonary infections mortality among patients with end –stage renal disease. Chest. 2001;120:1183-7.
Guía 8Se pensará en una endocarditis ante la persistencia del cuadro febril sin focalidad aparente o posterior a un proceso agudo. El 70 % de las colonizaciones se producen en la válvula tricúspide por S. aureus y Streptococcus viridans, son menos frecuentes las causadas por entero-coco. Es imprescindible demostrar la endocarditis mediante hemocultivos y ecocardiografía.
Bases documentalesAmandh U, Kishore R, Ballal HS. Infective endocarditis as a cause of fever in hemodialysis patients. J Assoc Physicians India. 2000;48: 736-8.
Besnier JM, Choulet P. Modalités et surveillance de l’antibiotherapie des endocardites infectiouses. Rev Prat (Paris). 1998;48:513-8.
Bonhour D, Boibieux A, Pryramond D. Prophylaxie des endocardites infectieuses. Rev Prat (Paris). 1998;48:519-22.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Hirakawa N, Tasaki H, Tanako S, Yamasita K, Okazaki M, Nakashima Y, et al. Infective tricuspid valve endocarditis due to abscces of an endogenous arteriovenous f istula in a chronic hemodialysis patient. JUOEH. 2004;26:451-60.
Hoen B, Selton-Suty CH, Bequinot I. Crítères diagnostiques des endocardites infectieuses. Rev Prat (Paris). 1998;48:497-501.
Levine DP, Fromm BS, Reddy BR. Slow response to vancomycin or vancomycin plus rifanpim in methicillin-resistant Staphylococcus aureus endocarditis. Ann Intern Med. 1991;115:674-80.
Maraj S, Jacobs LE, Maraj R, Kotler MN. Bacteremia and infective endocarditis in patients on hemodialysis. Am J Med Sci. 2004; 327:242-9.
Martínez M, Maldonado, Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
McCarthy JT, Steckelberg JM. Infective endocarditis in patients receiving long-term hemodialysis. Mayo Clin Proc. 2000;75: 1008-14.
Megran DW. Enterococcal endocarditis. Clin Infect Dis. 1992;15: 63-71.
Robinson DL, Fowler VG, Secton DJ, Corey RG, Coulon PJ. Bacterial endocarditis in hemodialysis patients. Am J Kidney Dis. 1997;30: 521-4.
Spies C, Madison JR, Schatz IJ. Infective endocarditis in patients with end-stage renal disease: Clinical preventation and outcome. Arch Intern Med. 2004;164:71-5.
Troprak O, Caglar BU, Bayata S, Yasar H, Tanrisev M, Ersoy R,et al. Severe mitral valve infective endocarditis with widespread septi emboli in a patient with permanent hemodialysis catheter. Amadolu Kardiyol Derg. 2004;4:374-5.
Guía 9El tratamiento empírico se recomienda iniciarlo con ampicilina + cloxacilina + gentamicina o amoxicili-na-clavulánico + gentamicina. Si no es posible el uso de betalactámicos, se utilizaría vancomicina + gentamicina. La pauta se adecuará en cuanto se identifique el germen, así como su sensibilidad. La duración del tratamiento será de 4 semanas por vía intravenosa, y el paciente debe permanecer hospitalizado.
Bases documentalesAmandh U, Kishore R, Ballal HS. Infective endocarditis as a cause of fever in hemodialysis patients. J Assoc Physicians India. 2000;48:736-8.
Besnier JM, Choulet P. Modalités et surveillance de l’antibiotherapie des endocardites infectiouses. Rev Prat (Paris). 1998;48:513-8.
Bonhour D, Boibieux A, Pryramond D. Prophylaxie des endocardites infectieuses. Rev Prat (Paris). 1998;48:519-22.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Hirakawa N, Tasaki H, Tanako S, Yamasita K, Okazaki M, Nakashima Y, Kabashima N, et al. Infective tricuspid valve endocarditis due to abscces of an endogenous arteriovenous f istula in a chronic hemodialysis patient. JUOEH. 2004;26:451-60.
Hoen B, Selton-Suty CH, Bequinot I. Crítères diagnostiques des endocardites infectieuses. Rev Prat (Paris). 1998;48:497-501.
Levine DP, Fromm BS, Reddy BR. Slow response to vancomycin or vancomycin plus rifanpim in methicillin-resistant Staphylococcus aureus endocarditis. Ann Intern Med. 1991;115:674-80.
Maraj S, Jacobs LE, Maraj R, Kotler MN. Bacteremia and infective endocarditis in patients on hemodialysis. Am J Med Sci. 2004;327: 242-9.
Martínez M, Maldonado Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
McCarthy JT, Steckelberg JM. Infective endocarditis in patients receiving long-term hemodialysis. Mayo Clin Proc. 2000;75: 1008-14.
Megran DW. Enterococcal endocarditis. Clin Infect Dis. 1992;15: 63-71.
Robinson DL, Fowler VG, Secton DJ, Corey RG, Coulon PJ. Bacterial endocarditis in hemodialysis patients. Am J Kidney Dis. 1997;30: 521-4.
Spies C, Madison JR, Schatz IJ. Infective endocarditis in patients with end-stage renal disease: Clinical preventation and outcome. Arch Intern Med. 2004;164:71-5.
Troprak O, Caglar BU, Bayata S, Yasar H, Tanrisev M, Ersoy R, et al. Severe mitral valve infective endocarditis with widespread septi emboli in a patient with permanent hemodialysis catheter. Amadolu Kardiyol Derg. 2004;4:374-5.
Guía 10Las vías urinarias son un foco de infección frecuente por las propias afecciones urorrenales de estos pacientes y por la falta de un flujo de lavado urinario suficiente. Cistitis y pielonefritis, en general, y prostatitis en el varón son las más habituales. Escherichia coli, Proteus, Klebsiella, Enterococcus, Pseudomonas y Serratia son los más prevalentes. El cultivo de los líquidos biológicos es obligado (orina y sangre).
Bases documentalesAslan S. Urinary tract infections. En: Wilcox CS, Craig C, editores. Handbook of Nephrology & Hypertension. 5.ª ed. Philadelphia: Lippincott Williams & Wilkins; 2004. p. 153-60.
Bibb JL, Serville KS, Gibel LJ, Kinne JF, White RE, Hartssome MF, et al. Pyocystis in patients on chronic dialysis. A potentially mis diagnosed syndrome. Int Urol Nephrol. 2002;34:415-8.
Bishop MC. Infections associated with dialysis and transplantation. Curr Opin Urol. 2001;11:67-73.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Martínez M, Maldonado Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
Nicolle LE. Urinary tract infection: traditional pharmacologie therapies. Dis Mon. 2002;49:111-28.
Tolkoff-Rubin NE, Rubin RH. Therapy of urinary tract infection. En: Brady HR, Wilcox CS, editores. Therapy in nephrology and hypertension. 2.ª ed. Philadelphia: WB Saunders; 2003. p. 415-23.
Torres A. Infecciones del tracto urinario. En: Lorenzo V, Torres A, Hernández D, Ayus JC, editores. Manual de Nefrología. 2.ª ed. Madrid: Harcourt; 2002. p. 67-82.
Guía 11Si la infección es localizada, iniciar tratamiento empírico con quinolona o cefalosporina de segunda generación o amoxicilina-clavulánico. Si la infección es complicada, inicar con cefalosporina de tercera generación + aminoglucósido o quinolona. Como alternativa en recidivas, recordar el aztreonam. Modificar una vez conocidos el germen y la sensibilidad. El tratamiento se mantendrá entre 7 y 14 días según la infección sea localizada o complicada y 21 días si hay hemocultivos positivos.
Bases documentalesAslan S. Urinary tract infections. En: Wilcox CS, Craig C, editores. Handbook of Nephrology & Hypertension. 5.ª ed. Philadelphia: Lippincott Williams & Wilkins; 2004. p. 153-60.
Bibb JL, Serville KS, Gibel LJ, Kinne JF, White RE, Hartssome MF, et al. Pyocystis in patients on chronic dialysis. A potentially mis diagnosed syndrome. Int Urol Nephrol. 2002;34:415-8.
Bishop MC. Infections associated with dialysis and transplantation. Curr Opin Urol. 2001;11:67-73.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Martínez M, Maldonado Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
Nicolle LE. Urinary tract infection: traditional pharmacologie therapies. Dis Mon. 2002;49:111-28.
Tolkoff-Rubin NE, Rubin RH. Therapy of urinary tract infection. En: Brady HR, Wilcox CS, editores. Therapy in nephrology and hypertension. 2.ª ed. Philadelphia: WB Saunders; 2003. p. 415-23.
Torres A. Infecciones del tracto urinario. En: Lorenzo V, Torres A, Hernández D, Ayus JC, editores. Manual de Nefrología. 2.ª ed. Madrid: Harcourt; 2002. p. 67-82.
Guía 12Las infecciones osteoarticulares comúnmente son de origen embolígeno de otro foco séptico, o por lesión directa o úlcera en una de las áreas óseas o articulares. Los gérmenes hallados pueden ser variados por lo que debemos estudiar y cultivar el líquido de la articulación afecta y los hemocultivos. Valorar también la necesidad de pruebas serológicas complementarias.
Bases documentalesLeonard A, Comty CM, Shapiro FL, Raij L. Osteomyelitis in hemodialysis patients. Ann Intern Med. 1973;78:651. Martínez M, Maldonado Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
Slaughter S, Dworkin RJ, Gilbert DN, Legget JE, Jones S, Bryan TR, et al. Staphylococcus aureus septic artritis in patients on hemodialysis treatment. West J Med. 1995;163:128-32.
Valero R, Castañeda O, de Francisco ALM, Piñera L, Rodrigo E, Arias
M. Sospecha clínica de osteomielitis vertebral: dolor de espalda en los pacientes con infección asociada a catéter de hemodiálisis. Nefrología. 2004;24:583-8.
Guía 13A título empírico, si se dispone de la tinción de Gram, con grampositivos, iniciar con cloxacilina o cefalosporina de primera generación + aminoglucósido, y si hay incompatibilidad con penicilinas, usar vancomicina. Con gramnegativos, cefalosporina de tercera generación + aminoglucósido, como alternativa a la cefalosporina, utilizar ciprofloxacino o levofloxacino. Modificar el tratamiento según los resultados de los cultivos. El tratamiento deberá prolongarse según el germen hasta 4 semanas.
Bases documentalesLeonard A, Comty CM, Shapiro FL, Raij L. Osteomyelitis in hemodialysis patients. Ann Intern Med. 1973;78:651.
Martínez M, Maldonado Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
Slaughter S, Dworkin RJ, Gilbert DN, Legget JE, Jones S, Bryan TR, et al. Staphylococcus aureus septic artritis in patients on hemodialysis treatment. West J Med. 1995;163:128-32.
Valero R, Castañeda O, de Francisco ALM, Piñera L, Rodrigo E, Arias
M. Sospecha clínica de osteomielitis vertebral: dolor de espalda en los pacientes con infección asociada a catéter de hemodiálisis. Nefrología. 2004;24:583-8.
Guía 14La cavidad abdominal, con la variedad de órganos que contiene, puede presentar infecciones por una gran diversidad de gérmenes: aerobios, anaerobios, grampositivos y gramnegativos, ya que su origen también es diverso: hemático, intestinal, oral, linfático, urinario, por lo que no entraremos a detallar cada órgano específicamente, salvo la vía biliar por su elevada incidencia. No incluimos aquí las complicaciones infecciosas de la diálisis peritoneal que se detallan en las guías 18 a 28.
Bases documentalesCheung AH, Wong LM. Surgical infections in patients with chronic renal failure. Infect Dis Clin North Am. 2001;15:775-96.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Ito H, Miyagi T, Katsumi T. A renocolic fistula due to colon diverticulitis associated with polycystic kidney. Nippon Hinyokika Gakkai Zasshi. 2004;95:67-70.
Lederman ED, McCoy G, Conti DJ, Lee EC. Diverticulitis and polycystic kidney disease. Am Surg. 2000;66:200-3. Levy MN. Infected aortic pseudoaneurysm following laparoscopic cholecistectomy. Ann Vasc Surg. 2001;95:67-70. McFadden DW, Smith GW. Hemodiaysis associated hemorrhagic cholecystitis. Am J Gastroenterol. 1987;82:1081-3.
Guía 15Una vez cursados los cultivos para la identificación, se iniciará pauta empírica según la infección. Infección de la via biliar: amoxicilina-clavulánico o quinolona; si el proceso es de gravedad, cefalosporina de tercera generación + metronidazol + aminoglucósido. Infeccción abdominal y otras localizaciones: cefalosporina de tercera generación + metronidazol + aminoglucósido o bien sustituir los 2 primeros por ciprofloxacino + clindamicina. Puede ser útil en casos resistentes disponer de imipenem o teicoplanina o linezolid. Modificaremos la pauta antibiótica una vez valorada la respuesta a las 48-72 horas o conocido el cultivo. En las infecciones fúngicas son de elección el fluconazol o la 5-fluorocitosina.
Bases documentalesCheung AH, Wong LM. Surgical infections in patients with chronic renal failure. Infect Dis Clin North Am. 2001;15:775-96.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Ito H, Miyagi T, Katsumi T. A renocolic fistula due to colon diverticulitis associated with polycystic kidney. Nippon Hinyokika Gakkai Zasshi. 2004;95:67-70.
Lederman ED, McCoy G, Conti DJ, Lee EC. Diverticulitis and polycystic kidney disease. Am Surg. 2000;66:200-3. Levy MN. Infected aortic pseudoaneurysm following laparoscopic cholecistectomy. Ann Vasc Surg. 2001;95:67-70. McFadden DW, Smith GW. Hemodialysis associated hemorrhagic cholecystitis. Am J Gastroenterol. 1987;82:1081-3.
Zarate MS, Jorda-Vargas L, Lanza A, et al. Estudio microbiológico de bacteriemias y fungemias en pacientes en hemodiálisis crónica. Rev Argent Microbiología. 2005;37:145-9.
Guía 16La tuberculosis es una infección que sigue siendo incidente en los pacientes de diálisis (10 veces superior a la población general), por lo que sería útil realizar un test (PPD), sobre todo en aquellos con fiebre de origen desconocido, pérdida de peso, desnutrición, derrame pleural o infiltrado pulmonar poco determinantes, adenopatías, ascitis o hepatomegalia. Es frecuente la localización extrapulmonar. Un PPD negativo no la excluye.
Bases documentalesBelcon MC, Smith EKM, Kahana LM, Shimizu AG. Tuberculosis in dialysis patients. Clin Nephrol. 1982;17:14.
Cengiz K. Increased incidence of tuberculosis in patients undergoing hemodialysis. Nephron. 1996;73:421-4.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Erkoc R, Dogan E, Sayarlioglu H, Etlik O, Tepal C, Calke F, et al. Tuberculosis in dialysis patients, single experience from a endemic area. Int J Clin Pract. 2004;58:1115-7.
Fang HC, Lee PT, Chen CL, Wu MJ, Chou KJ, Chung HM. Tuberculosis in patients with end-stage renal disease. Int J Tuberc Lung Dis. 2004;8:92-7.
Martínez M, Maldonado Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
Mensa J, Gatell JM, Martínez JA, Torres A, Vidal F, Serrano R, et al. Terapéutica antimicrobiana (infecciones en urgencias). 5.ª ed. Antares; 2005.
Treatment of tuberculosis-American Thoracic Society-Medical Specialty Society-Centers for Disease control and Prevention-Federal Government Agency (US). Infections Diseases Society of America. 2003;20:1-7.
Wanters A, Peeterman WF, Vanden Brande P, Demoor B, Evenepoel P, Keuleers M, et al. The value of tuberculin skin testing in haemodialysis patients. Nephrol Dial Transplant. 2004;19:433-8.
Woeltje KF, Mathew A, Rothstein M, Seiler S, Fraser VJ. Tuberculosis infection and anergy in hemodialysis patients. Am J Kidney Dis. 1998;31:848-52.
Guía 17El tratamiento se realizará con pauta triple: rifampicina + isoniazida + etambutol o pirazinamida durante 2 meses, con la dosis diaria ingerida, si es posible, tras la hemodiálisis. Continuar con pauta doble hasta los 9-12 meses. En casos de recidivas o tratamientos previos no completados, se debería realizar una pauta con 4 fármacos, en los primeros 2 meses, por la posibilidad de resistencias. Es aconsejable añadir piridoxina. La imposibilidad de utilizar en los 2 meses iniciales la terapia triple, por intolerancia a uno o varios de los antibióticos, condiciona a buscar una combinación doble, que puede obligar a mantenerla hasta 18 meses. La combinación de pirazinamida + levofloxacino sería útil en casos de imposibilidad de prescribir rifampicina, isoniazida o etambutol. A los pacientes con PPD previo negativo, que seroconviertan en diálisis o que presenten una induración > 10 mm, se debería prescribirles tratamiento profiláctico durante 6 meses. También sería aconsejable en los casos con PPD negativo en contacto con un portador activo.
Bases documentalesBelcon MC, Smith EKM, Kahana LM, Shimizu AG. Tuberculosis in dialysis patients. Clin Nephrol. 1982;17:14.
Cengiz K. Increased incidence of tuberculosis in patients undergoing hemodialysis. Nephron. 1996;73:421-4.
Dauguirdas JT, Blake PG, Todd S. Handbook of Dialysis. Philadelphia: Lippincott Williams & Wilkins; 2001. Segunda edición española. Barcelona: Masson; 2003. p. 518-44.
Erkoc R, Dogan E, Sayarlioglu H, Etlik O, Tepal C, Calke F, et al. Tuberculosis in dialysis patients, single experience from a endemic area. Int J Clin Pract. 2004;58:1115-7.
Fang HC, Lee PT, Chen CL, Wu MJ, Chou KJ, Chung HM. Tuberculosis in patients with end-stage renal disease. Int J Tuberc Lung Dis. 2004;8:92-7.
Martínez M, Maldonado Rodicio JL, Herrera J. Tratado de Nefrología. Norma; 1993. p. 1124-5.
Mensa J, Gatell JM, Martínez JA, Torres A, Vidal F, Serrano R, et al. Terapéutica antimicrobiana (infecciones en urgencias). 5.ª ed. Antares; 2005.
Treatment of tuberculosis-American Thoracic Society-Medical Specialty Society-Centers for Disease control and Prevention-Federal Government Agency (US). Infections Diseases Society of Ame-rica. 2003;20:1-7.
Wanters A, Peeterman WF, Vanden Brande P, Demoor B, Evenepoel P, Keuleers M, et al. The value of tuberculin skin testing in haemodialysis patients. Nephrol Dial Transplant. 2004;19:433-8.
Woeltje KF, Mathew A, Rothstein M, Seiler S, Fraser VJ. Tuberculosis infection and anergy in hemodialysis patients. Am J Kidney Dis. 1998;31:848-52.
Infección en diálisis peritonealGuía 18El paciente en tratamiento con diálisis peritoneal tiene infecciones específicas: relacionadas con el catéter o peritonitis. Las medidas profilácticas comentadas en la guía 1, como la administración de antibiótico intravenoso en la inserción del catéter: cefazolina o vancomicina1, habrá que implementarlas posteriormente con lavados con solución salina hipertónica del orifício del catéter peritoneal. Se evitará especialmente el agua oxigenada2. Es importante la búsqueda y el tratamiento de portadores nasales1.
Guía 19Debemos sospechar infección en el caso en que haya signos flogóticos periorificiales: tumor, rubor, dolor y, especialmente, exudado (relacionados con el catéter), sospecha de absceso subcutáneo, líquido de drenaje turbio o dolor abdominal (peritonitis) con o sin fiebre3.
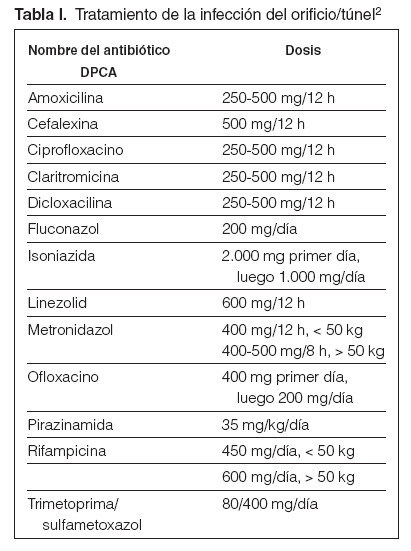
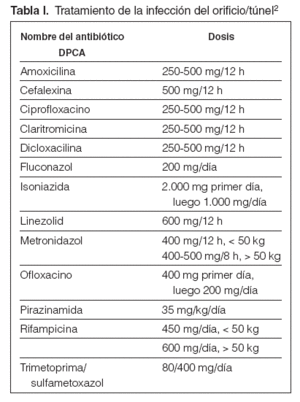
Guía 20En el caso de sospecha de infección del orificio (posible si hay eritema y con seguridad si hay exudado purulento), se reforzará la profilaxis local con lavados de solución salina hipertónica y la aplicación de crema de mupirocina al 2 % o gentamicina4. Si no hay respuesta en un término de 48-72 horas, habrá que usar el antibiótico específico para el germen aislado. Si no disponemos de los datos bacteriológicos, habrá que utilizar otros fármacos de más amplio espectro, como el ciprofloxacino o la bacitracina tópicos hasta conocer el antibiograma. Si hay exudado, el tratamiento será por vía sistémica (tabla I).
Tabla I. Tratamiento de la infección del orificio/túnel2
Guía 21En el caso de sospecha de infección del túnel (exudado y/o edema y/o dolor a la palpación), habitualmente precedida de infección del orificio, y después de proceder a los estudios bacteriológicos, se indicará tratamiento empírico local y sistémico, inicialmente vía oral (tabla I), en función del resultado de la tinción de Gram del frotis cutáneo o del exudado, si esta técnica fuera factible, según se indica en la guía 4. La confirmación del germen y de su sensibilidad implicará el cambio de tratamientos si procede. Estos tratamientos tendrán una duración mínima de 14 días2. Especialmente importante es identificar Staphylococcus aureus y/o Pseudomona aeruginosa, puesto que con estos gérmenes la duración del tratamiento antibiótico debe prolongarse.
Guía 22Ante la falta de respuesta se aconsejará introducir rifampicina, que no debe administrarse sola2 —con o sin aminoglucósido—, o ceftazidima, sola o asociada a aztreonam, según se trate respectivamente de un germen grampositivo o gramnegativo y de la gravedad de la clínica local y si hay clínica sistémica. La prolongación del tratamiento antibiótico más de 4 semanas comportará la inclusión de fluconazol, en una perspectiva tanto profiláctica como, virtualmente, terapéutica. La aparición de peritonitis o si la infección se mantiene pasadas 4 semanas de tratamiento implicará la retirada del cateter.
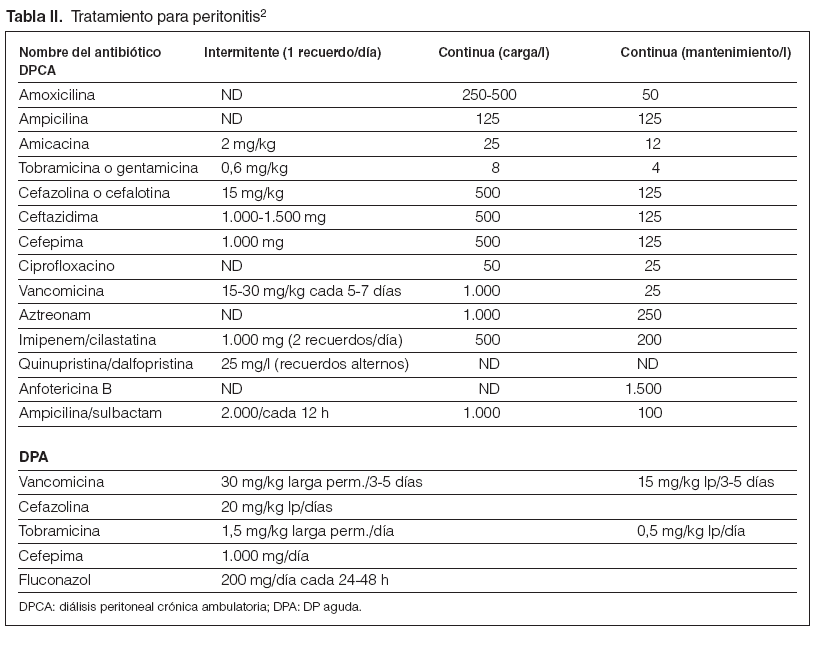
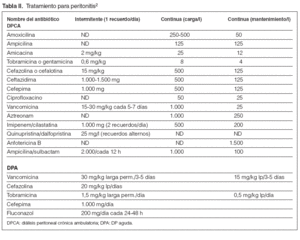
Guía 23En el caso de sospecha de peritonitis (líquido turbio, fundamentalmente) y después de las evaluaciones citológicas (más de 100 células/µl, con el 50 % de polimorfonucleares) y bacteriológicas (toma de cultivo y recomendable tinción de Gram) del efluente, se iniciará tratamiento empírico con vancomicina o cefalosporina de primera generación añadido un aminoglucósido o ceftazidima. Así cubrimos tanto grampositivos como gramnegativos. Algunos protocolos incluyen, además, ampicilina5. La tinción de Gram no sólo aporta datos bacterianos, sino que puede alertar precozmente de la presencia de hongos2. Véase las dosis en la tabla II.
Tabla II. Tratamiento para peritonitis2
Guía 24Confirmada la infección peritoneal e identificado el germen como un grampositivo, se podrá mantener la vancomicina sola o asociada a una cefalosporina, según el grado de respuesta al tratamiento aplicado previamente, sea empírico o dirigido. En el caso de confirmarse un gramnegativo, se retirará la vancomicina indicada empíricamente y se mantendrá el aminoglucósido, en principio, valorando introducir ceftazidima o cefepima (acción sinérgica) y/o, en su defecto, la inclusión de ciprofloxacino en este caso oral o i.p. En caso de Pseudomonas aeruginosa siempre debe emplearse 2 antibióticos antipseudomónicos asociados (ceftazidima, aminoglucósidos, piperacilina, ciprofloxacino, aztreonam, imipenem)6. Véase las dosis en la tabla II.
Guía 25En caso de confirmarse la peritonitis por Staphylococcus aureus y si la respuesta empírica a la vancomicina (o teicoplanina) no ha sido satisfactoria, se podrá introducir una cefalosporina o también rifampicina. De tratarse de un germen resistente a meticilina, la falta de respuesta a la vancomicina, por resistencia, implicará añadir rifampicina o la sustitución por linezolid u otros antibióticos menos usuales (daptomicina o quinupristina/dalfopristina)2. Sin embargo, en nuestro medio no se han observado resistencias a la vancomicina en enterococos y estafilococos, lo que conf iere un elevado poder resolutivo a este último antibiótico6.
Guía 26Otras recomendaciones a tener en cuenta3:
– Si se sospecha peritonitis por gérmenes anaerobios (p. ej., perforación), se recomienda añadir metronidazol y ampicilina. Si además es polimicrobiana, se recomienda la valoración quirúrgica.
– En caso de peritonitis en DPA, se recomienda tratar en el intervalo más largo y con mayores dosis o frecuencia (tabla II).
– Se recomienda ajustar las dosis al peso corporal, la función residual y también en altos transportadores.
En el caso de confirmarse una peritonitis fúngica, usualmente por Candida, se indicará fluconazol o fluocitosina, solos o en asociación, ya sea por vía sistémica o peritoneal y se efectuará la retirada precoz del catéter, aunque algunos autores aconsejan esperar 48-72 h la respuesta al tratamiento7,8.
Guía 28En cualquier tipo de peritonitis la ausencia de respuesta a los 5 días2 o, a lo sumo, una semana del tratamiento o el empeoramiento clínico podrán suponer la retirada del catéter. En esta circunstancia habrá que mantener el tratamiento antibiótico, tanto el administrado por vía peritoneal como el suministrado por vía sistémica, entre 3 y 7 días más.
Guía 29Criterios de aislamiento:
– Tuberculosis pulmonar en fase activa, durante las primeras 2 semanas de tratamiento de blanqueo.
– Infección sistémica o supuración abierta por S. aureus resistente a meticilina (MARSA). Los portadores nasales de MARSA no precisan aislamiento, pero recibirán tratamiento con mupirocina y se cuidará el estricto cumplimiento de todas las medidas indicadas en la “Guía 1”. Si hay lesiones cutáneas con positividad para MARSA, se mantendrán cubiertas durante su estancia en la unidad de diálisis.
– Pacientes con infección broncopulmonar aguda por Acinetobacter y/o Aspergillus.
Mensa J, Gatell JM, Martínez JA, Torres A, Vidal F, Serrano R, et al.
Terapéutica antimicrobiana (infecciones en urgencias). 5.ª ed.
Antares; 2005. Protocols de malalties infeccioses. Servei de Malalties Infeccioses.
Hospital Vall d’Hebron. Barcelona: Servei Català de la Salut; 2003.
Guía 30En situación de infección aguda, pero también en caso de infección crónica en hemodiálisis, es necesario ajustar dosis de los siguientes fármacos: amoxici-lina-clavulánico 500/125/24 h, con dosis adicional tras la diálisis; aztreonam 1 g/24 h y 500 mg tras la diálisis; cefazolina 1 g/24 h y 500 mg tras la diálisis; cefuroxima 750 mg/24 h intravenoso, con dosis adicional tras la diálisis; cefuroxima 500 mg/24 h oral; ceftazidima 500 mg/24 h, con dosis adicional tras la diálisis; ciprofloxacino 500 mg/24 h, con dosis adicional tras la diálisis y procurando no simultanear con sales cálcicas o de Fe9; cloxacilina 2 g/8 h; etambutol 15 mg/kg/48 h, flucitosina 37,5 mg/kg/48 h; fluconazol 200 mg/24 h; gentamicina 2 mg/kg/48 h tras la dálisis, levofloxacino 500 mg inicial y 125 mg/24 h y procurando no simultanear con sales cálcicas o de Fe9; rifampicina 300 mg/24 h; vancomicina 1 g/semana; pirazinamida, sin datos (valorar necesidad de tratamiento).
Guía 31Por la propia toxicidad específica, se deben monitorizar las posibles manifestaciones orgánicas o sistémicas asociadas al tratamiento antiinfeccioso. Por ello se debe prestar atención a:
– Betalactámicos: reacciones de hipersensibilidad sistémica, fiebre.
– Cefalosporinas: posibilidad de alergias y, ocasionalmente, encefalopatía.
– Etambutol: alteraciones oculares, hiperuricemia.
– Fluocitosina y fluconazol: molestias digestivas, reacciones cutáneas, alteraciones del sistema nervioso central, elevación de las transaminasas, toxicidad medular.
– Gentamicina: toxicidad sobre el VII par, son menos tóxicos los otros aminoglucósidos (tobramicina, amikacina).
– Isoniazida: neuritis periférica (evitable si se añade piridoxina), hepatotoxicidad en los primeros meses.
– Linezolid: no administrar con IMAO, no dar vía oral en pacientes con fenilcetonuria. Neuropatía.
– Metronidazol: molestias digestivas y reacciones cutáneas en tratamiento prolongado (polineuritis sensitiva, encefalopatía, convulsiones).
– Pirazinamida: fotosensibilidad, hepatotoxicidad, hiperuricemia, porfiria.
– Quinolonas: artralgias, fotosensibilidad, alteraciones del sistema nervioso central.
– Rifampicina: ataxia, miopatía, cefalea, fotosensibilidad, aumento de la bilirrubina, síndrome gripal administrada intermitentemente.
– Vancomicina: síndrome del hombre rojo (rash cutáneo si no se administra lentamente), leucocitopenia y trombocitopenia reversibles.
– Anfotericina B: dolor a la infusión intraperitoneal.
Los autores no declaran conflictos de intereses.
Correspondencia: Dr. A. Foraster. Servicio de Nefrología. GAMBRO Healthcare Catalunya. Amadeu Torner, 109. 08902 L’Hospitalet de Llobregat. Barcelona. España. Correo electrónico: andreu.foraster@gambro.com
Recibido el 6-9-2007; aceptado para su publicación el 21-2-2008.