Introducción
La colitis ulcerosa (CU) y la enfermedad de Crohn son las principales entidades que se incluyen en la denominación enfermedad inflamatoria intestinal (EII). Estas enfermedades se caracterizan por tener un curso crónico con brotes de actividad inflamatoria. Los corticoides sistémicos son el tratamiento convencional para controlar los brotes moderados-severos de EII. Al año de iniciar el tratamiento con corticoides, en alrededor 50 % de los casos la CU es resistente a los corticoides o no se puede retirarlos (corticodependencia)1. Además, los corticoides sistémicos presentan un tasa no despreciable de efectos secundarios, algunos irreversibles2.
En estas situaciones la actitud recomendable es el empleo precoz de inmunomoduladores, especialmente azatioprina y 6-mercaptopurina3, con eficacia en el mantenimiento de la remisión sin esteroides, específicamente en la CU corticodependiente, de un 70 %4.
Infliximab, anticuerpo monoclonal quimérico contra el factor de necrosis tumoral (TNF), se ha mostrado eficaz en inducir remisión y retirar los esteroides en la CU en 2 ensayos controlados y a doble ciego recientes5. No obstante, aún una parte de estos pacientes pueden no responder o no tolerar los tratamientos biológicos o inmunomoduladores6 y se necesita disponer de otras opciones terapéuticas.
La EII activa se asocia al aumento y la activación en sangre periférica de neutrófilos y monocitos-macrófagos, así como incremento de su vida media7. Tienen un papel importante la migración y la activacion de los leucocitos en el foco inflamatorio donde, tras la liberación de proteasas, las citocinas proinflamatorias (TNFα, interleucina [IL] 8, IL-1, LTB4, PAF), radicales libres de oxígeno y otros mediadores son causa, en gran medida, de la lesión tisular, así como de amplificar el proceso inflamatorio8. La cantidad de neutrófilos en la mucosa intestinal está cuantitativamente relacionada con la gravedad de la inflamación intestinal y puede predecir la recidiva9. Teniendo en cuenta estos aspectos, la depleción selectiva de leucocitos activados puede ser un tratamiento efectivo no farmacológico para promover la remisión de la CU.
Las técnicas de aféresis leucocitaria (LAF) se están utilizado en el tratamiento de la EII, especialmente en la CU, en Japón en la ultima década con resultados prometedores10,11.
Además de adsorber selectivamente leucocitos circulantes activados, la LAF induce cambios funcionales en estas células; así, se ha descrito reducción de las citocinas proinflamatorias, con disminución de IL-1β,TNFα, IL-6 e IL-812, en parte por una reducción en la expresión de factores de transcripción intracelular13.
Se ha atribuido otros efectos inmunomoduladores a la LAF: disminución de la expresión de moléculas de adhesión como L-selectina, importante en el inicio de la migración leucocitaria, modulación de la apoptosis granulocitaria12 e incremento de mediadores antiinflamatorios (receptores solubles de TNF, IL-1ra, IL-10)14.
Presentamos los resultados de un estudio abierto y prospectivo de práctica clínica que evalúa la eficacia de la LAF en la CU corticodependiente.
Pacientes y método
Pacientes
Se ha incluido a 13 pacientes con CU corticodependiente tratados mediante LAF. La CU se diagnosticó según los criterios de Lennard-Jones15. La corticodependencia se define por recidiva durante la reducción de la dosis de corticoides que impide suspenderlos por completo o al menos 2 brotes que requieren esteroides sistémicos en un período de 6 meses16. Las características basales de los pacientes se recogen en la tabla I. Un paciente había presentado una pancreatitis por azatioprina, en otro no se indicaron inmunomoduladores, y los restantes estaban en tratamiento con azatioprina, mercaptopurina o metotrexato por más de 6 meses sin que fueran eficaces. Los pacientes que llevaban tratamiento con salicilatos o corticoides rectales sin respuesta mantuvieron dosis estables o las redujeron en caso de evolución favorable.
Métodos
En la visita basal se efectuó evaluación clínica, analítica, estudio microbiológico de heces, y rectosigmoidoscopia. Se emplearon el índice de Truelove-Witts modificado para valorar la actividad clínica17 y el índice endoscópico de Rachmilewitz para la actividad endoscópica18. El índice de Truelove basal se calculaba con la dosis de corticoide que en ese momento llevaba cada paciente. Un paciente con brote de actividad al poco tiempo de haber suspendido corticoides rechazó volver a tomarlos (libre de corticoides sistémicos); en 9 pacientes se incrementó la dosis de prednisona a 40-60 mg/día. Al mes de la última aféresis, se realizó la evaluación clínica, analítica y endoscópica para establecer su eficacia. En 7 casos se disponía de determinación de calprotectina fecal, mediante ELISA en placa, basal y tras el tratamiento.
En Europa se comercializan 2 dispositivos de aféresis para su empleo en EII. En ambos se establece un circuito venoso extracorpóreo entre venas antecubitales de ambos brazos; la sangre del paciente pasa a través de la columna o filtro donde se adsorben diversas subpoblaciones leucocitarias. El sistema de columna de Adacolumn® consiste en una columna de 335 ml de capacidad que contiene 220 g de gránulos de diacetato de celulosa (Otsuka Pharmaceutical Europe). La columna está constituida por 35.000 cuentas de 2 mm de diámetro, bañadas por suero salino donde se adsorben leucocitos activados portadores de receptores del complemento (CD11b/CD18) y receptores FcγR; de esta manera se produce una adsorción selectiva de granulocitos y monocitos, pero no de linfocitos, por lo que se denomina específicamente granulocitoaféresis (GACF)10,11,19. El sistema de columna filtro de polipropileno de Cellsorba® (Asahi Medical, Tokio, Japón) contiene una membrana no trenzada de poliéster que permite filtrar un 99 % de los granulocitos y los monocitos y un 70 % de los linfocitos, por lo que se denomina específicamente leucocitoaféresis (LCAF)10,20.
A la semana de la visita basal, se iniciaron las sesiones de aféresis de forma ambulatoria, en la Unidad de Diálisis del Servicio de Nefrología. Si el acceso venoso periférico fue imposible, se recurrió a un acceso central mediante un catéter temporal de doble luz de 10 Fr (Split Cath pediátrico, Izasa, Barcelona, España). Las sesiones se practicaron de forma semanal durante 5 semanas con Adacolumn® y durante 6 semanas con Cellsorba®; 11 pacientes fueron tratados con Adacolumnì y 2, con Cellsorba®. Se planificaron sesiones de 1 h de duración a un flujo de 30 ml/min para Adacolumn® (con lo cual se filtran 1.800 ml/sesión) y 50 ml/min para Cellsorba® (3.000 ml/sesión). Al inicio del procedimiento se realiza un cebado del circuito con 4.000 UI de heparina sódica al 1 % y se administra un bolo de enoxaparina de 1 mg/kg en el circuito de entrada, para evitar su coagulación. Se recogieron los efectos adversos acontecidos durante cada sesión de aféresis.
El descenso de la dosis de corticoides se inició a razón de 5 o 10 mg/semana desde el momento en que la evolución clínica era favorable, nunca antes de la tercera sesión. La inducción de la remisión se evaluó al mes de la última sesión. La remisión clínica se definió como el logro de un índice de Truelove modificado < 11 junto con la retirada completa de esteroides, y la respuesta parcial, como un descenso > 4 puntos en el índice y reducción en la dosis de corticoides sin retirarlos. La remisión endoscópica fue definida como un índice de actividad endoscópica ≤ 4 sin tratamiento corticoideo y la mejoría, como un descenso de al menos 2 puntos en el índice21.
Análisis estadístico
Se han calculado frecuencias, medias y desviaciones estándar como análisis descriptivo. Para medir las diferencia de medias de los parámetros analizados antes y después del tratamiento, se ha utilizado el test de la t de Student y el test de Wilcoxon para muestras apareadas. Para analizar la asociación entre remisión clínica y endoscópica, se ha utilizado el test exacto de Fisher y el coeficiente de correlación de Pearson para medir la relación entre los índices de Truelove y el endoscópico.
Los análisis estadísticos se realizaron mediante el paquete estadístico SAS (SAS Institute para Windows versión 9.1).
Resultados
Inducción de la remisión
Al mes de la última sesión de aféresis, 7 (54 %) de 13 pacientes cumplían criterios de remisión y 3, de respuesta parcial; la eficacia general (remisión o respuesta) del 77 % (fig. 1).Se trató a 3 pacientes con otro ciclo adicional de 5 sesiones; uno de ellos entró en remisión, otro mejoró y en el otro el tratamiento fracasó. Por lo tanto, las tasas de remisión clínica y respuesta parcial en el total de ciclos de tratamiento fueron del 43,7 % (7/16) y el 31 % (5/16), respectivamente. El paciente que tras 10 sesiones entró en remisión tenía antecedente de brote grave corticorresistente, con respuesta a ciclosporina 9 meses antes y un curso posterior corticodependiente, sin que la azatioprina fuera eficaz y, por lo tanto, con alta probabilidad de precisar cirugía en el curso evolutivo de la enfermedad. Dos pacientes no respondedores fueron colectomizados (el 15,3 % de la serie), uno tras evolucionar a un brote grave y el otro ante el hallazgo de displasia severa confirmada.
Figura 1. Eficacia general clínica y endoscópica al mes de la leucoaféresis.
La remisión endoscópica al mes de la última aféresis se logró en 5 (38 %) de los 13 y la mejoría endoscópica, en otros 4 (31 %), con una respuesta general del 69 %. En el 71,4 % de los pacientes la remisión clínica se acompañó de remisión endoscópica (p = 0,02), con correlación significativa entre la mejoría del índice clínico y el índice endoscópico en los respondedores (r2 = 0,53; p = 0,016).
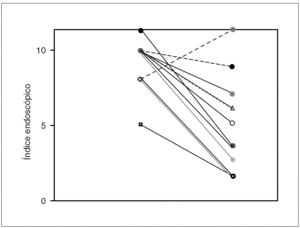
La media del índice de Truelove modificado descendió de 15,60 ± 1,57 a 10,30 ± 1,82 (p = 0,002) y la media del valor del índice endoscópico descendió de 9,30 ± 1,88 a 4,7 ± 2,66 (p < 0,001) en los respondedores, mientras no hubo cambio significativo en ambos índices de los no respondedores (figs. 2 y 3).
Figura 2. Evolución del índice de Truelove modificado tras el tratamiento con técnicas de aféresis (n = 13).
Figura 3. Evolución del índice endoscópico tras el tratamiento con técnicas de aféresis (n = 13).
La respuesta clínica se acompañó de un descenso en los parámetros biológicos: PCR, 25,36 ± 24,58 a 3,29 ± 2,44 mg/l (p = 0,009); VSG, 28,6 ± 17,67 a 16,1 ± 10,53 mm/h (p = 0,023) (fig. 4). De 7 pacientes respondedores se disponía de determinación de calprotectina fecal, que era > 4.000 mg/kg en 6 y en ellos su valor medio descendió a algo menos de la mitad, aunque no se normalizó en ningún caso.
Figura 4. Modificación de los valores medios de PCR y VSG antes y después del tratamiento en los pacientes con respuesta en general (remisión o respuesta parcial, n = 10).
Efectos adversos
Se realizó un total de 82 procedimientos en los 13 pacientes, que los toleraron bien. En 10 (12 %) sesiones fue necesario reducir el flujo y, por lo tanto, prolongar la sesión, pero sólo en 3 (3,6 %) de ellas no se completó el volumen que se preveía filtrar, por problemas en mantener el retorno venoso, 2 con Adacolumn® y uno con Cellsorba®.
La accesibilidad de las venas periféricas fue problemática en 3 casos. En uno se produjo un neumotórax en un intento de acceso a vena yugular, y se resolvió con tratamiento médico. En un segundo intento, unas semanas después, fue posible el acceso venoso periférico y completar el tratamiento. Dos pacientes, uno de ellos de edad avanzada, precisaron un catéter central hasta completar las sesiones de aféresis.
Discusión
Aunque con criterios de definición de la respuesta discordantes y algunas deficiencias metodológicas, al menos 4 estudios controlados han evaluado la eficacia de las técnicas de LAF en el tratamiento de la CU. Tres ensayos aleatorizados sin enmascarar sobre CU corticodependiente20,22,23 compararon su eficacia asociada a una dosis estable de corticoides para inducir remisión frente al incremento de nuevo de la dosis de corticoides sistémicos, con una tasa de respuesta de un 59-83 %, tan efectiva o más que el empleo de corticoides a altas dosis y con menos efectos secundarios. Un estudio controlado con placebo (columna ficticia) en la CU corticorresistente, aunque definida como falta de respuesta a una dosis de corticoides < 1 mg/kg/día en la mayoría de los casos24, mostró una tasa significativamente mayor de respuesta general (el 80 frente al 33,3 %; p < 0,05), pero no de remisión (el 20 y el 11 %). El número reducido de pacientes (19) no permite establecer conclusiones firmes.
La principal indicación de la LAF es la CU corticodependiente en casos en que es preciso inducir la remisión sin corticoides debido a su toxicidad o cuando los inmunomoduladores de primera línea son ineficaces o no se toleran. También puede utilizarse como tratamiento puente durante el tiempo que azatioprina o mercaptopurina tardan en hacer efecto, como se señala en un documento de consenso recientemente publicado25.
Aunque los criterios que definen la remisión no son homogéneos en diferentes estudios y no siempre incluyen la retirada completa de corticoides, la LAF muestra un papel ahorrador de esteroides en CU corticodependiente20,26, lo que permite disminuir la dosis en el 90 % de los casos26 y retirarlos totalmente en el 68 %27. En un estudio abierto y prospectivo de GETECCU en el que la remisión conlleva la retirada completa de esteroides e incluye a 13 pacientes con CU corticodependiente, la tasa de remisión a la semana de finalizar la GCAF con Adacolumn® fue del 62 % y la respuesta general, del 77 %28.
Hemos evaluado la eficacia al mes de finalizar la LAF, dadas las características de los pacientes remitidos para esta terapéutica, generalmente como último recurso previo a cirugía, con tiempo amplio de evolución de la enfermedad, en tratamiento corticoideo por períodos excesivamente largos que en algún caso condicionaban importantes efectos adversos. Por otro lado, la respuesta inmediata, una semana tras finalizar la LAF, parece incrementarse al cabo de un tiempo21,28.
Los resultados parecen mejores en pacientes con EII con menor dosis acumulativa de esteroides en el curso de la enfermedad27 o una menor duración29. Se ha empleado granulocitoaféresis para inducir remisión en pacientes corticodependientes sin volver a administrar corticoides sistémicos (libres de esteroides), con una tasa de remisión del 64 % y de respuesta general del 85 %26. Una situación especial son los pacientes que no han recibido previamente esteroides en el curso de su enfermedad (naives), con tasas de remisión completa elevadas11,27,29 (media ponderada del 82 %)30.
La pauta más difundida con Adacolumn® es la de una sesión semanal durante 5 semanas. No existe una pauta de número de sesiones que haya evidenciado una mayor eficacia, aunque en el estudio de Kanke et al27 la tendencia es más favorable tras 10 sesiones que tras un mínimo de 5. En 3 casos se añadieron otras 5 sesiones, y se consiguió completar la remisión en uno de ellos. Un reciente estudio controlado de Ricart, pendiente de publicación, no encuentra diferencia significativa entre 5 y 10, pero sesiones de aféresis adicionales pueden ser necesarias en algunos pacientes29. Un estudio controlado31 evidencia mayor rapidez de respuesta (22,5 días frente a 7,5; p < 0,05) con el empleo del mismo número de sesiones en menos tiempo, aspecto a tener en cuenta en situaciones de actividad más grave y de corticorresistencia.
Como en otros estudios, la respuesta clínica se acompaña de mejoría de los parámetros biológicos, especialmente PCR y VSG27,28. La reducción de los valores de la calprotectina fecal como indicador de inflamación intestinal también puede ser un marcador de mejoría de las lesiones mucosas32.
Parece haber correlación entre respuesta clínica y mejoría de las lesiones endoscópicas27,28, aunque la tasa de remisión endoscópica suele ser inferior a la de remisión clínica33, con cifras que dependen de lo estricto de los criterios empleados para medir la remisión.
Un aspecto que evaluar es si mayores tasas de curación mucosa se logran con el tiempo o incrementando el número de sesiones y si esto tiene consecuencias favorables en la evolución a largo plazo.
Uno de los principales argumentos favorables a la LAF (y el mejor aceptado por los pacientes) es la seguridad. Los efectos adversos descritos de la técnica son escasos, con una frecuencia general de un 5-6 %30, y suelen ser poco relevantes. La frecuencia de efectos moderados que precisan tratamiento o llevan a interrumpir la LAF es del 1,6 %34. Los más graves que se ha descrito (embolia, sepsis) han tenido relación con la necesidad de recurrir a la vía central más que con el tratamiento en sí28, como ha sucedido en el único efecto secundario relevante en nuestra serie.
Quizá el principal inconveniente sea la aplicabilidad de la técnica, fundamentalmente condicionada por no obtener accesos venosos periféricos adecuados, especialmente en pacientes tratados largo tiempo con corticoides que pueden incrementar la fragilidad vascular19,30 o de edad avanzada, como en nuestro caso, en que tuvimos que recurrir a un catéter central. Técnicamente pueden presentarse problemas en mantener el retorno, que condicionan que la sesión finalice antes de lo previsto en un 6,7 % de los casos35.
En resumen, las técnicas de aféresis constituyen una alternativa prometedora para el tratamiento de la CU corticodependiente y quizá también para otras situaciones en que hayan fracasado las opciones terapéuticas hasta ahora existentes; en algunos casos permite posponer o evitar la cirugía. Quedan aún aspectos por evaluar: momento de su empleo en el curso de la enfermedad, frecuencia y número de sesiones, tiempo de ejecución, etc. Registros multicéntricos de series amplias con criterios homogéneos y ensayos controlados, algunos en marcha, permitirán posicionar adecuadamente esta modalidad en el arsenal terapéutico de la EII.
No existe conflicto de intereses.
Correspondencia: Dr. J. Cabriada-Nuño.
Servicio de Aparato Digestivo. Hospital Galdakao.
B.º Labeaga, s/n. 48960 Galdakao. Vizcaya. España.
Correo electrónico: jcabriada@hgda.osakidetza.net
Recibido el 18-11-2006; aceptado para su publicación el 2-2-2007.