La hiperglucemia se ha considerado como un factor negativo en pacientes hospitalizados diabéticos y no diabéticos, relacionándose con la presencia de diversos desenlaces desfavorables. En los pacientes trasplantados de riñón el estrés quirúrgico, los medicamentos inmunosupresores y las estancias prolongadas en el hospital puede ser factores que favorezcan la hiperglucemia. Sin embargo, no se ha confirmado si la hiperglucemia durante el postrasplante inmediato se asocia con mayor riesgo de rechazo.
Población y métodosEstudio de cohorte retrospectivo en pacientes mayores de 15años que recibieron un trasplante renal y que contaron con mediciones de glucemia en las primeras 48h postrasplante. Se evaluó la presencia de hiperglucemia definida de 3 maneras diferentes (como un valor aislado, como la media de los valores y como un valor ponderado en el tiempo) en pacientes sometidos a un trasplante renal y su relación con el riesgo de rechazo agudo y el tiempo de estancia hospitalaria.
ResultadosSi bien un número elevado de pacientes (91%) presentaron alguna forma de hiperglucemia durante las primeras 48h postrasplante, independientemente de cómo esta fue definida, no hubo un mayor riesgo de rechazo (OR: 0,35; IC95%: 0,11-1,08) o diferencia en el tiempo de estancia hospitalaria (13,2 vs. 8,9 días, p=0,958) entre los pacientes que la presentaron y los que no.
ConclusionesEs frecuente encontrar algún tipo de hiperglucemia durante las primeras 48h después del trasplante renal; sin embargo, su presencia no acarrea mayor riesgo de rechazo del trasplante o mayor tiempo de estancia hospitalaria cuando se compara con pacientes que no la presentaron previamente.
Hyperglycemia has been considered as a negative factor in hospitalized patients, both diabetic and non-diabetic, and has been related to the presence of diverse adverse outcomes. In kidney transplant patients, surgical stress, immunosuppressive drugs and prolonged hospital stays may be factors that promote hyperglycemia. However, has not been studied whether hyperglycemia during transplantation is associated with increased risk of rejection.
Population and methodsA retrospective cohort study in patients older than 15years who received a kidney transplant and that included measurements of glucose in the first 48hours after transplantation. We evaluated the presence of hyperglycemia defined in three different ways (as a single value, as averaged value and as time-weighted value) in patients undergoing renal transplantation and its relationship to the risk of acute rejection and length of hospital stay.
ResultsWhile a large number of patients (91%) had some form of hyperglycemia during the first 48hours after transplantation regardless of how it was defined, there was no an increased risk of rejection (OR=0.35; 95%CI=0.11-1.08) or a difference in length of stay (13.2 vs. 8.9 days, P=.958).
ConclusionsIt is common to find some form of hyperglycemia during the first 48hours after kidney transplantation, but its presence does not entail increased risk of transplant rejection or longer hospital stay when compared with patients who did not present it.
La hiperglucemia se define como cualquier valor de glucemia mayor de 140mg/dl1. Basados en esta definición, se ha encontrado que hasta el 38% de todos los pacientes hospitalizados presentan hiperglucemia en cualquier momento de la hospitalización, mientras que en los críticamente enfermos el 41% de ellos la presentan, en pacientes con fallo cardiaco el 44% y en pacientes después de cirugía cardiaca el 80%. Llamativamente, entre el 30 y el 80% de los individuos no tienen el antecedente de diabetes mellitus2. La hiperglucemia de estrés es aquella que se presenta en pacientes sin antecedente de diabetes y usualmente es transitoria; es causada por la liberación de hormonas contrarreguladoras como el cortisol y la adrenalina, y por el incremento en la resistencia a la insulina3,4, aunque el factor más importante parece ser la gluconeogénesis hepática5. La hiperglucemia en un paciente hospitalizado, especialmente en trasplantados, también puede ser consecuencia del uso de diferentes tipos de medicamentos, como glucocorticoides y otros inmunosupresores6,7.
Los efectos deletéreos de la hiperglucemia en el largo plazo son bien conocidos, especialmente los relacionados con el daño micro y macrovascular8,9. En el contexto del paciente agudo la hiperglucemia produce cambios en el sistema inmune10 y la coagulación11; además, las fluctuaciones en los niveles de glucosa inducen apoptosis en las células endoteliales causando disfunción endotelial12.
En los pacientes sin antecedente de diabetes la hiperglucemia es un marcador de mortalidad, especialmente en aquellos en unidades de cuidados intensivos, y también se asocia a mayores tiempos de estancia hospitalaria y mayor riesgo de infección postoperatoria13–15. La hiperglucemia también se ha asociado a eventos adversos en pacientes con infarto agudo de miocardio16–19 y con enfermedad cerebrovascular20,21.
Los inmunosupresores son parte fundamental del tratamiento de un paciente trasplantado, y existe evidencia de que la resistencia a la insulina en pacientes trasplantados renales se incrementa con el uso de esteroides, independientemente del antecedente de diabetes mellitus, e incluso el incremento en la resistencia de los pacientes no diabéticos es comparable a la de los pacientes diabéticos22.
En pacientes sometidos a trasplante de órgano sólido no existen estudios prospectivos que evalúen la relación de la hiperglucemia en el periodo inmediatamente posterior al trasplante y su relación con desenlaces desfavorables. En algunos estudios retrospectivos la hiperglucemia inmediatamente posterior al trasplante renal se ha asociado con el riesgo de rechazo agudo (OR: 1,015 [IC95%: 1,008-1,022]) en pacientes no diabéticos23, mientras que en otros no se ha encontrado tal relación24. Basados en lo anterior, realizamos un estudio observacional para determinar si existe asociación entre los valores aumentados de glucemia durante las 48h posteriores al trasplante renal y el riesgo de rechazo temprano o un mayor tiempo de estancia hospitalaria. Nuestra hipótesis fue que la presencia de hiperglucemia sostenida en ese periodo de tiempo se asocia con mayor riesgo de rechazo temprano y mayor tiempo de estancia.
Materiales y métodosDiseño y población de estudioSe diseñó un estudio de cohorte de tipo retrospectivo en el cual se analizaron todos los registros de los pacientes trasplantados de riñón por primera vez durante los años 2006 a 2011 en el Hospital Pablo Tobón Uribe, un hospital universitario de alto nivel de complejidad y centro de trasplantes en la ciudad de Medellín. Incluimos pacientes mayores de 15años que tuvieran por lo menos una medición de glucemia en las primeras 48h después del trasplante y se excluyeron todos los que murieron como consecuencia de complicaciones quirúrgicas en las primeras 24h postrasplante.
MedicionesSe documentaron todos los valores de glucemia de las primeras 48h postrasplante desde el ingreso del paciente a la unidad de cuidados intensivos (UCI) y se emplearan 3 diferentes medidas para determinar la hiperglucemia: 1)al menos un valor >140mg/dl; 2)la media o la mediana de todas las mediciones >140mg/dl), y 3)el valor ponderado en el tiempo (equivalente a un área bajo la curva de todas las mediciones) de la glucosa >140mg/dl. Para esta última medición se asumió una relación lineal entre los valores de mediciones realizadas con intervalos de 2 o más horas, y el resultado que se obtiene es el porcentaje de tiempo de las primeras 48h postrasplante en el cual el paciente tuvo valores de glucosa >140mg/dl25. Se analizaron los pacientes de acuerdo con el antecedente de diabetes mellitus y se definió diabetes postrasplante en aquellos casos con al menos 2 valores de glucemia en ayunas superiores a 126mg/dl o de hemoglobina glicada superior a 6,5%, detectados luego del postoperatorio inmediato en un paciente sin antecedente de diabetes mellitus. Se evaluó el rechazo del injerto renal definido por el equipo médico encargado del tratamiento del paciente en aquellos casos en los cuales hay deterioro de la función renal dado por un incremento de la creatinina mayor al 10%, acompañado de prueba histológica de rechazo. Cuando no había prueba histológica de rechazo se acudió al criterio clínico por el cual un incremento de la creatinina mayor al 10% estaba a favor de rechazo, y una mejoría de la creatinina con el uso de terapia inmunosupresora en los primeros 90días era prueba de que había existido rechazo. La mortalidad fue definida como la muerte del paciente por causas diferentes a complicaciones inherentes al acto quirúrgico en la misma hospitalización.
Dentro de las variables de confusión se tuvieron en cuenta el tiempo de isquemia fría (superior a 24h), el desarrollo de necrosis tubular (diagnosticada por histología en la primera semana después del trasplante), las condiciones raciales que se asocian a mayor riesgo de rechazo renal, específicamente pacientes de raza negra receptores del injerto renal, y el tipo de inmunosupresión que recibieron los pacientes al momento del trasplante.
Plan de análisisLas variables continuas se presentan como promedios y las variables nominales como proporciones. La exploración de asociación para variables dicótomas se hizo por medio de las pruebas de Chi cuadrado o la prueba exacta de Fisher, de acuerdo con el valor esperado de las celdas, y la magnitud de asociación se estableció por medio de un riesgo relativo indirecto (odds ratio) obtenido por la aproximación de Woolf con intervalo de confianza del 95%. La exploración de asociación para variables continuas se hizo por medio de la prueba t de Student, asumiendo varianzas desiguales.
ResultadosSe recolectaron los datos de 474 pacientes sometidos a trasplante renal y se excluyeron del análisis 308 pacientes debido a la ausencia de registro de la glucemia de las primeras 48h en 280 y la edad menor de 15años en 28. La proporción de rechazo en los pacientes excluidos del análisis fue del 10,1% (n=31). De los 166 pacientes incluidos, el 71,1% (n=118) eran hombres y el promedio de edad fue de 47±12,9años; todos los trasplantes se realizaron de donante cadavérico por muerte encefálica. En la tabla 1 se muestra la información general de la población.
Datos de la población en estudio
| Variable | n=166 |
| Edad (rango) | 47±12,9 (18-74) |
| Sexo, n (%) | |
| Hombres | 118 (71,08) |
| Mujeres | 48 (28,91) |
| Raza, n (%) | |
| Negra | 13 (7,83) |
| Otras razas | 153 (92,17) |
| Características del trasplante | |
| Donante cadavérico, n (%) | 166 (100) |
| Primer trasplante, n (%) | 166 (100) |
| Tiempo de isquemia fría (horas) | 15,4±5,6 |
| Inmunosupresión, n (%) | |
| Esteroides | 166 (100) |
| Alentuzumab | 113 (68) |
| Daclizumab | 46 (28) |
| Basiliximab | 10 (6) |
| Timoglobulina | 1 (0,6) |
| Diabetes mellitus, n (%) | |
| Antecedente de diabetes mellitus | 13 (7,8) |
| Desarrollo de diabetes postrasplante | 11 (6,6) |
| Estancia hospitalaria en días (rango) | 12±15,5 (0-131) |
| Rechazo celular agudo temprano, n (%) | 35 (21,08) |
| Isquemia las primeras 24h, n (%) | 4 (2,4) |
| Necrosis tubular aguda, n (%) | 4 (2,4) |
| Infección en el sitio operatorio, n (%) | 1 (0,6) |
| Muerte, n (%) | 18 (10,84) |
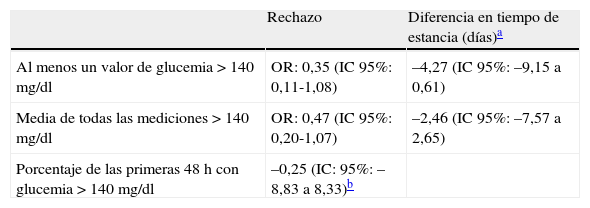
De acuerdo con las definiciones, el 91% de los pacientes analizados presentaron por lo menos una forma de hiperglucemia: al menos un valor mayor de 140mg/dl en 151 pacientes, y la media de mediciones mayores a 140mg/dl ocurrió en 128 pacientes. El promedio de glucosa al ingreso fue de 163±78mg/dl, y los pacientes permanecieron en promedio un 23,2% de las primeras 48h con valores de glucosa >140mg/dl. El rechazo del injerto se presentó en el 21,1% (n=35) de los pacientes, y solo hubo un caso de infección bacteriana documentada en el postrasplante. En el análisis bivariado la hiperglucemia, independientemente de su definición, no se asoció con un mayor riesgo de rechazo o con mayor tiempo de hospitalización (tabla 2). Ninguno de los factores considerados como potenciales variables de confusión se asoció con el riesgo de rechazo (datos no mostrados).
Asociación entre hiperglucemia y rechazo agudo o tiempo de estancia hospitalaria en pacientes con trasplante renal (Hospital Pablo Tobón Uribe, 2006-2011)
| Rechazo | Diferencia en tiempo de estancia (días)a | |
| Al menos un valor de glucemia >140mg/dl | OR: 0,35 (IC95%: 0,11-1,08) | –4,27 (IC95%: –9,15 a 0,61) |
| Media de todas las mediciones >140mg/dl | OR: 0,47 (IC95%: 0,20-1,07) | –2,46 (IC95%: –7,57 a 2,65) |
| Porcentaje de las primeras 48h con glucemia >140mg/dl | –0,25 (IC: 95%: –8,83 a 8,33)b |
En los pacientes con antecedente de diabetes no se encontró diferencia en la media del tiempo de estancia hospitalaria (13,2días vs. 8,9días, p=0,958) al compararlos con los no diabéticos. El 30,8% (n=4) de los pacientes que presentaban diabetes antes del trasplante renal hicieron rechazo agudo, mientras que el 20,3% (n=31) de los pacientes no diabéticos tuvieron este desenlace, aunque esta diferencia no tuvo significado estadístico (OR: 1,79; IC95%: 0,50-6,05).
DiscusiónEste estudio buscaba establecer si la hiperglucemia se asocia con un mayor riesgo de rechazo o mayor tiempo de estancia hospitalaria, y para ello se definió hiperglucemia tanto como un valor aislado, como también un valor promedio y un valor ponderado en el tiempo1–13.
Los resultados encontrados muestran que una gran proporción de pacientes sometidos a trasplante renal presentan algún grado de hiperglucemia durante las primeras 48h después del trasplante, y que un número importante de estos tienen valores elevados durante la mayor parte de este tiempo. Sin embargo, estos valores elevados de glucosa, independientemente de que se consideren como valores aislados, promedio o ponderados, no se asocian a un mayor riesgo de rechazo o a mayor tiempo de estancia24–25.
De acuerdo con investigaciones previas en modelos animales y algunas observaciones clínicas, la hiperglucemia se asocia con alteraciones inmunes y no inmunes que pudieran incrementar el riesgo de rechazo e infección en los pacientes trasplantados. Estas incluyen una mayor respuesta inflamatoria asociada a la isquemia por reperfusión, la cual parece estar mediada por una adhesión leucocitaria exagerada al endotelio26,27. Adicionalmente, la hiperglucemia en el postoperatorio refleja un estado de resistencia a la insulina, el cual se asocia a valores más altos de factor de necrosis tumoral alfa, interleucina1, 6 y 12; todo lo cual favorece un estado de inflamación sistémica que pudiera incrementar la respuesta inmunológica contra el injerto28. Finalmente, los niveles elevados de glucemia incrementan la expresión de las moléculasi y ii del complejo mayor de histocompatibilidad, con el subsecuente incremento potencial de los mecanismos de activación de la respuesta inmune innata29–35.
Desde el punto de vista clínico, en un estudio de Wyzgal et al.36 se analizó el impacto de presentar hiperglucemia (glucemia basal en ayunas >140mg/dl) durante la primera semana después del trasplante y su repercusión sobre la aparición de diabetes mellitus de reciente inicio (DMRI) y la función del injerto renal a los 3años. Estos autores encontraron que el riesgo de DMRI fue muy superior en los pacientes con hiperglucemia respecto a los normoglucémicos (75% frente al 8%, respectivamente); además, a los 3años de seguimiento los pacientes que habían presentado hiperglucemia en el postrasplante renal tenían peor función renal y mayor proteinuria. En otro estudio, Thomas et al.33 investigaron la relación entre la exposición del aloinjerto renal a la hiperglucemia y el riesgo de rechazo del trasplante renal en pacientes sin antecedente de diabetes, encontrando que el 42% de los pacientes con una glucosa menor de 144mg/dl después de la cirugía desarrollaron rechazo posteriormente, en comparación con el 71% de los pacientes que tenían una glucosa sérica por encima de este nivel, además la hiperglucemia no se asoció con ningún retraso de la función del injerto.
Por otra parte, se han realizado múltiples estudios para evaluar el impacto que tiene la hiperglucemia en los pacientes hospitalizados. En un estudio publicado por Umpierrez et al.13, en el cual la hiperglucemia se definió de acuerdo con sus valores aislados, esta se asoció con un mayor tiempo de estancia hospitalaria.
La mayoría de estudios que han evaluado la glucemia en los pacientes hospitalizados definen esta usualmente como uno o varios valores alterados en un periodo de tiempo, pero es importante considerar no solamente valores aislados o promediados sino también el tiempo durante el cual el paciente está sometido a estos valores elevados de glucosa, ya que estas diferencias en la medición pudieran explicar en parte los resultados contradictorios encontrados en los diferentes estudios donde se ha intervenido el control de la glucemia25,30–34.
Una de las limitaciones importantes de este estudio es el elevado número de pacientes que fueron excluidos por no contar con el registro adecuado de la medición de glucosa en las primeras 48h postrasplante, y la consiguiente disminución del tamaño de muestra efectivo para detectar diferencias. Sin embargo, todas las medidas de hiperglucemia parecían favorecer a la misma como un «factor protector» de eventos adversos, y la proporción de rechazos fue incluso menor en los pacientes no incluidos (10,1% vs 21,1%).
Una fortaleza importante del estudio es su detallada exploración de la variable de exposición, con las diferentes maneras como se definió la hiperglucemia buscando asociación no solo con valores aislados sino considerando también el tiempo que permanecen estos valores elevados.
A pesar de las limitaciones correspondientes a un estudio observacional en términos de confusión residual y tipo de población, esta investigación muestra que probablemente la hiperglucemia es un fenómeno frecuente en el postoperatorio inmediato de los pacientes sometidos a trasplante renal, y que las complicaciones como rechazo no dependen exclusivamente de un factor como la hipoglucemia, sino que otros factores —como los medicamentos inmunosupresores, la histocompatibilidad y la edad— pueden estar participando en la causa de ello. Un ensayo clínico podría confirmar si realizar alguna forma de control metabólico en los pacientes trasplantados de riñón proporciona algún beneficio sobre la función y la supervivencia del injerto. No obstante, hay estudios que señalan que el control estricto de la glucemia hace que los riesgos superen los beneficios en términos de mayor riesgo de hipoglucemias, e inclusive rechazos36. Los anteriores hallazgos, y los resultados de nuestro estudio, sugieren que el control de la glucemia aporta poco en términos de complicaciones en los pacientes sometidos a trasplante renal37–41.
FinanciaciónRecursos propios.
Conflicto de interesesNinguno reportado por los autores.