Las alteraciones del metabolismo óseo mineral asociadas a la enfermedad renal crónica (ERC-MOM) son actualmente consideradas una complicación sistémica importante de la ERC pues existen múltiples asociaciones descritas con el aumento de morbimortalidad de esta población. Por ello, desde hace muchos años se han desarrollado distintas guías de práctica clínica para el diagnóstico, evaluación, prevención y tratamiento de este complejo ERC-MOM: desde las ya clásicas KDOQI™ de la National Kidney Foundation americana hasta las últimas guías españolas de la Sociedad Española de Nefrología (SEN 2011) y de nuestra Sociedad (SEDYT). En este artículo se hará una comparación evolutiva entre ellas, subrayando especialmente las adaptaciones españolas a las últimas guías universales, aunque a veces poco prácticas, KDIGO 2009. Se debe reconocer que son muy frecuentes las sugerencias basadas en opiniones de expertos, pero aún perduran muchas similitudes entre los objetivos terapéuticos actuales considerados en España y los iniciales de las KDOQI™. Sin duda, en general, las principales diferencias a lo largo del tiempo han sido el incremento de la relevancia del control del fósforo, los niveles objetivo de PTH y la valoración de la calcificación vascular/valvular, considerándose razonable utilizar esta información para decidir entre los clásicos o los nuevos fármacos de los que disponemos para el control de las ERC-MOM. Muchos creemos que la falta de suficientes evidencias 1A justifica lógicamente posiciones críticas, pero no debería nunca servir de refugio a las frecuentes actitudes nihilistas y que abogan por una simple espera pasiva mientras se dispone de resultados concluyentes de difíciles estudios prospectivos.
Chronic kidney disease-mineral and bone disorder (CKD-MBD) is now considered an important systemic complication of CKD since multiple associations have been described with the increase in morbidity and mortality in this population. Therefore, several clinical practice guidelines for the diagnosis, evaluation, prevention, and treatment of CKD-MBD have been developed, ranging from the classic KDOQI™ of the American National Kidney Foundation to the latest Spanish guidelines from both the Spanish Nephrology Society (SEN 2011) and our own Society (SEDYT).
The present article compares the development of the various guidelines over time, with special emphasis on the Spanish adaptations of the latest universal but sometimes impractical KDIGO 2009 guidelines. Suggestions based on expert opinion are frequent, but there are still many similarities between the current Spanish therapeutic goals and the former KDOQI™. The main differences over time are the increasing relevance of phosphate control, PTH target levels, and the evaluation of vascular/valvular calcifications, since this information can reasonably be used to guide the management of CKD-MBD. Many of us believe that the lack of 1A evidence justifies critical attitudes but should not be used as a reason to vindicate therapeutic nihilism o passive approaches while definitive results from prospective studies are awaited.
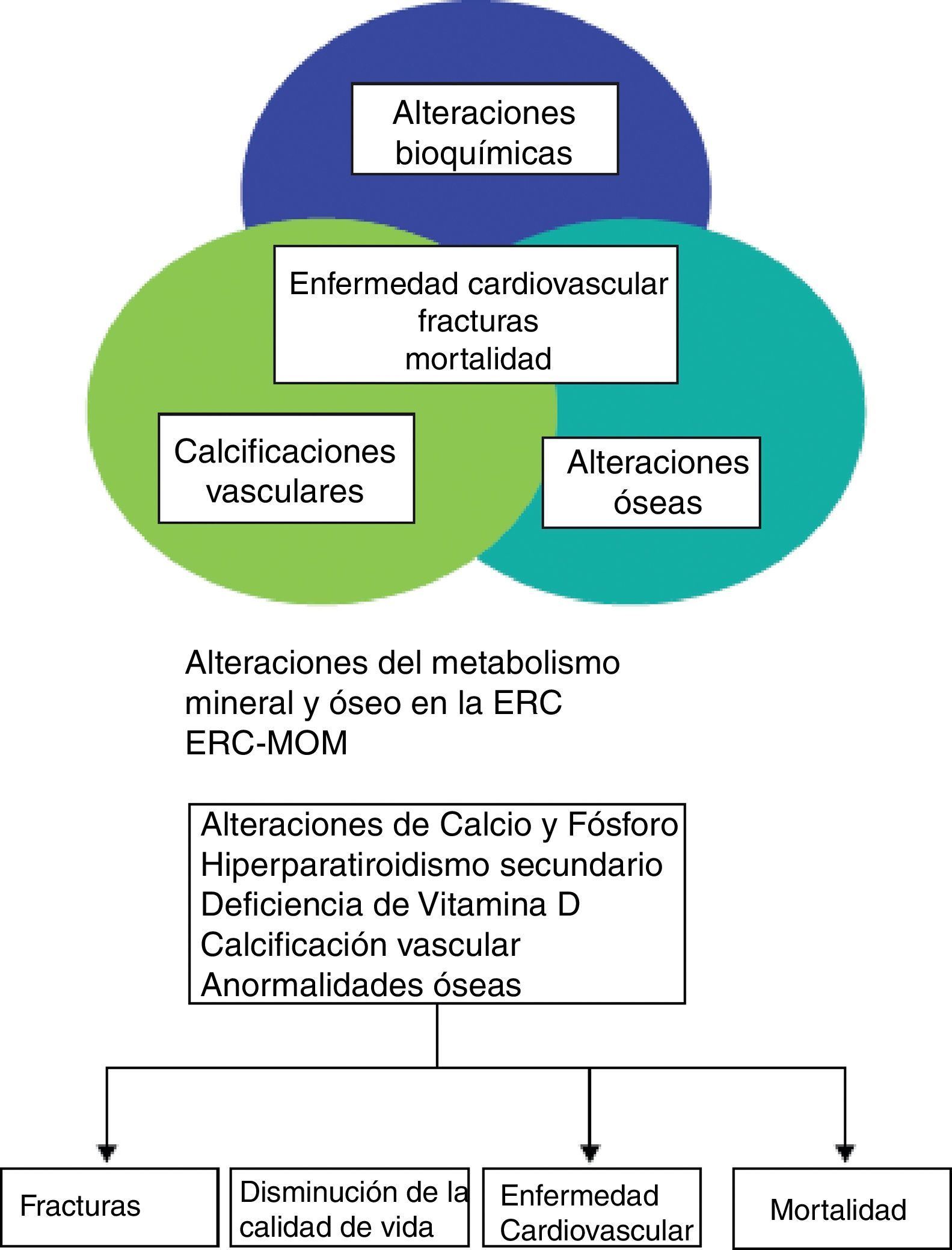
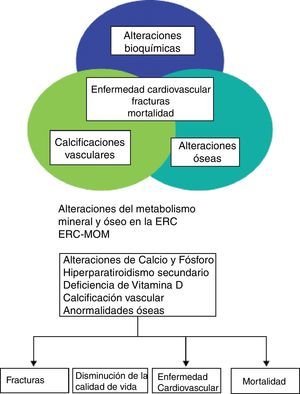
Las alteraciones del metabolismo óseo mineral (MOM) representan una complicación grave relacionada con la enfermedad renal crónica (ERC). El enfoque dado a dicha enfermedad obviamente ha evolucionado desde finales del siglo xix, cuando se hizo la primera asociación entre raquitismo y albuminuria en el primer volumen de The Lancet en 18831 hasta el concepto tradicional de osteodistrofia renal, acuñado en 1943 y mantenido hasta la definición actual en que la osteodistrofia renal representa solo una alteración morfológica en pacientes con ERC2–7 Las alteraciones englobadas en el concepto de ERC-alteraciones del metabolismo óseo mineral se expresan en las guías recientes de la Sociedad Española de Diálisis y Trasplante (SEDYT) con el acrónimo ERC-MOM, el cual no está generalizado, siendo más común su equivalente en inglés CKD-MBD (chronic kidney disease-mineral and bone disorder)4. De este modo, ERC-MOM (o CKD-MBD) se define como un desorden sistémico del metabolismo óseo y mineral debido a la ERC que se pone de manifiesto por una o por la combinación de: a) alteraciones en el metabolismo del calcio (Ca), fósforo (P), hormona paratiroidea (PTH) o vitamina D; b) anormalidades en el remodelado, mineralización, volumen, crecimiento lineal o fortaleza óseos y c) calcificaciones vasculares u otros tejidos blandos4–7. La importancia de este carácter sistémico radica en que, en su conjunto, estas alteraciones están estrechamente asociadas con fracturas y parecen contribuir de modo importante al incremento desproporcionado del riesgo cardiovascular y la mortalidad global que presentan los pacientes con ERC en relación a la población general (fig. 1).
Partiendo de una base fisiopatológica compleja, hoy en día se reconoce la necesidad de realizar un enfoque integral del paciente y del complejo ERC-MOM. De este modo se ha ido evolucionado en las técnicas diagnósticas y de seguimiento, incorporando nuevas herramientas terapéuticas que han permitido establecer y modificar, aunque de forma no homogénea, ciertos objetivos y terapias para los distintos estadios de la ERC. Asimismo, se han desarrollado distintas guías de práctica clínica para el diagnóstico, evaluación, prevención y tratamiento del complejo ERC-MOM3,5–7. Es necesario resaltar que no existen apenas niveles indiscutibles de evidencia 1A en ninguna de las guías y, curiosamente, estos se concentran en el campo de la osteoporosis, en el grupo de pacientes con estadios más tempranos de ERC5.
Todas las guías plantean recomendaciones o sugerencias basadas en un análisis exhaustivo de la bibliografía disponible, con selección de la más relevante3,5–7 así como su gradación en niveles de evidencia científica o de fuerza de las recomendaciones5. Se debe reconocer que son muy frecuentes las recomendaciones basadas en opiniones de expertos. En tal sentido, quizás las guías Kidney Disease Improving Global Outcomes (KDIGO) del año 2009, por su carácter universal, son las más estrictas y rigurosas, resultan académicamente intachables y fueron las primeras en introducir la metodología desarrollada por el Grading of Recommendations Assessment, Development and Evaluation (GRADE) Working Group y la participación de un equipo de revisión de las evidencias5,8. En este artículo se revisará de modo general la evolución en este campo desde las guías de la National Kidney Foundation americanas Kidney Disease Outcomes Quality Initiative (KDOQI™) publicadas en el año 20033 hasta las últimas publicadas por la Sociedad Española de Nefrología (SEN 2011)6 y la de la SEDYT7. Estas 2 últimas suponen adaptaciones a nivel nacional de las KDIGO, tal y como la propia KDIGO recomendó5–7. Solo un español formaba parte del board de las KDIGO (Dr. Jorge Cannata) y 5 españoles revisaron el borrador antes de su publicación final. Uno de los autores de este trabajo ha participado en esta corrección y revisión final de las KDIGO y fue cocoordinador de las guías SEN 2011. Asimismo participó activamente en nuestras guías. Gran parte del contenido de este trabajo resume una conferencia invitada en el XXXIV Congreso anual de la SEDYT 2012 celebrado recientemente en Valladolid (www.sedyt.org) en el que, aparte de la comparación entre las distintas guías, se introdujeron algunas informaciones posteriores que subrayan la oportunidad de algunas de las opiniones vertidas previamente.
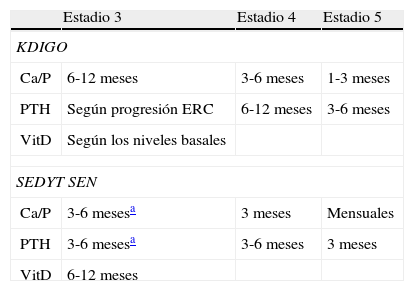
DiagnósticoAlteraciones bioquímicasLas alteraciones características del complejo ERC-MOM pueden identificarse de forma precoz, siendo este el primer paso para el diagnóstico en todas las guías, muchas veces anticipándose a la afectación ósea y quizás a la aparición o progresión de las calcificaciones vasculares. De acuerdo a las guías KDOQI™ y KDIGO, se recomienda la monitorización de los niveles plasmáticos de Ca, P, PTH y fosfatasa alcalina en todos los pacientes con ERC desde el estadio 3, a excepción de los niños, en los cuales se sugiere iniciar los controles en el estadio 23,5 Las recomendaciones españolas hacen mención a la ERC incluso con filtrado glomerular (FG)>60ml/min/1,73m2 (estadios 1-2). Del mismo modo ha variado con los años la frecuencia recomendada para la monitorización de las determinaciones analíticas según el estadio de la enfermedad renal. En la tabla 1 presentamos las últimas recomendaciones de la SEDYT7. Es importante tener en cuenta que tanto las recientes guías KDIGO como las de la SEDYT recomiendan disminuir los intervalos de control si se parte de valores analíticos muy alterados y siempre que se inicie o modifique un nuevo tratamiento, para valorar la respuesta individual al mismo. Asimismo, parece razonable decidir las actuaciones terapéuticas tomando en cuenta tendencias de valores en el tiempo (especialmente de la PTH) y no basadas en un valor absoluto aislado, dada la cierta variabilidad de las determinaciones analíticas9,10.
Intervalos de monitorización analítica sugeridos en ERC-MOM por distintas guías
| Estadio 3 | Estadio 4 | Estadio 5 | |
| KDIGO | |||
| Ca/P | 6-12 meses | 3-6 meses | 1-3 meses |
| PTH | Según progresión ERC | 6-12 meses | 3-6 meses |
| VitD | Según los niveles basales | ||
| SEDYT SEN | |||
| Ca/P | 3-6 mesesa | 3 meses | Mensuales |
| PTH | 3-6 mesesa | 3-6 meses | 3 meses |
| VitD | 6-12 meses | ||
Ca: calcio; ERC: enfermedad renal crónica; KDIGO: Kidney Disease Improving Global Outcomes; P: fósforo; SEN SEDYT: Sociedad Española de Nefrología/Sociedad Española de Diálisis y Trasplante; ERC-MOM: enfermedad renal crónica, metabolismo óseo mineral.
Actualmente se sabe que el proceso de calcificación vascular no obedece solo al depósito pasivo de Ca y P en forma de cristales de hidroxiapatita en el vaso, sino también a la transformación de las células musculares lisas vasculares en auténticos osteoblastos11. A diferencia de las KDOQI™ que introdujeron el valor del producto Ca × P, las guías KDIGO y las españolas consideran que la determinación del mismo ha perdido utilidad (especialmente en presencia de P alto e hipocalcemia, donde el producto puede representar erróneamente el riesgo real) y sugieren la valoración conjunta e individualizada de los niveles de Ca y P sin la necesidad de determinar necesariamente el producto (tabla 1).
Alteraciones óseasEn todas las guías se reconoce que la biopsia ósea es el gold-standard en el diagnóstico del tipo de afectación ósea en la ERC. Desde el punto de vista histopatológico se reconocen distintos tipos en el concepto global de osteodistrofia renal, englobados en la nueva o modificada clasificación turnover-mineralization-volume (TMV), que incluye parámetros histomorfométricos de remodelado óseo, tasa de mineralización y volumen de hueso5,6,4 Así, las lesiones óseas pueden ser de alto y bajo remodelado. Dentro de las formas de alto remodelado la forma más característica es la osteítis fibrosa y, en las formas de bajo remodelado, estas se dividen en función de la tasa de mineralización. Si es normal, la enfermedad se denomina enfermedad ósea adinámica (caracterizada también por disminución importante de la celularidad) y si hay un fallo de la mineralización (aumento de tejido osteoide) nos hallamos ante una osteomalacia (relacionada o no con el aluminio). Existen formas mixtas y es de destacar que todas las alteraciones morfológicas pueden cursar con masa ósea variable. Otras enfermedades estaban englobadas en el concepto global de osteodistrofia (raquitismo, amiloidosis por β2-microglobulina, etc.). En los últimos años, de modo multifactorial, se ha apreciado un cambio en la frecuencia de estas alteraciones óseas, siendo mucho más frecuente la presencia de enfermedad ósea adinámica2,5,6. La aparición de lesiones óseas importantes por hiperparatiroidismo secundario severo es cada vez menos frecuente, entre otras causas debido a cambios de características en la población, a los avances en el conocimiento bioquímico, al diagnóstico y al establecimiento de tratamiento en estadios precoces. Por ello, las técnicas de imagen como la radiología simple ósea en búsqueda de «reabsorción subperióstica de las falanges», tienen hoy muy escaso valor diagnóstico.
De un modo similar a las guías KDOQI™ y KDIGO, en las guías españolas e incluyendo nuestras guías de la SEDYT, se reconoce la práctica cada vez menos frecuente de biopsias óseas y se plantea como razonable su práctica en ciertas situaciones específicas, especialmente para esclarecer casos en los que existe controversia entre los datos clínicos y las demás exploraciones. Ejemplos clásicos son las fracturas óseas no explicadas, dolor óseo persistente, hipercalcemia o hipofosfatemia de origen incierto o sospecha de toxicidad por aluminio. Una nueva indicación recientemente aconsejada de biopsia ósea es antes del inicio de tratamientos con agentes antirresortivos (como los bifosfonatos) en pacientes con FG<30ml/min/1,73m25. Por su parte, en ninguna guía se recomienda, salvo en pacientes trasplantados, la determinación de la densidad mineral ósea como estudio rutinario, debido a su nulo valor predictivo de fracturas, a diferencia de la población general. La baja densidad mineral ósea no predice el tipo de osteodistrofia renal, por cuanto esta puede deberse tanto a enfermedades de bajo como de alto recambio, con aproximaciones terapéuticas completamente distintas5,6.
Por último, cabe resaltar que la gammagrafía ósea es especialmente considerada en nuestras guías para determinar la extensión de la afectación esquelética. Asimismo, puede ser útil para detectar la captación del trazador en partes blandas. La gammagrafía con Tc-sestamibi y ecografía cervical (entre otras) son técnicas mencionadas no solo para la localización y valoración del tamaño glandular, sino también para la detección de glándulas ectópicas6,7
Para evaluar la enfermedad ósea en los pacientes con ERC estadio 3-5D se pueden utilizar tanto las determinaciones aisladas de PTH como de fosfatasa alcalina total o la específica de hueso, aunque solo valores notablemente altos o bajos tienen un alto valor predictivo positivo del grado de remodelamiento óseo. La fosfatasa alcalina ósea probablemente tiene ventajas, pero estas no justifican el coste adicional6. La medición de calcitriol (1,25-dihidroxi-vitamina D) tampoco parece útil en el control del paciente renal, aunque puede usarse con fines de investigación o en algunos diagnósticos diferenciales de hipercalcemia. De hecho, en presencia de niveles aumentados de PTH se desconoce cuáles serían los niveles normales o aconsejables de calcitriol6. Otros marcadores de remodelado óseo, como la osteocalcina, piridolinas, telopéptidos, fosfatasa ácida tartrato resistente, entre otros, no mejoran el poder predictivo de la PTH o la fosfatasa alcalina6. Por ello, su uso sistemático no está aconsejado en ninguna guía. Tampoco se aconseja por el momento la medición del FGF-23 en el ámbito clínico. En este sentido, las guías SEN 2011 son las primeras en recomendar la medición de la calciuria y de la fosfaturia. Las mediciones seriadas de calciuria permitirían monitorizar a lo largo del tiempo la potencial sobrecarga de Ca o de P aun con niveles plasmáticos normales6.
Calcificaciones vascularesPara el diagnóstico de las calcificaciones vasculares asociadas a la ERC y al complejo ERC-MOM, las guías KDIGO sugieren que, en pacientes con ERC estadios 3-5D, se podría usar una radiografía simple lateral de abdomen para detectar la presencia o ausencia de calcificación vascular (para visualizar la aorta abdominal en los pacientes con ERC) y un ecocardiograma para detectar la presencia o ausencia de calcificación valvular como medidas alternativas razonables a las imágenes topográficas5. Es importante subrayar que por primera vez se considera que es razonable utilizar la información proporcionada por estas pruebas para guiar el manejo de las ERC-MOM y, por tanto, para tomar decisiones terapéuticas5. No obstante se reconoce que no existe ningún protocolo o algoritmo diagnóstico-terapéutico, basado en la evidencia, que dirija la actuación precisa que debe seguirse tras el hallazgo de una calcificación.
Las guías KDOQI™ solo hacen mención a las calcificaciones vasculares severas al hablar de opciones para el uso de quelantes de P sin Ca3. Las guías españolas, tanto las SEN 2011 como las de la SEDYT, sugieren utilizar radiografías simples para calcular los índices de Kauppila y Adragao12,13, ambos asociados a la morbimortalidad de origen cardiovascular de los pacientes. Para el índice de Kauppila se realiza la mencionada radiografía lateral de abdomen, incluyendo las vértebras desde T-10 a S-2 (centrada en L2), pero en la cual se toma en cuenta solo la porción de aorta que va de L1 a L4. Se puntúa de uno a 3 (según la presencia o no de calcificación), dividiendo en tercios la cara anterior y posterior de cada vértebra, obteniéndose así un índice que va de 0 a 6 por vértebra y, por tanto, de 0 a 24 en total13.
El índice de Adragao se calcula a partir de radiografías de manos y pelvis, dividiéndolas en 4 cuadrantes «simétricos» y asignando un punto a la presencia de calcificaciones en cada uno de ellos; así el índice de Adragao va de 0 a 814. A diferencia de las guías KDIGO en las que solo se sugiere la posibilidad de analizar la presencia de calcificaciones vasculares/valvulares, las últimas European Best Practice Guidelines van más allá y aconsejan la búsqueda de calcificaciones vasculares en los pacientes incidentes en diálisis15.Tanto las SEN 2011 como las SEDYT sugieren analizar a todos los pacientes con ERC6,7 especialmente, a los mayores de 60 años7. Para el análisis de la posible presencia de calcificaciones o rigidez vascular asociada, además de las radiografías o la ecografía mencionada, podrían usarse otras exploraciones según la disponibilidad, como simples radiografías de tórax, la ecografía carotídea, angiotomografías, el índice tobillo-brazo o la determinación de la velocidad de onda de pulso antes del uso de TAC helicoidal o EBCT (estos últimos los mejores métodos para el seguimiento o valoración de la progresión de las calcificaciones pero de elevado precio)6,16,17.
Objetivos terapéuticos y tratamientoLos objetivos de tratamiento del complejo ERC-MOM varían según el estadio de la enfermedad renal y las guías consideradas (tablas 2 y 3), así como también son algo diferentes las consideraciones que se realizan sobre la elección de pautas terapéuticas, con distintos fármacos disponibles para cada una de ellas.
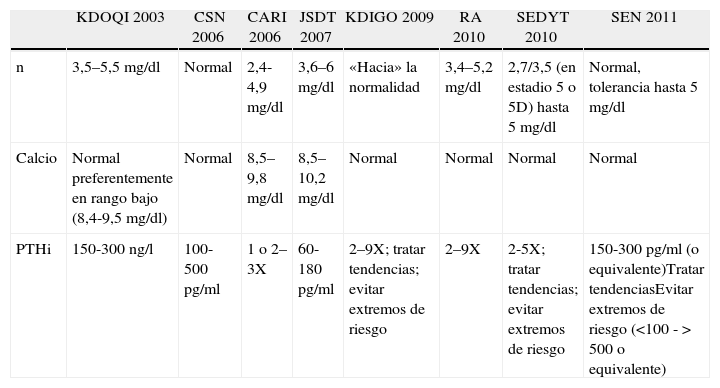
Evolución de los objetivos terapéuticos en las distintas guías de práctica clínica en ERC-MOM (principalmente estadio 5)
| KDOQI 2003 | CSN 2006 | CARI 2006 | JSDT 2007 | KDIGO 2009 | RA 2010 | SEDYT 2010 | SEN 2011 | |
| n | 3,5–5,5mg/dl | Normal | 2,4-4,9mg/dl | 3,6–6mg/dl | «Hacia» la normalidad | 3,4–5,2 mg/dl | 2,7/3,5 (en estadio 5 o 5D) hasta 5mg/dl | Normal, tolerancia hasta 5mg/dl |
| Calcio | Normal preferentemente en rango bajo (8,4-9,5mg/dl) | Normal | 8,5–9,8mg/dl | 8,5–10,2mg/dl | Normal | Normal | Normal | Normal |
| PTHi | 150-300ng/l | 100-500pg/ml | 1 o 2–3X | 60-180pg/ml | 2–9X; tratar tendencias; evitar extremos de riesgo | 2–9X | 2-5X; tratar tendencias; evitar extremos de riesgo | 150-300pg/ml (o equivalente)Tratar tendenciasEvitar extremos de riesgo (<100 ->500 o equivalente) |
CARI: Caring for Australasians with Renal Impairment; CSN: Canadian Society of Nephrology; JSDT: The Japanese Society for Dialysis Therapy; KDIGO: Kidney Disease Improving Global Outcomes; RA: the Renal Association; KDOKI: National Kidney Foundation; SEDYT: Sociedad Española de Diálisis y Trasplante; SEN: Sociedad Española de Nefrología; X=límite alto de la normalidad para el ensayo usado.
Valores recomendados de PTH para los distintos estadios ERC según las guías españolas
| Estadio 3 | Estadio 4 | Estadio 5 | Estadio 5D | |
| SEN | ||||
| PTH | 35-70a pg/ml | 70-110a pg/ml | 150-300a pg/ml | |
| SEDYT | ||||
| PTH | Valor normal método | 2 veces (2X) valor normal | 2X-5X veces valor normal | 2X-5X veces valor normal |
Fuente: adaptada de las guías SEN y SEDYT6,7.
SEDYT: Sociedad Española de Diálisis y Transplante; SEN: Sociedad Española de Nefrología; PTH: hormona paratiroidea.
Desde las guías KDOQI™ 2003 hasta las guías KDIGO 2009 se recomienda para los pacientes con ERC estadios 3-4 mantener valores de Ca y P normales para el laboratorio empleado3. En las guías KDOQI™ en estadio 5 y el actual estadio 5D se aconsejaba mantener niveles de P entre 3,5 y 5,5mg/dl (1,3 a 1,78mmol/l) mientras que las KDIGO sugieren disminuir los niveles de P elevados «hacia la normalidad» (un término muy criticado por la posibilidad de interpretaciones inadecuadas o laxitud terapéutica)18. La SEN 2011 recomienda niveles normales de P en todos los estadios de la ERC (< 4,6mg/dl) o lo más normal posible, con el empleo de medidas razonables y con un cierto nivel de tolerancia hasta 5mg/dl en pacientes en estadio 5D6. Este nivel de máxima tolerancia fue establecido a partir de los importantes resultados sobre supervivencia de Rodríguez-Benot et al. en un trabajo español19. En nuestras guías se aconsejan niveles normales de P desde el estadio 3A a 4, entre 2,7-5mg/d en estadio 5 y entre 3,5-5mg/dl en estadio 5D7, utilizando incluso la última terminología de estadificación de ERC7.
En cualquier caso, en todas las guías se sugiere limitar la ingesta de P en la dieta, sin comprometer la nutrición por una restricción excesiva de proteínas que pudiera condicionar malnutrición. Si los niveles de P persisten inadecuadamente altos a pesar de una dieta adecuada, debería asociarse un quelante como tratamiento. Especialmente subrayado y bien expresado en las KDIGO5, y corroborado en las siguientes guías, se considera razonable a la hora de seleccionar el tipo de quelante tener en cuenta el estadio de la ERC y la presencia de otros componentes del complejo ERC-MOM (por ejemplo la presencia o ausencia de calcificación vascular), así como terapias concomitantes y el perfil de efectos secundarios. En nuestras guías adquiere especial relevancia el concepto de individualización y la posibilidad también de atender las preferencias del paciente7. De este modo, como hemos mencionado, se recomendaba en las KDOQI™ 2003 restringir la dosis de quelantes cálcicos en presencia de calcificación vascular solo severa (punto siempre muy criticado en estas guías) o de otras calcificaciones extraesqueléticas3. Obviamente siempre se recomendó (evidencia 1B) que los quelantes cálcicos (así como calcitriol o análogos de la vitamina D) debían restringirse cuando existiera hipercalcemia persistente o recurrente (Ca corregido no deseable>9,5mg/dl e hipercalcemia definida como Ca corregido>10,2 en las KDOQI™ o simplemente definida por niveles de Ca por encima de la normalidad en todas las demás guías). De igual modo, se sugiere que también se deberían limitar los quelantes cálcicos en pacientes con calcificación vascular o enfermedad ósea adinámica o valores de PTH persistentemente bajos (por ejemplo<150pg/ml en 2 ocasiones consecutivas)5. Nuestras guías son más concretas y especifican que no deberían usarse los quelantes cálcicos cuando el Ca corregido es>10mg/día a pesar de un baño de diálisis de 2,5 mEq/l de Ca, hiperfosfatemia persistente y mantenida>6,5mg/dl, y tampoco en presencia de calcificaciones extraóseas y calcifilaxis7.
Actualmente no existe evidencia suficiente para recomendar un único tipo de quelantes, aunque de entrada se ha recomendado, en general por motivos económicos, utilizar quelantes cálcicos3,7 sin sobrepasar un máximo de 2.000mg (2g)/día, incluyendo todos los aportes y un máximo de 1.500mg/día de quelante3,6,7 (algunos autores consideran que no debería sobrepasarse de los 1.000 mg). Debe asumirse que el riesgo de hipercalcemia es mayor cuando se asocian a derivados de la vitamina D o activadores no selectivos del receptor de vitamina D. Las alternativas terapéuticas sin Ca, actualmente algunas disponibles también en prediálisis, son 2 formas galénicas distintas de sevelamer y el carbonato de lantano, los cuales se han asociado en algunos estudios a disminución de la progresión de la calcificación vascular o disminución de la mortalidad, tanto en prediálisis como en diálisis. Un estudio prospectivo más reciente en pacientes no incluidos en programa de diálisis va en este sentido20. En el caso de sevelamer, se reconoce además su efecto hipolipidemiante entre otros efectos pleiotrópicos6,7. Los quelantes no cálcicos se pueden dar de forma aislada o asociados a quelantes cálcicos, por ejemplo en caso de hiperfosfatemia mantenida>5mg/dl6,7 aunque no existe evidencia de una mayor efectividad con uso combinado6. Se menciona asimismo, en las guías españolas, la posibilidad de administración de carbonato de magnesio asociado con acetato de Ca6,7.
En cuanto al tratamiento de los valores anormales de PTH intacta (PTHi) y vitamina D especialmente en las KDOQI™ y KDIGO, se sugiere que en los pacientes con ERC y PTHi «elevada» se valore con prioridad la existencia de hiperfosfatemia, hipocalcemia o deficiencia de vitamina D. Estas alteraciones deberían tratarse indicando una dieta baja en P, y/o quelantes de P y/o suplementos de Ca y/o vitamina D nativa3,5. Es importante recordar de todos modos que la situación más frecuente, especialmente en ERC estadios 3-4, es la presencia de Ca y P normales con PTHi elevada y calcidiol plasmático por debajo de los límites actualmente recomendados, dato habitualmente poco subrayado en las guías2. En este sentido, hoy en día se conoce que la retención corporal de P es mucho más precoz que la aparición de hiperfosfatemia plasmática21–24y la tendencia actual posguías, gracias a los avances sobre la determinación con fines de investigación de FGF-23, es la de restringir el P o iniciar tratamiento quelante incluso antes de la aparición de hiperfosfatemia. Esta retención de P se reflejaría por un aumento de la fracción excretada de P y, quizá en un futuro, el aumento de FGF-23, otra fosfatonina o molécula asociada24. Una de las limitaciones es la elección adecuada del quelante, pues los quelantes no cálcicos, por ficha técnica y desde un punto de vista estricto, solo tendrían indicación en prediálisis, actualmente para niveles de p>5,5mg/dl (además de su indicación conocida en diálisis).
La evaluación de los niveles de calcidiol (25-OH-hidroxi-vitamina D), que valora la exposición solar o los depósitos corporales de vitamina D, fue por primera vez considerada en las guías KDOQI™ en una guía específica (guía 7) sobre prevención y tratamiento de la insuficiencia/deficiencia de vitamina D3. En estas se recomendaba la medida de calcidiol plasmático en cualquier caso de ERC estadio 3-4 si existía un aumento de PTHi, debiéndose repetir anualmente en caso de normalidad. Anteriormente se había menospreciado esta medición por la disminución de la actividad 1-α-hidroxilasa renal en la ERC, pero el reconocimiento de la existencia de 1-α extrarrenal, receptores ubicuos de vitamina D y la posibilidad de activación autocrina o paracrina de los mismos, incluso por calcidiol (presente en plasma en niveles mucho mayores)25,26, han revitalizado el concepto de deficiencia/insuficiencia de vitamina D y su tratamiento25,26. Si los niveles de calcidiol plasmáticos eran<30ng/ml (75 nmol/l) se opinaba que se debería suplementar con ergocalciferol (vitamina D2 de fácil acceso y dosificación en Estados Unidos, pero no disponible de forma aislada en nuestro medio) y se sugerían unas pautas adaptadas a los niveles encontrados3. En los pacientes con ERC 3-4 que presentaran valores aún elevados de iPTH con calcidiol>30ng/ml, se recomendaba la adición de «esteroles activos» de la vitamina D3. Es en las guías KDIGO donde, aparte de calcitriol, se introduce el término de «análogos» de la vitamina D y en las guías españolas se hace mención específica a los «activadores selectivos de los receptores de vitamina D» para referirse al análogo de la vitamina D paricalcitol.
La recomendación inicial de las KDOQI™ sobre el uso de suplementos de la vitamina D en estadios 3-4, se extiende a los estadios 5 y 5D de un modo especialmente claro en las guías españolas6,7. En estas se menciona el uso de calcifediol (calcidiol) en ampollas (Hidroferol 0,266®) para tratar el déficit de vitamina D, muy usado en nuestro medio ante la ausencia de dosificaciones cómodas de vitamina D nativa aislada (colecalciferol o vitamina D3), dado que la mayoría de los preparados asocian colecalciferol con dosis variables de Ca (indicados para la prevención y tratamiento de la osteoporosis). En nuestras guías se hace además especial hincapié en el cuidado que se debe tener con el uso de Hidroferol 0,266® pues con esta presentación, sin duda cómoda, se puede producir un aumento indeseable de la absorción intestinal tanto de Ca como de P secundaria a la activación de los receptores intestinales de vitamina D7,26. La vida media del compuesto es especialmente larga en caso de hipercalcemia. De este modo, se menciona la posibilidad de fraccionar la ampolla para evitar sobredosis por acumulación y dando dosis cada 2 semanas o cada mes cuando se alcanza la normalidad7. El Hidroferol «choque»® debería ser completamente contraindicado. En las guías de la SEDYT, los niveles de calcidiol plasmáticos recomendados son>de 20ng/ml, tomando en cuenta las últimas recomendaciones del Institute of Medicine americano que refiere, para la población general, que valores séricos>de 20ng/ml podrían ser suficientes27. En este caso también se aumentó la dosis máxima diaria de vitamina D nativa de 2.000 a 4.000U/día27. No existe consenso sobre los distintos kits disponibles o el mejor momento del año para efectuar estas determinaciones6, pero sí sobre que deberían realizarse al menos una vez cada 6-12 meses, especialmente si existen niveles elevados de PTHi.
En las guías KDOQI™ se definen por primera vez, a nivel de opinión, los niveles deseables de PTHi en estadios 3 y 4 (el estadio 5D actual no existía entonces y era referido simplemente como estadio 5). Así, en estadio 3 se recomendaban niveles entre 35 y 70pg/ml y en estadio 4 entre 70 y 110pg/ml3. Se admitían niveles discretamente elevados por 2 razones fundamentales: que la PTH intacta mide también algunos fragmentos no activos (7-84 de la PTH entera) y que, en presencia de ERC, existe «resistencia esquelética» a la acción de la PTH, resistencia progresivamente mayor a medida que avanza la ERC2,28. Para los pacientes en estadio 5 (y que por lo tanto incluían FG<15ml/min/1,73m2, estuvieran o no en diálisis) se recomendaron los ahora «clásicos» 150-300pg/ml3 (tablas 2 y 3). Si bien estos valores en diálisis han tenido una gran penetración entre los nefrólogos, los niveles recomendados para los pacientes prediálisis son ampliamente desconocidos por múltiples razones29. Entre otros motivos, las KDIGO mencionan que en los pacientes con ERC estadios 3-5 no se conocen realmente los niveles óptimos de PTH5.
Para los pacientes con ERC estadio 5D destacamos ciertas consideraciones adicionales a lo expresado con anterioridad:
- -
Emplear una concentración de Ca en el líquido de diálisis entre 1,25 y 1,50mmol/l (2,5-3 mEq/l). El líquido de diálisis de 1,75mmol/l (3,5 mEq/l) debería reservarse exclusivamente para el tratamiento de la hipocalcemia sintomática y como prevención de la hipocalcemia posparatiroidectomía.
- -
Se puede incrementar la eliminación de P en diálisis. En términos generales un incremento del tiempo o de la frecuencia de diálisis mejoran la eliminación de solutos5,6. La diálisis larga nocturna diaria (5-6 sesiones de 6-10 h de duración) produce una reducción importante del P plasmático, reducción de dosis de quelantes, incluso a pesar de haberse objetivado un aumento de aporte diario6. En ocasiones, se precisan incluso suplementos de P en el líquido de diálisis. Las técnicas de alto transporte convectivo son otra alternativa terapéutica6.
- -
Evitar el uso prolongado de quelantes con aluminio para evitar la intoxicación crónica. A pesar de que se acepta que tiene un poder quelante mayor7 en las guías españolas se especifica que no es aconsejable su uso6,7y que, en caso de usarse por cortos períodos de tiempo, debería hacerse con comidas cuyo contenido alto en P lo justificara6. Sin embargo, todavía existe en algunos lugares debate sobre su toxicidad en una época en que se usa agua ultrapura en diálisis30. Así se admite en el «rationale» de las KDIGO que los casos más severos de intoxicación ocurrieron en pacientes en los que hubo contaminación del agua de diálisis y en los que los quelantes solo jugaron un papel secundario. Sin embargo se afirma que existe un desconocimiento absoluto sobre la cantidad o dosis segura de aluminio, que no hay posibilidad de predecirla, ya que diversas circunstancias pueden favorecer su absorción (diabetes mellitus, hiperparatiroidismo secundario, estatus de vitamina D, sales de citrato, depleción de hierro)5,6 y que hoy existen alternativas terapéuticas5. Por todo, ello se recomienda (grado 1) limitar su uso en todo el mundo con un voto unánime5. Es de destacar que desde las KDOQI™ 2003 a las KDIGO2009, han desaparecido de modo remarcable las guías 11 y 12 de las KDOQI™ que se referían a la sobrecarga de aluminio y su toxicidad en la ERC, así como a su diagnóstico y tratamiento3. Al parecer los remanentes quelantes con aluminio se han retirado hace poco del mercado español.
- -
Como hemos mencionado, en las KDOQI™ se recomendó, con grado de evidencia (no de opinión), mantener la PTHi entre 150-300pg/ml3. En ninguna guía se menciona específicamente la necesidad de medición de PTH entera (1-84). Estas recomendaciones fueron implementadas en guías españolas previas31. Sin embargo, las nuevas guías KDIGO 2009 sugieren mantener, en ERC estadio 5D, niveles de PTHi en un rango mucho más amplio, aproximadamente entre 2X-9X el límite superior de la normalidad para el ensayo usado5. También se sugiere que cambios marcados en cualquier dirección entre estos rangos deberían provocar el inicio o cambio de terapia. Estos límites (2X-9X) tienen un alto poder predictivo positivo para osteítis fibrosa o enfermedad ósea adinámica en cada extremo. Así, en las SEN 2011 se especifica que niveles de PTH>450-500pg/ml (o equivalentes por ensayo usado) son específicos de enfermedad ósea de alto remodelado y que niveles<100-120pg/ml (o equivalentes) se asocian a enfermedad ósea de bajo remodelado con un valor predictivo cercano al 90%. En las KDIGO, 2X-9X son denominados extremos de riesgo y se debe evitar salir de estos límites. Tanto este concepto de extremos de riesgo como el de valorar tendencias, mencionado con anterioridad, han sido adoptados también en las guías españolas.
- -
Se subraya asimismo, principalmente en las KDIGO y después en las guías españolas, la variabilidad de los métodos usados para la medición de la PTH10 y que los laboratorios deberían informar del método usado, de los posibles cambios metodológicos, de la fuente de la muestra (suero o plasma) y de las especificaciones sobre el manejo de muestras en la fase preanalítica para facilitar la interpretación de los resultados bioquímicos5. En las recomendaciones de la SEN 2011 se aconseja incluso el uso de fórmulas de corrección para los ensayos de PTHi de más difusión hospitalaria. Están disponibles, incluso en forma de conversor automático, en su página web, aunque estos datos no están validados formalmente y deberían tomarse solo con fines orientativos32.
- -
Tanto nuestras guías como las de la SEN 2011 aconsejan valores objetivos más cercanos a las «antiguas» guías KDOQI™ (150-300pg/ml) y que se encuentran más próximos a 2X-5X en comparación al 2X-9X de las guías KDIGO. Esta notable diferencia fue en gran parte impulsada por la existencia de datos que podrían apoyar una mayor supervivencia de los pacientes en diálisis con PTHi entre esos valores33–35. Este hecho ha sido confirmado en otro estudio reciente posterior a las guías36.
- -
En pacientes con niveles de PTHi elevados o aumentando, aun dentro de los límites mencionados, todas las guías describen los fármacos a usar para el control de los niveles de PTHi, pudiéndose emplear en nuestro medio actualmente calcitriol, alfacalcidol, paricalcitol, calcimiméticos o una combinación de derivados de la vitamina D con calcimiméticos (estas 2 últimas opciones solo en diálisis). En nuestras guías se menciona que la combinación de fármacos (por ejemplo paricalcitol y calcimiméticos) parece ser la estrategia más prometedora para mejorar los resultados a largo plazo (incluida la supervivencia) en los pacientes en diálisis, a falta de los resultados de estudios prospectivos pendientes17,37–39.
- -
En todos los casos se considera razonable que la elección del tratamiento antiparatiroideo inicial debería seleccionarse basándose en los niveles de Ca y P, así como otros aspectos del complejo ERC-MOM (por ejemplo, presencia, ausencia o grado de calcificación vascular)5. Asimismo, se considera razonable ajustar las dosis de quelantes cálcicos o no cálcicos de modo que no comprometan los niveles de Ca y P. Obviamente, en los pacientes con hipercalcemia o hiperfosfatemia se debería reducir o suspender el tratamiento con calcitriol o derivados de la vitamina D. En presencia de hipocalcemia se debería reducir o suspender el tratamiento con calcimiméticos, dependiendo de la severidad, de otras medicaciones y de los datos clínicos. Es importante recordar que por ficha técnica los calcimiméticos no deben iniciarse con valores de Ca<8,4mg/dl aunque sí pueden permitirse en terapia de mantenimiento si la situación clínica y la seguridad lo permiten. En aquellos casos en los que los niveles de PTHi desciendan por debajo de 2X, el límite superior de la normalidad5,7 o<100-150pg/ml (o equivalente)6, se sugiere reducir o evitar el uso de calcitriol, derivados de la vitamina D o calcimiméticos. Algunos autores de las guías SEN 2011 creen que, en ausencia de repleción de niveles de calcidiol con vitamina D nativa, «dosis mínimas entre 1 y 5μg semanales de paricalcitol deberían mantenerse para asegurar la activación de los receptores de vitamina D»6 independientemente de niveles de PTHi. Algunos datos posteriores a las guías enlazan con este punto muy debatido, apreciándose un aumento de mortalidad en los pacientes con PTHi<150pg/ml respecto a los pacientes con PTHi>150pg/ml, pero con mejoría de la supervivencia en los pacientes con PTHi<150pg/ml tratados con paricalcitol o calcitriol respecto a los que no recibían derivados activos de la vitamina D40.
- -
En nuestras guías se mencionan efectos pleiotrópicos de la vitamina D, como por ejemplo la posibilidad de disminución de proteinuria con paricalcitol sobre IECA/ARA II en pacientes con nefropatía diabética antes de diálisis7,41. Asimismo, se mencionan en algunas guías los grandes debates sobre mejoría de la supervivencia, progresión de calcificación vascular o disminución de ingresos hospitalarios, al menos en algunos subgrupos, con sevelamer, lantano, paricalcitol, calcitriol y calcimiméticos16,37,38,42–44. Sin embargo, la mayoría de estos datos han sido obtenidos en estudios retrospectivos, aunque de gran tamaño.
- -
No es de extrañar que la parte de trasplante renal esté especialmente bien representada en las guías de la SEN 2011, donde se reconoce la necesidad de control del hiperparatiroidismo secundario, de la pérdida de masa ósea y de fracturas, de la hipercalcemia persistente (calcimiméticos si la calcemia es superior a 10,5mg/dl) así como la importante labor de prevención necesaria y algoritmos de tratamiento en los que se menciona incluso el teriparatide. Por último, todas ellas hacen una breve mención a las indicaciones de paratiroidectomía y tratamiento de la calcifilaxis en las que, aparte de considerar los factores de riesgo, se sugieren alternativas terapéuticas entre las que destacan los bifosfonatos y el tiosulfato sódico intravenoso en diálisis.
Aunque existe unanimidad en considerar las guías KDIGO como el trabajo académico más importante realizado en este campo, resultan para muchos poco específicas y, aunque se reconoce que son las más «puristas», son criticadas por poco concretas y poco útiles para la práctica clínica. Este hecho se hace más evidente entre nefrólogos que no tienen conocimientos específicos en este campo más allá de la práctica clínica habitual. De todos modos, esta situación no deja de reflejar la real falta de estudios prospectivos aleatorizados de calidad en ERC-MOM.
Es importante enfatizar que las propias guías KDIGO recomendaban la adaptación del consenso universal a cada una de las realidades geográficas y, de este modo, las últimas guías SEN 2011 y las de la SEDYT suponen este paso adelante en nuestro medio. Curiosamente, las guías españolas se acercan más a las «clásicas» KDOQI™, especialmente en los niveles de PTH recomendados (2X-9X o 150-300pg/ml o equivalente), que a las «laxas» KDIGO. Antes de las actuales guías españolas también se habían publicado otras anteriores45,46. Además, nuestra contribución a guías genéricas sobre la ERC, ya sea a nivel nacional o internacional47–49 favorecería, no solo el diagnóstico precoz de la ERC, sino también la detección y tratamiento temprano de las complicaciones asociadas. Muchos creemos que la ausencia de evidencias 1A en muchas guías justifica lógicamente actitudes críticas, pero no debería nunca servir de justificación a actitudes nihilistas sobre las ERC-MOM, adoptando una simple actitud de espera pasiva a los resultados concluyentes de un difícil estudio prospectivo.
Conflicto de interesesDr Jordi Bover ha participado en «advisory boards» nacionales e internacionales de Abbott, Amgen y Genzyme y ha dado conferencias esponsorizadas por Abbott, Amgen, Genzyme y Shire.