Pueden existir sesgos en el cálculo del Kt/V según el método empleado para la estimación del agua corporal total. Nuestro objetivo fue determinar la correlación y la concordancia entre la bioimpedancia y las ecuaciones de Watson, Hume y 58% peso, así como comprobar si nuevas ecuaciones basadas en parámetros antropométricos podrían mejorar la estimación del agua corporal total.
MétodosSe calculó el volumen de agua corporal total de 70 pacientes en programa de hemodiálisis. Se empleó el monitor BCM (Fresenius Medical Care) para la medición de la bioimpedancia. Se analizó la correlación entre métodos por regresión lineal simple y la concordancia por Bland y Altman y mountain plot. Por regresión lineal múltiple se desarrolló una nueva ecuación para el cálculo del agua corporal total.
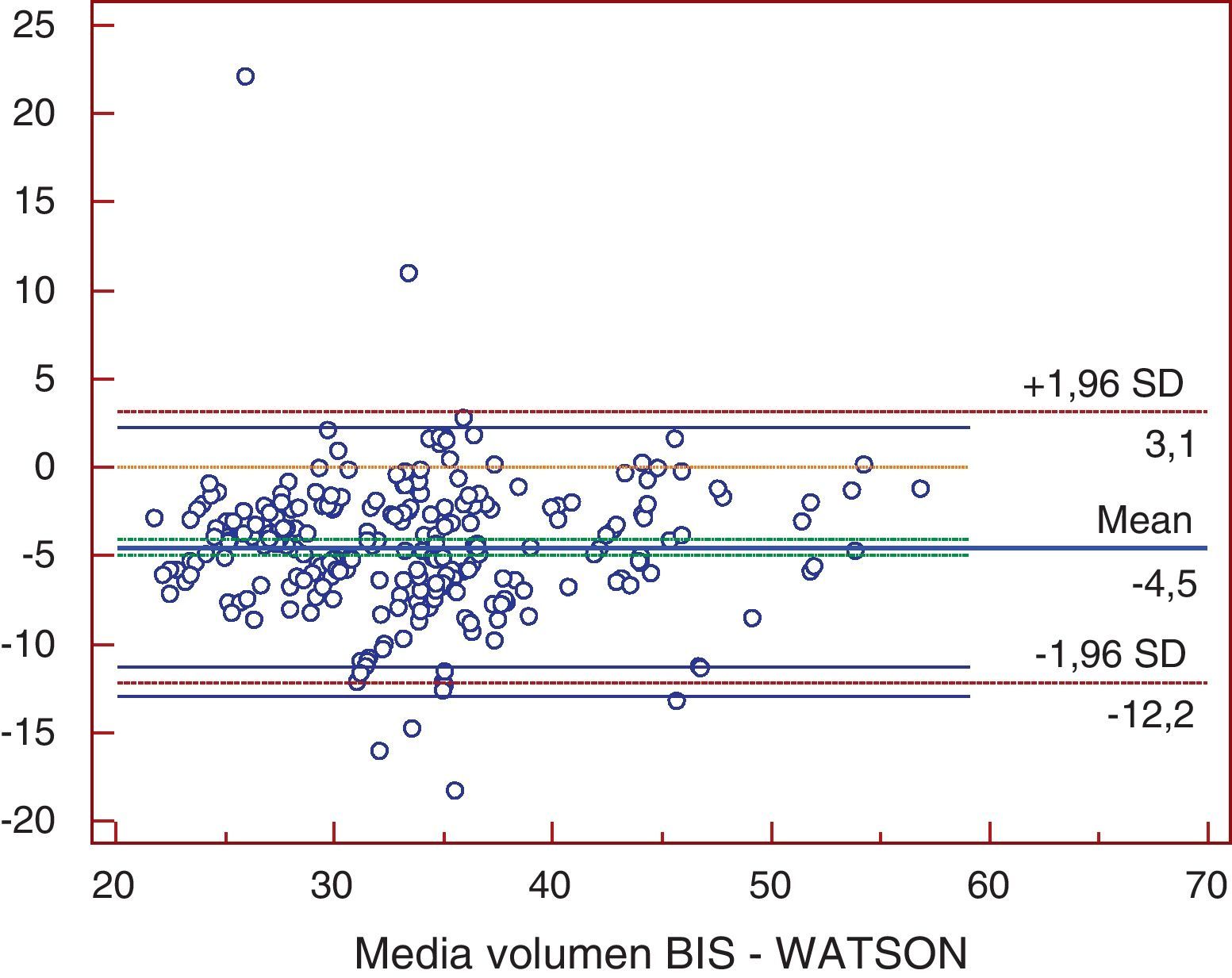
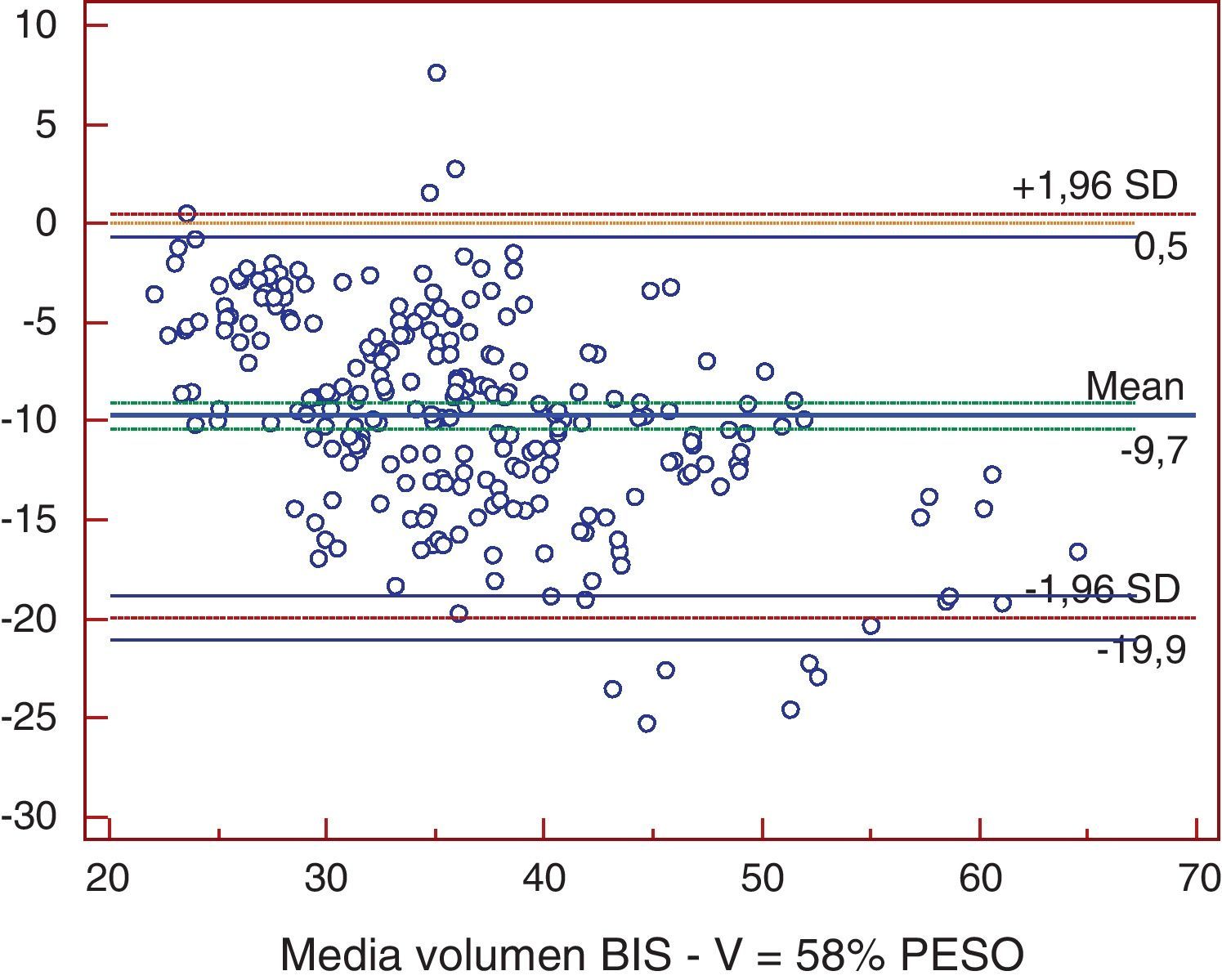
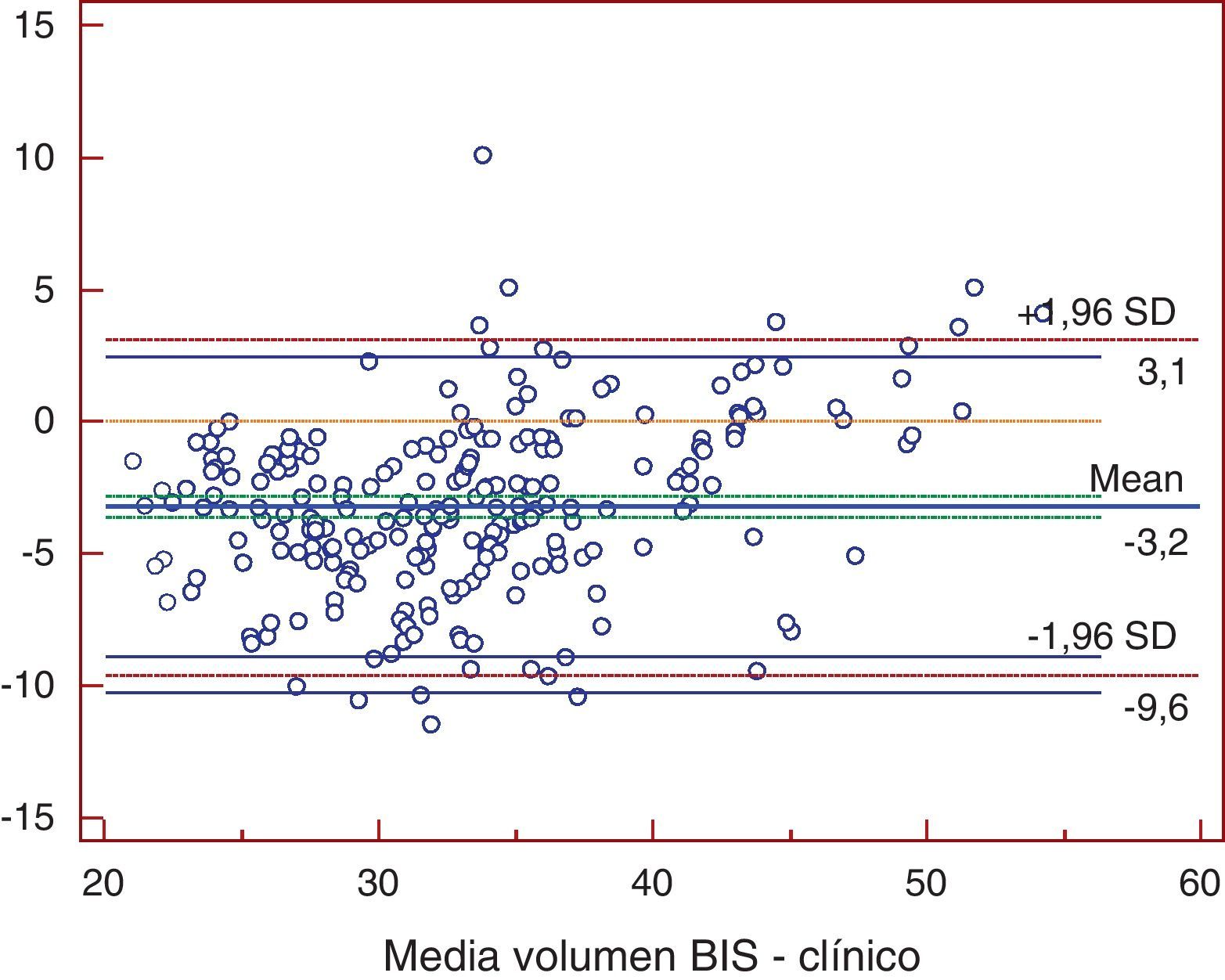
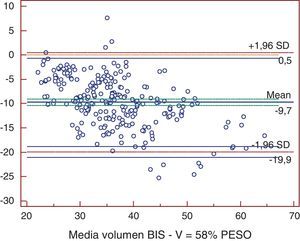
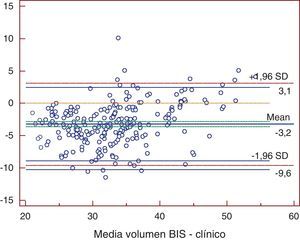
ResultadosTodos los métodos presentaron diferencias significativas excepto la comparación entre Watson y Hume. Al comparar bioimpedancia y Watson se encontró una diferencia media de -4,59 l (-12,2; 3,1). La mayor diferencia se obtuvo entre bioimpedancia y 58% peso, con -9,7 l (-19,9; 0,5). Los coeficientes de determinación fueron de r2=0,72 para 58% peso; r2=0,725 para Watson; y de r2=0,755 para Hume (p<0,001). La bioimpedancia presentó una diferencia media de -3,2 l (-9,6; 3,1) con la nueva ecuación.
DiscusiónLa falta de concordancia no permite intercambiar los métodos. La nueva ecuación basada en parámetros antropométricos de nuestra población, si bien no presentó diferencias significativas con Watson o Hume, sí mostró mayor concordancia con la bioimpedancia.
Biases can occur in Kt/V, depending on the method used to estimate total body water. The aim of this study was to determine the correlation and agreement among bioimpedance and the Watson, Hume and 58% weight equations, and to determine whether new equations based on anthropometric measurements in the Spanish population could be more accurate in estimating total body water.
MethodsThe study group consisted of 70 patients in a hemodialysis program. Total body water was estimated by multifrequency bioimpedance (BCM monitor, Fresenius Medical Care) and was calculated by the Watson, Hume and 58% weight equations. The correlation among methods was calculated by simple linear regression. The agreement among methods was assessed by Bland and Altman and Mountain plot. A new equation for estimating total body water was developed by multiple linear regression.
ResultsExcept in the comparison between the Watson and Hume equations, all the methods showed significant differences. Comparison between bioimpedance and the Watson equation showed a mean difference of -4.59 l (-12.2; 3.1). The greatest difference was found in the comparison between bioimpedance and 58% weight, with a mean of -9.7 l (-19.9; 0,5). Comparison between bioimpedance and 58% weight, the Watson equation and the Hume equation showed a coefficient of determination [r2] of 0,72, 0,725 and 0,755 respectively (p<0,001). The mean difference between the new equation and bioimpedance was -3.2 l (-9.6; 3.1).
DiscussionThe lack of agreement between bioimpedance and anthropometric equations does not allow these methods to be interchanged. Although the new equation based on anthropometric measurements in our population showed no significant differences when compared with the Watson and Hume equations, it showed the best agreement when compared with bioimpedance.
Mantener el equilibrio del agua corporal es esencial en el ser humano. Cuando este abandona el estado estacionario, como sucede con los individuos que requieren de terapia sustitutiva renal, la cinética de los compuestos químicos varía, de tal modo que la concentración final de una sustancia tras una sesión de hemodiálisis puede expresarse por: V(dC/dt)=G–KdC–KrC, siendo V el volumen de distribución de la sustancia, C la concentración de la misma, t el tiempo transcurrido, G la tasa de generación de la sustancia, Kd el aclaramiento proporcionado por la técnica de hemodiálisis y Kr el aclaramiento renal residual. Al integrar dicha expresión se obtiene como resultado Ct=Coexp[–Kdt/V]+(G/Kr)(1–exp[–Kdt/V], donde Co y Ct son las concentraciones inicial y final de la sustancia. Del valor de la expresión Kdt/V (en adelante Kt/V) depende el descenso en la concentración de soluto tras el procedimiento. El National Committee for Dialysis Study (NCDS), creado en 1976 para determinar la dosis adecuada de diálisis, observó que el nitrógeno ureico en sangre (BUN) se comportaba como función lineal de la tasa de catabolismo proteico normalizada (nPCR) si el valor Kt/V se mantiene constante, pudiéndose representar la relación de BUN respecto a nPCR como un conjunto de líneas de pendiente BUN/nPCR decreciente a medida que aumenta el valor de Kt/V1. Así pues, el volumen de agua corporal (V) quedó incluido en los cálculos para la adecuación de la dosis de diálisis. No existe un método que permita la medida directa del agua corporal, para ello debe recurrirse a métodos indirectos, siendo los métodos de dilución de isótopos de referencia2 (tritio, óxido de deuterio o bromuro de sodio) inaplicables en la práctica clínica por cuestión de tiempo (se requiere de 2 a 3 h para que la distribución del isótopo corresponda al agua corporal total3), de material y de experiencia. En un intento por facilitar tal cálculo se desarrollaron ecuaciones basadas en el modelo cinético de la urea o en estudios que buscaron la correlación del V con parámetros antropométricos, por lo general con escaso tamaño muestral y no generalizables. En 1971, Hume3 publicó los resultados de un trabajo que planteaba la estimación del V a partir del peso y la altura del paciente, según la regresión lineal obtenida al comparar con el método de la dilución de tritio. Aunque la muestra fue pequeña y el autor deja en entredicho el empleo de las medidas antropométricas para la estimación del agua corporal en individuos obesos, estos no se desviaron de las rectas de regresión obtenidas. En un estudio posterior, Watson2 recopiló datos de pacientes de trabajos anteriores con el objetivo de mejorar el tamaño muestral, que finalmente fue de 458 varones y 265 mujeres, y comparó las expresiones matemáticas obtenidas con los valores obtenidos en los estudios de Olsson y Saltin4, y en el de Seitchik5, donde se emplearon métodos de dilución. Las ecuaciones recomendadas, que presentaron buenos coeficientes de determinación, quedaban validadas así para su generalización. Otros métodos aplicados en la práctica clínica son la consideración del volumen de agua como el 58% del peso corporal o el análisis de la impedancia de los tejidos corporales (bioimpedancia) a una (monofrecuencial [BIA]) o varias frecuencias (multifrecuencial [MF-BIA] que obvia frecuencias del espectro medio, o multifrecuencial espectroscópica [BIS] que abarca el espectro hasta los 1.000kHz). Aunque tanto el cálculo por ecuaciones antropométricas como la estimación del volumen de agua por bioimpedancia son métodos validados, el empleo de uno u otro podrían mostrar diferencias y conducir a desviaciones en la estimación del Kt/V.
El objetivo del presente estudio fue analizar en nuestra población la correlación y la concordancia de las fórmulas antropométricas (Watson, Hume y 58% peso) respecto a BIS para el cálculo del V total en el paciente en hemodiálisis, y comprobar si una nueva ecuación basada en parámetros antropométricos de nuestra población podría mostrar mayor concordancia con BIS.
MétodosSe incluyó a un total de 70 pacientes en programa de hemodiálisis, con edad media de 63,87±14 años y rango entre 25 y 92 años, 38 hombres y 32 mujeres seleccionados, con una altura media de 162±11cm, un peso medio de 71,43±2kg y un índice de masa corporal medio de 27,17±0,68kg/m2. El tiempo medio en hemodiálisis fue de 50,9 meses con rango entre 37,1 y 64,7 meses. No existió exclusión de ninguno de los pacientes que cumplió los criterios. Fueron seleccionados durante el periodo comprendido entre el 1 de enero y el 31 de diciembre de 2009 en la Unidad de Hemodiálisis del Hospital Clínico Universitario de Valencia. Los criterios de inclusión fueron: edad superior a 18 años, enfermedad renal crónica estadio 5D en programa de hemodiálisis, ausencia de proceso agudo intercurrente, ausencia de marcapasos o dispositivos metálicos intravasculares, ausencia de amputaciones y consentimiento otorgado tras la información de los fines del procedimiento.
Cada paciente fue tallado y pesado con báscula digital calibrada. Se registró la presión arterial medida por el tensiómetro del monitor de hemodiálisis. Todas las medidas se realizaron previamente a la segunda sesión de hemodiálisis de la semana.
Para la determinación de la bioimpedancia se empleó el monitor BCM (Body Composition Monitor, Fresenius Medical Care Deutschland GmbH, Alemania) con apoyo del programa Fluid Management Tool (versión 3.2, Fresenius Medical Care Deutschland GmbH, Alemania) para el cálculo del volumen total de agua. El rango de emisión de frecuencias se extendió entre los 5 y los 1.000kHz. Antes de la prueba, el paciente permaneció en decúbito con un periodo de descanso de 15 min, previa retirada de todos los complementos y materiales que pudieran interferir con la medición. Se colocaron los electrodos en el lado contralateral a la fístula arteriovenosa, en muñeca a nivel de la apófisis estiloides del cúbito, en mano a nivel de las articulaciones metacarpo-falángicas, en tobillo a nivel de maléolos y en pie, a nivel de articulaciones metatarso-falángicas. Los resultados se registraron en una base de datos con cálculo simultáneo del volumen de agua por ecuaciones de Watson, Hume y 58% peso (anexo A). El análisis estadístico se realizó con los programas SPSS 15.0 y MedCalc 11.4 para la prueba de Bland y Altman y mountain plot. Se calcularon media, desviación estándar, máximos y mínimos de las diferentes variables. Se aplicaron pruebas paramétricas tras realizar prueba de normalidad (Kolmogorov-Smirnov). La comparación de más de 2 grupos se realizó mediante ANOVA de un factor en caso de variables de distribución normal y mediante test de Kruskal-Wallis en caso contrario. Los test de concordancia se realizaron mediante pruebas de Bland y Altman y mountain plot. La nueva ecuación desarrollada, basada en parámetros antropométricos, se obtuvo por regresión lineal múltiple.
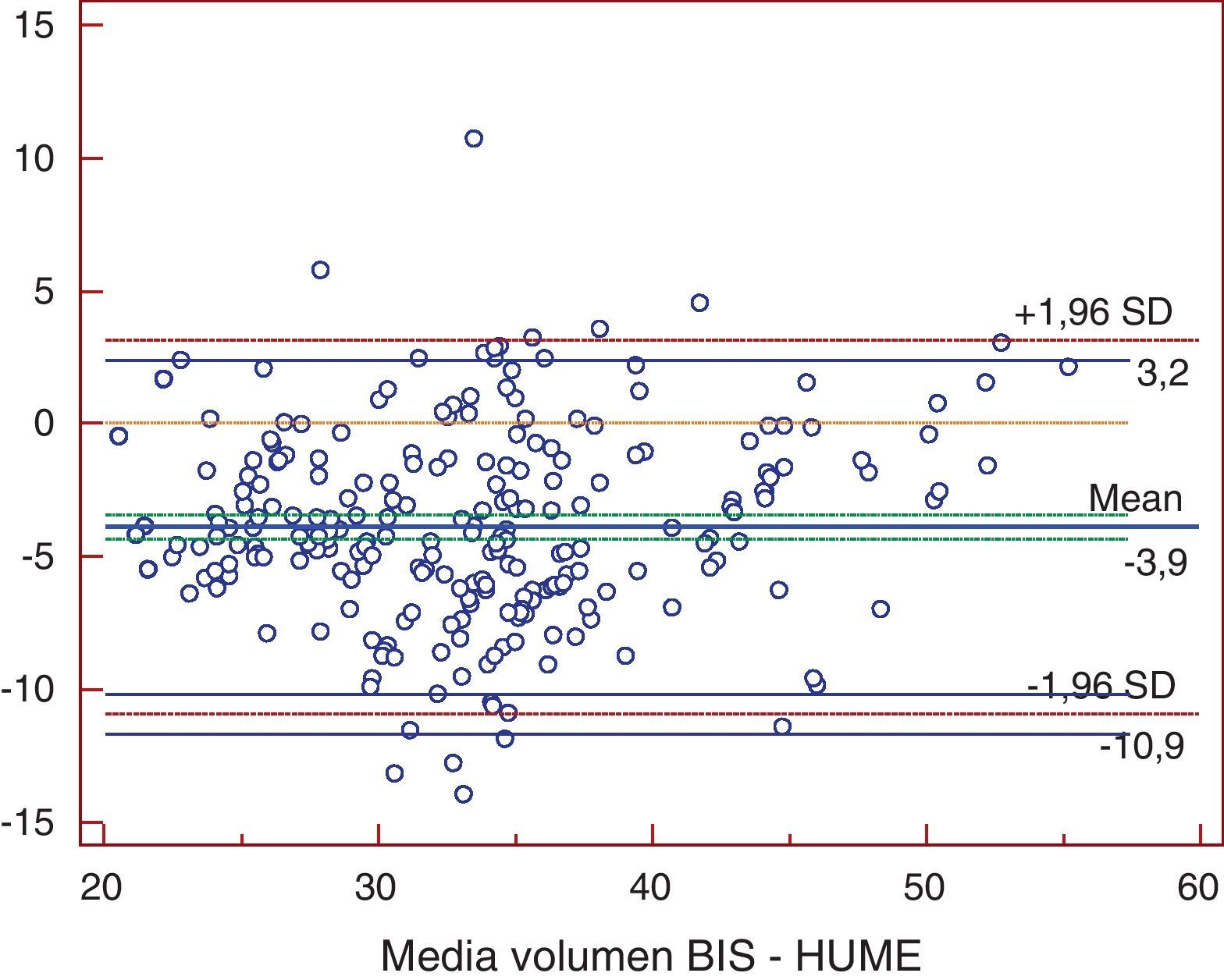
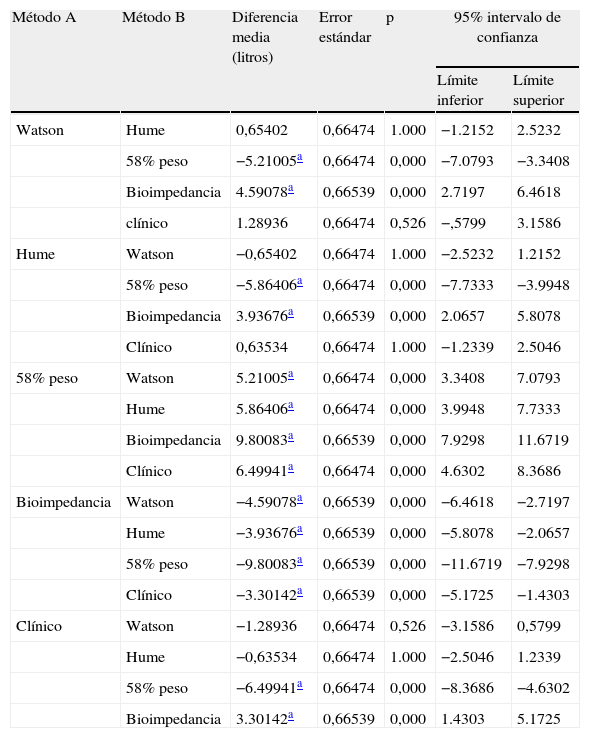
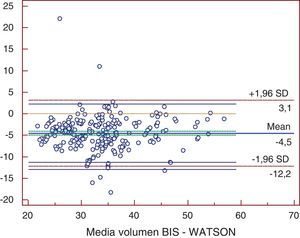
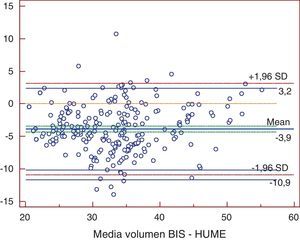
ResultadosLas medias de V obtenidas para cada método fueron, para BIS 31,69±7,16 l, Watson 36,22±7,15 l, Hume 35,56±6,82 l, 58% peso 41,43±9,7 l. En el análisis de comparación múltiple (tabla 1), se obtuvieron diferencias significativas a excepción de la comparación de Watson con Hume. Las mayores diferencias se obtuvieron en la comparación de BIS con 58% peso, con una diferencia media de -9,7 l (-19,9; 0,5). En el estudio de correlación, los métodos presentaron los siguientes coeficientes de determinación al comparar con BIS: r2=0,72 (58% peso), r2=0,725 (Watson), r2=0,755 (Hume), p<0,001. Por la prueba de Bland y Altman (fig. 1.), existió una diferencia de medias de -4,5 l (-12,2; 3,1) para la comparación de BIS con Watson, de -3,9 l (-10,9; 3,2) con Hume y de -9,7 l (-19,9; 0,5) con 58% peso. El gráfico de distribución acumulativa empírica o mountain plot, muestra diferencia similar para Watson y Hume respecto a la BIS, siendo mayor para el 58% peso. La nueva ecuación desarrollada no presentó diferencias significativas con Watson o Hume, con una diferencia media respecto a BIS de 3,3 l (1,4; 5,2).
Comparación múltiple
| Método A | Método B | Diferencia media (litros) | Error estándar | p | 95% intervalo de confianza | |
| Límite inferior | Límite superior | |||||
| Watson | Hume | 0,65402 | 0,66474 | 1.000 | −1.2152 | 2.5232 |
| 58% peso | −5.21005a | 0,66474 | 0,000 | −7.0793 | −3.3408 | |
| Bioimpedancia | 4.59078a | 0,66539 | 0,000 | 2.7197 | 6.4618 | |
| clínico | 1.28936 | 0,66474 | 0,526 | −,5799 | 3.1586 | |
| Hume | Watson | −0,65402 | 0,66474 | 1.000 | −2.5232 | 1.2152 |
| 58% peso | −5.86406a | 0,66474 | 0,000 | −7.7333 | −3.9948 | |
| Bioimpedancia | 3.93676a | 0,66539 | 0,000 | 2.0657 | 5.8078 | |
| Clínico | 0,63534 | 0,66474 | 1.000 | −1.2339 | 2.5046 | |
| 58% peso | Watson | 5.21005a | 0,66474 | 0,000 | 3.3408 | 7.0793 |
| Hume | 5.86406a | 0,66474 | 0,000 | 3.9948 | 7.7333 | |
| Bioimpedancia | 9.80083a | 0,66539 | 0,000 | 7.9298 | 11.6719 | |
| Clínico | 6.49941a | 0,66474 | 0,000 | 4.6302 | 8.3686 | |
| Bioimpedancia | Watson | −4.59078a | 0,66539 | 0,000 | −6.4618 | −2.7197 |
| Hume | −3.93676a | 0,66539 | 0,000 | −5.8078 | −2.0657 | |
| 58% peso | −9.80083a | 0,66539 | 0,000 | −11.6719 | −7.9298 | |
| Clínico | −3.30142a | 0,66539 | 0,000 | −5.1725 | −1.4303 | |
| Clínico | Watson | −1.28936 | 0,66474 | 0,526 | −3.1586 | 0,5799 |
| Hume | −0,63534 | 0,66474 | 1.000 | −2.5046 | 1.2339 | |
| 58% peso | −6.49941a | 0,66474 | 0,000 | −8.3686 | −4.6302 | |
| Bioimpedancia | 3.30142a | 0,66539 | 0,000 | 1.4303 | 5.1725 | |
En el eje de ordenadas se representa la diferencia entre cada pareja de valores. En el eje de abscisas se representa la media de cada pareja de valores.Volumen BIS: volumen de agua corporal determinado por bioimpedancia; Watson: volumen de agua corporal determinado por la fórmula de Watson.
Nuestros resultados indican que la determinación del volumen corporal total de agua calculado por las fórmulas antropométricas de Watson2, Hume3 y 58% del peso muestran una discordancia respecto al medido por BIS. Por tanto, en la determinación del Kt/V pueden encontrarse sesgos significativos según el método por el que se haya calculado V. Los monitores que incluyen la determinación de la dosis de diálisis habitualmente calculan el volumen de distribución de la urea por fórmulas antropométricas, principalmente Watson, lo que puede dar lugar a diferencias importantes si el ajuste de dosis se realiza por bioimpedancia.
El análisis de la bioimpedancia es un método cómodo para la práctica clínica basado en las propiedades que presenta el cuerpo humano al paso de la corriente alterna. La BIS consiste en la determinación de la resistencia y la reactancia capacitiva que presenta el cuerpo humano al paso de la corriente alterna, de frecuencias entre 5 y 1.000kHz. Permite determinar el volumen de agua intra- y extracelular6 ya que, a diferencia de la corriente de baja frecuencia, la corriente de alta frecuencia se transmite a través de la membrana celular. El modelo de analizador empleado en el presente estudio (BCM Body Composition Monitor, Fresenius Medical Care) asume el contenido fisiológico de agua que contiene el tejido magro y el tejido adiposo, determinando el exceso de agua por la diferencia entre el agua corporal total y el agua de los tejidos magro y adiposo normohidratados7. En 1986, Kusthner8, considerando el trabajo que Hoffer9 realizó en 1969, donde se demostraba una alta correlación (r2=0,92) entre la bioimpedancia y el V total, describió la BIA como un método fiable y validado con la dilución de óxido de deuterio. Cooper10 demostró la superioridad de la BIA según el modelo de Kusthner frente al volumen de agua calculado por la fórmula de Watson y otros métodos, como el 58% del peso corporal, al comparar con la dilución de óxido de deuterio. Aunque la ampliación del rango de frecuencias que emplea la BIS permitiría teóricamente estimar los volúmenes de agua corporal total, e intra- y extracelular, con mayor precisión frente a la MF-BIA, los resultados del metaanálisis realizado por Martinoli11, en el que se incluyeron estudios sobre pacientes obesos y con enfermedad renal crónica, tanto BIA (50kHz) como BIS (rango entre los 0 y los 1.000kHz) presentaron una sobreestimación significativa con respecto a los valores de referencia obtenidos por el método de la dilución de óxido de deuterio, lo que no ocurrió en los estudios en los que se determinó la bioimpedancia por MF-BIA (que obvia el rango entre los 15 y los 100kHz). Moissl12 mejoró la precisión de la BIS incorporando correcciones para el índice de masa corporal y validando nuevamente el método en comparación con técnicas de dilución. Basile13 validó el empleo de la BIA para el cálculo del peso seco en individuos en hemodiálisis y Wabel demostró la utilidad de la BIS para la estimación del cambio de volumen extracelular tras la sesión de hemodiálisis14. Varios trabajos han empleado la bioimpedancia para la valoración del volumen de agua en pacientes en diálisis peritoneal15–17. Desde su aparición, ha existido preocupación por las diferencias que podrían existir entre los métodos disponibles para el cálculo del V total, y por las desviaciones que podrían producirse al determinar la dosis de diálisis administrada. Actualmente, las guías europeas18 recomiendan un Kt/V equilibrado mínimo de 1,2, debiendo calcularse por un método validado. El método tradicional por el modelo de la cinética de la urea19 ha sido reemplazado por tecnologías de dialisancia iónica incorporadas a los monitores de hemodiálisis (Online Clearance Monitoring OCM20) que permiten el cálculo del aclaramiento sin necesidad de tomar muestras de sangre. Habitualmente, los monitores automáticos determinan el volumen de agua por fórmulas antropométricas, como Watson o Hume o considerando el 58% del peso corporal. Dentro de ellas, la fórmula de Watson es la más empleada.
En nuestro estudio encontramos diferencias significativas en la determinación del V realizada por BIS comparada con las fórmulas de Watson, Hume y 58% peso (tabla 1), con una diferencia de medias de -4,5 l (-12,2; 3,1) para la comparación de BIS con Watson, de -3,9 l (-10,9; 3,2) con Hume y de -9,7 l (-19,9; 0,5) con 58% peso. A pesar de la buena correlación existente entre los distintos métodos, las pruebas de concordancia nos demuestran que los métodos antropométricos no son intercambiables con la BIS (figs. 1–3). Nuestros resultados coinciden con lo descrito por otros autores. Dumler21 comparó bioimpedancia, Watson y Hume con el modelo monocompartimental de la cinética de la urea, encontrando que tanto la correlación (r2=0,972) como la concordancia fueron mayores con bioimpedancia. También la concordancia fue mayor con bioimpedancia. Lyndley22 comparó el valor de Kt/V obtenido por la ecuación de segunda generación de Daurgirdas con el Kt/V calculado mediante dialisancia iónica, Watson y por BIS, concluyendo que el Kt/V por Watson infraestimaba de modo significativo la dosis de diálisis. BIS presentó menor discrepancia con Daurgirdas (5%). Wuepper23 comparó el volumen calculado por ecuaciones antropométricas, entre las que se incluyeron Watson y Hume, con la BIS. Al analizar el grado de concordancia entre Watson y BIS obtuvo una diferencia de medias de 3,6±3,9 l, lo que sugería que la ecuación de Watson sobreestimaba sistemáticamente el V total. Analizando a 1.076 individuos en programa de hemodiálisis, Ahrenholz24 observó infraestimación de la dosis de diálisis cuando se determinó Kt/V por Watson (Kt/V 1,30±0,30), frente a BIS (Kt/V 1,44±0,37).
En el eje de ordenadas se representa la diferencia entre cada pareja de valores. En el eje de abscisas se representa la media de cada pareja de valores.Hume: volumen de agua corporal determinado por la fórmula de Hume; Volumen BIS: volumen de agua corporal determinado por bioimpedancia espectroscópica.
En el eje de ordenadas se representa la diferencia entre cada pareja de valores. En el eje de abscisas se representa la media de cada pareja de valores.58% peso: determinación del volumen de agua corporal por 58% peso; Volumen BIS: determinación del volumen de agua corporal por bioimpedancia espectroscópica.
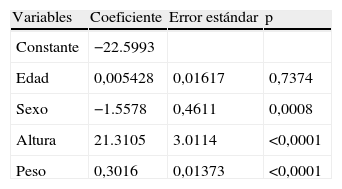
En el año 2005, Jainn-Shiun Chiu25 destacó la importancia de la elevada variabilidad intra- e interindividual de las ecuaciones antropométricas comparadas con la MF-BIA, y consideró esta última como método de referencia para su estudio. En este se desarrolló una red neuronal artificial (artificial neural network [ANN]) basada en parámetros antropométricos, datos demográficos y datos relevantes de la historia clínica. En el análisis de regresión múltiple, 3 variables fueron significativas: altura, peso y género, lo que les permitió elaborar una ecuación para la estimación del V. En nuestro estudio, por análisis multivariante encontramos también significación para peso, altura y género (tabla 2), lo que nos ha permitido desarrollar las siguientes ecuaciones:
Coeficientes obtenidos por regresión lineal múltiple de las variables descritas con relación al volumen de agua corporal total
| Variables | Coeficiente | Error estándar | p |
| Constante | −22.5993 | ||
| Edad | 0,005428 | 0,01617 | 0,7374 |
| Sexo | −1.5578 | 0,4611 | 0,0008 |
| Altura | 21.3105 | 3.0114 | <0,0001 |
| Peso | 0,3016 | 0,01373 | <0,0001 |
p corresponde al grado de significación.
Estas expresiones no presentaron diferencias significativas al comparar con Watson o Hume, dentro de nuestra población aunque, en las pruebas de concordancia, la discrepancia que mostraron con la bioimpedancia espectroscópica fue menor (fig. 4).
En el eje de ordenadas se representa la diferencia entre cada pareja de valores. En el eje de abscisas se representa la media de cada pareja de valores.Clínico: determinación del volumen de agua según ecuación obtenida en el presente trabajo; Volumen BIS: determinación del volumen de agua corporal por bioimpedancia espectroscópica.
Nuestro trabajo es un ejemplo de la conveniencia de realizar pruebas de concordancia en la comparación de métodos, pues la equivalencia entre los mismos no es evaluada por el coeficiente de correlación. Como ya se ha señalado, las diferencias halladas en el presente estudio muestran que los métodos de estimación del V no son intercambiables, a pesar de que las ecuaciones antropométricas presentan buenos coeficientes de determinación respecto a bioimpedancia espectroscópica. Actualmente la bioimpedancia aporta más precisión al cálculo del Kt/V que las ecuaciones antropométricas10. Aunque la estimación del V por bioimpedancia es un método cómodo, sencillo de aprender26 y de aplicar, no todos los centros disponen de él y, dado que muchos de ellos emplean las ecuaciones antropométricas para el cálculo del volumen de agua, la dosis de diálisis administrada queda infraestimada. Como señala Maduell27, la generalización del cálculo de Kt sin normalizar por volumen permitiría una comparación fiable entre los diferentes grupos de pacientes en hemodiálisis, asegurando un adecuado control y seguimiento en aquellos pacientes que quizás no alcanzasen una dosis de diálisis adecuada para su género o para su superficie corporal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.