Las técnicas de sustitución renal (TSR) se están utilizando cada vez con más frecuencia en enfermos graves y situaciones clínicas complejas. En muchas circunstancias es necesario administrar a estos pacientes fármacos potentes y de margen terapéutico estrecho cuyo manejo es complicado porque cualquier modificación en sus parámetros farmacocinéticos puede convertir el tratamiento en ineficaz o tóxico. Conviene conocer qué fármacos modifican su farmacocinética cuando se utilizan en pacientes con TSR y saber si es necesario determinar sus concentraciones plasmáticas para realizar los ajustes de dosis que sean oportunos.
Las características de los fármacos que más influyen en su cinética con TSR son peso molecular, fijación a proteínas plasmáticas, hidrofilia, lipofilia y volumen de distribución.
Por parte de la TSR, el aclaramiento de los fármacos depende del tipo de extracción que se realice: difusión o convección. También depende de los procesos de adsorción y de adhesión a la membrana semipermeable que se utilice.
La eficiencia de las distintas técnicas en la extracción de fármacos ordenadas de mayor a menor sería la siguiente: hemodiafiltración continua venovenosa >hemofiltración continua venovenosa >hemodiálisis intermitente.
En el caso de los antimicrobianos, para realizar un ajuste de dosis hay que tener en cuenta las relaciones farmacocinética/farmacodinamia. Cuando el efecto bactericida es concentración/dependiente conviene mantener o aumentar la dosis en cada administración y, si es necesario, aumentar el intervalo de tiempo entre las administraciones. Cuando el efecto bactericida es tiempo/dependiente puede ser necesario acortar los intervalos de tiempo entre las administraciones en lugar de aumentar la dosis en cada una de ellas.
No hay suficientes estudios clínicos que permitan definir de manera exacta las dosis. Se dispone de tablas de dosificación orientativas, pero siempre es necesario individualizar las dosis en función del fármaco, la situación clínica y la TSR utilizada.
Renal replacement therapy (RRT) techniques are increasingly being used in severely ill patients and complex clinical situations. In some circumstances, these patients must be administered potent drugs with a narrow therapeutic margin in which pharmacokinetic modifications can lead to a lack of efficacy or toxicity. Knowledge of which drugs undergo pharmacokinetic modification when used in patients under RRT is essential and therapeutic monitoring of plasma concentrations is needed for dosage adjustment. The drug characteristics to be considered are molecular weight, binding to plasma proteins, hydrophilicity, lipophilicity, and volume of distribution.
Drug clearance in RRT depends on the type of extraction performed (diffusion or convection), as well as on adsorption and adhesion to the semipermeable membrane used. The efficiency of different techniques in drug extraction, in decreasing order, is as follows: continuos veno-venous hemodiafiltration, continuos veno-venous hemofiltration and intermittent hemodialysis.
To perform dosage adjustment of antimicrobials, pharmacokinetics/pharmacodynamics relationships must be considered. When the bactericidal effect is concentration-dependent, the dose must be maintained or increased at each administration and, if necessary, the interval between administrations must be extended. When the bactericidal effect is time-dependent, the interval between doses may need to be shortened instead of increasing the dose at each administration.
There are insufficient clinical studies to allow precise definition of the doses to be administered. Schedules that serve as a guide are available but doses must be individually tailored depending on the drug, the clinical situation and the RRT technique used.
El manejo de los fármacos en los pacientes que se encuentran en régimen de diálisis sometidos a técnicas de sustitución renal (TSR) requiere unos condicionamientos especiales que se escapan la mayor parte de las veces de los conceptos que rigen la farmacoterapia en cualquier otro tipo de enfermos.
Por otro lado, la utilización de TSR es cada vez más frecuente y desde que se comenzaron a utilizar en las unidades de cuidados intensivos para tratar a pacientes de alto riesgo cada vez se aplican a enfermos más complejos en los que es difícil utilizar los fármacos correctamente.
Lo que fundamentalmente puede modificarse en relación con el tratamiento farmacológico en un paciente con TSR son los parámetros farmacocinéticas de los medicamentos que se estén empleando.
En muchas de estas circunstancias es obligado administrar fármacos muy potentes y de margen terapéutico estrecho, lo que hace que cualquier modificación en los parámetros farmacocinéticos teóricos que serían aplicables a cualquier paciente en otras circunstancias adquiera en estos casos un carácter de gran importancia, bien sea por que conduzcan a la ineficacia o a la toxicidad.
Por todo esto, parece conveniente prestar especial atención a conocer qué fármacos y en qué circunstancias pueden sufrir estas modificaciones y conocer hasta qué punto puede ser necesario determinar sus concentraciones plasmáticas para calcular su farmacocinética y hacer los ajustes de dosis que sean oportunos.
Son muchos los fármacos que pueden sufrir este tipo de modificaciones. Para algunos fármacos cuyos efectos son fácilmente detectables, como son los vasoconstrictores, los analgésicos, los anticoagulantes, los sedantes, etc., no es difícil darse cuenta de que hay que ajustar las dosis. Con otras sustancias activas las cosas pueden no estar tan claras y por eso los antimicrobianos son merecedores de una atención especial porque, además de la alta frecuencia de su utilización, si se están administrando de forma inadecuada y se cae en la ineficacia, esto puede representar un serio compromiso en la evolución de un determinado paciente1. La frecuente aparición de sepsis en pacientes con insuficiencia renal aguda y situación crítica hace más necesario aun dosificar bien los antimicrobianos en este tipo de enfermos.
Escenario marco de actuaciónExisten cuatro circunstancias que definen el entorno en el que se utilizan fármacos en pacientes con TSR:
- a)
Pacientes en situación grave. Esto quiere decir que si la dosificación que se está empleando no es la adecuada, tanto si es baja por ineficacia como si es alta por toxicidad, el pronóstico del paciente puede comprometerse seriamente porque no queda mucho margen en las posibilidades de evolución. No sucede lo mismo en pacientes menos graves en los que las posibilidades de manejar cualquier situación desfavorable suelen ser mucho más amplias. La dosificación de los fármacos en estos pacientes es difícil porque al factor de distorsión que supone la depuración extrarrenal del fármaco se añaden las alteraciones farmacocinéticas dependientes de la propia gravedad de la enfermedad y la rapidez con la que puede cambiar la situación clínica del paciente2.
- b)
Alteraciones hemodinámicas. Las modificaciones que se pueden producir en este sentido en pacientes en situación grave pueden afectar seriamente a la absorción, a la distribución y a la eliminación de los fármacos, como se verá más adelante, pero también a la respuesta a la intervención terapéutica. Esta respuesta modificada puede llevar a pensar en la necesidad de modificar dosificaciones sin que realmente ello sea necesario. Es por esto por lo que en estos casos está indicada la determinación de concentraciones plasmáticas y la adaptación a los parámetros farmacocinéticos que de ella puedan deducirse.
- c)
Tipo de fármacos. Existen diferentes características de cada fármaco que pueden influir sobre su comportamiento farmacocinético en un paciente con TSR: la hidrofilia o lipofilia, el peso molecular (PM), la fijación a proteínas plasmáticas, etc. son algunas de las características que pueden definir su farmacocinética. Pero también su farmacodinamia puede verse modificada sensiblemente y, en este sentido, los fármacos con margen terapéutico estrecho son más susceptibles de precisar ajustes posológicos, ya que pequeñas modificaciones en su farmacocinética pueden influir de manera definitiva en su efecto terapéutico.
- d)
Modificaciones farmacocinéticas: distribución y eliminación. Son éstos los cambios que en definitiva importa considerar en un paciente con TSR, porque son ellos los que definen la posología más adecuada en cada caso.
Los factores que pueden influir en estos cambios dependen del fármaco, el paciente y el tipo de TSR que se utilice.
Por parte del fármaco influyen el volumen de distribución (Vd), la fijación a proteínas, el PM, la semivida de eliminación, el aclaramiento, la lipofilia, etc.
Por parte del paciente influyen la volemia, el aclaramiento renal residual, la eficacia de la perfusión tisular y la presencia o no de insuficiencia hepática.
Por parte de la TSR influye fundamentalmente si es de difusión o de convención.
Características de los fármacos que influyen en su cinética con técnicas de sustitución renalEn términos generales puede decirse que los fármacos más fácilmente dializables son los que tienen un bajo PM, un elevado aclaramiento renal, un bajo Vd y una escasa fijación a proteínas plasmáticas. Otras características que se enumeran a continuación también pueden influir, aunque en menor grado.
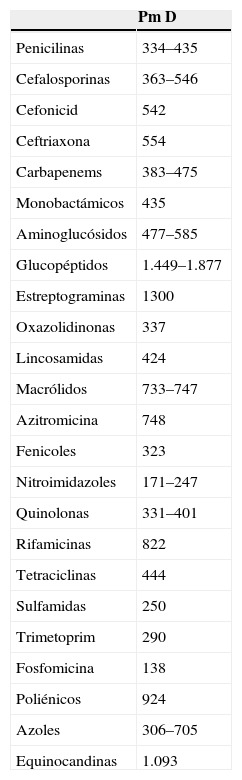
Peso molecularLa mayor parte de los fármacos tienen un PM que puede llegar hasta los 500 D. Sin embargo, moléculas de más alto PM, como la vancomicina (PM de 1.449 D), pasan fácilmente a través de las membranas de alto flujo, utilizadas en diálisis continua, que tienen poros de un tamaño situado entre los 20.000–30.000 D. Debido a este tamaño de los poros únicamente pueden atravesar las membranas los fármacos con una baja fijación a proteínas plasmáticas. En la tabla 1 puede verse, a título orientativo, el PM de distintos antimicrobianos3.
Fármacos y diálisis: pesos moleculares
| Pm D | |
| Penicilinas | 334–435 |
| Cefalosporinas | 363–546 |
| Cefonicid | 542 |
| Ceftriaxona | 554 |
| Carbapenems | 383–475 |
| Monobactámicos | 435 |
| Aminoglucósidos | 477–585 |
| Glucopéptidos | 1.449–1.877 |
| Estreptograminas | 1300 |
| Oxazolidinonas | 337 |
| Lincosamidas | 424 |
| Macrólidos | 733–747 |
| Azitromicina | 748 |
| Fenicoles | 323 |
| Nitroimidazoles | 171–247 |
| Quinolonas | 331–401 |
| Rifamicinas | 822 |
| Tetraciclinas | 444 |
| Sulfamidas | 250 |
| Trimetoprim | 290 |
| Fosfomicina | 138 |
| Poliénicos | 924 |
| Azoles | 306–705 |
| Equinocandinas | 1.093 |
D: dosis; PM: peso molecular.
Como regla general puede afirmarse que solo la fracción libre de un fármaco es la dializable. Por esto, de cualquier fármaco que tenga una fijación a proteínas plasmáticas superior al 80%, la mayor parte de la dosis administrada, no se puede eliminar ni por difusión ni por convención.
Por ejemplo, la amiodarona presenta una fijación a proteínas del 94% y, por tanto, su fracción libre es del 0,06 y no se produce una eliminación significativa por diálisis4.
Conviene tener en cuenta que en algunas situaciones clínicas puede estar modificada significativamente la tasa de fijación a proteínas de diversos medicamentos. La fracción libre puede aumentar en casos de hipoalbuminemia, hemodilución y acidosis. También puede estar aumentada la fracción libre de un determinado fármaco cuando otro medicamento o alguna sustancia orgánica tienen una mayor afinidad por la fijación a proteínas plasmáticas, como puede ser el caso de tratamientos con heparina o de la existencia de hiperbilirrubinemia. En estos casos se incrementa el aclaramiento de fármacos de alta fijación.
Hidrofilia, lipofilia y volumen de distribuciónEl Vd de un fármaco tiene importancia a la hora de valorar su eliminación por medio de TSR, en el sentido de que cuanto más amplio sea mayor dificultad representa para la eliminación del fármaco. Es por esto por lo que la hidrofilia o la lipofilia de un fármaco tienen mucha importancia, porque están directamente relacionados con su Vd5.
Los fármacos lipofílicos suelen tener un amplio Vd porque presentan una buena difusión a través de membranas y difunden en el medio intracelular. En el campo de los antimicrobianos esta propiedad es esencial cuando se necesita tratar una infección producida por gérmenes intracelulares. En general, este tipo de fármacos se metaboliza más o menos ampliamente antes de ser eliminados por vía renal (algunos no, como el levofloxacino o el ciprofloxacino) y, por tanto, lo que hay que valorar es cómo se produce el aclaramiento de sus metabolitos cuando se utilizan TSR. En general, con todos estos fármacos, al ser menos dializables por su amplio Vd, no suele ser necesario administrar dosis suplementarias al aplicar TSR.
Los fármacos hidrofílicos no atraviesan membranas celulares, por lo que únicamente difunden al compartimento extracelular y su Vd es menor que el de los lipofílicos. Se excretan por vía renal como fármacos inalterados, son más fácilmente dializables (excepto la ceftriaxona) y generalmente es preciso administrar dosis suplementarias cuando el paciente está siendo tratado con TSR.
Muchos fármacos siguen un modelo de distribución tricompartimental en el que el compartimento central es el plasma y además tienen otros compartimentos periféricos de distribución representados por distintos espacios tisulares. El que la depuración extracorpórea afecte a estos compartimentos depende de la relación entre la tasa de depuración extracorpórea y la cantidad de fármaco que va pasando de estos compartimentos al compartimento central al ir disminuyendo en este último la concentración del fármaco por la propia depuración. Por ejemplo, en los regímenes de diálisis intermitente, la mayor parte de las veces la depuración extracorpórea es mayor que el intercambio entre los compartimentos periféricos y el central, por lo que después de la diálisis puede producirse un incremento de las concentraciones plasmáticas al producirse un reequilibrio entre los compartimentos central y periféricos. Sin embargo, en los regímenes de depuración continua la importancia de la distribución compartimental es menor porque se produce un reequilibrado continuo entre los diferentes compartimentos6.
Influencia de los tipos de técnicas de sustitución renalLos tipos de TSR han evolucionado notablemente en los últimos años y con ellos el aclaramiento de los fármacos y las dosificaciones que es necesario emplear. Las dosis que se recomiendan para la típica hemodiálisis intermitente están basadas en estudios realizados en pacientes con hemodiálisis de tres veces por semana y con membranas de diálisis de baja permeabilidad y cambian sustancialmente cuando a un paciente de una unidad de cuidados intensivos se le aplica una técnica de hemofiltración continua con membranas de alta permeabilidad. Por ejemplo, la vancomicina, cuyo aclaramiento es muy bajo cuando se emplean las antiguas membranas de diálisis, tiene un aclaramiento muy elevado con las membranas de nueva generación y las técnicas de hemofiltración continua. Muchas guías de orientación sobre las dosificaciones siguen empleando los antiguos parámetros, por lo que hay que tenerlo en cuenta y buscar siempre la adaptación a las técnicas de hemofiltración que más se emplean actualmente.
Como es sabido, la extracción de solutos de la sangre a través de membranas semipermeables durante la aplicación de TSR puede tener lugar mediante dos procesos fisicoquímicos diferentes: difusión o convección.
La difusión es el proceso típico que se utiliza en hemodiálisis en el cual los fármacos atraviesan la membrana semipermeable, dependiendo del gradiente de concentración en que se encuentren a ambos lados de la membrana. Se produce, por tanto, un proceso de difusión pasivo que está condicionado por el PM, de manera que los fármacos con menor PM difunden mejor y su aclaramiento es mayor. En este sentido, las membranas de alto flujo han reducido las diferencias de aclaramiento que existían anteriormente entre los fármacos en función de su PM.
El tiempo necesario para llegar a conseguir un equilibrio de concentración de los fármacos entre el líquido de extracción y el plasma es un tiempo largo con relación a lo que sucede con los procesos de convención.
La convención es el proceso que se desarrolla durante las TSR de hemofiltración. Es un proceso activo y más rápido que el de difusión gracias al gradiente de presión que produce la bomba y la cantidad de fármaco extraído no depende de su PM. También el tiempo necesario para alcanzar el equilibrio de las concentraciones de fármacos, con las técnicas de convención, es más corto que en el caso de las técnicas basadas en la difusión7.
Algunas moléculas pueden eliminarse por un proceso de adsorción y adhesión a la membrana. Depende fundamentalmente del tipo de membrana que se utilice y solamente dura unas pocas horas hasta que la membrana se satura. Este proceso tendría únicamente cierta importancia para la eliminación de aminoglucósidos, pero no tiene utilidad para otros tipos de fármacos. En todo caso hay muchos factores que pueden influir sobre este tipo de absorción, por lo que en principio no se recomienda tenerla en cuenta para realizar ajustes de dosis8.
En general, la eficiencia de las distintas técnicas en la extracción de fármacos, ordenadas de mayor a menor, sería hemodiafiltración continua venovenosa > hemofiltración continua venovenosa > hemodiálisis intermitente. En todo caso, esta eficiencia depende también de las características fisicoquímicas y farmacocinéticas de los diferentes medicamentos.
Relación farmacodinámica/farmacocinética y ajuste de dosisCuando es necesario ajustar la dosificación de un fármaco, debido a que su aclaramiento por TSR es significativo, es frecuente que se plantee el dilema de si lo que conviene hacer es aumentar la dosis en cada administración o si es mejor mantener la dosis de cada administración y modificar los intervalos de tiempo que median entre administraciones sucesivas.
En el caso de los antimicrobianos es necesario tener en cuenta las relaciones que existen entre su farmacocinética, sus características farmacodinámicas intrínsecas, las propiedades de su efecto bactericida y la posible presencia y duración de efecto postantibiótico9.
En algunos casos, como sucede con los antimicrobianos cuyo efecto bactericida es concentración dependiente, será más oportuno incrementar o mantener la dosis en cada administración cuando su efecto bactericida dependa fundamentalmente del pico de concentración máxima que alcanzan en plasma, como es el caso de los aminoglucósidos o del área bajo la curva (ABC) de concentraciones plasmáticas en función del tiempo, como sucede con las fluoroquinolonas. Ambos grupos tienen efecto postantibiótico significativo. Con estos dos grupos de antimicrobianos conviene mantener o aumentar la dosificación en cada administración y, si es necesario, aumentar el intervalo de tiempo entre cada administración para que no se produzca una acumulación y, por consiguiente, aparezca toxicidad.
Por el contrario, hay antimicrobianos cuyo efecto bactericida depende del tiempo durante el que sus concentraciones plasmáticas se mantienen por encima de la concentración mínima inhibitoria (CMI) sobre el germen que esté causando la infección. En este grupo se encuentran los betalactámicos, los macrólidos, los glucopéptidos, las oxazolidinonas y los antifúngicos azólicos. Con estos antimicrobianos conviene mantener o acortar los intervalos de tiempo entre cada administración en lugar de aumentar la dosis en cada una de ellas.
El tener en cuenta las relaciones farmacodinámica/farmacocinética a la hora de establecer un régimen de dosificación con antimicrobianos no solo mejora su eficacia y seguridad, sino que además reduce el desarrollo de resistencias microbianas10.
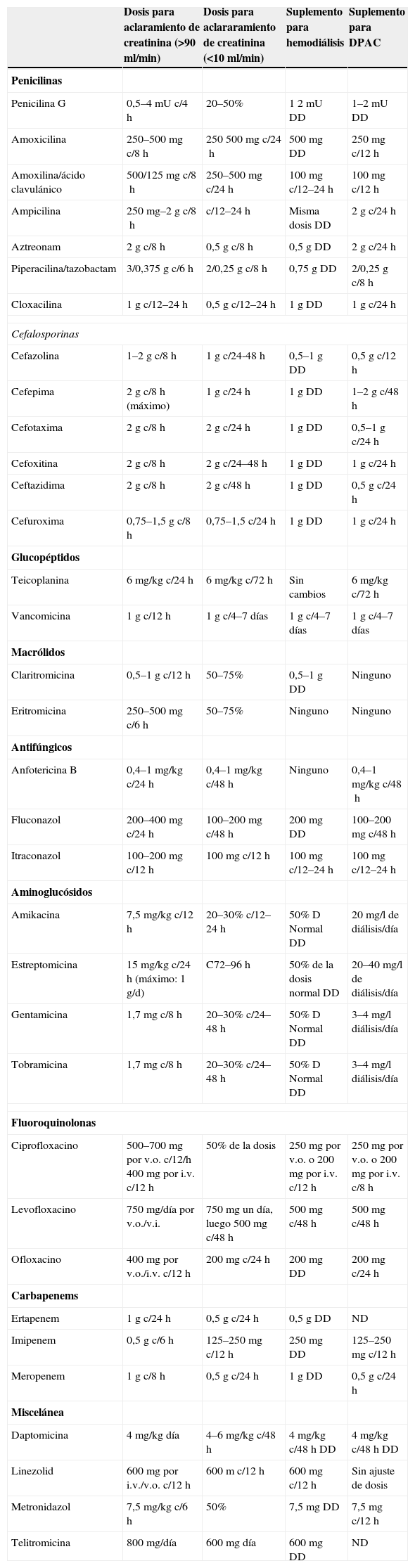
Ajustes de posología en diálisisComo ya se ha citado, el ajuste de la posología en pacientes en régimen de hemodiálisis de distintos antibióticos depende de las características que se han mencionado.
Betalactámicos: su Vd es bajo y su fijación a proteínas plasmáticas también, por lo que su aclaramiento extracorporal es importante. Como su eficacia depende en parte de que las concentraciones plasmáticas se mantengan, en el tiempo, por encima de las CMI de los patógenos causantes de la infección, es importante administrar el fármaco después de la hemodiálisis y, en ocasiones, administrar dosis suplementarias.
Un esquema orientativo de las dosis por administrar aparece en la tabla 2, donde también figuran las dosis que se deben utilizar para diálisis peritoneal.
Diálisis. Ajuste de posología11
| Dosis para aclaramiento de creatinina (>90ml/min) | Dosis para aclararamiento de creatinina (<10ml/min) | Suplemento para hemodiálisis | Suplemento para DPAC | |
| Penicilinas | ||||
| Penicilina G | 0,5–4mU c/4h | 20–50% | 12mU DD | 1–2mU DD |
| Amoxicilina | 250–500mg c/8h | 250500mg c/24h | 500mg DD | 250mg c/12h |
| Amoxilina/ácido clavulánico | 500/125mg c/8h | 250–500mg c/24h | 100mg c/12–24h | 100mg c/12h |
| Ampicilina | 250mg–2g c/8h | c/12–24h | Misma dosis DD | 2g c/24h |
| Aztreonam | 2g c/8h | 0,5g c/8h | 0,5g DD | 2g c/24h |
| Piperacilina/tazobactam | 3/0,375g c/6h | 2/0,25g c/8h | 0,75g DD | 2/0,25g c/8h |
| Cloxacilina | 1g c/12–24h | 0,5g c/12–24h | 1g DD | 1g c/24h |
| Cefalosporinas | ||||
| Cefazolina | 1–2g c/8h | 1g c/24-48h | 0,5–1g DD | 0,5g c/12h |
| Cefepima | 2g c/8h (máximo) | 1g c/24h | 1g DD | 1–2g c/48h |
| Cefotaxima | 2g c/8h | 2g c/24 h | 1g DD | 0,5–1g c/24 h |
| Cefoxitina | 2g c/8h | 2g c/24–48h | 1g DD | 1g c/24h |
| Ceftazidima | 2g c/8h | 2g c/48h | 1g DD | 0,5g c/24h |
| Cefuroxima | 0,75–1,5g c/8h | 0,75–1,5c/24h | 1g DD | 1g c/24h |
| Glucopéptidos | ||||
| Teicoplanina | 6mg/kg c/24h | 6mg/kg c/72h | Sin cambios | 6mg/kg c/72h |
| Vancomicina | 1g c/12h | 1g c/4–7 días | 1g c/4–7 días | 1g c/4–7 días |
| Macrólidos | ||||
| Claritromicina | 0,5–1g c/12h | 50–75% | 0,5–1g DD | Ninguno |
| Eritromicina | 250–500mg c/6h | 50–75% | Ninguno | Ninguno |
| Antifúngicos | ||||
| Anfotericina B | 0,4–1mg/kg c/24h | 0,4–1mg/kg c/48h | Ninguno | 0,4–1mg/kg c/48h |
| Fluconazol | 200–400mg c/24h | 100–200mg c/48h | 200mg DD | 100–200mg c/48h |
| Itraconazol | 100–200mg c/12h | 100mg c/12h | 100mg c/12–24h | 100mg c/12–24h |
| Aminoglucósidos | ||||
| Amikacina | 7,5mg/kg c/12h | 20–30% c/12–24h | 50% D Normal DD | 20mg/l de diálisis/día |
| Estreptomicina | 15mg/kg c/24h (máximo: 1g/d) | C72–96h | 50% de la dosis normal DD | 20–40mg/l de diálisis/día |
| Gentamicina | 1,7mg c/8h | 20–30% c/24–48h | 50% D Normal DD | 3–4mg/l diálisis/día |
| Tobramicina | 1,7mg c/8h | 20–30% c/24–48h | 50% D Normal DD | 3–4mg/l diálisis/día |
| Fluoroquinolonas | ||||
| Ciprofloxacino | 500–700mg por v.o. c/12/h 400mg por i.v. c/12h | 50% de la dosis | 250mg por v.o. o 200mg por i.v. c/12h | 250mg por v.o. o 200mg por i.v. c/8h |
| Levofloxacino | 750 mg/día por v.o./v.i. | 750mg un día, luego 500mg c/48h | 500mg c/48h | 500mg c/48h |
| Ofloxacino | 400mg por v.o./i.v. c/12h | 200mg c/24h | 200mg DD | 200mg c/24h |
| Carbapenems | ||||
| Ertapenem | 1g c/24h | 0,5g c/24h | 0,5g DD | ND |
| Imipenem | 0,5g c/6h | 125–250mg c/12h | 250mg DD | 125–250mg c/12h |
| Meropenem | 1g c/8h | 0,5g c/24h | 1g DD | 0,5 g c/24h |
| Miscelánea | ||||
| Daptomicina | 4mg/kg día | 4–6 mg/kg c/48h | 4 mg/kg c/48h DD | 4mg/kg c/48h DD |
| Linezolid | 600mg por i.v./v.o. c/12h | 600m c/12h | 600mg c/12h | Sin ajuste de dosis |
| Metronidazol | 7,5mg/kg c/6h | 50% | 7,5mg DD | 7,5mg c/12h |
| Telitromicina | 800mg/día | 600mg día | 600mg DD | ND |
D: dosis; DAPC: diálisis peritoneal ambulatoria crónica; DD: después de diálisis; DP: diálisis peritoneal; HD: hemodiálisis; i.v.: intravenosa; ND: no hay datos; PD: posdiálisis; v.o.: vía oral.
Glucopéptidos: aunque su elevado PM haría pensar que son difícilmente dializables, en realidad su hidrofilia y su bajo Vd junto con su elevado aclaramiento renal hacen que sea necesario administrar dosis suplementarias en pacientes con TSR y, más concretamente, hemodiálisis. En todo caso es bastante difícil precisar las dosis suplementarias debido a que el aclaramiento por TSR puede estar modificado por las diferentes situaciones patológicas y su grado de gravedad clínica, por lo que es aconsejable determinar las concentraciones plasmáticas y ajustar las dosis en función de los resultados que se obtengan. Como orientación pueden utilizarse las siguientes dosificaciones:
Las dosificaciones más recomendables para otros antibióticos figuran en la tabla 2.
Ajustes de posología en hemofiltraciónEl comportamiento de los fármacos en pacientes sometidos a TSR de depuración continua varía sensiblemente entre las distintas clases farmacológicas y no son aplicables a ellos, de una forma estricta, los principios que se han citado en referencia a las técnicas de hemodiálisis.
Por ejemplo, la dopamina, la adrenalina y la noradrenalina se eliminan poco con estas técnicas, alrededor de un 0,05% de la dosis administrada, a pesar de que tienen un bajo PM, son hidrófilas y se fijan poco a las proteínas plasmáticas. Por tanto, no es necesario hacer ajustes posológicos12.
La morfina debe evitarse porque es probable que se produzca una acumulación de sus metabolitos que pueden inducir una depresión del centro respiratorio.
El fentanilo tiene una fuerte fijación a proteínas plasmáticas y un elevado Vd, por lo que es poco dializable13. Tampoco se dializa la buprenorfina, que se metaboliza fundamentalmente en el hígado y, por tanto, no se acumula y no es necesario hacer ajustes posológicos. Tampoco es necesario hacer ajustes con propofol.
La heparina no fraccionada tiene un PM demasiado elevado para ser ultrafiltrada, por lo que es un anticoagulante de primera elección ya que su cinética no se modifica por la utilización de esta TSR. Por el contrario, las heparinas de bajo PM presentan una eliminación muy escasa y puede haber peligro de acumulación14. El fondaparinux se elimina cuando se emplean membranas de alto flujo15.
El cortisol no se encuentra en el ultrafiltrado y, por tanto, no es preciso modificar las dosis de esteroides en pacientes con hemofiltración.
Como ya se ha citado, los antibióticos betalactámicos tienen un efecto bactericida que depende del tiempo durante el que su concentración plasmática está por encima de las CMI correspondientes al germen que cause la infección.
Las penicilinas tienen un Vd bajo y una fijación a proteínas variable, por lo que en general es necesario hacer una adaptación posológica cuando se administraran a pacientes en hemofiltración. A este respecto, la infradosificación, con la consiguiente pérdida de eficacia, es mucho más peligrosa que la sobredosificación dado el amplio margen terapéutico que tienen estos fármacos y que hace poco frecuente la inducción de toxicidad.
En relación con los carbapenems, en la insuficiencia renal se reduce el aclaramiento de cilastatina, por lo que puede producirse una acumulación de este compuesto cuando se utiliza imipenem. Sin embargo, las técnicas de hemofiltración incrementan la eliminación de cilastatina, por lo que en estas circunstancias no se produce un problema de toxicidad por cilastatina. En todo caso, el carbapenem que ofrece menos problemas y el mejor estudiado es el meropenem y todavía no disponemos de suficiente información sobre doripenem.
Con las cefalosporinas sucede lo mismo que con las penicilinas, salvo para el caso de la ceftriaxona, que se elimina preferentemente a través de la bilis.
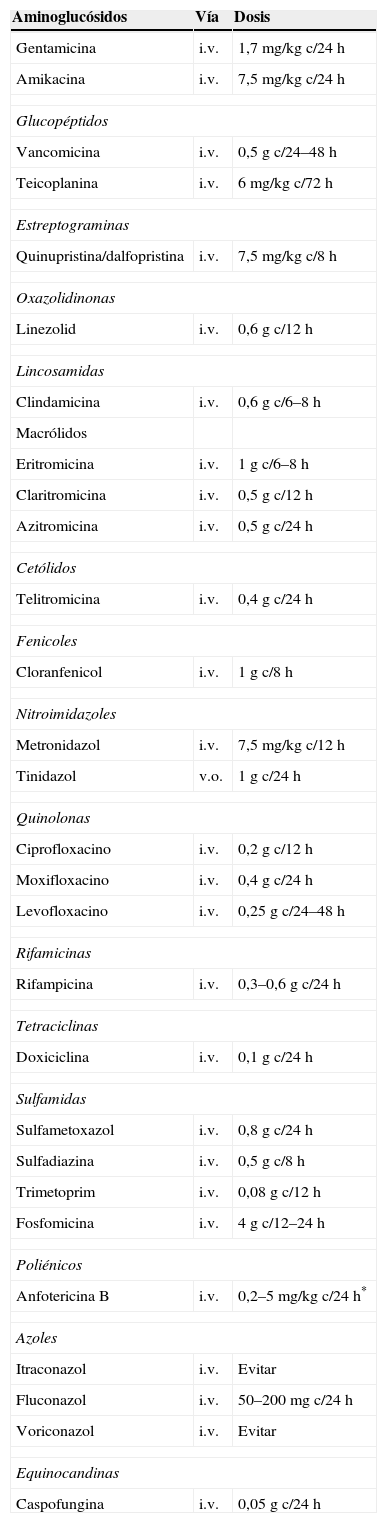
En las tablas 3 y 4 figuran algunas dosis orientativas sobre los ajustes que es necesario hacer con penicilinas, carbapenems y cefalosporinas.
Hemofiltración: ajuste posología
| Penicilinas | Vía | Dosis |
| Penicilina G | i.v. | 3M.UI c/8h |
| Amoxicilina | i.v. | 1–1,5g c/12h |
| Amoxicilina/ácido clavulánico | v.o. | 0,5g c/12h |
| Ampicilina | i.v. | 1,5g c/12h |
| Cloxacilina | i.v. | 0,5–1g c/12h |
| Piperacilina/tazobactam | i.v. | 2g c/8h |
| Carbapenems | ||
| Imipenem | i.v. | 0,5–1g c/12h |
| Meropenem | i.v. | 1g c/12h |
| Ertapenem | i.v. | 0,5g c/24h |
| Monobactámico | ||
| Aztreonam | i.v. | 1g c/12h |
| Cefalosporinas | ||
| Cefadroxilo | v.o. | 0,5g c/12h |
| Cefazolina | i.v. | 1g c/12h |
| Cefuroxima | i.v. | 0,75g c/24h |
| Cefonicid | i.v. | 1g c/72h |
| Cefoxitina | i.v. | 2g c/8–12h |
| Cefixima | v.o. | 0,4g c/24h |
| Ceftibuteno | v.o. | 0,2g c/24h |
| Cefotaxima | i.v. | 2g c/12–24h |
| Ceftazidima | i.v. | 2g c/12–24h |
| Ceftriaxona | i.v. | 2g c/24h |
| Cefepima | i.v. | 1g c/12h |
i.v.: intravenosa; v.o.: vía oral.
Hemofiltración: ajuste de posología
| Aminoglucósidos | Vía | Dosis |
| Gentamicina | i.v. | 1,7mg/kg c/24h |
| Amikacina | i.v. | 7,5mg/kg c/24h |
| Glucopéptidos | ||
| Vancomicina | i.v. | 0,5g c/24–48h |
| Teicoplanina | i.v. | 6mg/kg c/72h |
| Estreptograminas | ||
| Quinupristina/dalfopristina | i.v. | 7,5mg/kg c/8h |
| Oxazolidinonas | ||
| Linezolid | i.v. | 0,6g c/12h |
| Lincosamidas | ||
| Clindamicina | i.v. | 0,6g c/6–8h |
| Macrólidos | ||
| Eritromicina | i.v. | 1g c/6–8h |
| Claritromicina | i.v. | 0,5g c/12h |
| Azitromicina | i.v. | 0,5g c/24h |
| Cetólidos | ||
| Telitromicina | i.v. | 0,4g c/24h |
| Fenicoles | ||
| Cloranfenicol | i.v. | 1g c/8h |
| Nitroimidazoles | ||
| Metronidazol | i.v. | 7,5 mg/kg c/12h |
| Tinidazol | v.o. | 1g c/24h |
| Quinolonas | ||
| Ciprofloxacino | i.v. | 0,2g c/12 h |
| Moxifloxacino | i.v. | 0,4g c/24h |
| Levofloxacino | i.v. | 0,25g c/24–48 h |
| Rifamicinas | ||
| Rifampicina | i.v. | 0,3–0,6g c/24h |
| Tetraciclinas | ||
| Doxiciclina | i.v. | 0,1g c/24h |
| Sulfamidas | ||
| Sulfametoxazol | i.v. | 0,8g c/24h |
| Sulfadiazina | i.v. | 0,5g c/8h |
| Trimetoprim | i.v. | 0,08g c/12h |
| Fosfomicina | i.v. | 4g c/12–24h |
| Poliénicos | ||
| Anfotericina B | i.v. | 0,2–5mg/kg c/24h* |
| Azoles | ||
| Itraconazol | i.v. | Evitar |
| Fluconazol | i.v. | 50–200mg c/24h |
| Voriconazol | i.v. | Evitar |
| Equinocandinas | ||
| Caspofungina | i.v. | 0,05g c/24h |
i.v.: intravenosa; v.o.: vía oral.
Los aminoglucósidos que son hidrofílicos tienen baja fijación a proteínas plasmáticas y escaso Vd, y presentan, con las técnicas de hemofiltración continua, un aclaramiento importante y rápido, por lo que conviene determinar las concentraciones plasmáticas para realizar ajuste de dosis si es necesario.
Los glucopéptidos, a pesar de su elevado PM, también son aclarados fácilmente con las técnicas de hemofiltración, por lo que es necesario administrar dosis supletorias. En todo caso, las condiciones clínicas pueden hacer variar sensiblemente su aclaramiento, por lo que conviene dosificarlos sobre la base de la determinación de sus concentraciones plasmáticas16,17.
Por lo que respecta a las quinolonas, la mayor parte de los trabajos que se han realizado han puesto en evidencia una eliminación muy escasa con las técnicas de hemofiltración continua. Sin duda contribuyen a este resultado su amplio Vd, su alta fijación a proteínas plasmáticas y su metabolización hepática18.
Sobre los antifúngicos conviene señalar que la hemofiltración produce un incremento del aclaramiento del fluconazol que puede llegar a ser el mismo que en un paciente con función renal normal19,20. El itraconazol y el voriconazol están comercializados en formulaciones de administración por vía parenteral y enteral. La formulación parenteral está solubilizada por un diluyente con aclaramiento muy bajo por hemofiltración y que, por tanto, se acumula. No es recomendable utilizar la formulación parenteral en pacientes en hemofiltración.
ConclusionesPara la mayoría de los fármacos no hay suficientes estudios que hayan permitido aclarar su farmacocinética en pacientes en tratamiento con TSR debido probablemente, por un lado, a la gran cantidad de fármacos que hay que utilizar en estos pacientes y, por el otro, a la diversidad de TSR que se emplean. Es por esto, y también por la necesidad de individualizar cada caso, por lo que no se puede disponer de directrices concretas que permitan definir pautas de actuación absolutamente establecidas.
Se han postulado numerosos métodos para calcular el ajuste de dosis necesario en este tipo de pacientes, pero su misma profusión hace pensar en que su eficacia no está suficientemente contrastada ya que si alguno fuera realmente eficaz no se habrían ideado tantos.
En todo caso, puede disponerse de dosificaciones orientativas, como las que se han citado en esta revisión en relación con los antimicrobianos, pero siempre es necesario individualizar los pacientes y las situaciones clínicas para orientar el tratamiento buscando su mayor eficacia y el menor riesgo posible para los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.