Conceptos básicos en enfermedad inflamatoria intestinal crónica
Generalidades
La enfermedad inflamatoria intestinal crónica (EIIC) ha despertado en los últimos años un extraordinario interés, probablemente por su complejidad etiopatogénica y diversidad clínica y porque actualmente carece de un tratamiento curativo, todo ello consecuencia de su origen multifactorial y su heterogeneidad genética e inmunológica. A esto hay que añadir un importante aumento de su incidencia, con una media de edad de comienzo situada entre la segunda y la cuarta décadas de la vida, además de una preocupante diversificación hacia las formas pediátricas.
La diversidad topográfica de las lesiones y las distintas formas clínicas de presentación, sobre todo en la enfermedad de Crohn (EC), nos hacen pensar más en un síndrome que en una entidad única; hecho cada vez más confirmado con el descubrimiento de nuevos marcadores genéticos utilizados para identificar diferentes subgrupos de pacientes, con la consiguiente mejora en el manejo terapéutico.
El término enfermedad inflamatoria crónica intestinal idiopática (EICI) incluye como entidades clínicas más representativas la colitis ulcerosa (CU), la EC y la colitis inclasificable.
La EICI se define como una inflamación crónica de una o más capas de la pared intestinal, de causa no específica, que puede afectar sólo al intestino grueso (colitis) y/o al resto del tubo digestivo (enteritis) de etiología no totalmente conocida, de curso recidivante y que se asocia a complicaciones locales y/o sistémicas.
Colitis ulcerosa
Es la inflamación de la mucosa del colon que se extiende desde el recto en sentido proximal y continuo. Clínicamente se manifiesta como diarrea con sangre y/o moco en las heces. Evoluciona en forma de "brotes de actividad", alternando fases de quiescencia con otras de actividad inflamatoria, y son imprevisibles el número, la periodicidad y la gravedad de éstas.
Enfemedad de Crohn
Inflamación segmentaria y transmural que puede afectar a cualquier tramo del tubo digestivo, desde la boca al ano, y se localiza preferentemente en el íleon terminal e íleon y colon. Clínicamente se manifiesta por cuadros de dolor abdominal, diarrea y pérdida de peso.
Colitis inclasificable
Se define así la inflamación de la mucosa del colon que presenta datos histológicos tanto de CU como de EC.
Base etiopatogénica
Tanto en la CU como en la EC se encuentran implicados:
1. Factores genéticos predisponentes (genes de susceptibilidad, genes determinantes de fenotipo y genes específicos de enfermedad) que condicionan la susceptibilidad de los sujetos a contraer la enfermedad, así como la edad de aparición y su forma de presentación.
2. Microflora intestinal y disfunción del sistema inmunitario: datos observacionales y experimentales indican que la inflamación intestinal aparece como consecuencia de una respuesta inmunitaria anormal a la flora bacteriana intestinal en individuos genéticamente susceptibles. Esta respuesta inmunitaria incontrolada se expresa por un desequilibrio entre citocinas proinflamatorias e inmunorreguladoras cuya gravedad depende de genes que regulan la producción de citocinas, de los que el factor nuclear kappa B (NF-κB) es el regulador más importante de un gran número de genes de citocinas involucradas en la función inmunitaria y la respuesta de fase aguda de la enfermedad.
3. Factores medioambientales, como el tabaco, los anticonceptivos orales, los antiinflamatorios no esteroideos, los factores dietéticos, la lactancia materna y los acontecimientos perinatales, el "ambiente higienizante", la apendicectomía, la flora bacteriana, el estrés, etc. Estos factores modulan la evolución de la enfermedad e incrementan su incidencia.
Tratamiento
El tratamiento convencional de la EICI incluye: aminosalicilatos, antibióticos, corticoides e inmunosupresores. Los pacientes no respondedores o con efectos secundarios a estos fármacos requieren otras opciones terapéuticas. Para este grupo de pacientes, en los últimos años han aparecido las terapias biológicas, producto de la ingeniería genética, como son:
Inhibidores del factor de necrosis tumoral alfa (TNF-α): infliximab, CDP 571/870, adalimumab, onercept, etanercept, CNI-1493.
Inhibidores de otras citocinas proinflamatorias: STA 5326 (contra la interleucina [IL] 12), daclizumab (anti-IL-2R), atlizumab (anti-IL-6R), tacrolimus (anti-IL-2).
Bloqueadores de los receptores de linfocitos: visilizumab (anti-CD3), anti-CD4.
Administración de citocinas antiinflamatorias: tenovil (IL-10), interferón alfa (IFN-α), IFN-β-1a.
Reducción de neutrófilos/monocitos: aféresis de leucocitos con uso clínico en la EC y CU que en el momento actual presenta un nivel de recomendación 2b/B.
Aféresis terapéutica
La aféresis terapéutica es una técnica que ha entrado a formar parte de las nuevas opciones terapéuticas utilizadas en el tratamiento de la EICI.
Tanto la EC como la CU tienen reñación con elevadas concentraciones de inmunocomplejos, factores solubles y neutrófilos, que, junto con los linfocitos, tienen un papel bien definido en la activación y el mantenimiento de la inflamación de la mucosa intestinal.
Partiendo de este planteamiento, se ha señalado que la aféresis selectiva de determinadas células (citoaféresis) sería una nueva aproximación no farmacológica a la depleción o eliminación de los leucocitos activados, con la consiguiente disminución de la inflamación intestinal. Para la extracción de los distintos componentes leucocitarios de la sangre venosa, se está utilizando distintos sistemas de citoaféresis.
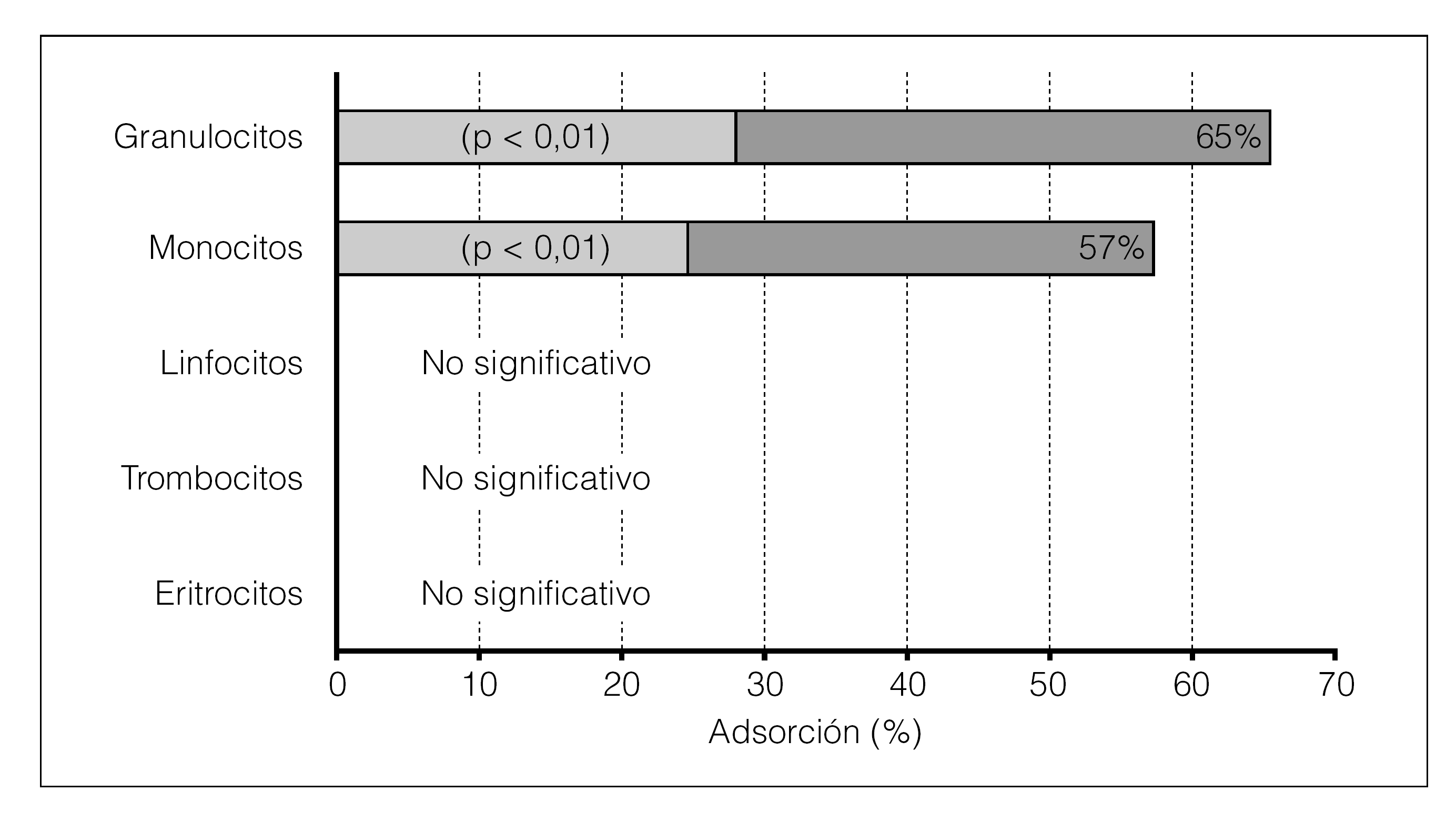
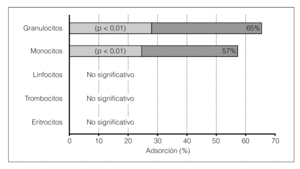
1. Aféresis granulocítica. Es una variante de las técnicas de aféresis que elimina de la circulación venosa, de forma selectiva, un 65% de los granulocitos y más de un 58% de los monocitos/macrófagos, haciendo pasar la sangre a través de una columna de adsorción (acetato de celulosa) en un circuito extracorpóreo. Con esta técnica, los linfocitos, trombocitos y eritrocitos no sufren variaciones significativas (fig. 1).
Figura 1. Extracción porcentual de células sanguíneas en la aféresis granulocítica.
2. Aféresis leucocítica. En este otro subtipo de aféresis terapéutica se emplea un filtro de CellsorbaTM (malla de poliéster), y se moviliza más de un 90% de los monocitos/granulocitos y hasta un 70% de los linfocitos.
3. Aféresis linfocítica. Mediante técnicas de centrifugación, se logra movilizar hasta un 40% de los granulocitos y más de un 60% de los linfocitos.
Como todos estos sistemas de citoaféresis determinan un efecto inmunosupresor, se está utilizándolos en el tratamiento de la EICI corticodependiente/corticorresistente y resistente a los inmunosupresores o con efectos secundarios a estos fármacos.
Pautas de tratamiento
En la mayoría de los estudios realizados con estas técnicas, se ha establecido como tratamiento inicial una sesión de citoaféresis por semana durante 5 semanas, y como tratamiento de mantenimiento, una sesión al mes durante un año.
Aunque algunos autores, como Hanai utilizan 8 sesiones en el tratamiento de inducción cuando la CU es de larga evolución y tiene una actividad grave, en el protocolo de un ensayo clínico internacional, aleatorizado, prospectivo, a doble ciego y controlado con placebo (simulador), en el que se evalúa la seguridad y la efectividad de una columna de aféresis Adacolumn® para el tratamiento de la CU moderada-grave, se utiliza como tratamiento inicial 10 sesiones de la técnica según la siguiente pauta: 2 sesiones por semana las primeras 2 semanas, 1 sesión en la semana tercera y 1 en la cuarta, con una quinta semana de descanso, y en las 4 semanas siguientes, 1 sesión de aféresis granulocítica cada semana. Estos resultados, junto con los del estudio europeo en marcha, probablemente establecerán de forma definitiva el tratamiento inicial según la actividad y el tiempo de evolución.
Técnica de la aferésis granulocítica
Cada sesión de citoaféresis dura 60 min, durante los cuales se realiza un filtrado de 1.800 ml de sangre total, con un flujo de 30 ml/min, utilizando la vía antecubital o, en su defecto, la subclavia o la femoral. Durante el procedimiento y justo antes de que la sangre del paciente entre en el circuito de aféresis, se inyecta heparina sódica o de bajo peso molecular (2.000 U) en el circuito de acceso o de entrada en infusión continua durante los 60 min que dura la técnica, para prevenir la formación de coágulos en el sistema. Los parámetros analíticos exigidos para la realización de una sesión son: leucocitos, > 3.500; hemoglobina, > 10, y trombocitos, > 150.000.
Con estas técnicas se permite tratamientos concomitantes y ajuste del tratamiento farmacológico, según la respuesta clínica.
Sistema de aféresis Adacolumn®
Consta de 4 componentes principales: cartucho, circuito sanguíneo, adamonitor y bomba (fig. 2).
Figura 2. Componentes del sistema de aféresis granulocítica.
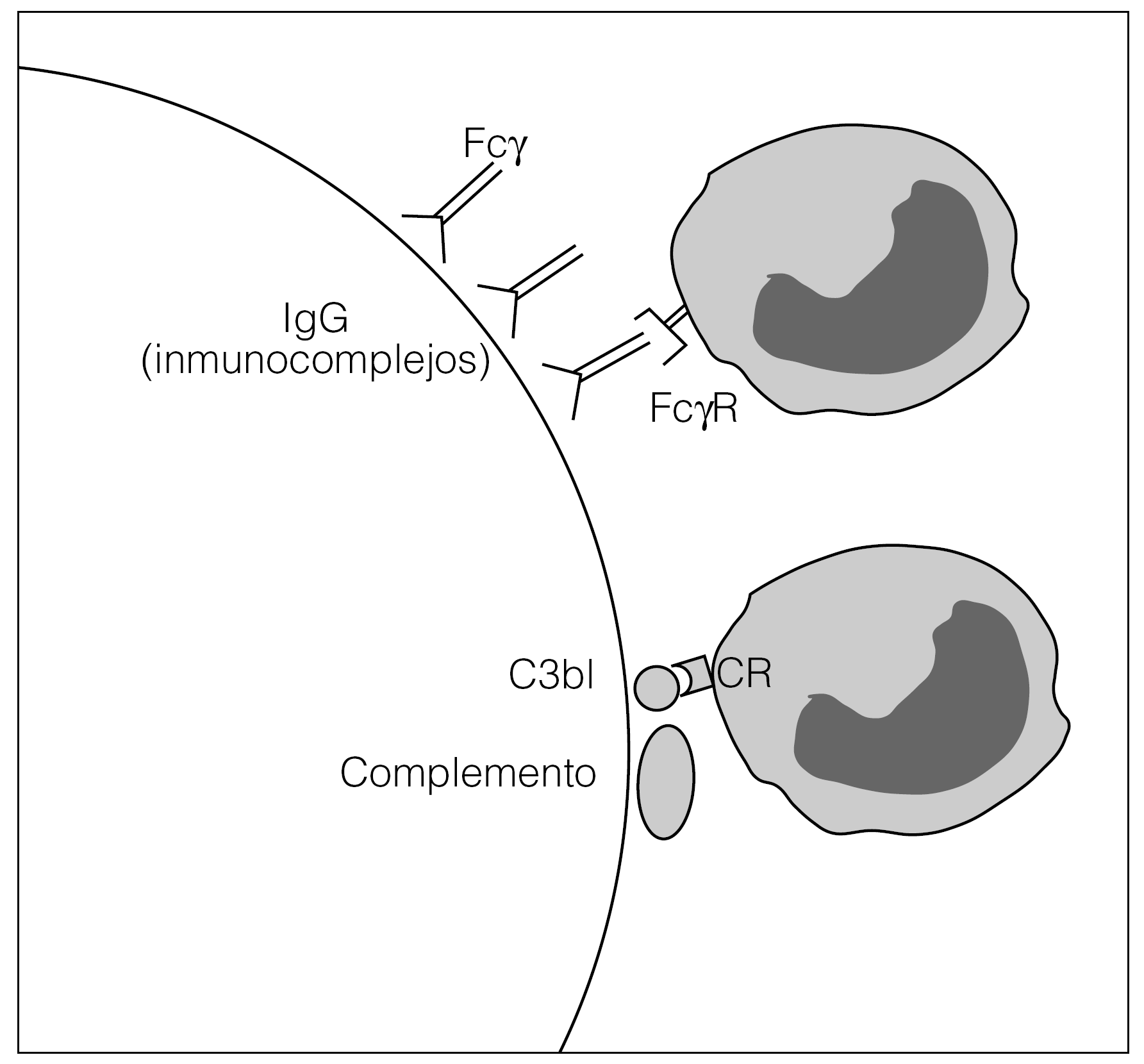
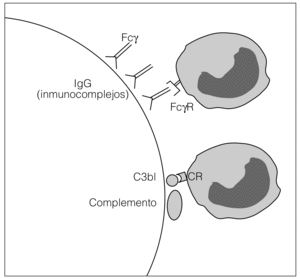
1. Cartucho de Adacolumn®. De uso único, tiene una capacidad de 335 ml. Está relleno de 220 g de esferas de acetato de celulosa (unas 35.000 unidades) de 2 mm de diámetro, bañadas en solución salina isotónica esterilizada (130 ml); las esferas de acetato de celulosa tienen una superficie con capacidad para atrapar granulocitos y monocitos/macrófagos mediante la expresión de receptores de inmunoglobulinas y activando el complemento que sus receptores reconocen (fig. 3).
Figura 3. Mecanismo de acción de la aféresis granulocítica. Tomado de D'Arrigo et al.
2. Circuito sanguíneo. Está sellado herméticamente para mantener estériles los tubos. El material es PVC y su capacidad, 80 ml.
3. Adamonitor. Consta de una bomba para mantener la sangre en circulación y otras 4 unidades (indicadores de velocidad de flujo, tiempo y presión y un cuarto indicador de alarma), que aseguran la seguridad del sistema.
4. Final de la sesión de aféresis granulocítica. Cuando el tiempo de la sesión de la técnica ha acabado, el Adamonitor detiene automáticamente el flujo sanguíneo. En ese momento, la sangre residual del circuito y el cartucho debe volver al paciente, para lo cual se saca la vía conectada a la vena antecubital y se conecta a una bolsa de solución salina (200 ml); entonces se da la vuelta al cartucho de Adacolumn® y la bomba se programa a un ritmo de 30 ml/min, fase que termina cuando han pasado alrededor de 200 ml de solución salina.
La persona que está realizando la aféresis debe estar controlando la presión venosa y el estado general del paciente durante el proceso.
Mecanismo de acción de la aféresis granulocítica
La EIIC es un proceso inflamatorio crónico de la pared intestinal de etiología multifactorial. En su patogenia está implicada una alteración de la regulación de la respuesta inmunitaria determinada genéticamente que causa una respuesta inflamatoria descontrolada. Al igual que en otras enfermedades autoinmunitarias, en la EIIC se produce en sangre periférica un aumento de los neutrófilos y los factores proinflamatorios solubles derivados de los leucocitos, así como una activación del sistema inmunitario celular. Por otra parte, en las formas activas de la EIIC hay una extravasación importante de neutrófilos y monocitos/macrófagos en el tejido mucoso. La liberación de proteasas de degradación, radicales de oxidación y citocinas proinflamatorias a partir de los leucocitos infiltrados en la mucosa puede ocasionar lesión tisular de la mucosa intestinal. Al igual que en otras enfermedades autoinmunitarias, también hay una activación por inmunocomplejos.
Por este motivo, se ha planteado como estrategia terapéutica la extracción selectiva de granulocitos y monocitos activados y citocinas proinflamatorias mediante aféresis granulocítica.
La aféresis granulocítica actúa por diversos mecanismos. En primer lugar, la eliminación selectiva de granulocitos y monocitos en sangre periférica sin afectar de manera significativa al resto de las células sanguíneas (linfocitos, hematíes y trombocitos). La adherencia de los granulocitos y monocitos a las esferas de acetato se produce por activación de la cascada del complemento en presencia de calcio y de inmunoglobulina del tipo G (IgG). Por otro lado, se produce una modulación de la función leucocitaria, ya que la unión de los productos de degradación del complemento a receptores específicos activa señales intracelulares que modifican la expresión de proteínas de membrana leucocitaria. La activación del complemento causa también una liberación de mediadores antiinflamatorios y radicales libres como consecuencia de la desgranulación de los neutrófilos. Se produce una estimulación de los leucocitos mediante la activación de los antagonistas de los receptores de la IL-1 (IL-1ra) que bloquean esos receptores, con el consiguiente efecto antiinflamatorio. Las modificaciones de la expresión de proteínas de superficie modulan los mecanismos de migración desde el pool intravascular al extravascular, y dificultan los mecanismos de reclutamiento de los granulocitos que perpetúan la inflamación en la pared intestinal. Esta modificación de la función leucocitaria tiene como consecuencia una disminución en la capacidad de excreción de las citocinas proinflamatorias. De esta forma se facilitan los mecanismos de apoptosis que son fundamentales en la mantenimiento de la inflamación en estas enfermedades. Por último, se produce un reclutamiento de granulocitos jóvenes en el pool intravascular, que no se encuentran activados por lo que no migran de forma directa hacia las áreas donde se está produciendo la respuesta inflamatoria (pool extravascular). En resumen, aunque aún no se conoce bien todos los mecanismos de acción de la aféresis granulocítica, podemos decir que causa una modulación de la respuesta inflamatoria celular.
Aféresis terapéutica en la colitis ulcerosa
Aféresis linfocítica en la colitis ulcerosa
Las primeras técnicas de aféresis utilizadas para el tratamiento de la CU fueron las de centrifugación, que conseguían extraer del torrente circulatorio del paciente un 40% de los granulocitos y un 60% de los linfocitos. El primer grupo en utilizar esta técnica fue el de Ayabe et al (1997), que trató a 23 pacientes con CU, y consiguió la remisión en el 78%. Ese mismo grupo publicó en 1997 una serie en la que se trató a 14 pacientes de CU corticorresistentes, y obtuvo una respuesta clínica favorable en el 100% y la remisión completa en el 92,9% de los casos. En los últimos tiempos, destaca el trabajo realizado por Kohgo et al (2002), en el cual trataron a 50 pacientes con CU corticorresistentes y en tratamiento con inmunosupresores, y consiguieron un 74% de respuesta y un 50% de remisiones completas.
Aféresis leucocítica en la colitis ulcerosa
Los primeros trabajos realizados con aféresis leucocítica en la CU fueron publicados por Sawada et al (2003), en los que, además de tratar a pacientes con EC, trataron a 25 pacientes con CU, y obtuvieron respuestas del 84 y el 32% de remisiones. En los pacientes en que el tratamiento de inducción se siguió de tratamiento de mantenimiento, se observó un 24% de recidivas. Los pacientes que habían mejorado mostraban en la citometría de flujo elevados porcentajes de células HLADR+, HLADR+CD3+, HLADR+CD8+ y CD11a+CD8+ antes de la primera aféresis leucocítica, valores que descendieron a un rango normal tras la terapia, tanto intensiva como de mantenimiento. En los pacientes con escasa respuesta, por el contrario, los valores habían estado en un nivel normal o próximo al normal antes de la administración de la aféresis leucocítica. En el año 1998, Amano et al publicaron una serie de 37 pacientes con CU que no habían respondido al tratamiento habitual. Fueron tratados con aféresis leucocítica según la pauta: 1 sesión a la semana durante 3 semanas, y luego 2 veces al mes durante 2 meses; 34 de los 37 pacientes presentaron algunos efectos beneficiosos, y en ningún caso empeoró la clínica de los pacientes. Los corticoides se redujeron o suprimieron en 18 de 21 pacientes que recibían corticoides al ser incluidos en el estudio. No se apreciaron efectos adversos graves en ninguno de los pacientes tratados. Ese mismo año Sasaki et al publicaron un estudio con 9 pacientes de CU, 7 de ellos con corticorresistencia. Consiguieron un 66,7% de respuesta clínica y un 33,3% de remisiones completas, con un porcentaje de recidivas del 33% cuando se usó para el mantenimiento de la remisión.
En 2003, Sawada et al publicaron un ensayo multicéntrico, aleatorizado y controlado con esteroides en el que incluyeron a 76 pacientes. Los pacientes se asignaron de forma aleatoria a: grupo de aféresis leucocítica (39 pacientes), 1 sesión semanal durante 5 semanas como terapia intensiva, que se añadían al tratamiento que viniera recibiendo previamente el paciente (se podía mantener, pero no aumentar, la dosis de corticoides), y posteriormente las sesiones de aféresis leucocítica se redujeron a 1/mes, como terapia de mantenimiento; y grupo de dosis altas de prednisolona (37 pacientes): se añadía prednisolona o se aumentaba hasta conseguir dosis de 30-40 mg/día si era CU moderada-grave, y 60-80 mg/día si era CU grave, y posteriormente se reducía la dosis si se obtenía mejoría en los pacientes.
Los resultados obtenidos fueron que la aféresis leucocítica conseguía un 74% de efectividad, frente a un 38% de los corticoides y menor incidencia de efectos adversos (el 24 frente al 68% del grupo de los corticoides). Obtuvieron un 23% de remisiones completas en el grupo tratado mediante aféresis leucocítica.
Aféresis granulocítica (Adacolumn®) en la colitis ulcerosa
El primer estudio publicado sobre el uso de la aféresis granulocítica en la CU fue el de Rembacken et al en 1998. Trataron a 18 pacientes con CU y 6 con EC, de los que el 50% recibía también inmunosupresores, y consiguieron un 16% de remisiones.
El primer ensayo clínico de Adacolumn® en pacientes con CU activa fue un estudio abierto, multicéntrico y controlado, llevado a cabo en 14 hospitales de Japón. De 105 pacientes que cumplían los criterios de inclusión, se incluyó a 53 en el grupo de tratamiento con Adacolumn® (grupo I) y 52 en el grupo de tratamiento convencional (grupo II). De acuerdo con el protocolo del estudio, en el grupo II la prednisolona se aumentó a 63,1 ± 13,82 mg/día por paciente en la semana 1 para favorecer la remisión, comparado con los 23,5 ± 3,42 mg/día por paciente en el grupo I. La dosis de prednisolona se podía reducir en ambos grupos si se obtenía mejoría clínica o remisión de la enfermedad en los pacientes. Los pacientes del grupo I recibieron una sesión de aféresis semanal durante 5 semanas consecutivas. En la semana 7 (punto de valoración de eficacia) la dosis media de prednisolona en el grupo I era de 14,2 ± 2,25 mg (n = 37) frente a 22,9 ± 2,07 mg (n = 26) en el grupo II. De forma global, 31 (58,5%) de los 53 pacientes del grupo I respondieron a la aféresis granulocítica, 11 pacientes alcanzaron la remisión y 20 pacientes consiguieron mejoría de sus síntomas. En el grupo II, el 44,2% de los pacientes respondió al tratamiento convencional, 7 pacientes obtuvieron la remisión clínica y 16 mejoraron clínicamente. En el grupo I se contabilizó un total de 8 efectos adversos en 5 pacientes (rubor facial, cefalea leve, etc.), pero ningún paciente interrumpió el tratamiento con aféresis por los efectos secundarios. Por el contrario, en el grupo II se observaron 40 efectos adversos en 24 pacientes, y hubo que suspender el tratamiento médico en 3 de ellos. Después de este ensayo clínico, Adacolumn® fue aprobado para el tratamiento de la CU activa en Japón, y está muy extendido su uso en ese país.
Por último, Hanai et al han publicado en el año 2003 una amplia serie de pacientes con CU corticorresistente (31 pacientes) que recibieron tratamiento con aféresis granulocítica. Los resultados conseguidos son francamente favorables, con un 87% de respuestas clínicas y un 80% de remisiones clínicas.
Recientemente se ha publicado el estudio de Yamamoto et al (2004) en el que valoran la eficacia de la aféresis granulocítica para el tratamiento de la CU distal. Utilizaron 1 sesión de aféresis semanal durante 5 semanas consecutivas, en 30 pacientes consecutivos con CU distal. Se consiguió una remisión clínica en 21 (70%) pacientes tras las 5 sesiones de aféresis, y la tasa de efectos adversos fue escasa, leves en todos los casos. También en 2004 se ha publicado el trabajo de Suzuki et al en el que valoraban la eficacia de la aféresis granulocítica en el tratamiento de pacientes que no habían recibido nunca corticoides. Se incluyó en el estudio a 20 pacientes, que recibieron entre 6 y 10 sesiones de aféresis granulocítica. Se consiguió una tasa de remisión del 85% al terminar el estudio, y el 60% de los pacientes mantenía dicha respuesta al cabo de 8 meses. Se determinó la concentración de proteína C reactiva (PCR), que mostró un descenso importante en la sangre que retornaba a los pacientes tras pasar por el cartucho de aféresis granulocítica. No se apreciaron efectos adversos clínicamente significativos en los pacientes que fueron tratados con esta técnica.
Conclusiones de la aféresis terapéutica en la colitis ulcerosa
Tras analizar todos los estudios arriba descritos, nos podemos hacer una idea global de cómo estas técnicas pueden influir en el tratamiento de los pacientes con CU.
En los últimos 2 o 3 años, las técnicas de aféresis se han extendido por los países occidentales y han empezado a formar parte del arsenal terapéutico de los pacientes con CU, aunque en la mayoría de las ocasiones haya sido en forma de estudios clínicos o como uso compasivo.
Existe una base científica racional, ya explicada en la introducción de esta revisión, en la que se apoya la eficacia clínica demostrada en estos estudios de las diferentes técnicas de aféresis (sobre todo la aféresis granulocítica) para el tratamiento de la CU. Pero todavía no disponemos de un ensayo clínico, multicéntrico y controlado con simulador para valorar de forma más estricta la eficacia exacta del sistema de aféresis granulocítica evitando el efecto placebo de los pacientes que se saben tratados con una técnica novedosa; efecto placebo cuyo valor en la EIIC no es nada desdeñable, ya que en algunos estudios se ha visto que llega hasta un 30%. Ahora mismo está en marcha un estudio internacional, controlado con simulador, de aféresis granulocítica en la CU, en el que van a participar centros americanos y europeos (entre ellos el HGU Gregorio Marañón de Madrid), que intentará subsanar esta deficiencia de la base evidencial para poder sustentar el uso de la aféresis granulocítica en dichos pacientes.
Lo que también será interesante es el análisis de los subgrupos de pacientes de CU que, según la localización (pancolitis, colitis extensa, distal, izquierda, sigmoiditis o proctitis), la gravedad (valorada según índices clínicos de actividad clínica previamente validados) o el tratamiento previo/actual (corticoides, inmunosupresores), más se podrían beneficiar del tratamiento con aféresis granulocítica.
Aféresis terapéutica en la enfermedad de Crohn
Aféresis linfocítica en la enfermedad de Crohn
Aunque en el momento actual la tendencia es usar mecanismos con columnas que filtren o absorban leucocitos, las primeras aféresis usadas en la EC se basaban en métodos de centrifugación que extraían linfocitos a los pacientes.
Los primeros casos tratados por Bicks et al datan de 1989. Ese autor desechó un método inicial de plasmaféresis linfocítica por impredecible y no rentable y porque produce un 100% de morbilidad. Con posterioridad utilizó un protocolo de ultracentrifugación que elimina selectivamente linfocitos-T. Con este procedimiento, combinado con corticoides y nutrición parenteral total, trató en un estudio no controlado a pacientes con EC en brote severo, y consiguió la remisión clínica en 48 de 54 pacientes.
En otro ensayo no controlado, Faradji et al trataron en 1988 a 12 pacientes con EC severa corticorresistente mediante 12 sesiones de aféresis linfocítica. Objetivaron mejoría clínica en todos los casos, pero a los 3 meses sólo el 50% de los pacientes permanecían en remisión.
En 1994, Lerebours et al realizaron un estudio controlado que valoró la eficacia de la aféresis linfocítica (por un método de centrifugación) en la prevención de recaídas de EC en pacientes que estaban en remisión tras un brote tratado con corticoides. De los 12 pacientes del grupo de aféresis linfocítica, 12 consiguieron eliminar totalmente los corticoides, frente a 10/15 pacientes del grupo control. Durante el período de seguimiento de 18 meses, la tasa acumulada de recidivas fue del 83% en el grupo de aféresis linfocítica y del 62% en el grupo control. Por tanto, en ese estudio la aféresis linfocítica no previno las recaídas en pacientes con EC.
La aféresis linfocítica se ha visto sobrepasada en seguridad y eficacia (y por ello no se usa en la actualidad en la EC) por los métodos de aféresis leucocítica que comentamos a continuación.
Aféresis leucocítica en la enfermedad de Crohn
Los métodos que extraen leucocitos con mayor o menor selectividad se van imponiendo en el manejo de enfermedades autoinmunitarias diversas. Ello depende en parte del notable impulso que supuso la aprobación por el Ministerio de Salud Japonés de 2 sistemas de aféresis leucocítica para el tratamiento de la CU (como se describe en el apartado correspondiente).
El primero, denominado CellsorbaTM, consiste en un sistema de perfusión de sangre a través de una columna con un filtro de fibras de poliéster que retiene todas las poblaciones de leucocitos junto con plaquetas. Sawada et al trataron a pacientes con EC (con mala respuesta al tratamiento farmacológico) en un estudio no controlado que consistió en 5 sesiones de aféresis leucocítica con separación de 1 semana como tratamiento de choque, seguidas de 5 sesiones cada mes como tratamiento de mantenimiento. De los 19 pacientes con EC, 16 experimentaron alguna mejoría clínica, pero sólo en 4 de los 19 pacientes se consiguió la remisión clínica. La mejoría clínica continuó durante el período de mantenimiento en 12 de los 19 pacientes. Los pacientes que respondieron tenían elevados los valores basales de células HLADR+, HLADR+CD3+ y HLADR+ CD8+, de PCR y de velocidad de sedimentación globular (VSG); valores que se normalizaron al final de la terapia.
En 1999, Kosaka et al, usando CellsorbaTM en un estudio no controlado con un protocolo similar al anterior, trataron a 18 pacientes con EC activa. El 50% (9/18) entró en remisión al final del período de tratamiento intensivo de 5 sesiones semanales. Los pacientes que no respondieron tenían una enfermedad de mayor duración. Solo en los pacientes que consiguieron la remisión se objetivó una disminución significativa de los valores de PCR y VSG.
El segundo es un sistema de aféresis leucocítica selectiva, aprobado por el Ministerio de Salud Japonés para la indicación CU, denominado Adacolumn®. Consiste en una columna que contiene cuentas de acetato de celulosa de 2 mm de diámetro sumergidas en suero salino, que absorbe selectivamente granulocitos y monocitos/macrófagos, conectada a un sistema de perfusión de sangre.
En un estudio no controlado publicado en 2003 por Matsui et al, 7 pacientes con EC resistente a terapia convencional fueron tratados con Adacolumn®. El protocolo incluía 1 sesión semanal de aféresis durante 5 o 6 semanas, manteniendo durante ese período la terapia farmacológica que toma cada paciente. De los 7 pacientes 5 entraron en remisión al final del tratamiento con Adacolumn® (CDAI [Crohn Disease Activity Index] basal, 285,4 ± 62; CDAI post, 94,4 ± 3,7; p < 0,01). En el grupo total, el CDAI basal de 244,7 ± 50,4 disminuyó a 103,4 ± 8,4 al final de tratamiento (p < 0,01). Los pacientes que respondieron eran más jóvenes y con lesiones predominantes en colon, mientras que los no respondedores tenían una enfermedad de mayor duración, que se expresa con úlceras aftoides en íleon. Ningún paciente presentó efectos adversos reseñables. La remisión en 5 pacientes se mantuvo durante 1 año, en 3 de ellos con terapia farmacológica convencional y en los otros 2 con una sesión mensual de Adacolumn®. Pasado el año todos los pacientes recayeron.
Tres estudios no controlados en la EC que usaron aféresis selectiva de granulocitos y monocitos se presentaron como abstracts en la American Gastroenterological Association (AGA) 2004, celebrada en Nueva Orleans, publicados algunos posteriormente en forma de artículos. Fukuda et al tratan a 21 pacientes con EC pertinaz mediante 1 sesión semanal de Adacolumn®, durante 5 semanas, como adyuvante a la medicación. A la séptima semana del inicio de la aféresis se objetivó una mejoría significativa del CDAI (basal, 275 ± 55; postratamiento, 214 ± 90; p < 0,0005). Conviene resaltar que los valores de CDAI postratamiento siguen siendo elevados e indican que no se ha conseguido la remisión completa en la mayoría de los pacientes. Petermann et al trataron a 8 pacientes con EC activa resistente a corticoides y azatioprina, y a 4 pacientes con resistencia a infliximab. El protocolo era de 2 sesiones de Adacolumn® por semana durante 3 semanas y 1 sesión por semana durante 3 semanas adicionales. Se consiguió la remisión completa (CDAI < 150) en 4/8 pacientes, y se objetivó la cicatrización de las lesiones endoscópicas. De estos 4 pacientes, 3 permanecían en remisión sin precisar corticoides a los 4 meses. Por último, en un estudio español, de Domenech et al, 7/11 pacientes con EC corticodependientes entraron en remisión completa tras 5 infusiones semanales de Adacolumn®, y en todos ellos se retiraron totalmente los corticoides que precisaban. Es de destacar que, en estos 3 trabajos presentados en la AGA 2004, Adacolumn® muestra un excelente perfil de seguridad.
En la experiencia con CellsorbaTM o Adacolumn® no se objetiva aparición de infecciones oportunistas. En la aféresis leucocítica con CellsorbaTM, el descenso inicial de leucocitos en sangre periférica desencadena el flujo de éstos desde los depósitos marginales. Tras la aféresis con Adacolumn®, se comprueba mediante citometría de flujo un aflujo de nuevos granulocitos desde los depósitos marginales, que son inmaduros e inactivos (neutrófilos CD10). En ambos casos, el flujo de nuevos leucocitos inmaduros a la circulación periférica hace que disminuya su capacidad para producir citocinas proinflamatorias como TNF-α, IL-1β, IL-2, IL-8 e IFN-γ. Todas estas sustancias están implicadas en la fisiopatología de la EC. Sin embargo, el mantener los recuentos de leucocitos en sangre periférica (aunque sean inmaduros) conlleva persistencia de las defensas naturales.
En cualquier caso no se conoce los mecanismos precisos mediante los que CellsorbaTM y Adacolumn® producen su efecto terapéutico.
Conclusiones de la aféresis terapéutica en la enfermedad de Crohn
A diferencia de lo que ocurre en la CU, entidad en la que la aféresis leucocítica total o selectiva ha demostrado su eficacia y existen protocolos aceptados, al menos en Japón, en la EC los estudios realizados han sido menos numerosos y sus resultados, menos concluyentes. Por ello en el momento actual no existen una indicación ni un protocolo aceptados para pacientes con EC.
Las evidencias científicas disponibles, aunque realizadas en estudios no controlados, abren sin embargo expectativas muy interesantes en la EC. Un primer aspecto a destacar es que los pacientes tratados en la mayoría de los estudios eran pacientes con resistencias a las terapias convencionales, incluidos corticoides y/o inmunomoduladores. En estos pacientes con enfermedad muy severa, el tratamiento coadyuvante con CellsorbaTM o Adacolumn® consigue en muchos casos (alrededor del 50%) la remisión completa. Es interesante buscar marcadores pronósticos para seleccionar a los candidatos idóneos. En ese sentido, los pacientes con enfermedad de corta evolución, con afección predominante de colon y con PCR elevada, parecen responder mejor al tratamiento coadyuvante con aféresis. Un dato no bien estudiado es la influencia de la aféresis leucocítica en la tendencia a recaídas posteriores de estos pacientes, y por tanto no se puede recomendar su uso para el tratamiento de mantenimiento.
El uso adyuvante de la aféresis leucocítica en la EC se ve favorecido por la ausencia de efectos adversos serios. Los dos sistemas utilizan vías periféricas y son seguros en ese sentido. El mantenimiento de las concentraciones de leucocitos en sangre periférica conlleva la persistencia de defensas naturales: los métodos de aféresis citados no condicionan la aparición de infecciones oportunistas.
En la EC es necesario delimitar el protocolo a seguir. En ese sentido se ha propugnado que la EC, al tratarse de una enfermedad más proliferativa y con lesiones que llegan a capas profundas de la pared intestinal, pueda precisar un tratamiento más intensivo que el aceptado para la CU (cuya lesión es más superficial). Esto se puede conseguir acortando el intervalo entre sesiones de aféresis o aumentando el número de éstas. La respuesta a los interrogantes planteados hace necesario realizar en la EC ensayos controlados multicéntricos de los sistemas de aféresis frente a placebo (simulador), estudios que, según la evidencia actual, están plenamente justificados.
Experiencia en España con la aféresis granulocítica para el tratamiento de la enfermedad inflamatoria intestinal
En España, diferentes grupos de investigadores han llevado a cabo varios estudios en relación con el uso de la aféresis granulocítica en la EIIC. De todos los estudios realizados, destacan el del Grupo de Madrid, el de GETECCU (Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa) y el del Hospital de Alcázar de San Juan.
Grupo de Madrid
Se realizó un estudio piloto, abierto, prospectivo y no aleatorizado, en el que participaron el Hospital General Universitario Gregorio Marañón, el Hospital Clínico San Carlos y el Hospital Puerta de Hierro.
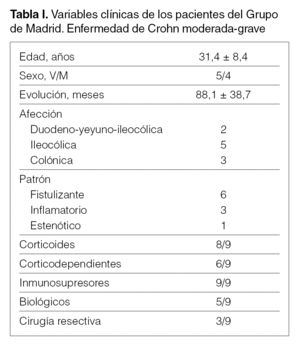
Se incluyó en el estudio a pacientes con EC con actividad moderada-grave que no habían respondido al tratamiento habitual (aminosalicilatos, corticoides, azatioprina/6-mercaptopurina, metotrexato o infliximab). Se evaluó como variables fundamentales: los índices de actividad clínica, la reducción de la dosis corticoidea, el mantenimiento de la remisión y la seguridad del tratamiento.
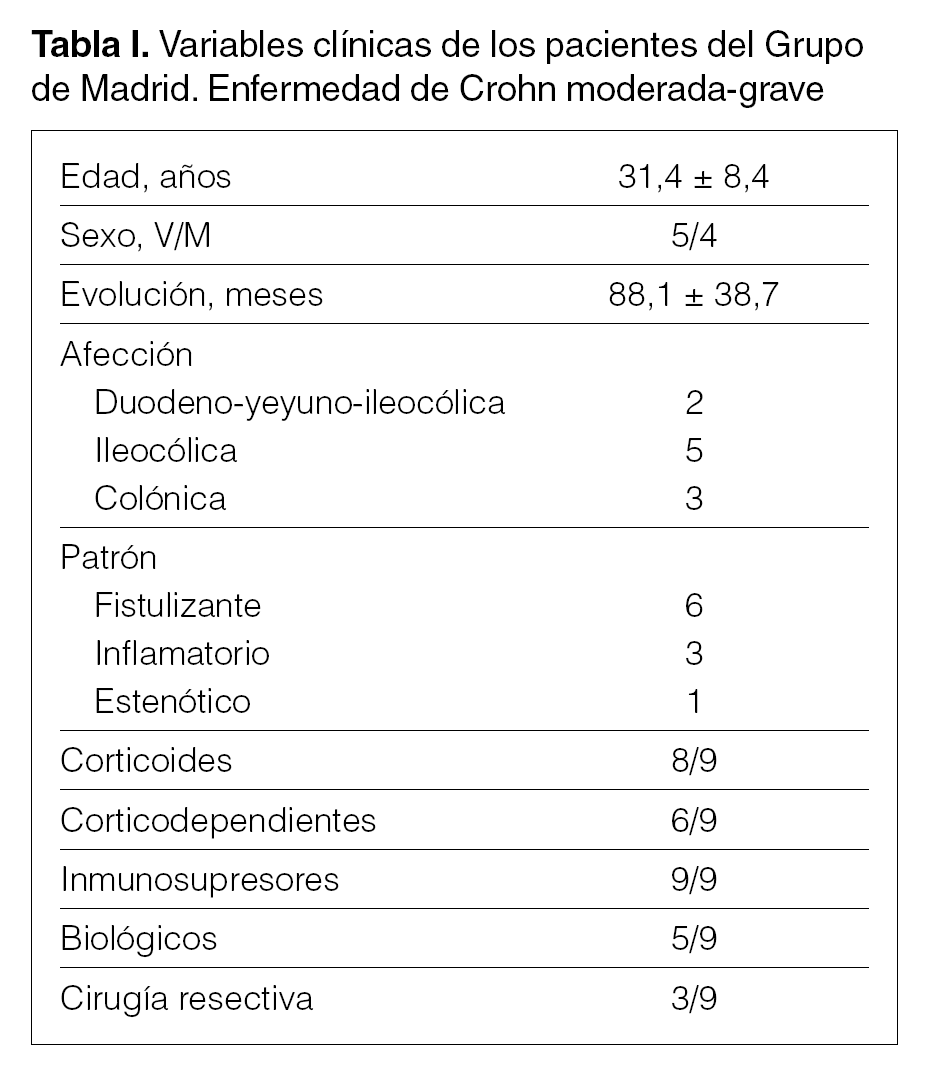
Se usaron unidades de diálisis, con sistema Adacolumn®, realizando 1 sesión a la semana durante 5 semanas, con posteriores visitas de monitorización mensuales durante 6 meses. Se incluyó a 10 pacientes en el estudio, de los que luego se eliminó a 1 porque no cumplía estrictamente los criterios de inclusión. Las características clínicas de los pacientes aparecen detalladas en la tabla I.
Los resultados fueron: el 66% de remisiones completas, que se mantuvieron a largo plazo en dos tercios de los pacientes que alcanzaron esta remisión. Se consiguió reducir la dosis de corticoides en el 77% de los pacientes a la semana 12 de inicio del tratamiento.
Los efectos adversos observados fueron mínimos, y destacaron varios episodios aislados de cefalea y un cuadro seudogripal, aunque no se tuvo que interrumpir el tratamiento en ningún caso por su aparición.
GETECCU
Realizaron un estudio piloto multicéntrico, prospectivo y abierto en pacientes con enfermedad inflamatoria intestinal corticodependiente. Todos los pacientes comenzaron con 60 mg/día de prednisona, iniciando al cabo de 1 semana un programa de 5 sesiones de aféresis granulocítica (1/semana). Se redujo la dosis de esteroides de forma progresiva si se observaba mejoría clínica. Definieron la remisión como un índice de actividad clínica compatible con enfermedad inactiva junto con la eliminación de la necesidad de usar corticoides a la semana 6. Incluyeron en el estudio a 26 pacientes (14 de CU y 12 de EC); más de la mitad de los pacientes habían sido previamente tratados con inmunosupresores. Consiguieron una tasa de remisiones del 62% en CU y del 70% en EC. En el seguimiento realizado a largo plazo (media de 12 meses), la mayoría de los pacientes con CU mantenía la remisión, mientras que sólo un escaso porcentaje de los pacientes con EC seguía en remisión.
Hospital de Alcázar de San Juan
En ese hospital se ha utilizado la aféresis granulocítica en 15 pacientes (13 con EC y 2 con CU). Los resultados obtenidos fueron:
5/15 pacientes libres de corticoides (4 EC/1 CU).
1 efecto terapéutico primario (no otra medicación coadyuvante).
4/15 disminución en un 50% de dosis mínima (4 EC).
6 fracasos (1 CU/5 EC).
1 disminución rápida de corticoides (fase aguda).
Resumen global de la experiencia española
El resumen de los estudios realizados en España es que la aféresis granulocítica es una técnica útil para el tratamiento de los pacientes con enfermedad inflamatoria intestinal grave, rebeldes a otros tipos de tratamiento o con efectos secundarios de éstos. Quedan aún muchas preguntas por responder, como son: ¿ofrece los mismos resultados en EC y en CU?; ¿hay algún subgrupo de pacientes con EC que se beneficiaría en mayor medida del tratamiento?; ¿qué pauta de sesiones sería la idónea para la inducción?; ¿y para el mantenimiento? Es probable que se vaya respondiendo a todas estas preguntas en los próximos años, en parte gracias a un ensayo clínico en marcha, internacional, multicéntrico, aleatorizado y controlado con simulador (sham), para valorar la utilidad de la aféresis granulocítica en el tratamiento de los pacientes con CU.
Correspondencia: Dr. V. González Lara.
Hospital General Universitario Gregorio Marañón.
C/ Dr. Esquerdo, 46. 28007 Madrid. España.
Bibliografía recomendada
Amano K, Amano K. Filter leukapheresis for patients with ulcerative colitis: clinical results and the possible mechanism. Ther Apher. 1998;2(2):97-100.
Ayabe T, Ashida T, Taniguchi M, et al. A pilot study of centrifugal leukocyte apheresis for corticosteroid-resistant active ulcerative colitis. Intern Med. 1997;36:322-6.
Bicks RO, Groshart KD. The current status of T-lymphocyte apheresis (TLA) treatment of Crohn's disease. J Clin Gastroenterol. 1989;11:136-8.
D'Arrigo C, Candal-Couto JJ, Greer M, Veale Dj, Woof JM. Human neutrophil Fc receptor mediated adhesion under flow: a hallow fiber model of intravascular arrest. Clin Exp Immunol. 1994;100:173-9.
Domenech E, Hinojosa J, Esteve-Comas M, Gomollon F, Herrera JM, Bastida G, et al. Granulocyteapheresis in steroid-dependent inflammatory bowel disease: a prospective, open, pilot study. Aliment Pharmacol Ther. 2004;20:1347-52.
Faradji A, Duclos B, Bohbot A, Baumann R, Levy S, Lang JM, et al. Treatment using lymphocytapheresis of severe forms of Crohn's disease. Preliminary results. Ann Med Interne. (Paris) 1988;139 Suppl 1:55-9.
Fukuda Y, Matsui T, Suzuki Y, Kanke K, Matsumoto T, Takazoe M, et al. Adsorptive granulocyte and monocyte apheresis for refractory Crohn's disease: an open multicenter prospective study. J Gastroenterol. 2004;39(12):1158-64.
Hanai H, Watanabe F, Takeuchi K, Iiada T, Yamada M, Iwaoka Y, et al. Leukocyte adsorptive apheresis for the treatment of active ulcerative colitis: a prospective, uncontrolled, pilot study. Clin gastroenterol Hepatol. 2003;1(1):28-35.
Hiraishi K, Takeda Y, Shiobara N, et al. Studies on the mechanisms of leukocyte adhesion to cellulose acetate beads: an in vitro model to assess the efficacy of cellulose acetate carrier-based granulocyte and monocyte adsorptive apheresis. Ther Apher Dial. 2003;7:334-40.
Kohgo Y, Hibi H, Chiba T, Shimoyama T, Muto T, Yamamura K, et al. Leukocyte apheresis using a centrifugal cell separator in refractory ulcerative colitis: a multicenter open label trial. Ther Apher. 2002;34(2):255-60.
Kosaka T, Sawada K, Ohnishi K, Egashira A, Yamamura M, Tanida N, et al. Effect of leukocytapheresis therapy using a leukocyte removal filter in Crohn's disease. Intern Med. 1999;38(2):102-11.
Lerebours E, Bussel A, Modigliani R, Bastit D, Florent C, Rabian C, et al. Tretment of Crohn's disease by lymphocyte apheresis: a randomized controlled trial. Groupe d'Etudes Therapeutiques des Affections Inflammatoires Digestives. Gastroenterology. 1994;107(2):357-61.
Matsui T, Nishimura T, Matake H, et al. Granulocytapheresis for Crohn's disease: a report on seven refratory patients. Am J Gastroenterol. 2003;98:511-2.
Petermann S, Ramlow W, Liebe S, Emmrich J. Efficacy of granulocyte and monocyte adsorption apheresis in chronic active Crohn's disease. Gastroenterology. 2004;126:A632(W1420).
Rembacken BJ, Newbould HE, Richards SJ, Misbah SA, Dixon ME, Chalmers DM, et al. Granulocyte apheresis in inflammatory bowel disease: possible mechanisms of effect. Ther Apher. 1998;2(2):93-6.
Saniabadi AR, Hanai H, Takeuchi K, et al. Adacolumn, an adsorptive carrier based granulocyte and monocyte apheresis device for the treatment of inflammatory and refractory diseases associated with leukocytes. Ther Apher Dial. 2003;7:48-59.
Sasaki M, Tsujikawa T, Fujiyama Y, Bamba T. Leukocytapheresis therapy for severe ulcerative colitis. Ther Apher. 1998;2(2):101-4.
Sawada K. Leukocytapheresis as an adjunt to conventional medication for Inflammatory Bowel Disease. Dis Colon Rectum. 2003;46 Suppl 10:S66-77.
Sawada K, Muto T, Shimoyama T, et al. Multicenter randomizaed controlled trial for the treatment of ulcerative colitis with a lekocytapheresis column. Curr Pharm Des. 2003;9:307-21.
Sawada K, Ohnishi K, Kosaka T, Fukui S, Yamamura M, Amano K, et al. Leukocytapheresis therapy with leukocyte renoval filter for inflammatory bowel disease. J Gastroenterol. 1995;30 Suppl 8:124-7.
Shimoyama T, Sawada Y, Tanaka T, et al. [Granulocytapheresis in active ulcerative colitis. A multicenter randomized control study] [resumen en inglés]. Jpn J Apher. 1999;18:117-31.
Shimoyama T, Sawada K, Saniabadi A. Safety and efficacy of granulocyte and monocyte apheresis in patients with active ulcerative colitis: a multicenter study. J Clin Apher. 2001;16:1-9.
Suzuki Y, Yoshimura N, Saniabadi AR, et al. Selective granulocyte and monocyte adsorptive apheresis as a first-line treatment for steroid naïve patientes with active ulcerative colitis: a prospective uncontrolled study. Dig Dis Sci. 2004;49:565-71.
Takeda Y, Hiraishi K, Takeda H, et al. Cellulose acetate beads induce release of interleukin-1 receptor antagonist, but not tumour necrosis factor-alpha or interleukin-1beta in human peripheral blood. Inflamm Res. 2003;52:287-90.
Yamamoto T, Umegae S, Kitagawa T, et al. Granulocyte and monocyte adsorptive apheresis in the treatment of active distal ulcerative colitis: a prospective, pilot study. Aliment Pharmacol Ther. 2004;20:783-92.