Introducción
Los virus hepatotropos presentan mayor prevalencia en los pacientes en hemodiálisis. De ellos, se ha conseguido disminuir drásticamente la incidencia y la prevalencia del virus de la hepatitis B (VHB), gracias al descubrimiento de la vacuna en 1986, la obligatoriedad de determinar el HBsAg en los bancos de sangre y el imperativo de aislar a los pacientes con antigenemia positiva en una unidad especial.
Dadas las características del virus de la hepatitis C (VHC) (ARN, 6 tipos mayores con subtipos diferentes sin inmunidad cruzada, no existe vacuna, no es obligatorio el aislamiento), es más difícil controlarlo, y hay evidencia de que los pacientes con insuficiencia renal crónica (IRC) en hemodiálisis constituyen una población de riesgo para la infección por este virus1,2.
Que la trasmisión nosocomial en las unidades sea posible hace que tengamos que utilizar todos los medios posibles para evitar su trasmisión y, con ello, el desarrollo de hepatopatía crónica que aparece en un elevado porcentaje de los pacientes infectados3,4.
Existe evidencia de que el tratamiento sustitutivo de la IRC con HD estimula la producción del factor de crecimiento hepatocitario (HGF), que puede servir como protección en el desarrollo de hepatopatía en pacientes infectados por el VHC5-9.
La disminución de la carga viral respecto a pacientes sin insuficiencia renal podría hacer pensar en que éste fuera uno de los factores controlados por el HGF y que contribuyera a una mejor evolución de la hepatopatía en estos pacientes10,11.
Se podría valorar la indicación de la hemodiálisis como terapia sustitutiva si la técnica influyera en la mejor evolución de la hepatopatía por VHC, para proteger a los pacientes infectados del desarrollo de hepatopatía crónica y, en un porcentaje bajo pero no despreciable, de desarrollo posterior de hepatocarcinoma12.
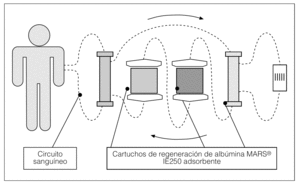
Por último, en la actualidad, como sistema de desintoxicación en hepatopatías agudas fulminantes o descompensaciones agudas de hepatopatías crónicas (incluidas en el inicio del síndrome hepatorrenal), se está utilizando en algunos centros el sistema MARS (sistema de recirculación de adsorbentes moleculares) que, utilizando un circuito cerrado de albúmina combinado con una membrana de alta permeabilidad, consigue una desintoxicación selectiva (a diferencia de la hemodiálisis) tanto de productos tóxicos de la albúmina (ácidos biliares, bilirrubina, cobre...) como de sustancias hidrosolubles (amonio, creatinina), sin que medie contacto directo entre el circuito y la sangre del paciente.
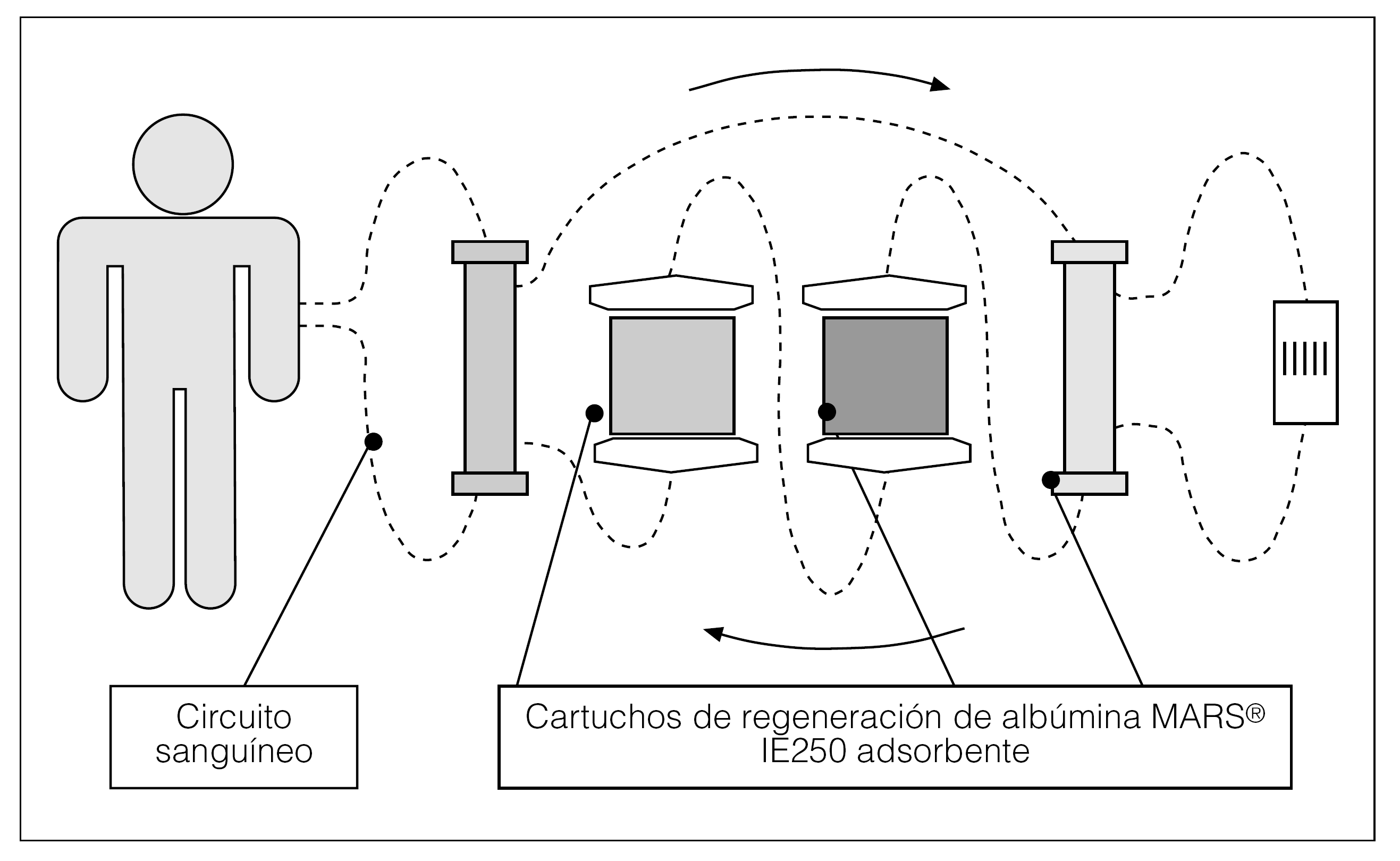
El sistema consiste en establecer un circuito extracorpóreo como el de la hemodiálisis, en el que el circuito de sangre es igual, y se pasa por el circuito del baño 600 ml de albúmina al 20% que están recirculando durante toda la sesión. Para regenerar esta albúmina, que por adsorción atraparía las sustancias ya comentadas, se hace pasar una vez, sale del dializador por un sistema de filtro de baja permeabilidad conectado al monitor de hemodiálisis con baño de bicarbonato y posteriormente por 2 cartuchos --uno de carbón activado y otra columna de sorbentes-- para limpiar la albúmina y que siga recirculando (fig. 1)13-18.
Figura 1. Esquema sistema MARS (Teraklin).
Dado que tanto la hemodiálisis como el sistema MARS son 2 técnicas extracorpóreas de depuración de sustancias y que en los casos de insuficiencia renal avanzada se puede hacer combinada con sesiones de hemodiálisis, nos pareció interesante plantearnos la similitud y las diferencias de las 2 técnicas en la disminución de la carga viral del VHC y la estimulación del HGF.
Material y métodos
Los objetivos del estudio fueron:
Cuantificar la estimulación del HGF en pacientes con IRC en hemodiálisis y establecer si hay diferencias entre los pacientes con PCR+ para VHC y PCR (mantenido), para valorar si la infección por el VHC modifica esta estimulación del HGF.
Analizar la variación de la carga viral durante la sesión de hemodiálisis y su posible correlación con la variación HGF.
Valorar si la técnica MARS (adsorción con albúmina) puede incidir en la disminución de la carga viral y el HGF de forma diferente que la hemodiálisis.
Valorar las variaciones en la disminución de la carga viral y la posible estimulación del HGF tanto in vivo como in vitro y valorar la concordancia entre ellos y de las modificaciones obtenidas.
Para ello en este trabajo se ha realizado sesiones de MARS y hemodiálisis tanto in vitro como in vivo.
Sesiones in vitro
Para las sesiones in vitro se utilizó un circuito extracorpóreo idéntico al que se utiliza in vivo para los 2 técnicas con la diferencia de que la sangre provenía de una bolsa, proporcionada por el banco de sangre, que no se podía utilizar por estar caducada.
Se establecía un circuito cerrado y la tasa baja de ultrafiltración se reponía con suero fisiológico. Se inyectaba en la bolsa una concentración de VHC conocida.
Reprodujimos el tiempo correspondiente a una sesión de MARS o hemodiálisis y obtuvimos muestras para la determinación de la carga viral y el HGF en los tiempos siguientes:
Hemodiálisis: en la bolsa después de la inyección de VHC, en el circuito nada más establecer la conexión, a los 15 min y al final de la sesión. También en el ultrafiltrado.
MARS: al inicio de la conexión y al final de la sesión, también en la albúmina que actúa como baño y en el ultrafiltrado.
Cada experimento in vitro se repitió 2 veces, tanto en hemodiálisis como con MARS.
Sesiones in vivo
Sesiones de MARS in vivo: se estudió las variaciones de la carga viral del VHC y el HGF en 2 pacientes, a los que se realizaron 3 sesiones consecutivas de MARS a cada uno.
La indicación de un paciente era una hepatopatía alcohólica e infección por el VHC evolucionada y desarrolló insuficiencia renal oligúrica, y el otro era un paciente con IRC con hepatopatía por VHC en estadio de cirrosis con prurito intratable.
La carga viral del VHC fue medida al inicio y al final de las 3 sesiones, así como en la albúmina. El HGF fue medido al inicio de cada sesión, a la mitad y cuando las sesiones terminaron.
Sesiones de hemodiálisis in vivo: se realizaron las sesiones en 7 pacientes en hemodiálisis de la unidad, de los que 3 tenían PCR+ para VHC, 2 tenían tanto anticuerpos como PCR+ y 1 con PCR+ a títulos bajos y anticuerpos negativos. A la vez, utilizamos como control a 4 pacientes con anticuerpos negativos y PCR negativa.
Las membranas de hemodiálisis utilizadas fueron: polisulfona, diacetato de celulosa, triacetato de celulosa y polimetilmetacrilato.
La carga viral fue medida al inicio y final de la primera sesión, así como al inicio de la siguiente, y el HGF, además de las anteriores, se determinó a los 15 min desde el inicio de la primera sesión.
Las sesiones tanto in vitro como in vivo se realizaron en la Unidad de Hemodiálisis del Servicio de Nefrología del Hospital Universitario de la Princesa de Madrid.
Las muestras de sangre para las determinaciones de carga viral del VHC y el HGF se enviaron al laboratorio de la Fundación para el estudio de hepatitis virales, donde se realizaron las determinaciones de la carga viral --mediante test Amplicor (Roche)-- y el HGF (Elisa R&D System).
Los resultados se procesaron de forma conjunta y se introdujeron en una base de datos SPSS para realizar su proceso estadístico.
Resultados
En primer lugar, vamos ha mostrar los resultados tanto in vitro como in vivo de la disminución de la carga viral para posteriormente analizar los resultados de estimuación del HGF.
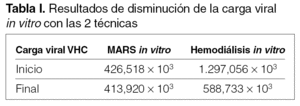
Resultados de disminución de carga viral tanto in vitro como in vivo en las dos técnicas (tablas I, II y III)
En la disminución de la carga viral del VHC vemos como disminuye más con la hemodiálisis que con MARS en la modalidad in vitro.
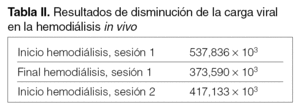
En los estudios in vivo sobre disminución de carga viral con ambas técnicas, vemos que disminuye a lo largo de las sesiones, y se recupera una parte al inicio de la siguiente sesión, tanto de hemodiálisis como de MARS. En el resultado final de las 3 sesiones de MARS en los 2 pacientes, vemos como la carga viral ha disminuido considerablemente.
En segundo lugar, vamos ha mostrar los resultados de la estimulación del HGF tanto in vitro como in vivo en las dos técnicas:
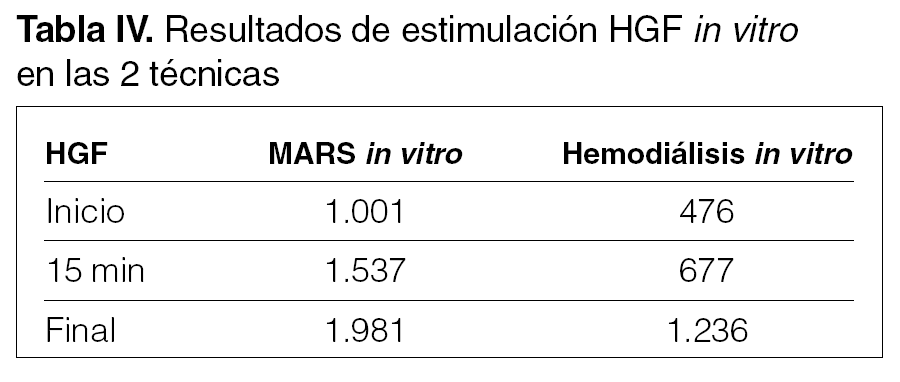
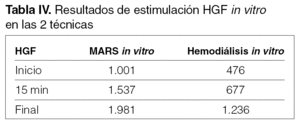
Estimulación del HGF in vitro en MARS y hemodiálisis (tabla IV)
En el estudio in vitro vemos que hay estimulación de HGF en las dos técnicas, si bien sigue aumentando hasta el final de la sesión.
Estimulación de HGF in vivo en MARS y hemodiálisis
En primer lugar, el resultado de la estimulación del HGF en cada sesión de MARS en 2 pacientes in vivo.
Vemos que se estimula a lo largo de la sesión y al final de las 3 sesiones queda con un nivel más alto del que partíamos.
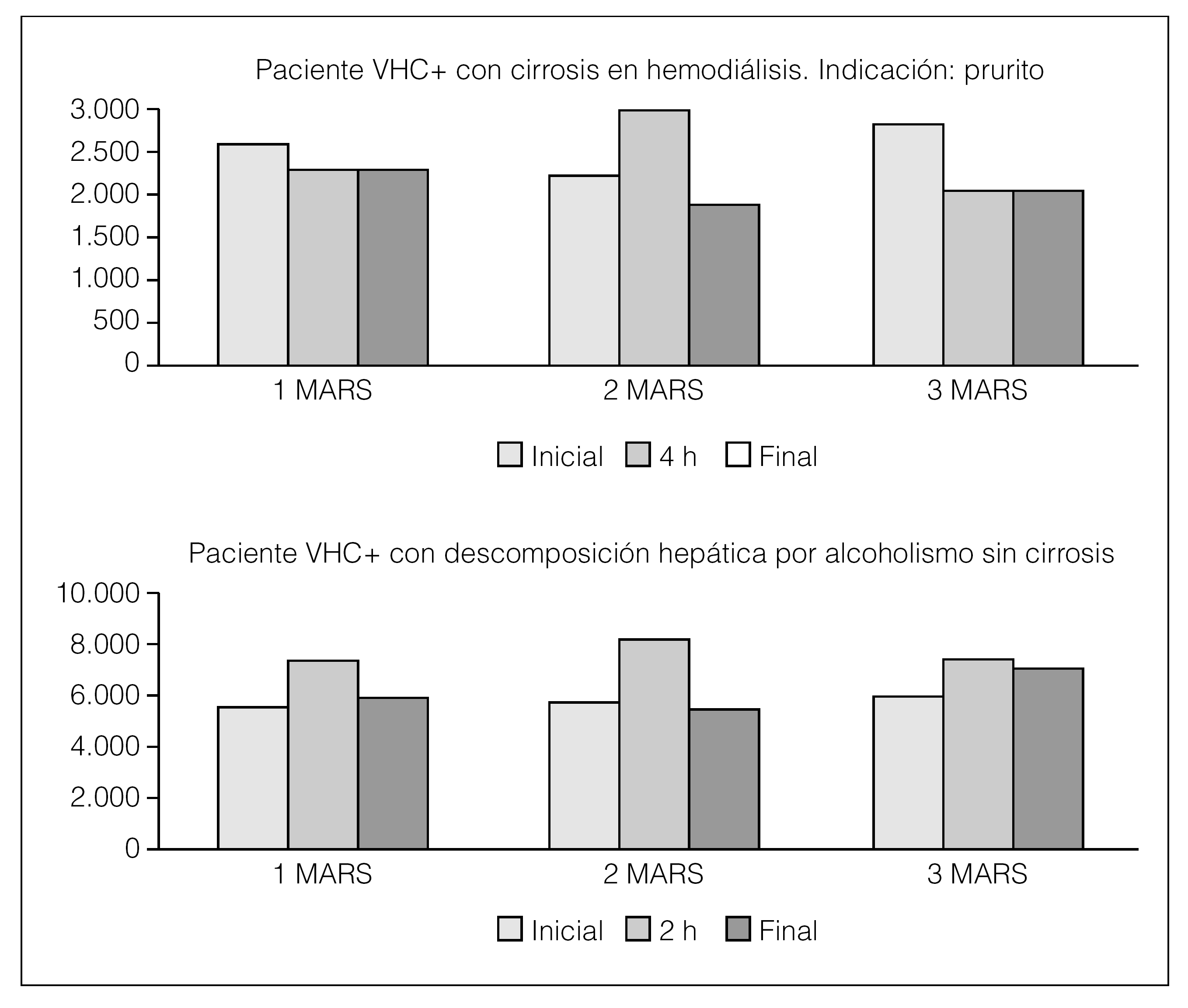
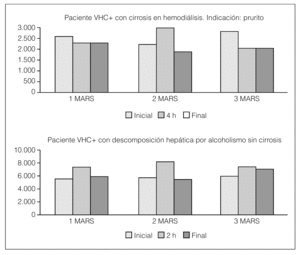
Si analizamos los valores de HGF en cada sesión de MARS en los 2 pacientes, vemos que el paciente en hemodiálisis con cirrosis no estimula tanto el HGF; sin embargo, el que tiene VHC+ y la descompensación es por alcoholismo es capaz de generar el HGF, posiblemente por tener el hígado con mayor capacidad de respuesta (fig. 2).
Figura 2. HGF en sesiones de MARS.
En segundo lugar, el resultado de estimulación del HGF en cada sesión de hemodiálisis en 7 pacientes in vivo.
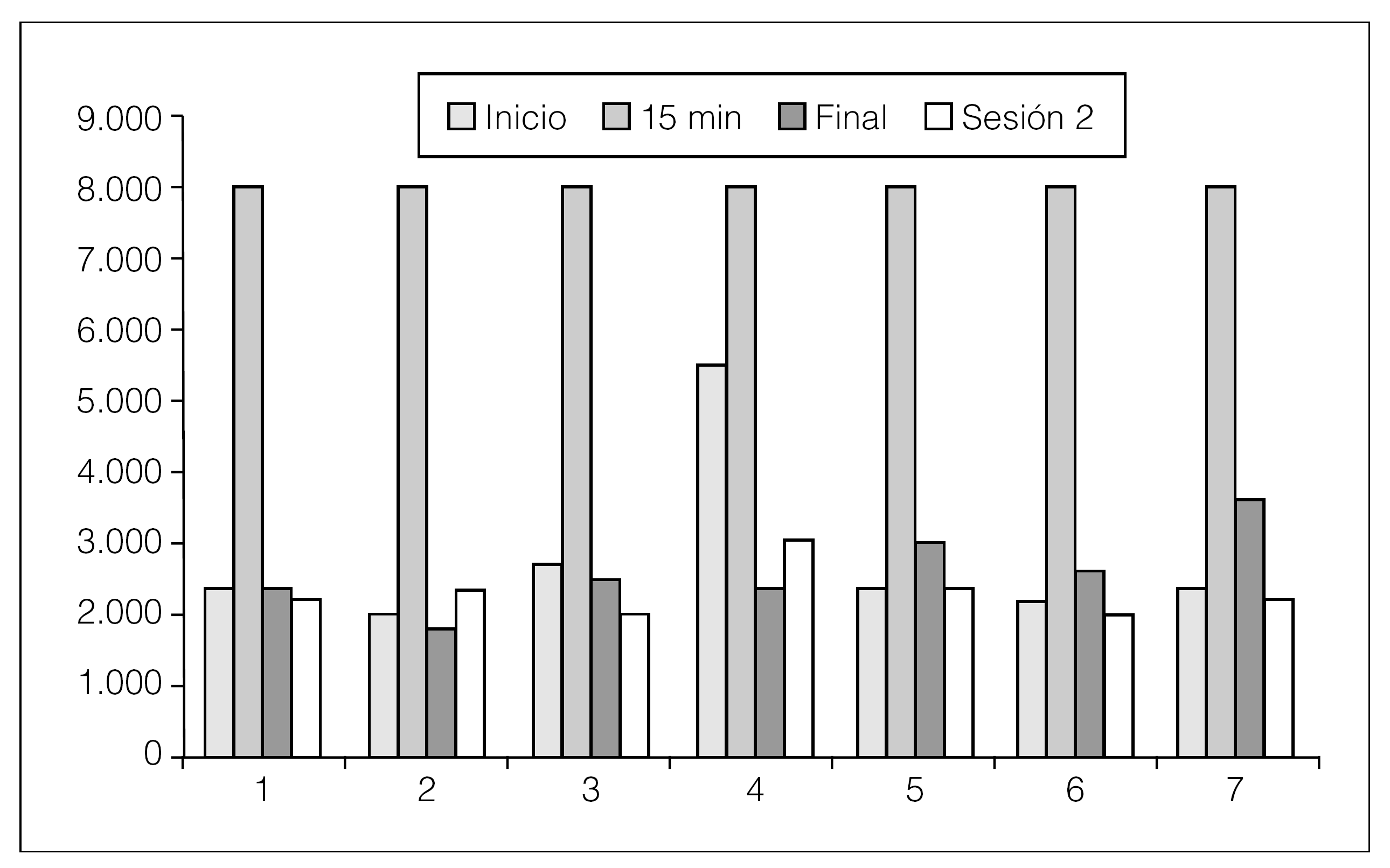
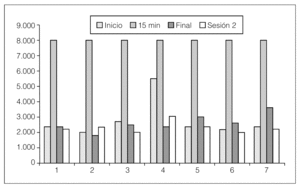
Realizamos la determinación en 7 pacientes, 3 VHC+ y 4 VHC, y se comprobó que la estimulación es máxima en ambos casos a los 15 min y que, aunque el número de casos es pequeño, los pacientes VHC+ parecen tener de inicio más alto el recuento de HGF. En los pacientes estudiados al finalizar la sesión, los valores bajan hasta ser similares a los del inicio en los primeros 4 pacientes que se dializan 4 h; sin embargo, en los 3 últimos que están en hemodiálisis diaria, que tienen un tiempo de sesión entre 2 h y 2.30 h, el HGF al finalizar la sesión se mantiene algo más elevado que al principio, si bien baja en todos los casos en el período interdiálisis (fig. 3).
Figura 3. Cifras de HGF en 7 pacientes en hemodiálisis.
Discusión
La infección por el VHC evoluciona a la hepatopatía crónica lentamente en más del 60% de los casos, y en un 20% de ellos, a la cirrosis. También se ha encontrado en la cirrosis secundaria al VHC una incidencia de hepatocarcinoma insertado variable (1,9-6,7%) según los autores1,2,12.
La transmisión nosocomial es la vía más frecuente entre los pacientes en hemodiálisis, lo que ha llevado a considerar, dada la prevalencia significativamente menor del VHC en la diálisis peritoneal, que ésta podría estar indicada para los enfermos infectados por VHC, ya que, al ser una técnica domiciliaria, se obvia la transmisión nosocomial3,4,8.
No todos los pacientes infectados por el VHC presentan hepatopatía en el mismo tiempo (suele ser un período muy largo) ni presentan la misma viremia, y algunos autores han publicado artículos donde se analizan los 3 patrones de carga viral persistentemente positiva, fluctuante y persistentemente negativa, y se ponen en correlación con elevación y persistencia de aminotrasferasas. Se encuentra una carga viral significativamente mayor como signo de disfunción hepática en los pacientes con viremia persistentemente positiva10.
La carga viral en los pacientes con IRC es, en cualquier caso, baja respecto a los pacientes infectados por el VHC con función renal normal, lo que haría pensar en que la inmunodepresión producida por la IRC, la pérdida de carga viral en las hemodiálisis repetidas u otros factores de la técnica de hemodiálisis en sí (¿HGF?) podrían ser algún factor a considerar10,11.
Está descrito que la carga viral del VHC se modifica desde el comienzo al final de la hemodiálisis. Esto llevaría a preguntarnos si esta disminución podría dar aumento de la replicación o si se podría pensar que la hemodiálisis podría tener algún efecto a largo plazo al disminuir la carga viral12.
Por último, la introducción del sistema MARS en el año 2000, como tratamiento fundamentalmente de soporte previo previo al trasplante hepático en hepatopatías fulminantes o en hepatopatías muy evolucionadas, ha abierto un campo nuevo de alternativa de soporte para estos pacientes17-21.
Como ya comentamos, utiliza un sistema extracórporeo similar al de la hemodiálisis, salvo que el baño de hemodiálisis es albúmina que se regenera por el paso de filtros adecuados a lo largo de la sesión.
Permite eliminar sustancias tóxicas unidas a la albúmina, como ácidos biliares y bilirrubina, y otras sustancias hidrosolubles, como el amonio, mediante un mecanismo de adsorción a través de la membrana, utilizando la albúmina como transporte22-24.
El HGF es un potente estimulador de la proliferación del hepatocito, y se encuentra valores altos en relación con procesos de regeneración de daño hepático25-28. Asimismo existe evidencia de que este factor también está elevado en afecciones renales, fundamentalmente en ERC29-32.
La descripción de que la hemodiálisis conlleva una liberación del HGF (sin diferencias con las membranas de hemodiálisis), que es máxima a los 15 min del inicio, hace que se la haya implicado como posible mediador de efecto protector contra el desarrollo de la hepatopatía por VHC y que nos planteemos otras alternativas de tratamiento e indicaciones para los pacientes infectados por el VHC, para lograr proteger, en lo posible, contra el desarrollo de la IRC33,34.
Se ha publicado una relación entre la estimulación de HGF en la hemodiálisis, con un efecto atenuador del daño causado por el VHC6-9.
Se ha postulado, por otro lado, que es independiente del uso de heparina (no se modifica con su administración) y el HGF liberado se transforma rápidamente a su forma activa. El HGF liberado en la sesión de hemodiálisis se activa rápidamente por factores de coagulación que se han denominado zimógenos homólogos. Al finalizar la sesión queda aumento de pro-HGF y poco activado por depósitos en tejidos periféricos o reducida actividad zimógena. Que exista forma proactiva circulante explica la posibilidad de que pueda reactivarse en cualquier momento en tejidos lesionados.
Se han reseñado en un estudio de biopsias hepáticas en 11 pacientes sin IRC con anti-VHC+, y comparando el resultado histológico con el de 10 pacientes en hemodiálisis con igual fecha de seroconversión, que el grado de lesión histológica, fibrosis y apoptosis es menor en el caso de los pacientes en hemodiálisis en que se demuestra HGF aumentado8.
No obstante, en este estudio no se ha realizado un seguimiento en el tiempo, y no se ha valorado el tiempo que estos pacientes llevaban en hemodiálisis como posible estímulo crónico de la producción y la liberación del HGF (como ya hemos mencionado, sólo un autor refiere el tiempo en hemodiálisis como factor en la liberación del HGF)8,34.
La descripción de que la hemodiálisis conlleva una liberación del HGF, que se ha implicado como posible mediador de efecto protector contra el desarrollo de la hepatopatía por VHC, hace que nos planteemos otras alternativas de tratamiento e indicaciones para los pacientes infectados por el VHC para lograr proteger, en lo posible, contra el desarrollo de la IRC7,8,33.
Se han realizado estudios en los que se demuestra que la técnica de hemodiálisis en sí actúa produciendo una estimulación del HGF que ya es elevada a los 15 min, 240 min, y que persiste aumentado hasta 24 h después, similar a la IRC en tiempo 0 o el inicio de la hemodiálisis. Consta en un artículo que el tiempo en hemodiálisis puede ser un factor en la elevación del HGF en suero de pacientes, pues encontraron valores significativamente más altos en los pacientes que llevan 5-10 años que los que llevan 1 año o menos de 1 año en hemodiálisis. No obstante, en este estudio no se ha realizado un seguimiento en el tiempo, y no se ha valorado el tiempo que estos pacientes llevaban en hemodiálisis como posible estímulo crónico a la producción y liberación del HGF (como ya hemos mencionado sólo un autor refiere el tiempo en HD como factor en la liberación del HGF). Tampoco se refleja en este estudio si los pacientes han estado previamente a la seroconversión con viremia VHC mantenida o no.
En los resultados se pone de manifiesto que con las dos técnicas, MARS y hemodiálisis, se produce una disminución de la carga viral del VHC, así como una estimulación del HGF, que queda más elevado en las hemodiálisis más cortas y en el MARS.
Los posibles explicaciones a estos fenómenos son:
Una, en el MARS de los 2 pacientes estudiados, el que tenía VHC+ y hepatopatía alcohólica, pero le quedaba hígado con posibilidades de regeneración, los valores de HGF eran más altos, no así en el paciente en hemodiálisis (sin regeneración renal) con cirrosis de larga evolución (sin regeneración hepática).
Otra, en las hemodiálisis cortas no da tiempo a que la estimulación máxima a los 15 min se contrarreste con mecanismos contrarreguladores, que tardan unas horas en actuar (en la hemodiálisis de 4 h ya se ha contrarrestado y en 2.30 h, sólo parcialmente).
Como resumen final de la valoración realizada, podemos concluir:
1. Tanto en la hemodiálisis como en MARS se obtiene una disminución de la carga viral del VHC, que fundamentalmente debe atribuirse a atrapamiento en la membrana del dializador, ya que el virus no es capaz de pasar, salvo circunstancias especiales, la membrana.
2. En las dos técnicas se produce estimulación del HGF, y es necesario un tiempo tras ella para que bajen los valores, debido a que ciertos mecanismos contrarreguladores se ponen en marcha fisiológicamente para evitar efectos no deseados con estimulación alta.
3. Que las dos técnicas tengan en común un circuito extracorpóreo con un dializador y que se diferencien en el baño (hemodiálisis, baño de dializado habitual; MARS, baño sustituido por albúmina al 20%, que se regenera continuamente) hacen pensar que sea el paso de la sangre a través de la membrana del dializador lo que cause la disminución de la carga viral y del HGF.
4. Serían necesarios estudios más amplios para confirmar estos hallazgos, no descritos previamente y que podrían ayudar a explicar los efectos beneficiosos de ambas técnicas en pacientes VHC+.
Trabajo financiado por una Beca SEDYT al mejor proyecto de investigación.
Correspondencia: Dra. G. Barril.
Servicio de Nefrología. Hospital Universitario de la Princesa.
C/Diego de León, 62. 28006 Madrid. España.
Correo electrónico: gbarril@wanadoo.es