Introducción
La desnutrición en pacientes con insuficiencia renal (IR), fundamentalmente cuando ya han iniciado diálisis, tiene una alta prevalencia y una importante repercusión en la morbimortalidad total. Marcen et al 1, en una población de 761 pacientes de 20 hospitales de Madrid, en los que se analizaron parámetros bioquímicos y antropométricos, encontraron una prevalencia total de desnutrición del 80,6 % de los varones (el 31 %, de grado severo) y del 68,7 % de las mujeres (el 23 %, severa), con predominio de desnutrición proteínica en varones y calórica en mujeres. En estudio HEMO 2, respaldado por los National Institutes of Health (NIH) para establecer el efecto de la dosis de diálisis y permeabilidad de la membrana en la morbimortalidad, el 29 % de los pacientes incluidos tenían una cifra de albúmina plasmática < 3,5 g/dl, sin haber incluido a pacientes mayores de 80 años y/o cifras de albúmina < 2,8 g/dl. En el estudio DOPPS (Dialysis Outcome and Practice Patterns Study) realizado en 7 países (Estados Unidos, Japón, Francia, Alemania, Reino Unido, Italia y España), cuyo objetivo era determinar qué parámetros de diálisis se asociaban a un mejor pronóstico, un 18,9 % de los pacientes incluidos tenía desnutrición moderada-severa determinada por valoración global subjetiva (VGS) 3.
Son muchos los factores determinantes de la desnutrición en los pacientes en diálisis, algunos presentes ya en la fase de enfermedad renal crónica (ERC) como la anorexia, los trastornos digestivos, la comorbilidad asociada, alteraciones hormonales, acidosis metabólica, el entorno urémico, las dietas no controladas, etc. 4. Una vez iniciada la diálisis, se produce una mejoría general del paciente, incluidos los aspectos nutricionales, fruto de la corrección parcial de factores relacionados con el entorno urémico 5. Sin embargo, en algunos pacientes esta mejoría es transitoria o no llega a producirse al añadirse otros factores relacionados con la técnica de diálisis, como son una inadecuada dosis de diálisis que limita la depuración total de las toxinas urémicas, el grado de bioincompatibilidad del sistema (filtro, líneas, agua de diálisis, liquido de diálisis, catéteres, prótesis de Goretex, etc.) que desencadena una respuesta inflamatoria sistémica en mayor o menor grado y tener múltiples intercurrencias (infecciones, comorbilidad) que amplían esa reacción sistémica 4.
Por tanto, podemos decir que existen 2 tipos de desnutrición, dependiendo del grado de inflamación subyacente asociada, y es fundamental poder diferenciarlas para un tratamiento efectivo 6:
Desnutrición tipo I: cursa con cifras de albúmina ligeramente disminuidas, la ingesta proteinocalórica es baja, apenas hay comorbilidad, no hay datos de inflamación y los valores de proteína C reactiva (PCR) son normales. El gasto energético en reposo es normal. En este tipo de desnutrición, la intervención nutricional es eficaz y puede revertir la situación.
Desnutrición tipo II: cursa asimismo con valores de albúmina bajos, pero en este caso sí hay datos de inflamación asociada y las cifras de PCR están elevadas. El gasto energético en reposo está aumentado. Si la causa es sólo la inflamación subyacente, se denomina de tipo IIb; si además se acompaña de disminución de ingesta proteinocalórica se denomina de tipo IIa. En ambos casos la intervención nutricional no consigue una mejoría sustancial de la situación en tanto no se trate además el proceso inflamatorio subyacente.
La desnutrición implica un aumento de la morbimortalidad de los pacientes que se plasma en un aumento de los ingresos hospitalarios, con aumento de la estancia media, un aumento del número de infecciones y un aumento de la mortalidad fundamentalmente de causas cardiovasculares de hasta 8 veces respecto a la población normal. Esta mayor mortalidad cardiovascular tiene su origen en la alta prevalencia de factores de riesgo cardiovascular que inciden en estos pacientes (diabetes mellitus, hipertensión arterial, hipercolesterolemia e hipertrigliceridemia, hipertrofia ventricular izquierda [HVI], etc.), a los que se suma el efecto nocivo de la reacción inflamatoria subyacente en el endotelio, que conlleva una ateromatosis acelerada y que se ha denominado síndrome MIA (malnutrición, inflamación, ateromatosis) 7-9. Por todo ello, la valoración del estado nutricional de los pacientes en diálisis y en fase de ERC, debe ser incluida en el proceder habitual de seguimiento de estos pacientes y debe despertar el mismo interés y atención que el resto de los parámetros (hiperparatiroidismo, anemia, etc.).
Con el fin de establecer una metodología en la valoración, el seguimiento y la intervención del estado nutricional en los pacientes en diálisis, se ha elaborado el presente consenso, fruto del análisis amplio y minucioso de la literatura médica, que extrae unas recomendaciones del panel de expertos que compusieron el grupo de trabajo.
Áreas de consenso
El abordaje general de la nutrición de los pacientes en diálisis comprende 4 grandes áreas:
I.Valoración nutricional.
1. Historia clínica.
2. Exploración física.
3. Parámetros bioquímicos.
4. Análisis de la composición corporal.
II.Recomendaciones nutricionales.
III.Seguimiento y control evolutivo.
IV.Intervención nutricional.
1. Optimización de la diálisis.
2. Corrección de la acidosis.
3. Consideraciones nutricionales complementarias.
4. Otras intevenciones.
Valoración nutricional
Historia clínica
La historia clínica debe de incluir tanto aspectos generales del paciente como los específicamente nutricionales.
Historia clínica general
Debe de recopilar datos generales del paciente, comorbilidad asociada, procesos intercurrentes recientes o actuales que puedan ser de interés, tratamiento farmacológico actual, ejercicio físico y capacidad funcional y entorno social del paciente.
Historia clínica nutricional
Recoge aspectos relacionados con el estado nutricional como pérdida o aumento de peso, cambios en el apetito, alteraciones en el tracto digestivo, tales como trastornos de deglución, masticación, náuseas, vómitos, sensación se saciedad precoz, estreñimiento, diarrea, antecedentes de cirugías, intervenciones nutricionales previas, etc.
Historia dietética: debe ser realizada por un dietista-nutricionista (relación 1/100-150 pacientes) o en su defecto por un profesional entrenado, en una consulta con ambiente relajado y dedicándole el tiempo necesario (entre 30 y 90 min en la primera visita y 45-60 min en las sucesivas). En esta entrevista se ahonda en aspectos sobre hábitos de vida, sociales y gastronómicos que puedan determinar la nutrición del paciente (situaciones de riesgo de desnutrición específica y/o general) 10-18. Para conocer el consumo de alimentos y nutrientes del paciente existen fundamentalmente 3 métodos:
Recuerdo de 24 h (anexo I).
Cuestionario de frecuencia de consumo (anexo II).
Registro alimentario de 3 días (anexo III).
Lo ideal es realizar los 3 métodos para obtener una valoración general de la ingesta del paciente y de sus hábitos nutricionales. El registro de 3 días debe incluir un día de diálisis y un día de fin de semana. Se debe repasar con el paciente el diario con fotografías o modelos de alimentos para cuantificar mejor los alimentos. La ingesta de nutrientes se calcula a partir de un programa informático. Es la única fuente de información para conocer la ingesta calórica del paciente y de otros nutrientes distintos de las proteínas 11-18.
Exploración física
La exploración física general, las escalas de valoración global y el peso actual deben obtenerse siempre posdiálisis y sin edemas. La talla debe medirse una vez al año.
Exploración física general
Con especial atención a aspectos nutricionales como mucosas y anejos (pelo, uñas, aspecto de la piel, etc.).
Escalas de valoración global
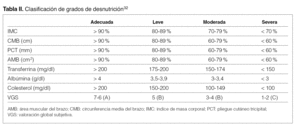
VGS (anexo IV): escala semicuantitativa con 5 criterios: cambio del peso últimos 6 meses, cambio en la ingesta diaria, síntomas gastrointestinales de más de 2 semanas de duración (anorexia, náuseas, vómitos, diarreas), deterioro en la capacidad funcional y exploración física para detectar pérdida de la grasa subcutánea (ojos hundidos, piel colgante alrededor de los ojos y en mejillas, pliegues de tríceps y bíceps), pérdida de la masa muscular (depresión alrededor de las sienes, músculo deltoides, clavícula prominente, linea axilar media de la pared lateral del torax, músculos interóseos de la mano, músculos del cuadríceps, rodilla y pantorrilla) y edemas (sacros, maleolares). Los 4 primeros se puntúan como A (normal), B (leve-moderada alteración) y C (alteración severa) y la exploración física se puntúa como 0 (normal), 1 (leve pérdida), 2 (pérdida moderada) y 3 (pérdida severa). De la valoración global se obtienen 3 grados de estado nutricional: A (estado nutricional correcto), B (desnutrición leve-moderada) y C (desnutrición severa) 14.
Escala de desnutrición para pacientes en diálisis (Dialysis Malnutrition Score: DMS) (anexo V): test cuantitativo con 7 variables: cambio de peso, cambio de la ingesta alimentaria, síntomas gastrointestinales, capacidad funcional, comorbilidad asociada, pérdida de la grasa subcutánea y pérdida de la masa muscular. Cada variable se valora en una escala de 1 (normal) a 5 (muy severa). La suma de todas las puntuaciones determina el grado de nutrición del paciente, que puede variar ente 7 (normal) y 35 (severamente desnutrido). Kalantar-Zadeh et al 15 encontraron mejor correlación con otros parámetros nutricionales y mejor clasificación de los pacientes que la VGS.
Escala de desnutrición-inflamación (Malnutrition Inflammation Score: MIS) (anexo VI): test cuantitativo que valora en general la nutrición y la inflamación. Añade al anterior (DMS) 3 parámetros (capacidad total de ligar hierro que representa la transferrina, albúmina e índice de masa corporal [IMC]) y por tanto valora en total 10 variables, con 4 niveles de severidad que varían de 0 (normal) a 3 (muy severo). La suma de todas las puntuaciones determina el grado de nutrición del paciente, que puede variar desde 0 a 30. Tiene mejor correlación que la VGS y el DMS con el resto de los parámetros nutricionales, la inflamación, la anemia y la morbimortalidad 14-16.
Talla, peso actual, IMC, porcentaje peso habitual y peso estándar o ideal
Tablas de referencia para la población española de Alastrué et al 17 de 1982 (anexo VII).
Parámetros bioquímicos
Combinación de parámetros para establecer el pool de proteínas viscerales y somáticas y tener una aproximación a la ingesta calórica y proteínica 18-21.
Proteínas viscerales
Albúmina: parámetro de valoración nutricional e indicador pronóstico de morbimortalidad. Influyen factores no nutricionales, que se debe investigar ante una hipoalbuminemia: infección, inflamación, hidratación, pérdidas diálisis, acidosis metabólica, etc. Valores de normalidad, 4-4,5 g/dl (se debe especificar el método de laboratorio).
Prealbúmina: es un parámetro válido de valoración nutricional que no demuestra mayor sensibilidad que la albúmina. En ERC el aclaramiento renal está disminuido, por lo que valores < 30 mg/dl indican déficit nutricional. Su vida media corta (2 días) puede ser de utilidad en la determinación seriada para detectar cambios rápidos del estado nutricional. Es fundamentalmente válido en pacientes en diálisis. Influyen los mismos factores no nutricionales que en la albúmina.
Transferrina: no es un adecuado parámetro de valoración nutricional en pacientes en diálisis por su dependencia del metabolismo del hierro; sí es adecuado en pacientes con ERC prediálisis sin tratamiento con EPO, hierro o pérdidas por dializador. Influyen factores no nutricionales. Se recomienda su medición directa, no calculada.
Proteínas somáticas
Creatinina sérica: proporcional a la masa muscular e ingesta de proteínas musculares. Al inicio de la diálisis, < 10 mg/dl implica realizar valoración nutricional del paciente.
Índice de creatinina: suma de la creatinina eliminada en orina y diálisis, el incremento del pool plasmático de creatinina y la tasa de degradación de creatinina. Se utiliza para el cálculo de la ingesta de proteínas musculares o para el cálculo de la masa muscular corporal libre de edema (magra). En pacientes con ERC estable, valores subestimados por la mayor excreción tubular y gástrica.
Tanto la creatinina sérica como el índice de creatinina están inversamente relacionados con la mortalidad.
Ingesta de proteínas
nPCR o nPNA, tasa de catabolismo proteínico o equivalente proteínico de aparición de N total, normalizada al volumen de distribución de urea/0,58, que se correlaciona con la masa corporal magra o libre de grasa. En pacientes con peso actual < 90 % o > 115 % del peso estándar (desnutridos u obesos respectivamente) y en pacientes edematosos, la normalización del PNA debe realizarse respecto al peso ajustado libre de edema para evitar resultados erróneos.
P ajustado = peso actual + [(peso estándar peso actual) x 0,25]
Limitaciones: sólo es determinación válida de la ingesta de proteínas cuando el paciente está estable. La nPNA puede sobrestimar la ingesta real de proteínas cuando ésta es < 1 g/kg/día o cuando el paciente está hipercatabólico (degradación de proteínas endógenas) y la subestima cuando la ingesta de proteínas es muy alta por las pérdidas no medidas 18.
Otros parámetros
PCR: identifica la presencia de inflamación. Valores elevados obligan a descartar procesos inflamatorios-infecciosos por el riesgo de desnutrición y cardiovascular que implica a medio-largo plazo (MIA). Si hay aumento de PCR, la albúmina pierde la especificidad como parámetro nutricional.
Colesterol: marcador nutricional poco sensible y específico, pero valores < 150 mg/dl obligan a la búsqueda de déficit nutricionales y comorbilidad. Fundamentalmente refleja la ingesta de energía. Predictor independiente de mortalidad en HD, siguiendo una curva en J (aumento de mortalidad si > 200 mg/dl o si < 150 mg/dl); no se ha demostrado esta relación con el colesterol bajo, en pacientes en DP.
Recuento linfocitos y neutrófilos, inmunidad retardada: como parámetros nutricionales en diálisis, tienen un significado incierto. Se ha observado un aumento del riesgo de mortalidad con linfocitos < 1.500/μl o neutrófilos > 2.800/μl.
Proteína transportadora del retinol: proteína visceral, no discrimina los bien nutridos de los mal nutridos.
Factor de crecimiento similar a la insulina tipo I (IGF-I), fibronectina, ribonucleasa: su relación no está bien establecida.
Bicarbonato: se debe medirlo periódicamente al inicio de la diálisis. La acidemia induce catabolismo de aminoácidos y proteínas, disminución de la síntesis de albúmina y efectos perniciosos en el metabolismo de la vitamina D y el hueso. Valores adecuados son > 22 mEq/l. Debe evitarse la alcalosis (> 27 mEq/l) por aumentar la intolerancia en la sesión HD y la mortalidad.
Otros: triglicéridos, urea, K+ y P complementan el panel de datos analíticos que ayudan a valorar el estado nutricional del paciente.
Análisis de la composición corporal
Existen varios métodos para la estimación de la composición corporal total, con grados variables de complejidad, disponibilidad y costo. Unos determinan los compartimientos corporales de forma directa y otros infieren a partir de unos datos iniciales.
Métodos indirectos
Antropometría: aporta información sobre las reservas proteínicas y energéticas, pero es poco sensible para detectar cambios agudos del estado nutricional. Es un método preciso, reproductible, estandarizado y que precisa de personal entrenado para disminuir la variabilidad. Es económico, dado que tan sólo precisa de un lipocaliper o plicómetro y una cinta métrica no deformable. Los parámetros que se obtienen son: pliegue cutáneo tricipital (PCT), pliegue cutáneo bicipital (PCB), pliegue cutáneo subescapular (PCsc), pliegue cutáneo suprailíaco (PCsil), circunferencia del brazo (CB) y tamaño de la estructura del esqueleto (Frisancho, NHANES II) 22. El IMC y los pliegues establecen la cantidad de grasa corporal; la circunferencia muscular y el área muscular del brazo valoran la masa muscular (anexo VIII). Los datos obtenidos se comparan con los correspondientes a la población general para determinar el percentil del paciente y su estado nutricional (tablas de población española, Alastrué et al, 1983 y 1988; Ricart et al, 1993; Esquius et al, 1993, con población anciana) 17,23-26. Los pliegues y la CB deben ser medidos posdiálisis, sin edemas, en el brazo contralateral a la FAVI o brazo no dominante en DP, con el paciente de pie o en su defecto sentado, el brazo totalmente descubierto para localizar las referencias anatómicas de medida. Tres medidas por pliegue, obteniéndose la media. Si entre dos medidas hay una diferencia > 0,5 mm en pliegues o 0,5 cm en CB, se debe realizar una cuarta medición y calcular la media de las cuatro 18.
Bioimpedancia eléctrica (BIA): método de análisis rápido y no invasivo de la composición corporal, basado en su versión más estándar, en la emisión de una corriente eléctrica alterna de múltiples frecuencias (> 100 kHz) o una sola frecuencia, de baja intensidad (50 kHz), que aplica una corriente eléctrica directamente proporcional a la impedancia (oposición al paso de esa corriente) eléctrica del material, en este caso el cuerpo humano. Existen fundamentalmente 2 versiones:
1. BIA convencional o multifrecuencia, en la que la aplicación de las ecuaciones que incluyen estatura, peso, edad y sexo trasforman la medida obtenida en volúmenes (intracelular y extracelular), masa libre de grasa, masa grasa, masa celular, metabolismo basal y otras variables de composición corporal.
2. BIA vectorial o monofrecuencia (BIVA). El resultado de la medida es un vector que se representa en una gráfica de distribución de la población sana de referencia, específica de sexo y cuya orientación varía en relación con las variaciones de hidratación y tejidos blandos. No precisa del dato del peso para los cálculos.
La BIA es un método de análisis de la composición corporal con resultados contrastados para la población sana adulta y normohidatada. La aplicación de este método en pacientes en diálisis ha dado lugar a resultados muy dispares, probablemente por la variación cíclica del estado de hidratación de estos pacientes. Actualmente es un instrumento muy útil para la valoración del estado de hidratación y el cálculo del peso seco; no obstante, en la actualidad la BIA vectorial (BIVA) precisa de una futura validación clínica que confirme su utilidad en análisis de la composición corporal y el estado nutricional de los pacientes en diálisis 18-20,27.
Métodos directos
Dosimetría (DEXA): método preciso de estimación de la composición corporal con menor influencia del estado de hidratación. Medida directa de masa grasa, masa libre grasa, masa y densidad mineral (superior a BIA, antropometría, K corporal total, índice creatinina). Sus limitaciones son su coste, espacio y que no distingue bien entre agua intracelular y extracelular. Recomendado para casos en los que se requiere medición precisa de la composición corporal, pero no para uso habitual 18-20.
Valoración del agua corporal total (dilución con deuterio): precisa de equipo complejo, es caro y sólo es factible experimentalmente y en investigación.
Nitrógeno corporal total: es el mejor método para cuantificar el contenido de proteínas corporales en pacientes con ERC y, por tanto, es método de referencia para comparar otros métodos.
Consenso en valoración nutricional
La valoración del estado nutricional de los pacientes con IRC, hayan iniciado la diálisis o no, debe ser incluida en la práctica habitual de control y seguimiento de estos pacientes, con igual atención que el resto de aspectos (evidencia C).
La valoración nutricional debe sustentarse en el análisis de una combinación de variables que evalúan aspectos distintos y complementarios del estado nutricional. No hay ningún parámetro que individualmente sea capaz de establecer el estado nutricional general y varios son los que están independientemente relacionados con la morbimortalidad (albúmina, creatinina, IMC, VGS) (evidencia C).
Es recomendable disponer de un dietista-nutricionista que realice la historia clínica nutricional, para valorar íntegramente el estado nutricional del paciente, detecte hábitos nutricionales de riesgo y realice su seguimiento y control evolutivo (evidencia C).
La exploración física debe realizarse siempre tras la diálisis y estando el paciente en su peso seco. La antropometría debe incluir el porcentaje del peso corporal habitual y del peso estándar, el IMC, los pliegues cutáneos y la circunferencia del brazo. Las tablas de referencia serán las de la población española (evidencia A).
El panel de datos analíticos se realizará siempre antes de la diálisis del día mitad de semana, tanto en la hemodiálisis convencional como en la hemodiálisis diaria; en diálisis peritoneal se realizará indistintamente cualquier día, salvo cambios de pauta en fin de semana (evidencia C).
El método ideal de análisis de la composición corporal es la DEXA, pero su coste y disponibilidad limitan su uso a estudios de investigación. La antropometría es una alternativa rápida, precisa y reproducible, con una alta correlación con los datos obtenidos por DEXA. La BIA es un método fundamentalmente válido para valorar el estado de hidratación; la BIVA está pendiente de validación clínica que confirme su utilidad en el análisis de la composición corporal y la nutrición de los pacientes en diálisis (evidencia A y B).
Recomendaciones nutricionales
Múltiples son las causas de desnutrición en los pacientes en diálisis, pero la falta de ingesta de nutrientes es probablemente de las más importantes. El gasto de energía (calorimetría indirecta) en reposo, tras ejercicio y tras ingesta es similar en pacientes con ERC, hemodiálisis y DP, comparado con población sana. Sin embargo, el consumo de energía durante la diálisis ha dado resultados dispares, así, para Kopple 28 no hay un aumento en el consumo de energía y, sin embargo, para Ikizler et al 29 sí se produce. Cuppari et al 30 encuentran por calorimetría indirecta que ciertos procesos coadyuvantes se acompañan de un aumento del consumo de energía (diabetes, un 12,5 %; hiperparatiroidismo, un 25 %; inflamación crónica, proporcional al grado de inflamación). Para Kopple 28, el aporte calórico mínimo para mantener un balance nitrogenado neutro o positivo es 35 cal/kg/día (30-35 cal/kg/día, si es mayor de 65 años) y el aporte proteínico, 1,2 g/kg/día en HD y 1,3 g/kg/día en CAPD. Partiendo de estas premisas, las recomendaciones nutricionales consensuadas en las guías K-DOQI 18, el Consenso Europeo 19,20 y las Guías de la Sociedad Americana de Dietética para el cuidado nutricional de pacientes renales 31 son:
Proteínas: HD, 1,2 g/kg/día; DP, 1,2-1,3 g/kg/día, en ambos casos el 50 % de alto valor biológico (proteínas de origen animal). Ajustar el tratamiento para el control del fósforo, colesterol y acidosis.
Energía: HD y DP, 35 kcal/kg/día; en mayores de 65 años u obesidad, 30 kcal/kg/día. En DP, cuantificar la glucosa absorbida desde peritoneo ([0,89 x g/día de glucosa deshidratada infundida] 43) y restringir azúcares simples (hipertrigliceridemia). En caso de estrés o actividad física importante, aumentar el aporte.
Vitaminas-minerales: ácido fólico, 1 mg/día; vitamina B6, 10 mg/día; vitamina C, 50 mg/día; vitamina E, 800 UI/día; vitamina B12, 5 mg/día; hierro, 10-18 mg/día; cinc y selenio.
Carnitina: 20 mg/kg post-HD intravenosa durante 4 meses para valorar respuesta en anemia resistente a EPO, debilidad muscular, arritmias y calambres intradiálisis e hipertrigliceridemia.
Sodio: individualizado, aproximadamente 2-3 g/día en HD y 2-4 g/día en DP.
Potasio: individualizado, aproximadamente 40 mg/ kg/día en HD; en DP restringir según datos laboratorio.
Fósforo: individualizado, menos de 15 mg/kg/día; puede requerir tratamiento con quelantes.
Calcio: aproximadamente 1.000-1.500 mg/día, pero individualizado en relación con cifras de fósforo, paratirina y dosis de vitamina D.
Líquidos: aproximadamente 500-750 ml/día por encima de la diuresis residual o 1.000 ml en anúricos en HD; individualizado en DP según balance de líquidos.
Los cálculos realizados en relación con el peso se refieren al peso ajustado cuando el peso actual está un 80 % por debajo o un 120 % por encima del peso estándar:
Peso ajustado = peso actual + ([peso estándar peso actual]x 0,25)
Consenso en recomendaciones nutricionales
En pacientes cuyo peso corporal es inferior al 95 % o superior al 115 % del peso estándar, se recomienda que el peso corporal utilizado para el cálculo de los aportes nutricionales sea el peso seco ajustado (evidencia C).
El aporte proteínico diario en pacientes en HD será de 1,2 g/kg/día (peso ajustado) y en DP, de 1,2-1,3 g/kg/día (peso ajustado). Al menos el 50 % de las proteínas ingeridas serán de alto valor biológico (origen animal, lácteos y huevos) (evidencia B).
El aporte calórico mínimo para garantizar una utilización adecuada del aporte proteínico será de 35 kcal/kg/día (peso ajustado), salvo en pacientes mayores de 60 años u obesos, que será de 30 kcal/kg/día (peso ajustado). En situaciones de estrés o aumento de actividad física, se deberá aumentar el aporte proporcionalmente (evidencia B).
Seguimiento y control evolutivo
Dada la alta prevalencia de desnutrición y su repercusión en la morbimortalidad de los pacientes, es preciso instaurar un adecuado seguimiento de los aspectos nutricionales para detectar precozmente a pacientes en riesgo o con déficit nutricionales y realizar una intervención nutricional precoz que consiga revertir la situación.
En este sentido es recomendable disponer de un dietista-nutricionista especializado en pacientes en diálisis, con una relación de 1 dietista por cada 100-150 pacientes 18. El primer contacto debería ser realizado precozmente, en el primer mes de la inclusión en diálisis, inicialmente intensivo (una vez al mes los primeros 2-3 meses) y posteriormente cada 4-6 meses o menos en caso de deterioro del estado basal, proceso intercurrente o desnutrición ya instaurada.
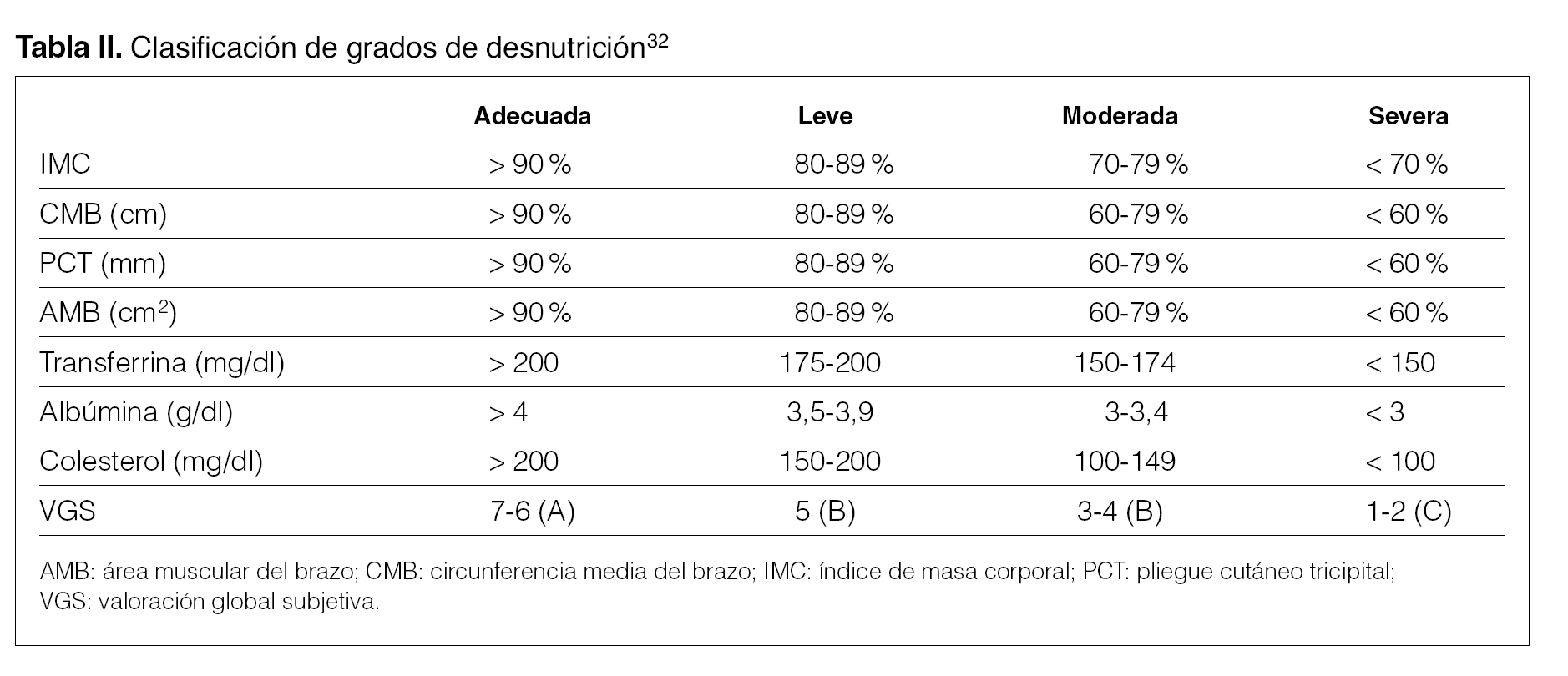
Las Guías K-DOQI 18 establecen 3 categorías de prioridad en el seguimiento evolutivo del estado nutricional en los pacientes en diálisis:
1. Control sistemático de todos los pacientes:
Porcentaje del peso habitual tras hemodiálisis o tras drenaje en DP del peso actual (mensual).
Porcentaje del peso estándar (población española) cada 4 meses.
Valoración global subjetiva (cada 6 meses).
nPNA (mensual en HD y cada 3-4 meses en DP)
2. Controles para confirmar o ampliar información:
Antropometría (cuando se considere necesario).
DEXA (cuando se considere necesario).
3. Controles clínicamente útiles que cuando están bajos indican la necesidad de un análisis más riguroso del estado nutricional:
Creatinina (cuando sea necesario).
Urea (cuando sea necesario).
Colesterol (cuando sea necesario).
El Consenso Europeo de Nutrición establece el seguimiento en 2 fases 19-21:
1. Parámetros que hay que analizar sistemáticamente:
Clínica: historia de pérdida de peso; porcentaje del peso estándar y porcentaje del peso habitual; IMC; evaluación clínica de músculo y grasa subcutánea; comorbilidades.
Bioquímica: albúmina, creatinina, bicarbonato, colesterol, PCR.
2. Parámetros para un análisis más detallado:
VGS.
Antropometría.
DEXA.
Tanto las Guías DOQI como el Consenso Europeo no incluyen la BIA ni el K+ como métodos para establecer el estado nutricional y la composición corporal en pacientes en diálisis.
Consenso en seguimiento y control evolutivo
Considerando las recomendaciones tanto de las Guías K-DOQI 18 como del Consenso Europeo 19-21, el Grupo de trabajo ha elaborado la tabla I, con una distribución de los parámetros nutricionales en dos prioridades, sistemática y confirmatoria. El objetivo principal de esta clasificación ha sido facilitar la inclusión de la valoración nutricional en la práctica habitual del seguimiento de estos enfermos, evitando incluir en una primera aproximación parámetros o determinaciones poco habituales. Para una correcta valoración nutricional, la historia nutricional debería ser realizada por un dietista-nutricionista especializado, pero en su defecto puede realizarla un nefrólogo entrenado para obtener una orientación de la situación nutricional del paciente. Debe conocerse asimismo en qué situación se encuentra nuestro paciente respecto a la población general (porcentaje del peso estándar), para lo cual en nuestro caso hay que recurrir a las tablas de población española 17,23-26.
Si en una evaluación habitual se obtienen datos que indican o establecen desnutrición, se debe realizar un análisis más amplio mediante antropometría, VGS o sus variantes de HD (MDS o MIS) o DEXA, según disponibilidad en cada caso. Esta evaluación permitirá confirmar los datos y clasificar al paciente en un percentil y/o grado de desnutrición para realizar una intervención nutricional proporcional a la situación del paciente (tabla II).
Intervención nutricional
La intervención nutricional debe iniciarse desde el momento que el paciente comienza la diálisis, mediante una valoración nutricional periódica y protocolizada que detecte precozmente cambios que indiquen desnutrición o riesgo de desnutrición. La intervención nutricional más eficaz es la prevención mediante la instauración de medidas que eviten situaciones de riesgo de desnutrición: ayudar a realizar el cambio de esquema alimentario que el paciente debe realizar cuando pasa de situación de ERC a diálisis, evitar tiempos de ayuno prolongados y muchas veces innecesarios (análisis, pruebas complementarias, etc.), evitar dietas restrictivas durante procesos intercurrentes, prescribir siempre la diálisis óptima para cada paciente, etc. Una vez que la desnutrición está ya establecida, además de seguir con las medidas anteriores, es preciso instaurar intervenciones específicas y proporcionales a la situación y el grado de desnutrición del paciente.
Optimización de la diálisis
Es el primer paso en toda intervención nutricional de un paciente con desnutrición, dada la relación directa entre Kt/V y nPNA 33. El término optimización se refiere tanto a la dosis de diálisis como a la calidad de la diálisis en lo referente a la máxima biocompatibilidad de todo el sistema (dializador, agua tratada, líquido de diálisis, esterilizante, líneas, etc.).
En hemodiálisis, la dosis mínima de diálisis recomendada es un Kt/V monocompartimental (spKt/V) de 1,2 (correspondiente a un Kt/V equilibrado, eKt/V de 1,0). Sin embargo, el spKt/V prescrito que garantice ese spKt/V recomendado debe ser de 1,3-1,4 34-36. La Sociedad Europea de Diálisis y Trasplante recomienda incluso un spKt/V mínimo de 1,4 (eKt/V, 1,2) 37. En pacientes con desnutrición marcada, el Kt/V puede estar exagerado por un volumen de distribución pequeño por el bajo peso; por ello, en estos pacientes hay que garantizar Kt/V incluso más altos 38.
En diálisis peritoneal, la dosis de diálisis se determina por 2 parámetros: el Kt/V semanal total (peritoneal más la función renal residual), que para CAPD se recomienda sea de 2, y el aclaramiento semanal de creatinina, que se recomienda sea de 50-60 l/semana, según corresponda a alto o bajo transportador 39.
La biocompatibilidad del sistema de diálisis determina una reacción inflamatoria sistémica, lo que conlleva un estado catabólico mantenido que favorece la desnutrición. Asimismo, procesos intercurrentes añadidos, como infecciones agudas y/o crónicas larvadas y enfermedades inflamatorias de base, añaden mayor o menor intensidad a ese proceso sistémico. En pacientes con riesgo de desnutrición y sobre todo con desnutrición ya establecida, es necesario buscar la máxima biocompatibilidad del sistema, la máxima pureza del agua de tratamiento y detectar cualquier foco de infección (catéteres de diálisis, injertos de Goretex, periodontitis, etc.), para a reducir al mínimo la reacción inflamatoria sistémica que favorece la desnutrición 40-42.
La hemodiálisis diaria, tanto diurna como nocturna, está revelando resultados excelentes en lo referente a una mejoría del estado nutricional de los pacientes, manifestado por un aumento del peso corporal, mayor nPNA, mayor ingesta calórica por una clara mejoría del apetito y una elevación de las cifras de albúmina 43-45.
Corrección de la acidosis
La acidosis metabólica favorece la degradación de las proteínas musculares y aumenta la oxidación de aminoácidos. La acidosis metabólica puede tratarse aumentando la concentración de bicarbonato del líquido de diálisis, administrando bicarbonato oral o una combinación de ambos. Se debe mantener valores de bicarbonato normales, 22-26 mEq/l (en gasometría), evitando la alcalosis metabólica tras la diálisis que puede condicionar cefaleas, calambres musculares, hipoventilación y disminución del calcio iónico 18,21. En pacientes en DPCA, se puede aumentar la concentración de lactato del líquido de diálisis de 35 a 40 mEq/l, asociando o no bicarbonato oral hasta alcanzar la concentración plasmática de bicarbonato deseada 46.
Consideraciones nutricionales complementarias
Es esencial que en la realización de la historia nutricional se detecte las alteraciones en los hábitos, los excesos o las carencias nutricionales; se debe evaluar especialmente la ingesta alimentaria del día de diálisis (en hemodiálisis), dado que es habitual, sobre todo en los pacientes que se dializan en el turno intermedio, que la comida principal del día no se realice o se realice de forma incompleta. Una vez analizado individualmente el paciente, hay que establecer una intervención específica para él.
Medidas generales
Cambio de horario, mejora del entorno para comer, eliminar alimentos que son claramente rechazados, disminuir el volumen de comida y aumentar la frecuencia, incluso liberar la dieta y añadir sal en pequeña cantidad si eso puede favorecer una mayor ingesta, suplementar cada comida con alimentos de alta concentración de proteínas y/o alta densidad calórica (clara de huevo, aceite de oliva, etc.). Obviamente, el refuerzo nutricional va a exigir un control analítico más frecuente y en algunos casos realizar cambios en la pauta de diálisis 47,48. Es recomendable evitar en pacientes desnutridos o en riesgo de desnutrición, así como en diabéticos, que las sesiones de HD se realicen en el turno intermedio, por su interferencia con la comida principal.
Si la desnutrición es leve o tan sólo se trata de un paciente con riesgo de desnutrición, la intervención anterior puede ser suficiente, pero en caso de desnutrición moderada o en un paciente con desnutrición leve en situación de hipercatabolismo por un proceso intercurrente, es preciso, además de las anteriores consideraciones, pautar una suplementación nutricional, con suplementos caseros o comerciales 48.
Suplementación enteral (anexo IX)
Es la administración de nutrientes de forma oral o por una sonda enteral, dependiendo de la situación del paciente. Las recomendaciones generales para el uso de nutrientes enterales son:
Si la nutrición enteral va a ser la única fuente de alimentación, se debe emplear fórmulas completas que aporten los 3 principios inmediatos y las necesidades diarias de vitaminas y minerales. Si tan sólo se va a realizar una suplementación nutricional, se puede utilizar tanto fórmulas completas como suplementos nutricionales (no contienen todos los minerales y vitaminas diarios necesarios) o incluso módulos de los nutrientes específicos que queramos complementar (hidratos de carbono, lípidos, proteínas, vitaminas, oligoelementos, minerales).
Si hay disfunción del tracto digestivo, es preferible utilizar fórmulas oligoméricas o monoméricas cuyos componentes están parcialmente digeridos; en caso contrario, se puede utilizar fórmulas poliméricas.
En pacientes en diálisis, es recomendable la utilización de fórmulas con alta densidad calórica para administrar el menor volumen de líquidos posible.
Existen fórmulas y módulos enterales especiales para pacientes con ERC y diálisis, que están adaptados a las necesidades específicas de estos pacientes (alta densidad calórica, contenido bajo en potasio, sodio y fósforo) y fórmulas estándar que también pueden ser utilizadas por su adecuada composición para estos pacientes.
Una limitación en la utilización de estos preparados comerciales es el pobre cumplimiento del paciente, bien por intolerancia digestiva, bien por su sabor poco agradable. Por ello, se recomienda indagar periódicamente si el paciente está tomando los preparados y, en caso de incumplimiento de la pauta, averiguar la causa. Si el sabor es el problema, se puede añadir al preparado canela, café soluble en mínimas cantidades u otros saborizantes. Si la causa es la intolerancia digestiva, se debe de descartar el concurso de factores distintos del preparado que puedan estar favoreciendo esa intolerancia, evitando en la medida de lo posible tener que suspenderlos.
Si está previsto que el paciente precise tomar fórmulas enterales durante mucho tiempo, es frecuente el cansancio y esto favorece el abandono. Se recomienda el cambio alternativo de sabores dentro del mismo preparado, la alternancia de preparados e incluso se puede preparar recetas con estos productos: flanes, mousses, helados, etc.
Nutrición parenteral intradiálisis (NTPID)
Es la administración de nutrición artificial durante la sesión de diálisis a través del retorno venoso del sistema de diálisis (cámara venosa). Por norma general, no debe iniciarse un tratamiento con NTPID en tanto no se haya realizado una pauta previa de suplementación nutricional vía oral y ésta haya sido insuficiente o inviable por intolerancia.
Tiene como principal ventaja que no precisa una vía venosa específica, ya que se utiliza el sistema de diálisis y el volumen administrado se ultrafiltra durante la sesión; su desventaja es que sólo se realiza 3 veces por semana por tanto, es un complemento nutricional y el aporte calórico total administrado por sesión está limitado fundamentalmente por el límite en la utilización hepática de la glucosa de 4 mg/kg/min. Se recomienda aumentar el tiempo de la sesión de diálisis a un mínimo de 4 h en pacientes a los que se instaura NTPID.
La composición estándar recomendada es:
Proteínas: 1,2 g/kg, administrando mezcla de aminoácidos esenciales y no esenciales.
Calorías: 15 kcal/kg, administrar hidratos de carbono a la máxima concentración para utilizar el mínimo volumen (glucosa al 40-70 %). La administración de lípidos es opcional pero recomendable, porque en poco volumen se administra un número importante de calorías, preferiblemente triglicéridos de cadena larga. La proporción de calorías no proteínicas por gramo de nitrógeno debe ser de 1/110-150 kcal. De cualquier manera, la densidad calórica máxima será de 1 kcal/ml. Durante la infusión en la sesión de hemodiálisis es preciso realizar un control de la glucemia al inicio, a la mitad y al final de la sesión, para ajustar la dosis de insulina. Con el fin de evitar la hipoglucemia, se recomienda dar un alimento 20-30 min antes de finalizar la infusión de NTPID.
Se debe de considerar el porcentaje de pérdida de aminoácidos durante la sesión de HD, mayor cuanto mayor sea la permeabilidad de la membrana (el 64 y el 47 %) y menor cuanto mayor sea la velocidad de infusión 49.
La administración de NTPID está indicada en pacientes que presentan las siguientes características 50:
Albúmina < 3 g/dl o < 3,5 g/dl si la creatinina es < 8 mg/dl en los últimos 3 meses.
Disminución del peso habitual > 10 % y/o disminución > 20 % del peso ideal en los últimos 6 meses.
Valoración global subjetiva estándar o modificada de desnutrición moderada-severa.
Por lo general, es preciso mantener el tratamiento de NTPID al menos durante 4 meses e incluso 1 año para valorar realmente un beneficio en los parámetros nutricionales. Varias publicaciones han evaluado la eficacia de este tratamiento tanto en los parámetros nutricionales clínicos, analíticos y antropométricos como en la morbimortalidad de los pacientes a medio y largo plazo. Sin embargo, de los estudios publicados, pocos tienen suficiente rigor metodológico como para extraer conclusiones de peso, ya sea por los criterios de selección de los pacientes, la falta de aleatorización, el escaso número de casos tratados, los parámetros tan dispares analizados, etc., pero salvo escasas excepciones, en todos ellos se obtiene un beneficio a medio plazo en la mayor parte de los parámetros nutricionales evaluados 47,50,51. Asimismo, en los estudios que analizan el beneficio del tratamiento en la morbimortalidad, en general hay una disminución en la tasa de hospitalizaciones y en la mortalidad total a medio y largo plazo en los pacientes en quienes se instaura la NTPID con cifras de albúmina por debajo de 3,5 mg/dl 50,52.
Solución de aminoácidos en diálisis peritoneal (DP)
En pacientes en DP con desnutrición moderada-severa y escasa ingesta de proteínas, se puede utilizar 1 o 2 veces al día solución de DP de aminoácidos al 1-1,1 %, siempre en el período diurno y asegurando un adecuado aporte calórico para que los aminoácidos absorbidos (90 %) puedan ser adecuadamente utilizados 53,54.
Otras intervenciones
Además de las anteriores intervenciones, hay otras cuyos beneficio y aplicación en alguna de ellas es aún experimental y, por tanto, su recomendación no está claramente establecida 55.
Corregir la anemia
La mejoría de la anemia se acompaña de mejoría general del paciente, aumento del apetito y del estado nutricional 21.
Carnitina
La suplementación regular de carnitina mejora el metabolismo de los lípidos y la utilización de las proteínas, aumenta el nPNA y los valores de albúmina sérica, pero no se acompaña de cambios en la grasa corporal; además, disminuye la resistencia periférica a la EPO, los calambres intradiálisis, los episodios de hipotensión durante las diálisis, la debilidad muscular. Se recomienda una pauta de tratamiento corta, que se deberá suspender a los 3 meses en caso de que no haya mejoría. Es preferible el tratamiento por vía intravenosa tras hemodiálisis en dosis de 20 mg/kg, dada la escasa biodisponiblidad de la vía oral (15 %) y la ausencia de efecto muscular por esta vía 18,56,57.
Fármacos que aumenten la motilidad intestinal
Metoclopramida, cinitraprida, cleboprida y domperidona favorecen la evacuación gástrica y disminuyen la sensación de plenitud.
Estimuladores del apetito
Varios son los fármacos que de una u otra manera estimulan directa o indirectamente el apetito (sulfato de hidralazina, metoclopramida, prednisolona, ciproheptadina, etc.), pero el mejor evaluado, fundamentalmente por la experiencia en pacientes con cáncer y sida, es el acetato de megestrol en dosis de 40-160 mg/día, que ha demostrado aumentar el apetito y los parámetros nutricionales (pliegues, peso, albúmina) 58,59.
Anabolizantes
La uremia produce una resistencia periférica a hormonas anabólicas (hormona del crecimiento, insulina, IGF-I, etc.). La utilización de estas hormonas ha demostrado un beneficio en los parámetros nutricionales:
Decanoato de nandrolona: ampliamente utilizado como tratamiento inicial de la anemia en la era previa a la EPO, produce un aumento de la expresión del ARN mensajero del receptor androgénico en el músculo esquelético, un aumento del uso intracelular de aminoácidos derivados de la degradación de proteínas y una estimulación de la síntesis neta de proteínas musculares; además inhibe el catabolismo proteínico mediante la interacción con el receptor de glucocorticoides. La dosis utilizada varía de 25 mg/semana o 100 mg/cada 15 días intramuscular durante 6 meses. Su utilización favorece un aumento del peso y una mejoría de la anemia. Los efectos secundarios más destacables son disminución de HDL, virilización, hirsutismo y reglas irregulares en mujeres, atrofia testicular e infertilidad en varones; asimismo, favorece un estado de hipercoaguabilidad y causa riesgo de carcinoma hepatocelular y cardiopatía 47,60.
Somatotropina (GH): varios estudios recientes han sido publicados referentes a la utilización de la GH en el tratamiento farmacológico de la desnutrición, en los que en general los resultados revelan que se produce una clara mejoría de los parámetros antropométricos y bioquímicos e inmunidad. La dosis utilizada en dichos estudios es variable, pero la más recomendada es 0,05 mg/kg/día por vía subcutánea. Son estudios con un volumen de pacientes, tiempo de seguimiento y diseño insuficientes para recomendar en la actualidad su uso habitual. Además, presentan importantes efectos secundarios de hipoglucemia, alteración mental, arritmia cardíaca, náuseas y riesgo de favorecer el crecimiento de tumores 47.
Insulina: su administración induce un aumento de la síntesis de proteínas y de la utilización celular de glucosa. Por lo general se utiliza en pacientes ingresados y con NTP continua.
Ejercicio físico
Realizado de forma regular, mejora la utilización de las proteínas y el balance de nitrógeno y favorece un aumento de la masa muscular.
Fármacos antiinflamatorios
Los pacientes en diálisis presentan una alta prevalencia de inflamación crónica y, como posibles estrategias para actuar contra ella, se describen 47:
Estatinas: se ha descrito que la utilización de 20 mg/ día durante 8 semanas produce una disminución del colesterol y PCR y un aumento de la albúmina.
Inhibidores de la ECA: han mostrado propiedades antiinflamatorias tanto en la población general como en pacientes con IRC y son futuros candidatos al tratamiento de la desnutrición en pacientes en diálisis.
Vitamina E: tiene efectos antiinflamatorios y pudiera contribuir a disminuir la mortalidad cardiovascular en pacientes en diálisis, a la vista de algunos estudios epidemiológicos en la población general, que no ha confirmado el estudio HOPE.
Anticuerpos anticitocinas (anticuerpos anti-TNF-a, antagonistas de los receptores de IL-1, IL-6 y TNF-a): utilizados en enfermedades depauperantes como artritis reumatoide o insuficiencia cardíaca crónica, mejoran los parámetros inflamatorios y la situación clínica, pero no se han utilizado en pacientes en diálisis.
Consenso en intervención nutricional
La intervención nutricional debe iniciarse desde el primer momento que el paciente comienza la diálisis, con una evaluación inicial y un seguimiento periódico y protocolizado. La prevención es el mejor tratamiento: evitar todos los factores que impliquen riesgo de desnutrición (evidencia C).
La optimización de la diálisis es el primer paso en toda intervención nutricional, para garantizar en HD un spKt/V ≥ 1,4 (eKt/V ≥ 1,2) y en DP un Kt/V semanal≥ 2 y un aclaramiento semanal de creatinina de 50-60 l. Además se debe alcanzar la máxima biocompatibilidad del sistema y controlar focos crónicos de infección para reducir al mínimo la reacción inflamatoria sistémica (evidencia B).
Se debe corregir la acidosis metabólica hasta alcanzar valores de bicarbonato plasmático de 22-26 mEq/l, bien aumentando el bicarbonato en el líquido de diálisis, bien administrando bicarbonato oral (evidencia A).
En pacientes con riesgo de desnutrición o desnutrición establecida leve, puede ser suficiente recomendar cambios de horarios y hábitos y reforzar la dieta con alimentos de alta densidad proteínica y calórica (evidencia C).
En pacientes con desnutrición leve durante procesos intercurrentes o desnutrición moderada, es preciso, además de las anteriores medidas, aportar suplementos nutricionales, preferiblemente en forma de fórmulas especiales para IR, dada su composición específica, si bien también se puede utilizar fórmulas estándar cuya composición permite usarlas en estos pacientes (evidencia C).
En pacientes con desnutrición severa, desnutrición moderada con intolerancia digestiva a los suplementos nutricionales o durante procesos intercurrentes, se debe instaurar una pauta de nutrición parenteral intradiálisis (NTPID) manteniendo todas las medidas anteriores. Los mejores resultados en la morbimortalidad se obtienen cuando la albúmina sérica es < 3 g/dl. La duración mínima de la sesión de diálisis debe ser de 4 h y el tratamiento, por lo general, se debe mantener entre 4-12 meses para obtener resultados (evidencia B).
En DP, la administración de aminoácidos intraperitoneales se debe acompañar de un suficiente aporte calórico oral para la máxima utilización de los aminoácidos absorbidos, y el tiempo de permanencia del intercambio debe ser de 4-5 h (evidencia A).
Otras intervenciones, como la corrección de la anemia y la realización habitual de ejercicio físico, contribuyen a mejorar el estado nutricional. En pacientes con resistencia a la EPO, debilidad muscular y/o síntomas en diálisis, se puede realizar una pauta de 4 meses de tratamiento con carnitina intravenosa en dosis de 20 mg/kg post-HD. Los fármacos que aumentan la motilidad intestinal y los estimuladores del apetito pueden contribuir a una mayor ingesta total (evidencia C).
No hay datos suficientes para recomendar la utilización de la GH como anabolizante, y queda de momento relegada a uso experimental. El decanoato de nandrolona (25 mg/semana o 100 mg/15 días por vía intramuscular) se ha utlizado y se utiliza como tratamiento de la anemia, lo que consigue una mejoría del estado nutricional. Su utilización obliga a evaluar periódicamente sus efectos secundarios (evidencia C).
Actualmente, se está investigando el efecto de fármacos con propiedades antiinflamatorias en el proceso de inflamación crónica de los pacientes en diálisis; algunos de ellos son de uso habitual en estos pacientes (estatinas e inhibidores de la ECA), pero otros están en una fase claramente hipotética y, por tanto, su utilización no puede ser recomendada (GH) (evidencia C).
Correspondencia:
Dra. E. Huarte-Loza.
Servicio de Nefrología. Hospital San Millán.
Avda. La Rioja, 3. 26004 Logroño. La Rioja. España.
Correo electrónico: ehuartel@senefro.org