Introducción
En la actualidad, la diálisis peritoneal (DP) es una de las modalidades de tratamiento sustitutivo de la insuficiencia renal crónica final. Presenta una supervivencia (SV) de pacientes similar a la de la hemodiálisis (HD) cuando las poblaciones se ajustan a los principales factores de comorbilidad (edad, diabetes y enfermedad cardiovascular), tanto en estudios poblacionales amplios de registros multicéntricos 1 como en estudios referidos a un único centro con amplia experiencia en ambos tratamientos 2.
La SV de la técnica se define como la permanencia en DP de los pacientes hasta que son excluidos por transferencia a HD por cualquier causa, censurando a aquellos que abandonan el tratamiento porque recuperan función renal, reciben trasplante o fallecen, es decir, es el mejor pronóstico posible para el tratamiento con DP.
Aunque en los últimos años la SV de la técnica ha mejorado sustancialmente, en la mayoría de los estudios está por encima del 50 % a los 5 años 3, sigue siendo francamente inferior a la SV de la técnica de HD, que se refiere en los últimos estudios en un 93-95 % a los 3 años 4,5.
Las principales causas del fallo de la DP son la pérdida de ultrafiltración (UF), la diálisis inadecuada y las peritonitis 3,4.
Esta pérdida de la UF y el desarrollo de diálisis inadecuada según el tiempo en DP se deben a un daño progresivo en la estructura de la membrana peritoneal. Aunque determinados factores influyen en esta lesión de la membrana, como por ejemplo las peritonitis, es la bioincompatibilidad de diversos componentes de las soluciones a los que se expone el peritoneo durante el tratamiento lo que más se relaciona con el daño (fig. 1). Esto conduce a un incremento progresivo de la permeabilidad, con rápida disipación del gradiente osmótico y una aparición gradual de una inadecuada diálisis 6. Cuando este fallo de UF se desarrolla, es necesario incrementar las dosis de soluciones hipertónicas, que a su vez exacerban la disfunción de la membrana peritoneal, traducción clínica del daño estructural producido en ésta a largo plazo: alteración de la microcirculación peritoneal (neoangiogénesis), alteraciones leucocitarias y en los mecanismos de defensa, aumento de la estroma por fibrosis y pérdida de mesotelio (fig. 2) 7.
Figura 1. Factores de bioincompatibilidad de las soluciones convencionales de diálisis peritoneal.
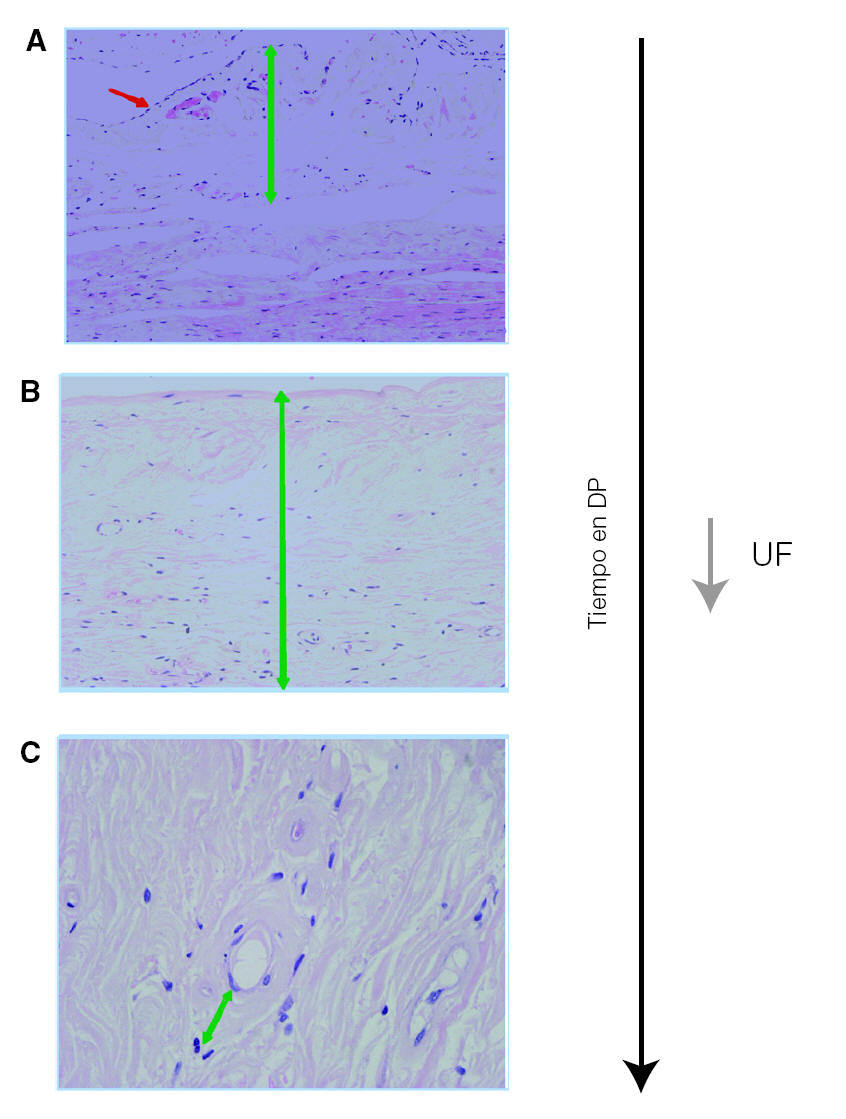
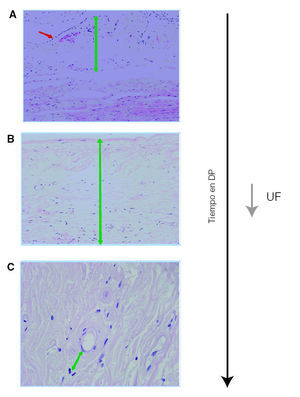
Figura 2. Las alteraciones estructurales del peritoneo a largo plazo conducen a una hiperpermeabilidad y a una disminución de la ultrafiltración. A) Peritoneo normal; línea mesotelial conservada (flecha roja) y espesor normal de la estroma. B) Pérdida del mesotelio e importante aumento de la estroma por fibrosis (flecha verde). C) Neoangiogénesis con vasos de pared engrosada por hialinosis (flecha verde). DP: diálisis peritoneal; UF: utrafiltración.
Las altas concentraciones de glucosa favorecen esta toxicidad en el peritoneo. Este daño se produce por distintas vías, como son el estrés osmótico, las vías de los polioles, el estrés oxidativo, la producción directa de productos avanzados de la glucosilación (AGE) y la síntesis de medidadores de la inflamación y el crecimiento (factor beta 1 transformador de crecimiento [TGFβ1]; factor de crecimiento vascular endotelial [VEGF]). Todo ello lleva a fenómenos de inflamación, fibrosis, apoptosis de la estructura celular de la membrana peritoneal, neoangiogénesis y alteraciones diabetiformes de los microvasos peritoneales (fig. 3) 8,9.
Figura 3. Mecanismos fisiopatológicos de la toxicidad peritoneal de las altas concentraciones de glucosa y pruducto de la degradación de la glucosa (PDG) (modificado de Holmes 8). AGE: productos avanzados de la glucosilación; DP: diálisis peritoneal; TGFβ1: factor beta 1 transformador del crecimiento; VEGF: factor de crecimiento vascular endotelial.
De igual forma, los PDG producidos durante la esterilización por calor y el almacenamiento de las bolsas de diálisis son tóxicos para las células peritoneales e inducen la formación de productos de AGE aún de forma más rápida que la glucosa misma 10.
Son los pacientes con un alto transporte de pequeños solutos los que más cantidad de glucosa utilizan y más riesgo de lesionar la membrana peritoneal presentarán. El daño en la estructura del peritoneo lo hará más permeable a la dextrosa, y serán necesarias soluciones cada vez más hipertónicas, dando lugar a un círculo vicioso que empeora con el tiempo de permanencia en este tratamiento (fig. 4) 11.
Figura 4. Correlación entre la exposición a la glucosa y el transporte de solutos: el grupo que mayor dosis de glucosa ha recibido durante el tratamiento en diálisis peritoneal (DP) presenta un incremento en la media del transporte de solutos medida por el cociente de creatinina dializado/plasma (D/P). Modificado de Davis et al 11.
Todo esto se traduce clínicamente en un fallo de la UF, manifestado por hipertensión arterial (HTA), edemas, sobrecarga e hipertrofia de ventrículo izquierdo.
Otros componentes de las soluciones clásicas usar como tampón el lactato, el bajo pH (necesario para evitar la caramelización de la glucosa durante la esterilización por calor) o la elevada osmolaridad, aunque en menor grado, han sido relacionados con algunas de estas alteraciones. La combinación del pH bajo y el lactato parece ser más tóxica in vitro por el descenso del pH intracelular que en los pacientes, donde al mezclarse con el volumen residual conduce a una elevación rápida de éste. En todo caso, el pH bajo causa algunas de las molestias que refieren los enfermos a la infusión de estas soluciones, lo que indica sin ninguna duda cierta bioincompatibilidad 12.
Además de todo esto, las altas concentraciones de glucosa pueden llevar a hiperglucemia, hiperinsulinemia y disminución del glucagón, todos ellos conocidos efectos que aumentan el riesgo de obesidad y arteriosclerosis en la población general 13.
¿Cómo pueden ayudar las nuevas soluciones a preservar el peritoneo?
Son tres los puntos donde inciden las nuevas soluciones. En primer lugar, la supresión de PDG durante la fabricación y el almacenamiento de las bolsas; en segundo lugar, la reducción a la exposición de la glucosa y, por último, la utilización de un tampón más fisiológico, como el bicarbonato.
En la actualidad la fabricación de bolsas bicamerales ha permitido que soluciones basadas en la glucosa como agente osmótico tengan un contenido extremadamente bajo en PDG, al esterilizar la glucosa separada de todos los demás componentes de la solución a un pH más ácido. Pero debido a esta gran acidez, no se podría infundirla a los pacientes, salvo que se añada un tampón químico capaz de conseguir un pH más biocompatible. Esto se consigue utilizando bolsas de doble cámara, donde el segundo compartimento contiene un pH lo bastante alto para compensar el extremadamente bajo de la cámara que contiene la glucosa.
Las soluciones bicamerales con pocos PDG pueden estar tamponadas con lactato 14, una combinación de bicarbonato/lactato o sólo con bicarbonato, todas ellas con pH superior al de las convencionales, 6,3 (lactato) o 7,4 (bicarbonato/lactato y bicarbonato) (fig. 5). In vitro, todas estas soluciones han demostrado una mejor biocompatibilidad 15-17. En estudios clínicos aleatorizados y con grupo control de pacientes prevalentes en diálisis peritoneal continua ambulatoria, estas soluciones se asocian a un aumento del antígeno CA125 y una disminución de hialuronato 18. Se considera que lo primero es reflejo de la masa celular mesotelial y su recambio en los pacientes en DP 19, mientras el hialuronato puede reflejar inflamación peritoneal.
Figura 5. Nuevas soluciones más biocompatibles en diálisis peritoneal. A la izquierda, soluciones que usan como agente osmótico la glucosa, bicamerales, con baja concentración de productos de degradación de la glucosa (PDG) y tamponadas con bicarbonato, bicarbonato/ lactato o sólo lactato. A la derecha, las soluciones que usan un agente osmótico distinto de la glucosa y con nula o escasa concentración de PDG.
Con respecto a los probables beneficios clínicos de las soluciones bicamerales con pocos PDG, como aumentar el tiempo de permanencia de los pacientes en DP, prevenir o evitar el empeoramiento de la comorbilidad (p. ej., diabetes, arteriosclerosis) o, lo más importante, disminuir la comorbilidad y mortalidad relacionadas con la DP, no existen estudios a largo plazo que así lo ratifiquen. Sin embargo, hay algunas evidencias muy prometedoras con soluciones con glucosa y pocos PDG, tamponadas con bicarbonato/lactato (Physioneal®) 20 o sólo bicarbonato (Bicavera®) 21, que han demostrado una menor tasa de peritonitis e incluso una menor duración de los episodios. Con respecto a la función renal residual (FRR), en el estudio EuroBalance 17 (estudio aleatorizado, abierto, prospectivo, cruzado) que comparó una solución convencional con la solución Balance® (bicameral, pocos PDG y lactato como tampón), se ha constatado una mejor conservación de la FRR y un ligero aumento del transporte peritoneal medido por el cociente dializado/plasma de creatinina a las 4 h. No se puede descartar la posibilidad que esta mejor FRR pudiera ser secundaria a una situación de sobrehidratación producida en estos pacientes por una menor UF, secundaria a este aumento en el transporte peritoneal (fig. 6). Por último, y en otro estudio que de nuevo ha comparado estas 2 soluciones, pero en este caso utilizando los datos de un registro sobre 2.000 pacientes en Corea, se refiere una ventaja significativa en la SV de los pacientes tratados con la solución más biocompatible con pocos PDG y pH neutro 22 (fig. 6). A este estudio se le puede hacer todas las críticas derivadas de ser un estudio observacional retrospectivo y deja abierta la necesidad de un estudio aleatorizado, prospectivo y controlado más adecuado para obtener esta evidencia.
Figura 6. Comparación de solución convencional con solución bicameral con glucosa y escasos productos de la degradación de la glucosa (Balanceì). A) mejor conservación de la función renal residual (FRR) con Balance (tomado de Williams et al 17). B) mejor supervivencia de los pacientes con Balance. Tomada de Lee et al 22.
Por todo esto, el comité de expertos encargado por la Asociación Europea Renal (ERA-EDTA) para la elaboración de las Guías Europeas de DP, ha propuesto que se deba considerar como la primera elección (evidencia de nivel C) estas soluciones que contienen bajo PDG tamponadas con lactato, bicarbonato o ambos, a pesar de que aún no se ha demostrado un beneficio clínico a largo plazo, ya que se ha demostrado su mejor biocompatibilidad respecto a las soluciones convencionales (evidencia de nivel B) 23.
Una segunda estrategia para la preservación del peritoneo sería disminuir la exposición a la glucosa. Esto se puede conseguir utilizando agentes osmóticos alternativos como la icodextrina y las soluciones con aminoácidos (fig. 5).
La icodextrina (Extraneal®) es un agente osmótico que induce UF por un fenómeno de ósmosis coloidal 24. Su peso molecular es 16.800 Da. Únicamente se absorbe a través de los linfáticos en una cantidad entre el 10 y el 20 %, y la molécula permanece más tiempo en el espacio peritoneal y permite así una UF mantenida en las permanencias largas. La solución disponible comercialmente es al 7,5 %, y presenta una UF similar a la glucosa al 3,86 % en permanencias entre 8 y 12 h y superior a la dextrosa al 2,5 % 25,26 (fig. 7). También aumenta la UF en los períodos diurnos de la diálisis peritoneal automática (DPA) 27. Debido a su dificultad para difundir a través de la membrana peritoneal, es capaz de obtener un UF prolongada en pacientes que presentan una mayor superficie vascular y fallo importante en la UF (alto transporte peritoneal), como ocurre en algunos pacientes que permanecen largo tiempo en DP. En 2 estudios aleatorizados se ha podido demostrar una significativa disminución del peso corporal, el agua total y extracelular, con una menor perdida de FRR y una reducción de la masa ventricular izquierda en el grupo tratado con icodextrina 28,29. También es capaz de mantener una adecuada UF en períodos de fallo transitorio por aumento del área vascular, como ocurre en las peritonitis 30.
Figura 7. Perfil de ultrafiltración (UF) de la icodextrina respecto a las soluciones con glucosa. Modificada de Mujais et al 26.
Sin embargo, esta solución sólo puede ser usada una vez al día, por el riesgo de acumulación de oligosacáridos y maltosa en el volumen extracelular 31. La acumulación de maltosa es causa de un ligero descenso, de unos 2 mmol/l, en la concentración de sodio 32, así como de interferir en la monitorización de la glucemia cuando se emplea tiritas medidoras de glucosa capilar, que utilizan el método de la glucosa deshidrogenasa, y de una falsa elevación de los valores de amilasa por interferencia con el sustrato utilizado para la medición de la actividad de la amilasa 33. No se han descrito otros efectos derivados de la acumulación de maltosa. La hipersensibilidad a esta sustancia ha sido publicada con variable incidencia (1 episodio/60 pacientes/año en un amplio registro de farmacovigilancia poscomercialización 34). Consiste en un eritema cutáneo que en la mayoría de los casos es leve, y más de la mitad de los pacientes no necesitan abandonar el tratamiento. En 2001-2002 fue publicada una alta incidencia (por encima del 8 %) de peritonitis con cultivos negativos en relación con la utilización de la icodextrina 35. Muy probablemente todo esto fue ocasionado por una alta concentración de peptidoglucano (componente de la pared celular de las bacterias grampositivas) por encima 60 ng/ml. En la actualidad, debido a una modificación en la fabricación de esta sustancia, se ha conseguido reducir la concentración a menos de 7,4 ng/ml, y la frecuencia de peritonitis estériles a niveles similares al anterior período referido (datos de Baxter®, no publicados).
Las recientemente publicadas guías europeas para la práctica de la DP aconsejan el empleo de las soluciones con icodextrina al 7,5 %, como parte de la estrategia en pacientes sobrehidratados por insuficiente UF peritoneal, especialmente indicada en pacientes con peritoneo hiperpermeable de forma transitoria o permanente, en permanencias largas (DPCA y DPA) y para disminuir la excesiva exposición a la glucosa.
Para evitar un excesivo aumento de maltosa y polímeros de alto peso en plasma, no debe ser utilizada más de una vez al día 23.
Otro agente osmótico empleado ha sido la mezcla de aminoácidos, con un doble objetivo: soporte nutricional y sustitución de la glucosa. La única formula comercial es una solución al 1,1 %, fundamentalmente compuesta por aminoácidos esenciales (Nutrineal®). Su uso en un intercambio/día coincidente con la comida principal (para aportar calorías) consigue un balance nitrogenado positivo, acompañado por mayor concentración de transferrina y proteínas totales 36 (fig. 8). Sin embargo, se ha recomendado un solo cambio al día para evitar la disminución de bicarbonato sérico y el aumento de urea sanguínea observados con un uso mayor. En la guía europea se indica su uso para pacientes desnutridos, como parte de la estrategia para mejorar su estado nutricional, especificando que para evitar un aumento en la acidosis metabólica y síntomas urémicos, sólo se debe administrarla una vez al día y durante un período de 4-6 h 23.
Figura 8. Las soluciones con aminoácidos incrementan el balance nitrogenado en pacientes desnutridos (n = 19). Modificada de Kopple et al 36.
Conclusiones
La exposición durante años a las soluciones de glucosa-lactato y pH ácido pueden inducir daño en el peritoneo, mediado fundamentalmente por los PDG y las altas concentraciones de glucosa, y conducir a un fallo de UF debido a la pérdida mesotelial, la fibrosis de la estroma y principalmente al aumento del área vascular por la neoangiogénesis.
Las nuevas soluciones han demostrado de forma muy evidente una mejor biocompatibilidad.
Esta mejor biocompatibilidad clínicamente se traduce en:
Un mejor pronóstico de la técnica minimizando las alteraciones de la membrana y las infecciones.
Un mejor pronóstico de los pacientes por el adecuado balance de los líquidos por el mantenimiento de la UF y la reducción de los efectos inflamatorios sistémicos (son necesarios más estudios con diseños adecuados y a más largo plazo para demostrar este beneficio clínico).
Se puede recomendar, por los puntos anteriores:
Utilizar las nuevas soluciones bicamerales: pobres en PDG y con pH neutro, tamponadas con lactato, bicarbonato/lactato o sólo bicarbonato.
Evitar el uso excesivo de altas concentraciones de glucosa: mediante las soluciones con nuevos agentes osmóticos.
Todo esto puede predecir que la utilización de la DP en todo el mundo va a incrementarse sustancialmente en los próximos 10-15 años.
Agradecimientos
Los autores queremos agradecer a la Dra. Belén Marrón y a la Dra. Covadonga Hevia la generosa colaboración prestada con la cesión de esquemas y presentaciones, que nos han ayudado con la redacción y la iconografía de este artículo.