Aunque el cáncer testicular ocupa sólo una proporción pequeña de todos los cánceres, es la neoplasia más común en varones de 1535 años, y debe considerarse en cualquier adolescente o adulto joven con una masa testicular o retroperitoneal. Los factores de riesgo para esta afección incluyen criptorquidia, infertilidad e historia familiar o personal de cáncer testicular1, aunque sólo el 7-10% de los pacientes tienen historia de criptorquidia. El cáncer de testículo abarca el 25% de todos los cánceres en el rango de edad comentado, pero debido a su tasa alta de curación, tan sólo menos del 5% de los pacientes mueren por esta causa.
Los cánceres de testículo dependen de células germinales en un 95% de los casos, y éstos se dividen en seminomas y no seminomas.
Los tumores dependientes del estroma gonadal abarcan un 1-2%, y se dividen en: a) dependientes de células de Sertoli; b) dependientes de células de Leyding, y c) dependientes de estructuras gonadales primitivas. Los linfomas son mucho menos comunes, aunque pueden confundirse con seminomas.
Los tumores no seminomas se dividen en: a) carcinoma embrionario; b) tumor del saco de Yolk; c) coriocarcinoma, y d) teratoma, aunque la mayoría de los tumores tiene un componente mixto, por lo que se llaman tumores mixtos de células germinales1.
Caso clínicoVarón de 18 años de edad, que ingresó en el servicio de urgencias del Hospital General de Ciudad Juárez (México), con dolor abdominal de 3 días de evolución, localizado en el epigastrio, que irradiaba a la espalda, acompañado de vómito de contenido gastrobiliar en 10 ocasiones, en menos de 24 h, lo que causaba disminución en la intensidad del dolor. No había antecedentes de ingesta de medicamentos, y el dolor no guardaba relación con alimentos. En el momento de la exploración, el paciente se encontraba consciente, orientado, reactivo, cooperador, con un Glasgow de 15. El abdomen presentaba resistencia muscular, con dolor a la palpación superficial y profunda. Se palpó una masa en la región paraumbilical derecha. En los genitales externos se encontró una masa escrotal derecha de aproximadamente 6 meses de evolución, a presión, no dolorosa, sin transiluminación, de aproximadamente 7 × 5 × 5 cm. El resto de la exploración no presentó datos de anomalías o agregados a su afección actual.
En los análisis del laboratorio se observaron los datos siguientes: amilasa de 4.622 U/l, bilirrubina total de 1,1 mg/dl, bilirrubina directa de 0,2 mg/dl, bilirrubina indirecta de 0,8 mg/dl, proteínas totales 6,6 g/l, albúmina 4 g/l, globulinas 2,6 g/l, relación A/G 1,5 g/l, aspar-tato-transaminasa de 33 U/I, alanino-aminotransferasa de 12 U/I, fosfatasa alcalina de 55 U/I, glucosa 135 mg/dl, nitrógeno ureico en sangre de 37 mg/dl, urea 79,2 mg/dl, creatinina 2 mg/dl, ácido úrico 7,2 mg/dl, grupo A RH+, TP 15,9 s, IRN 1,3 s, tiempo de tromboplastina parcial de 28,4 s, test de serología luética y virus de la inmunodeficiencia humana negativos, leucocitos 21,41 K/Ul, neutrófilos 83,4%, linfocitos 5,1%, monocitos 9,9%, eosinófilos 0,9%, basófilos 0,7%, hemoglobina 14,8 g/dl, hematocrito 43,4%, MCV 89,3 fL, MCH 30,5 pg, MCHC 34,4 g/dl, banda de distribución de hematíes del 10,9%, plaquetas 277 K/U, alfafetoproteína de 20,132 μg/I, fracción beta específica de gonadotropina coriónica humana (β-hCG) de 408 U/l, DHL de 474.
El ultrasonido mostró tumoración sólida de 65 × 55 mm, con imágenes quísticas y múltiples calcificaciones de testículo derecho, testículo izquierdo de tamaño normal con calcificaciones, tumoración vesical vegetante en las paredes laterales, páncreas aumentado de tamaño y ecogenicidad, con tumoración adyacente a la cabeza del páncreas de 114 × 84 mm sólido, con imagen ovoide quística por abundantes septos. Se observaron ambos riñones con bordes lobulados e irregulares, con aumento moderado de la ecogenicidad y dilatación del sistema colector derecho.
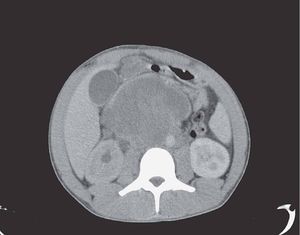
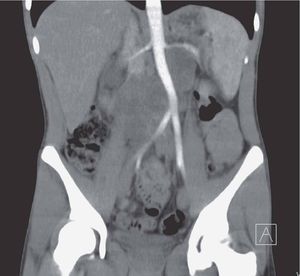
La tomografía computarizada (TC) de abdomen mostró tumoración retroperitoneal multilobulada con metástasis a páncreas y ganglios regionales, además de compresión de la aorta y del uréter derecho (figs. 1 y 2), con pielocalectasía del mismo lado. Se obtuvieron datos de pancreatitis edematosa con dilatación del conducto pancreático. Se realizó toma de biopsia percutánea guiada por TC de la masa retroperitoneal.
Figura 1. Imagen por tomografía computarizada de masa metastásica retroperineal.
Figura 2. Imagen por tomografía computarizada de compresión de la arteria aorta por el tumor retroperitoneal.
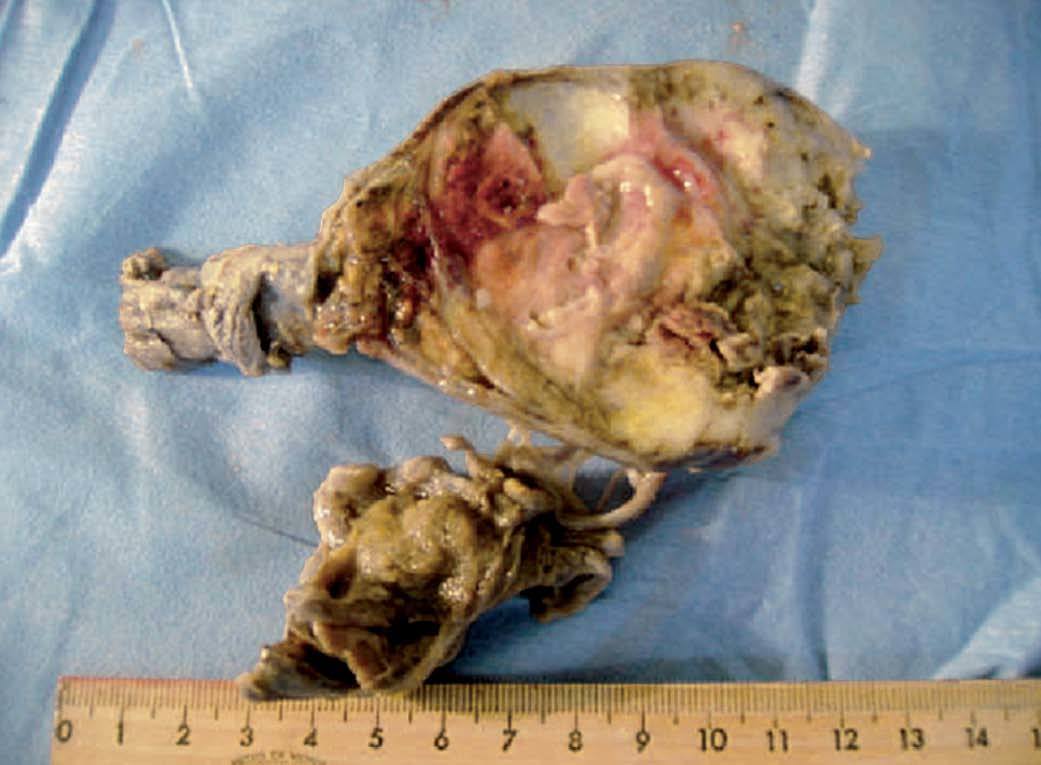
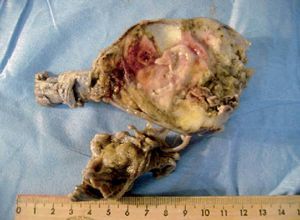
Se llevó a cabo una orquiectomía radical derecha (fig. 3) y se envió la pieza quirúrgica al departamento de patología, que reportó un teratoma inmaduro con extensión a la cápsula, así como carcinoma embrionario con áreas de necrosis (figs. 4-6). La biopsia percutánea guiada por TC de masa retroperitoneal se informó como metástasis de carcinoma embrionario. Actualmente, el paciente está en tratamiento quimioterapéutico por oncología.
Figura 3. Cortes macroscópicos del tumor primario de origen testicular.
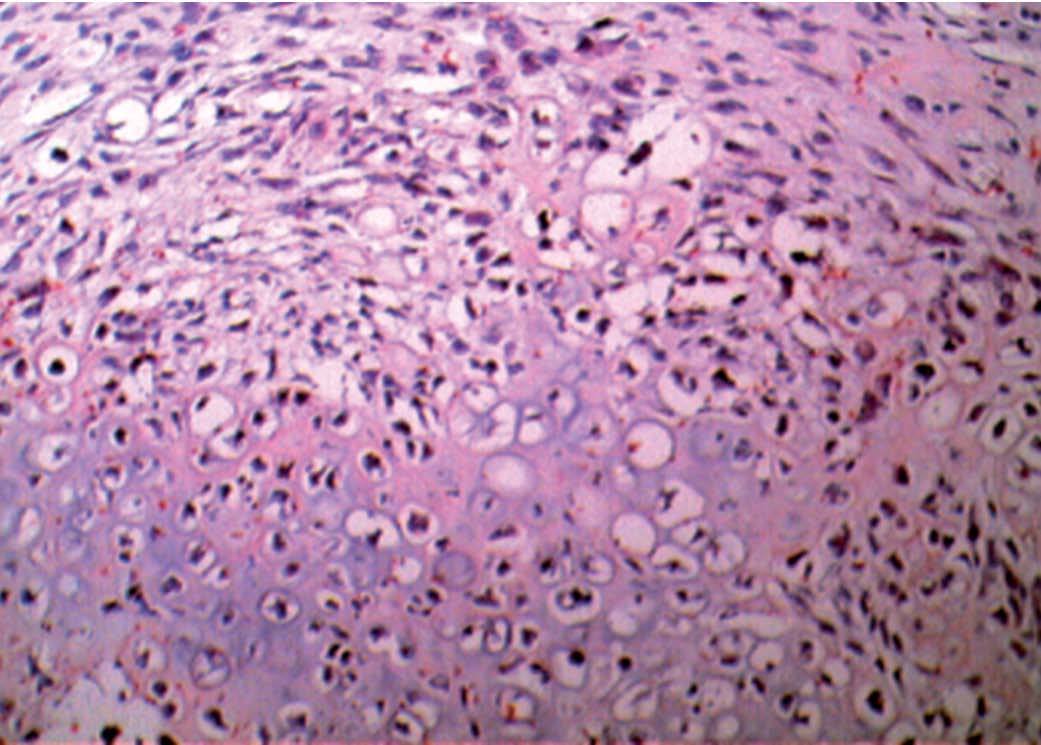
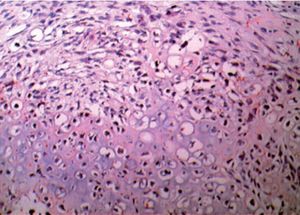
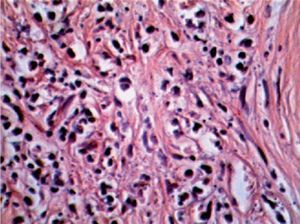
Figura 4. Formaciones epiteliales tubulares con franca heterotipia celular (aspecto de adenocarcinoma embrionario). Arriba a la derecha, brote cartilaginoso inmaduro y heterotípico, con aspecto de condrosarcoma.
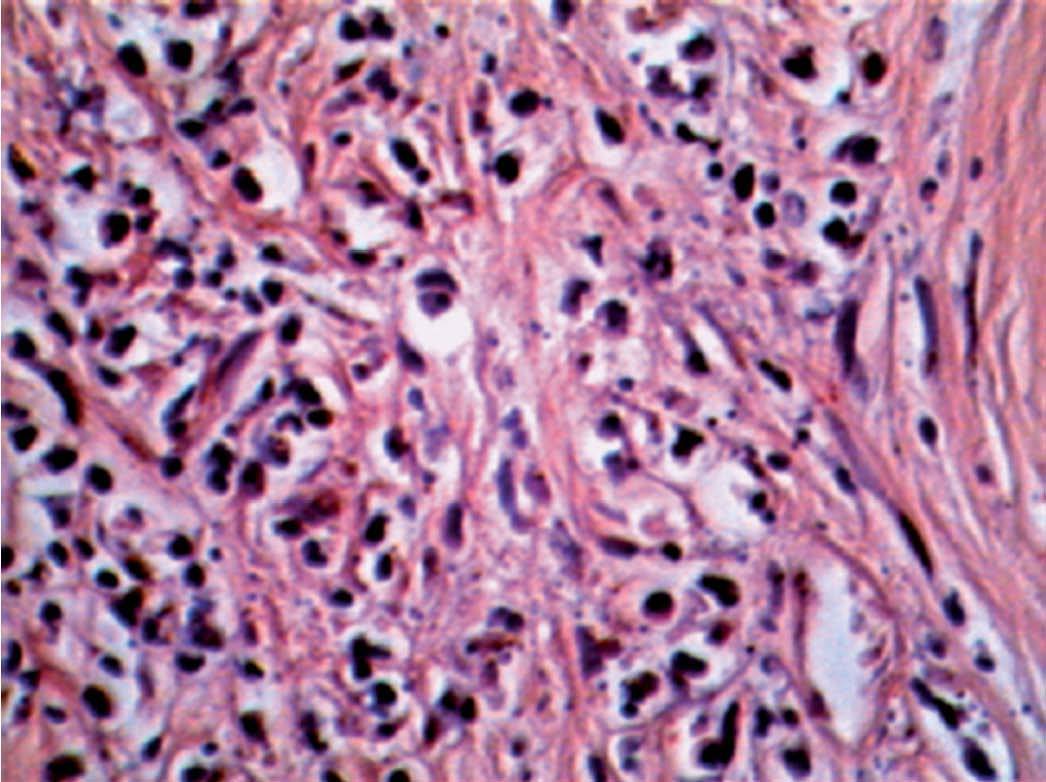
Figura 5. Tejido de aspecto embrionario, estructura de tipo epitelial, sólida.
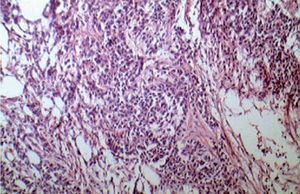
Figura 6. Formaciones de tipo epitelial, sólida a la derecha y tubulares al centro. Entre las formaciones epiteliales, tejido de tipo conectivo con células fusadas inmaduras.
DiscusiónDe las causas de pancreatitis, menos del 1% se relaciona con tumores. Entre éstos se encuentra el carcinoma pancreático, el carcinoma ampular, el colangiocarcinoma, y —como en nuestro caso— el tumor metastásico2. En cuanto a su fisiopatología, se ha propuesto que la activación precipitada de tripsina, de la elastasa y la fosfolipasa A2, así como de forma adicional mediadores locales de la inflamación en células acinares pancreáticas, son los desencadenantes de la inflamación pancreática, independientemente de su etiología3. En este caso, el cuadro clínico fue secundario a la proximidad del tumor retroperitoneal al páncreas y al conducto colédoco, lo que causó compresión de éste y pancreatitis.
El 20% de los tumores de células germinales testiculares son de más de una estirpe histológica4, que en este caso corresponde a teratoma inmaduro y a carcinoma embrionario. El teratoma inmaduro es un tumor infrecuente y la presencia de tumores retroperitoneales de células germinales debe considerarse como una metástasis probable y se debe descartar siempre una neoplasia testicular.
La clasificación de la Organización Mundial de la Salud de los tumores de células germinales distingue los teratomas como maduros (usualmente benignos) e inmaduros (con comportamiento malig-no)5. De las presentaciones anatómicas del teratoma, un 10% corresponde al testículo5. En los teratomas inmaduros, predominan las estructuras neuroectodérmicas primitivas6. Los teratomas maduros son más frecuentes (G0, 54,5%) que los teratomas inmaduros (G1-G3, 45,5%). Sólo el 7,8% de todos los teratomas muestran un grado alto de inmadurez (G3).
El comportamiento de los teratomas depende de variantes clínicas y epidemiológicas, como la edad del paciente en el momento del diagnóstico, el sexo, el tamaño del tumor, la histología y la correlación con las aberraciones biológicas y citogenéticas. Los teratomas testiculares son generalmente benignos en los pacientes prepuberales. En contraste, los teratomas testiculares pospuberales, como en nuestro caso, se pueden presentar con un comportamiento claramente maligno. Estos tumores muestran aberraciones citogenéticas, como el isocromosoma 12p5, y la expresión de lipasa hormonosensitiva (HSL, del inglés hormone-sensitive lipase)7, cuya presencia muestra alteración del metabolismo del colesterol, y una función aún no conocida de esta enzima que podría estar relacionada con la regulación de ciclo celular7. La otra parte del tumor, el carcinoma embrionario, representa un tumor de células totipotenciales inmaduro4.
El carcinoma embrionario puro es relativamente raro; sin embargo, histológicamente es idéntico a los tumores mixtos. Es más común en personas en la tercera y la cuarta décadas de la vida. Principalmente, se caracteriza por un rápido crecimiento y por su diseminación linfática y hematógena, sobre todo a pulmón, hígado e, incluso, hasta bazo. Al realizarse el diagnóstico, más del 60% de los pacientes tienen metástasis. La invasión vascular es un factor de pronóstico importante para identificar a pacientes de riesgo alto8. A menudo, es más pequeño que un seminoma y, en ocasiones, muestran algunas zonas hemorrágicas y de necrosis. En algunas series se ha informado que la combinación más común de tumores de células mixtas es el carcinoma embrionario y el teratoma9. El carcinoma embrionario es el componente más común en tumores mixtos de células germinales, seguido de teratoma, tumor del saco de Yolk, seminoma y coriocarcinoma10. Se puede detectar por varios marcadores tumorales, los ya mencionados (AFP, βGC) y otros, como CD30, antígeno epitelial de membrana, fosfatasa alcalina placentaria y OCT4. Este último es el más sensible para diagnosticar carcinoma embrionario puro10,11.
Aunque en este caso había afección clínica testicular, hay casos en los que la presencia de metástasis retroperitoneales es el primer dato de la presencia de tumores de células germinales testiculares; y en los que clínicamente no había datos de afección testicular12, tal vez se debe a una regresión tumoral espontánea (burned-out) después de extenderse a otros órganos13.
Los teratomas inmaduros muestran elevaciones leves de hCG (usualmente < 100 μg/I), usualmente asociado a tumor del saco de Yolk en el teratoma. Las concentraciones mayores de 100 ug/I indican la presencia de tumor de células germinales de naturaleza maligna, con un componente de tumor de saco del Yolk4. En este caso, el teratoma con grado alto de inmadurez se correlaciona con sus concentraciones elevadas de alfafetoproteína, y la detección de focos intratumorales dependientes de tumores de saco de Yolk.
Un componente esencial en el tratamiento de tumores testiculares es la quimioterapia (con cisplastino) y la disección de ganglios linfáticos retroperitoneales, que en la mayoría de los casos es curativa15.
La detección temprana es prácticamente la única manera de mejorar el pronóstico de estos pacientes. El retardo en el inicio de los síntomas hasta un diagnóstico definitivo por orquiectomía radical tiene un promedio de 4-5 meses. Es razonable enseñar a los pacientes jóvenes a autoexaminarse, particularmente a los que presentan factores de riesgo14. La finalidad de exponer este caso clínico es el de estudiar el tipo de presentación clínica que de inicio ofreció el tumor metastásico, y el que una entidad patológica, en este caso la pancreatitis, se convirtió en la base para el diagnóstico de cáncer testicular. Una vez más, el estudio integral del paciente es la base de un diagnóstico completo.
*Autor para correspondencia. Correo electrónico: juandedios@salud.gob.mx (J.D. Díaz-Rosales).