Introducción
La insuficiencia renal crónica (IRC) es una entidad de prevalencia creciente debido a una mayor longevidad de la población y capacidad de tratamiento de las nefropatías. Recientemente se ha estimado que el 13 % de la población española tiene algún grado de afección renal, que en algunos progresará hasta necesitar tratamiento renal sustitutivo (TRS). La incidencia y la prevalencia de los pacientes que precisan este tratamiento aumentan cada año de forma lineal. También la edad y el tiempo de permanencia en un programa de diálisis van aumentando. El 89 % de los pacientes que inician TRS utiliza hemodiálisis (HD), frente al 10 % que entra en un programa de diálisis peritoneal y el 1 % que recibe un trasplante renal preventivo. Así, la necesidad de creación, mantenimiento y reparación de accesos vasculares (AV) también es creciente y aumenta aproximadamente un 10 % cada año.En muchos casos, el seguimiento de un paciente con IRC permite prever la necesidad de HD y planificar un AV con tiempo para que éste madure e incluso se repare o se reconstruya si fuera necesario. Éste es un objetivo importante, ya que se estima que actualmente casi el 50 % de los enfermos que comienzan la HD llegan a la unidad con retraso y precisan un catéter temporal al no disponer de un AV maduro. Esto conlleva mayor morbimortalidad, mayor tasa de fracasos de AV y que los enfermos perciban una menor calidad de vida. Así, es importante intentar garantizar la disponibilidad de un AV funcionante en los enfermos subsidiarios de un tratamiento con HD, lo que exige un manejo multidisciplinario, con estrecha colaboración entre médicos de atención primaria, nefrólogos, cirujanos vasculares, radiólogos y personal de enfermería.
Cuidados previos a la construcción de un acceso vascularLa identificación precoz de un enfermo renal y su derivación y manejo en una unidad nefrológica permite: instaurar un tratamiento específico, preservando la máxima función renal posible el máximo tiempo posible; tratar otros procesos concomitantes (estado nutricional, tabaquismo, hipertensión, diabetes mellitus, anemia, acidosis, alteraciones del metabolismo fosfocálcico), optimizando el estado general del enfermo y su calidad de vida; educar al paciente en su enfermedad crónica, hábitos de vida, visitas médicas, etc., intentando conseguir su colaboración y estableciendo una relación médico-paciente que será necesaria probablemente durante años; y esta educación incluye la protección de las venas periféricas de sus extremidades superiores, fundamentalmente las venas cefálicas y basílicas bilaterales, que serán vitales para la futura construcción de un AV si fuera necesario; y finalmente, remitir al enfermo al cirujano vascular cuando la función renal llegue a niveles terminales con tiempo para poder garantizar en la medida de lo posible la disponibilidad de un AV maduro en el momento de iniciar la HD, evitando el catéter temporal de urgencia. En la tabla I se incluyen algunas recomendaciones para preservar la red venosa en pacientes renales.
Acceso vascular: definición y tipos
Un acceso vascular es un cortocircuito creado entre una arteria y una vena, ya sea directo o a través de la interposición de un injerto, con el fin de conseguir extraer y devolver un flujo de sangre elevado para filtrarlo periódicamente. Un AV pretende: asegurar un acceso fácil y repetible al flujo sanguíneo; obtener flujos suficientes para el programa de HD; permitir un manejo ambulante y asegurar la mayor calidad de vida posible, y evitar complicaciones. Para ello precisa: una arteria donante de calibre y flujo suficientes; un drenaje venoso permeable y en continuidad con la aurícula derecha sin estenosis en su trayecto, y distensibilidad de ambos para madurar el acceso y adaptarse a la nueva hemodinámica del sistema. Existen tres tipos de AV: fístulas arteriovenosas (FAV) autólogas, en las que se realiza una conexión directa entre una arteria y una vena periférica, sirviendo la longitud de ésta para la canulación; AV protésicos, en los que se interpone un injerto entre una arteria y una vena nativas, utilizándose la longitud de este injerto para la canulación; y un catéter venoso central (CVC), que se introduce en una vena yugular, subclavia o femoral, sin manipulación arterial.
La FAV autóloga es la que más se acerca a los requisitos de un AV ideal. Su punción percutánea es sencilla y repetible en un trayecto más o menos largo, obtiene habitualmente flujos venosos de más de 350 ml/s, alcanza altas tasas de permeabilidad a largo plazo (el 75 % a los 5 años), con baja incidencia de infección y de otras complicaciones, es el AV más confortable para el enfermo, y desarrolla la red venosa de la extremidad, preservando la posibilidad de otros AV en el futuro. Como desventaja, requiere un mínimo de un mes para su maduración, que puede llegar hasta 3 meses. Y un porcentaje de FAV autólogas no llegan a desarrollarse y fracasan precozmente, con tasas que oscilan entre el 10 y el 30 % para las FAV radiocefálicas (RC).
El AV protésico ofrece una superficie larga y fácil para su canulación, consigue flujos habitualmente mayores de 650 ml/s, su maduración es rápida (2-3 semanas, hasta 1 mes) y su tasa de fracaso inicial es menor que la de las FAV autólogas. Sin embargo, la incidencia de fracasos tardíos es mucho mayor, ya que suelen desarrollar hiperplasia intimal en su anastomosis venosa, con eventual oclusión, con una duración media de 2 años. Las diferentes técnicas quirúrgicas utilizadas para intentar minimizarla sólo consiguen prolongar la permeabilidad unos meses. Se calcula que este tipo de AV precisa entre 1,2 y 2,57 intervenciones secundarias por paciente y año para mantener su permeabilidad. Y su tasa de infección y otras complicaciones es muy elevada. Además, la comodidad del enfermo con este tipo de AV es menor. Los CVC se colocan de forma percutánea en una vena yugular, subclavia o femoral, permitiendo un acceso sencillo al flujo venoso central, sin necesidad de punciones repetidas. Consigue flujos adecuados para la HD y no precisa tiempo de maduración, y es muy útil en situaciones de urgencia, pues se puede utilizar de forma inmediata. Tiene una tasa mínima de fracaso inicial. Sin embargo, su duración media es menos de 1 año, con una incidencia de infección más elevada que en los otros dos tipos. También pueden causar estenosis o incluso oclusión en una vena central (habitualmente subclavia, posiblemente yugular, ilíaca o incluso vena cava superior), que invalide la extremidad isolateral para futuros AV. Además, son poco confortables para el enfermo. Suelen ser el último recurso en pacientes nefrópatas.
Valoración preoperatoria
La valoración preoperatoria de un paciente con IRC avanzada que precisa un AV pretende asegurar la creación de un AV funcionante y duradero y minimizar las complicaciones. Debe ser realizada por un equipo quirúrgico con experiencia. Incluye una historia clínica completa, una exploración física minuciosa y, en ocasiones, pruebas de imagen complementarias.
La historia clínica completa de estos pacientes debe incluir:
- Edad, sexo, factores de riesgo cardiovascular.
- Comorbilidad: la insuficiencia cardíaca puede verse agravada por el aumento de precarga que conlleva la construcción de una FAV; un accidente cerebrovascular previo puede influir en la funcionalidad y utilidad de una extremidad para la construcción de un AV; la aterosclerosis puede ser generalizada y ocasionalmente afectar a las extremidades superiores, con mayor riesgo de robo en caso de construir un AV; ciertos trastornos hemáticos pueden predisponer a la trombosis o a la hemorragia, lo cual es importante en la manipulación arteriovenosa de un AV; una neoplasia activa puede limitar el pronóstico de vida, etc.
- La esperanza de vida estimada puede condicionar la elección de un AV u otro, primando la necesidad de un acceso duradero o, por el contrario, un acceso rápido y poco agresivo a corto plazo como un CVC permanente.
- La situación funcional también puede condicionar el uso de una extremidad u otra.
- Medicación habitual, con especial énfasis en anti-agregantes o anticoagulantes para planificar un procedimiento quirúrgico electivo, o corticoides e inmunosupresores que puedan influir en la cicatrización de las heridas quirúrgicas y el riesgo de infección.
- Alergias medicamentosas, especialmente a antibióticos o anestésicos locales.
Más específicamente enfocado a la elección técnica del AV, recogeremos:
- Antecedentes de AV, incluidos catéteres, actuales y previos. Nos interesa conocer la localización y el tipo de AV, su fecha aproximada de creación, duración, complicaciones y motivos de fracaso. Nos aporta mucha información sobre las reservas arteriales y venosas ya agotadas y las restantes, que posteriormente confirmaremos con la exploración física y las pruebas complementarias.
- La cateterización venosa central actual o previa, en forma de vías centrales (para HD u otros fines), marcapasos o desfibriladores intracamerales, implica un riesgo de estenosis o incluso trombosis en venas yugular, subclavia, tronco braquiocefálico o incluso vena cava superior (VCS) de hasta el 40 %, a menudo poco sintomáticas. Realizar un AV en esta extremidad supondría el fracaso inmediato del acceso y un edema doloroso y masivo en el brazo que podría incluso poner en peligro la extremidad. Por lo tanto, su detección invalidaría la extremidad para un nuevo AV o requeriría su reparación previa.
- Lo mismo se aplica a la cirugía torácica o los traumatismos previos en la cintura escapular o en las extremidades superiores, que han podido lesionar las venas centrales y/o periféricas o incluso las arterias principales.
- Los antecedentes de TVP subclavioaxilar pueden anular la posibilidad de un AV isolateral, como ya hemos mencionado. Las punciones repetidas por procesos médicos o adicción a drogas por vía parenteral con o sin flebitis clínicas pueden haber anulado las venas periféricas de una o ambas extremidades superiores para la construcción de un AV.
- Se intentará siempre que sea posible utilizar la extremidad superior no dominante del enfermo para construir el AV para aumentar su comodidad.
La historia clínica se debe complementar con una exploración física minuciosa de la red arterial y venosa de ambas extremidades superiores y, ocasionalmente, de las extremidades inferiores. Se realiza un examen del aporte arterial con la palpación de pulsos a lo largo de la extremidad (axilar, humeral, radial y cubital) y la auscultación de soplos subclavios. El test de Allen se realiza sobre las arterias radial y cubital en la muñeca para verificar la integridad de los arcos palmares y la dependencia de la perfusión digital de una u otra arteria. Un test de Allen positivo puede contraindicar una FAV distal. También se verifica la simetría de la presión arterial en ambas extremidades superiores, que descarten estenosis u oclusiones arteriales proximales que también invaliden la extremidad o precisen una reparación previa para garantizar la funcionalidad de un AV. Se observa la perfusión de ambas manos.
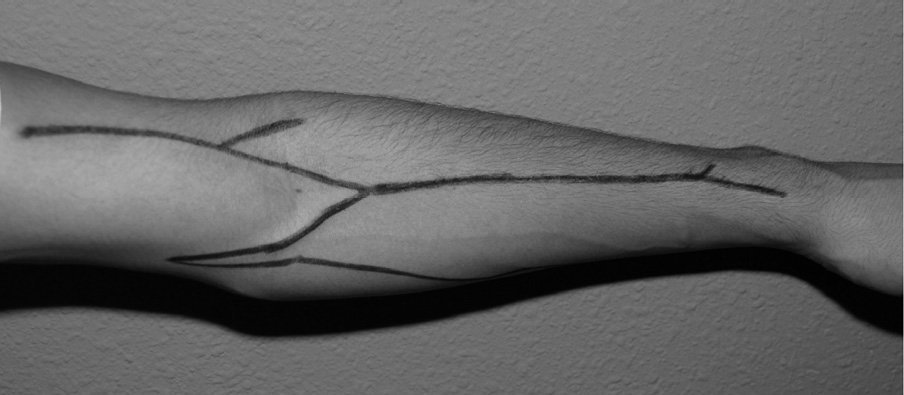
La exploración del sistema venoso superficial debe realizarse en una habitación cálida, con el paciente sentado y el brazo colgando. Para una mejor visualización de la red venosa y la determinación de su capacidad de distensión, se utiliza un compresor, que se coloca en el antebrazo para valorar primero la región distal del brazo y el carpo, y luego en el tercio proximal del brazo para visualizar la red alrededor del codo y proximal. Se explora todo el recorrido de las venas cefálica y basílica en ambos brazos y antebrazos (fig. 1), atendiendo a su permeabilidad, calibre, tortuosidad y distensibilidad, signos de punciones previas, cicatrices de intervenciones previas o segmentos fibrosados por flebitis previas a lo largo de su trayecto. En pacientes multipuncionados, la tasa de trombosis puede ser de hasta el 38 %, y afecta a la vena cefálica en más de la mitad de los casos. En general, se considera una vena adecuada para un AV si es visible o claramente palpable a través de la piel, aplicando un torniquete o sin él. La presencia de circulación colateral en el hombro o el edema de una extremidad pueden indicar una estenosis u oclusión del eje venoso subclavioaxilar, con desarrollo de circulación colateral subcutánea compensadora y déficit de drenaje, y obligan a confirmarlo o descartarlo con una prueba de imagen. La adiposidad abundante en una extremidad superior puede ocultar la presencia de venas útiles para la construcción de un AV (antes de descartar la realización de una FAV autóloga en estos pacientes se debe realizar una prueba de imagen más concluyente), pero también puede dificultar o incluso impedir las punciones de un acceso funcionante.
Figura 1. Venas cefálica, basílica y mediana en brazo y antebrazo izquierdos.
Otros detalles complementarios de la exploración física incluyen los posibles déficit motores y/o sensitivos o las limitaciones articulares de una extremidad que puedan obstaculizar su utilización para el AV. En casos extraordinarios, en pacientes con historia de múltiples accesos vasculares no funcionantes, en los que se han agotado las posibilidades de nuevos accesos en extremidades superiores, se considera la opción de construir un AV en una extremidad inferior. En estos pacientes la exploración continuará en las extremidades inferiores con la valoración arterial mediante la palpación de pulsos (femoral, poplíteo, tibial posterior [TP] y pedio), la auscultación de soplos y la valoración de la perfusión en ambos pies. El índice tobillo-brazo (IT/B) nos aporta una cuantificación objetiva de la perfusión distal. Una extremidad inferior con signos objetivos de déficit de perfusión distal contraindica la realización de un AV, ya que el robo arterial que inevitablemente conlleva puede precipitar un proceso gangrenoso y poner en peligro la extremidad. Se explora el trayecto de la vena safena interna que si es varicosa no es apta para una FAV autóloga. Las varices, el edema perimaleolar, la hiperpigmentación y otros trastornos cutáneos distales indican insuficiencia venosa, superficial y/o profunda, que serían seriamente agravados por la sobrecarga venosa que supone un AV. Las cicatrices en la extremidad pueden mostrar la extracción previa de la vena safena interna para bypass, intervenciones por varices, por isquemia arterial o lesiones traumáticas que también puedan haber comprometido el sistema venoso de la extremidad. La historia clínica y la exploración física son indispensables en la valoración preoperatoria de un AV. En muchos casos será suficiente para sentar una indicación quirúrgica con éxito del AV. Pero en algunos otros no son suficientes para identificar con garantías la vena receptora de un acceso autólogo o protésico, o habrá signos que hagan sospechar una red arterial deficiente. En estos casos hay varias pruebas de imagen que pueden darnos información clave sobre el estado de las redes arterial y venosa de las extremidades. Su objetivo es identificar venas periféricas útiles para AV (aunque se debe recordar que si la vena no es visible ni palpable en la exploración física, es probablemente poco distensible o muy profunda y difícilmente acabará generando un AV útil; se estima en general que utilizar un protocolo de mapa venoso por imagen en la valoración preoperatoria aumenta la realización de accesos autólogos en un 10-40 %, cifras muy variables según las series), y confirmar la permeabilidad del sistema venoso central (el eje subclavioaxilar hasta la vena cava superior) para garantizar la salida de una FAV autóloga y la funcionalidad de un AV protésico.
Se suelen indicar cuando la exploración física plantea dudas sobre la permeabilidad de los ejes cefálico, basilar y/o central, es decir, cuando las venas cefálica y basílica no son evidentes, como en pacientes obesos, o de suficiente calidad en la exploración física. Signos físicos sospechosos de estenosis u oclusión venosa central y antecedentes de cateterización venosa o traumatismos o procedimientos quirúrgicos en la cintura escapular también obligan a confirmar la utilidad de la extremidad para AV. Trayectos cefálico y quizá basílico multipuncionados y antecedentes de flebitis también indican una prueba de imagen que las estudie en toda su longitud. Los signos de arteriopatía periférica en extremidades superiores (pulsos disminuidos o ausentes, soplos proximales, diferencia de presión > 15 mmHg entre las extremidades superiores) suelen invalidar la extremidad como donante arterial para un AV y también obligan a completar su estudio. Finalmente los antecedentes de AV previos fallidos obligan a estudiar cuidadosamente las reservas arterial y venosa restantes.
Guías y protocolos
La elección del momento adecuado para iniciar la hemodiálisis condiciona el tipo de AV inicial. Y el tipo de AV disponible al inicio de la HD determina la eficacia de la depuración sanguínea y, así, la morbimortalidad de los enfermos: como mencionamos en la introducción, si el primer AV es un CVC, es mayor que con una FAV.
Algunas guías (DOQI, SNC, VAS, SEN-SEACV) pretenden establecer pautas y protocolos para la indicación, realización, mantenimiento y seguimiento de los AV para HD. Su objetivo principal es obtener AV que cumplan los requisitos de durabilidad, disponibilidad y baja tasa de complicaciones, especialmente considerando que las complicaciones derivadas de los AV son la principal causa de ingreso hospitalario de los pacientes en IRC terminal en HD, con el consiguiente deterioro de su calidad de vida y mayor coste económico. En todas estas guías las FAV autólogas son de primera elección, por las características que hemos descrito anteriormente. Se intenta que al menos el 50 % de los nuevos AV sean FAV autólogas (DOQI). Los protocolos de consenso han conseguido aumentar en los últimos años el número de FAV autólogas y CVC en detrimento de los AV protésicos. Esto es lo que ocurre en España, donde se realizaron 4.482 FAV autólogas, 1.875 CVC y 682 AV protésicos en 2005.
Existen unos criterios generales sobre la indicación de AV que se pueden considerar unánimes: la localización preferente en extremidades superiores sobre extremidades inferiores, dado que en aquéllas se dan menores tasas de complicaciones con mayores permeabilidades a largo plazo; distal mejor que proximal, ya que preserva la red venosa más proximal para futuros AV si fueran necesarios y reduce la posibilidad de robo arterial y compromiso de la extremidad; extremidad no dominante, para mayor comodidad del paciente; trayecto de fácil punción y largo, para rotar los puntos de punción, y confortable para el paciente durante la HD; FAV autóloga sobre AV protésico, por mayor permeabilidad a largo plazo y menor tasa de complicaciones; y prever que los AV suelen tener una vida útil limitada y que, si el paciente permanece en un programa de HD durante muchos años, es previsible que con el tiempo necesite nuevos accesos, por lo que es interesante preservar la mayor reserva venosa posible para el futuro a la hora de planificar el AV.
En general, el orden de construcción de AV comienza por una FAV radiocefálica (RC) en el brazo no dominante, y después en el brazo dominante. Si esto ya no es posible, la siguiente opción es una FAV humerocefálica (HC) en el mismo orden. Después, AV protésicos en el antebrazo y trasposiciones de vena basílica. Finalmente, existe la opción de AV protésicos proximales en brazo. Los AV en extremidades inferiores son de último recurso cuando se han agotado las opciones de realizar nuevos accesos en extremidades superiores, junto con los CVC, daba su baja permeabilidad y alta tasa de complicaciones (el 55 % de trombosis, el 35 % de infecciones), y deben indicarse de forma individualizada. Existen algunos AV atípicos, como los realizados en la pared anterior del tórax o en el abdomen, que son realizados de forma extraordinaria, en casos límite, y según la anatomía del paciente y el criterio de cirujano vascular.
Recomendaciones especiales
El AV más cercano a lo ideal actualmente es la FAV RC. Pero existen algunos factores que se asocian a mayor tasa de fracaso precoz de este tipo de AV: la edad avanzada, que se acompaña de menor distensibilidad arterial y mayor disfunción endotelial, lo que entorpece la maduración del AV; el sexo femenino, que suele tener vasos de menor calibre; la obesidad, que, como comentamos antes, hace más profunda la localización de las venas, con dificultades para la punción, mayor incidencia de hematomas y lesiones del acceso; la diabetes mellitus y la hipertensión, que a menudo implican calcificación arterial, con mayores dificultades técnicas para la construcción del acceso y menores tasas de maduración efectiva; la hipotensión, que aumenta el riesgo de trombosis precoz; la cardiopatía, tanto isquémica como dilatada, que también favorecen el fracaso de la fístula o pueden empeorar con el aumento de la sobrecarga cardiaca por el shunt vascular; la arteriopatía periférica, que reduce la presión de aflujo donante a la FAV y aumenta el riesgo de robo arterial distal; la presencia actual o previa prolongada de CVC; los trastornos hematológicos trombofílicos; la remisión tardía a un cirujano vascular; los AV previos, con manipulación y alteración de las redes vasculares; la arteria radial y vena cefálica de pequeños calibres o mala calidad (una arteria radial de un calibre 1,5 mm se asocia a un alto porcentaje de fracasos precoces, una vena cefálica con un diámetro > 3,4 mm se asocia a éxito del acceso en un 99 %); y el flujo en la vena subclavia infraclavicular durante la inspiración no forzada < 400 ml/min.
Así, aunque de forma generalizada se recomienda la FAV RC como primera elección, en algunos casos concretos el AV más recomendable puede ser otro. Los ancianos suelen presentar mayor afección arterial distal y frecuentemente menos desarrollo venoso distal o su agotamiento por múltiples punciones previas, con una esperanza de vida más corta, por lo que se puede indicar una FAV HC como primer acceso. En las mujeres son muy habituales las venas periféricas de escaso calibre, a menudo poco útiles en sus segmentos distales, por lo que en estas pacientes puede tener también mayor garantía de utilidad una FAV HC como primera elección, salvo que encontremos una buena vena cefálica en la muñeca con continuidad en el antebrazo. Los pacientes obesos pueden a menudo requerir la superficialización de los trayectos venosos, y, en caso de escaso desarrollo venoso, lo que ocurre con gran frecuencia, su mejor opción puede ser un AV protésico. La cardiopatía dilatada con episodios de insuficiencia cardíaca congestiva puede verse agravada por el aumento de precarga secundario al shunt arteriovenoso, lo que obliga a valorar los CVC. La isquemia arterial significativa en extremidades superiores e inferiores puede contraindicar un AV que pudiera comprometer la viabilidad de la extremidad, y obliga a valorar un CVC como opción más segura, o considerar la diálisis peritoneal. Los antecedentes de ictus se han relacionado con falta de maduración de los accesos. Se recomienda, aunque no está totalmente aceptado y habrá que individualizarlo, realizar un AV en la extremidad parética, para no limitar aún más la calidad de vida del paciente, aunque la falta de movilidad de la extremidad también puede influir en la ausencia de maduración y el éxito del acceso. En caso de neoplasia activa se deberá valorar la esperanza de vida del paciente y quizá optar por el CVC como primera opción o un AV protésico en el brazo, con buenas permeabilidades durante su primer año. En caso de prever que el tratamiento con HD será necesario sólo de forma temporal y a corto plazo, se puede implantar un CVC, sin necesidad de un AV permanente. Los trastornos de la hemostasia se deberán tratar de forma específica antes de la intervención quirúrgica para intentar garantizar lo máximo posible el éxito del acceso y evitar complicaciones. En caso de AV previos fracasados y utilización de CVC, se deberán valorar de forma exhaustiva los ejes arteriales y la reserva venosa e indicar de forma individualizada el AV más factible. Finalmente, los niños constituyen una población de pacientes renales especial. En general, toleran mal la diálisis y suelen ser candidatos a recibir un trasplante renal en 6-12 meses. Si en el período intermedio precisan un TRS, suelen recibir diálisis peritoneal en 2 de cada 3 casos, siempre que tengan un entorno familiar capaz de manejar adecuadamente los dispositivos. En el tercio restante de niños que precisan HD, es habitual utilizar CVC pediátricos, que consiguen buenos flujos y permeabilidades durante los meses que son necesarios, previos al trasplante, y evitan las punciones repetidas, a las que muchos niños desarrollan pánico, y las posibles hemorragias. En caso de precisar HD a más largo plazo, se deberá realizar un AV más definitivo, siguiendo los mismos criterios generales que para los adultos: distal antes que proximal, autógeno antes que protésico, extremidad no dominante, extremidad superior antes que inferior. Las técnicas quirúrgicas son muy parecidas pero mucho más difíciles de realizar por el tamaño menor de las estructuras y su especial propensión al vasospasmo y la trombosis.
Conclusiones
En conclusión, los AV se deben planear y programar con la suficiente antelación para estar disponibles al inicio de la hemodiálisis. Conseguir un AV funcionante y adecuado para el paciente exige una colaboración multidisciplinaria. Los factores más importantes para el éxito de un AV son las características de los vasos seleccionados y el correcto escalonamiento de los procedimientos, ya que no sólo se debe planear el primer AV, sino también prever otros nuevos AV a medio y largo plazo. Las FAV autólogas son generalmente de primera elección, recomendando los AV protésicos cuando se han agotado las posibilidades de FAV autólogas en extremidades superiores. Los CVC se indican en fracaso renal agudo, HD temporal, maduración o imposibilidad o contraindicación de otro tipo de AV. Los AV en extremidades inferiores se utilizan excepcionalmente en casos individualizados. Y, finalmente, las características clínicas de cada paciente pueden influir en la indicación de la técnica a realizar.
Correspondencia: Dra. M. Vega-de-Céniga.
Servicio de Angiología y Cirugía Vascular.
Hospital de Galdakao-Usansolo.
Barrio Labeaga, s/n. 48960 Galdakao-Usansolo. Vizcaya. España.
Correo electrónico: mvega@hgda.osakidetza.net
Bibliografía general
Brimble KS, Rabbat CG, Schiff D, Ingram AJ. The clinical utility of Doppler ultrasound prior to arteriovenous fistula creation. Semin Dial. 2001;14:314-7.
Camblor Santervás LA, Menéndez Herrero MA, Carreño Morrondo JA, Llaneza Coto JM, Rodríguez Olay J. Estudio preoperatorio del paciente: examen físico y pruebas de imagen. Angiología. 2005;57: S23-34.
Collins A, Xia H, Ma J. Pre-ESRD VA insertion is associated with improved elderly patient survival. J Am Soc Nephrol. 1997;8:230-5.
Davison JA. Access for dialysis: surgical and radiologic procedures. 2.ª ed. Georgetown: Landes Bioscience; 2002. p. 1-10.
De Francisco ALM, Otero A. Epidemiología de la enfermedad renal crónica en España. Nefrologia. 2003;28:475-7.
Del Río Prego A, Aparicio Martínez C, González García A. Accesos vasculares para hemodiálisis. En: SEACV: Tratado de las enfermedades vasculares. Barcelona: Viguera; 2006. p. 1255-67.
Feldman HI, Joffe M, Rosas S, Burns JE, Knauss J, Brayman K. Predictors of successful AVF maturation. Am J Kidney Dis. 2003;42: 1000-12.
Fernández Heredero A, Martínez Aguilar E, March García JR, Acín García F. Momento idóneo de creación del AV desde el punto de vista técnico. Angiología. 2005;57 Supl 2:S47-54.
Górriz JL, Sancho A, Pallardó LM, Amoedo LM, Martín M, Sanz P, et al. Prognosis significance of unplanned start of dialysis. A Spanish multicentrical study. Nefrologia. 2001;22:49-59.
López Revuelta K, Saracho R, García-López F, Gentil MA, Castro P, Castilla J, et al. Informe de diálisis y trasplante año 2001 de la Sociedad Española de Nefrología y registros autonómicos. Nefrologia. 2004;24:21-33.
Malovrh M. Approach to patients with ESRD who need an AV fistula. Nephrol Dial Trasplant. 2003;18 Suppl 5:V50-2.
Moreno RM. Registro de actividad de la SEACV, año 2005. Angiología. 2007;59:83-102.
National Kidney Foundation. K/DOQI clinical practice guidelines for vascular access, 2000. Am J Kidney Dis. 2001;37 Suppl 1: S137-81.
Nguyen N, Cinat ME. Vascular access in the neonatal and pediatric patient. En: Wilson SE, editor. Vascular access: principles and practice. 4.ª ed. St. Louis: Mosby; 2002. p. 132-48.
Riera Vázquez R, Cordobès Gual J, Lozano Vilardell P, Manuel Rimbau E, Corominas Roura C, Juliá Montoya J. Selección del tipo de AV en pacientes crónicos y agudos. Angiología. 2005;57 Supl 2:S35-45.
Rodríguez Hernández JA, González Parra E, Gutiérrez Julián JM. Guías SEN. Guías de acceso vascular en hemodiálisis. Nefrologia. 2005;25 Supl 1:1-97.
Rodríguez JA, González Parra E. Accesos vasculares para hemodiálisis: preparación del paciente con insuficiencia renal crónica. Angiología. 2005;57 Supl 2:S11-21.
Sociedad Española de Nefrología. Guías de acceso vascular en hemodiálisis, 2004. Disponible en: http://www.senefro.org Stevick CA. Angioaccess. En: Scribner RG, Brown WH, Tawes RL, editores. Decision making in vascular surgery. Philadelphia: BC Decker; 1987. p. 186-7.
Weiswasser JM, Sidawy AN. Estrategias de los accesos arteriovenosos para diálisis. En: Rutherford R, editor. Cirugía vascular. 6.ª ed. Madrid: Elsevier; 2006. p. 1669-76.
White GH, Wilson SE. Planning and patient assessment for vascular access surgery. En: Wilson SE, editor. Vascular access: principles and practice. 4.ª ed. St. Louis: Mosby; 2002. p. 7-13.
Wong V, Ward R, Taylor J, Selvakumar S, How TV. Factors associated with early failure of arterio-venous fistulae for hemodialysis access. Eur J Vasc Endovasc Surg. 1996;12:207-13.
Yerdel MA, Kesenci M, Yazicioglu KM, Doseyen Z, Turkcapar AG, Anadol E. Effect of haemodynamic variables on sugically created arteriovenous fistula flow. Nephrol Dial Transplant. 1997;12:1684-8.