La enfermedad renal crónica (ERC) es un problema de salud pública global y el filtrado glomerular (FG) se reduce con la edad. Analizamos la evolución de la función renal (FR) a los 36 meses en pacientes ancianos diagnosticados de ERC.
Pacientes y métodosOchenta pacientes clínicamente estables, con una mediana de edad de 83 años (rango: 69-97; 69% mujeres [35% con diabetes mellitus y 83% con hipertensión arterial]), fueron reclutados aleatoriamente y seguidos durante 36 meses. Basándonos en la concentración de creatinina sérica (Crs) basal, dividimos la cohorte en dos grupos: Grupo 1: 38 con Crs ≤ 1,1mg/dL (rango: 0,7-1,1), y Grupo 2: 42 con Crs>1,1mg/dL (rango: 1,2-3). Estimamos el FG (FGe) basalmente y repetimos las determinaciones después de 36 meses usando la fórmula Modification in Diet of Renal Disease (MDRD).
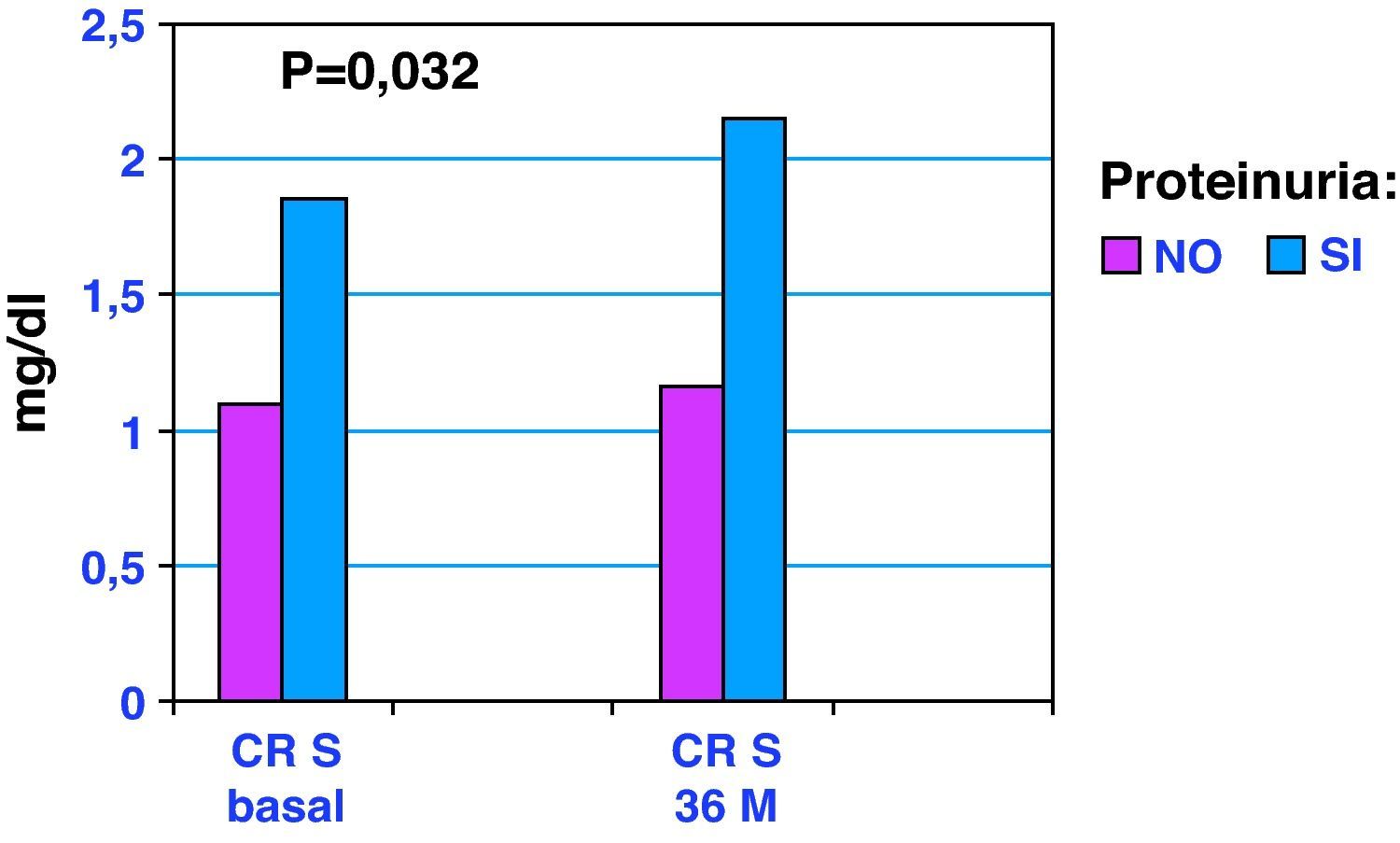
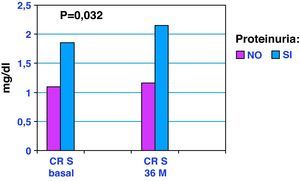
ResultadosVeinticuatro pacientes fallecieron en el seguimiento. La evolución global de la FR (basal vs 36 meses) fue: Crs (mg/dL) 1,25±0,47 vs 1,36±0,61 (p=0,020); urea (mg/dL) 57,92±30 vs 66,75±40 (p=0,006); MDRD (mL/min) 53,33±16 vs 50,23±17 (p=0,032). No hubo diferencias significativas en la evolución de FR en grupos. La evolución de Crs en los grupos sin/con proteinuria basal (g/24 horas); (basal vs 36 meses) fue: sin proteinuria, 1,10±0,25 vs 1,16±0,32; con proteinuria, 1,85±0,68 vs 2,15±0,85 (p=0,032).
ConclusionesConfirmamos un deterioro lento de la FR con el tiempo, pero este deterioro no fue mayor en los ancianos con peor FR basal pero sin proteinuria. Estas conclusiones nos permiten dar un mensaje tranquilizador en ancianos con FGe reducido sin proteinuria.
Chronic kidney disease (CKD) is a global public health problem and the estimated glomerular filtration rate (eGFR) decreases with age. We tracked renal function (RF) in elderly patients with CKD for 36 months.
Patients and methodsEighty clinically stable patients, with a median age of 83 years (range: 69-97; 69% women, 35% with diabetes and 83% with hypertension), were randomly recruited and followed-up for 36 months. The patients were divided into two groups based on serum creatinine (SCr) concentration: group 1 consisted of 38 patients with SCr≤1.1mg/dL (range: 0.7-1.1) and group 2 consisted of 42 patients with SCr>1.1mg/dL (range: 1.2-3). We estimated baseline eGFR and repeated the determinations after 36 months using an abbreviated Modification of Diet in Renal Disease (MDRD) formula.
ResultsTwenty-four patients died during follow-up. The overall change in RF (baseline versus endpoint) was as follows: SCr (mg/dL) 1.25±0.47 vs 1.36±0.61 (P=.020); urea (mg/dL) 57.92±30 vs 66.75±40 (P=.006); MDRD (mL/min) 53.33±16 vs 50.23±17 (P=.032). There were no significant differences between the two groups. Changes in SCr in groups without/with initial proteinuria (g/24h; baseline versus 36 months) were as follows: without proteinuria, 1.10±0.25 vs 1.16±0.32; with proteinuria, 1.85±0.68 vs 2.15±0.85 (P=.032).
ConclusionsWe confirm that RF slowly deteriorates over time. However, this deterioration was not worse in elderly patients with a worse baseline RF without proteinuria. This finding is an optimistic outcome for elderly patients with low eGFR and no proteinuria.
La enfermedad renal crónica (ERC) es considerada como un problema de salud pública1. Este reconocimiento ha sido posible en parte por la definición y clasificación de ERC establecida por la NKF/KDIGO, siendo aplicable a toda la población2. Dicha clasificación se basa en la presencia de manifestaciones de daño renal (hematuria, proteinuria…) y en el grado de filtrado glomerular (FG). Así un filtrado glomerular estimado (FGe) menor de 60ml/min es suficiente para diagnosticar a un paciente de ERC estadio 3. Las guías actuales de ERC definen como progresión rápida de la ERC a un descenso del FG a un ritmo ≥ 4ml/min/año3. Los principales pronósticos que conlleva la ERC son, por un lado, la pérdida progresiva de función renal (FR) y el desarrollo de ERC terminal que requiera terapia sustitutiva renal (TSR), y por otro, un incremento de la mortalidad especialmente cardiovascular3,4. Por tanto, la finalidad de esta clasificación es detectar la ERC desde sus estadios más precoces e instaurar medidas para frenar la progresión y reducir la mortalidad.
Por otra parte, el envejecimiento conlleva un descenso del FG5,6. Considerando que muchas personas añosas son diagnosticadas de ERC basándose en la existencia de un FGe reducido, en el presente estudio nuestro objetivo fue analizar cómo evoluciona la FR de ancianos a los 36 meses de seguimiento. También analizamos la influencia de la diabetes mellitus (DM) y la proteinuria en la evolución de la FR. Por último, valoramos los pronósticos asociados con la ERC: a) porcentaje de pacientes diagnosticados de ERC que inicia TSR, y b) mortalidad a lo largo del seguimiento.
Pacientes y métodosPacientesEstudiamos 80 pacientes clínicamente estables con una mediana de edad de 83 años (rango: 69-97 años), reclutados aleatoriamente cuando los pacientes acudían a las consultas externas programadas de Geriatría y de Nefrología General, en el período comprendido entre enero-abril de 2006. Según los niveles de Crs basal establecimos dos grupos: (Grupo 1: n=38, Crs ≤ 1,1mg/dl [rango: 0,7-1,1], y Grupo 2: n=42, Crs>1,1mg/dl [rango: 1,2-3]).
La distribución de pacientes según estadio de ERC (fórmula MDRD abreviada) en el periodo basal fue: estadio 1: 0%; estadio 2: 30%; estadio 3: 60%; estadio 4: 10%, y estadio 5: 0%.
MétodosEstudio observacional prospectivo. La primera valoración se hizo coincidiendo con una visita programada de los pacientes a su consulta correspondiente en el período enero-abril de 2006. Todos los pacientes fueron seguidos clínica y analíticamente durante 36 meses, realizando una reevaluación en el período enero-abril de 2009.
Las determinaciones analíticas se realizaron una semana antes de acudir los pacientes a las consultas programadas de Geriatría y Nefrología, de forma basal y al cabo de 36 meses. Se determinó en sangre venosa, con la metodología rutinaria del hospital: creatinina y urea. En orina se realizó un análisis sistemático a todos los pacientes para despistaje de proteinuria; en el grupo 1 se hizo el cociente proteinas/creatinina en una micción y en el grupo 2 se hizo una cuantificación de proteinas en orina de 24 horas.
Se estimó el FG con la fórmula MDRD abreviada7. Clínicamente se estudió el desarrollo de ERC terminal/inicio de TSR, la mortalidad y sus causas.
En el período basal, en el grupo 1 no se detectó presencia de proteinuria en el sistemático de orina y el cociente proteinas/creatinina en orina fue<0,05g. En el grupo 2 la proteinuria basal fue de 0,31±0,51g/24 horas (rango: 0-3,0g/24 horas): un 87% de este grupo 2 tenía una proteinuria<0,5g/24 horas, un 5,2% entre 0,5-1g/24 horas y un 7,8% entre 2 y 3g/24h.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS 11.0. Los datos se expresan como porcentajes, medias y desviaciones estándar. Para valorar la evolución de la FR con el paso del tiempo se utilizó un modelo lineal para medidas repetidas. La comparación de proporciones se hace con χ2. El nivel de significación es del 95% (p<0,05). Para analizar el efecto simultáneo de varias variables en la mortalidad se utilizó un análisis de Cox.
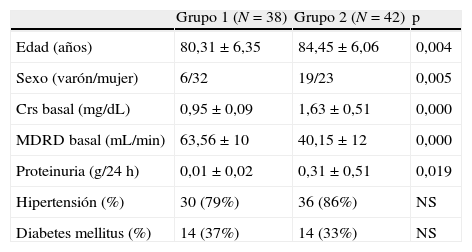
ResultadosEn conjunto, 55 (69%) de los pacientes eran mujeres; 28 (35%) tenían DM y 66 (83%) hipertensión arterial (HTA). Las características sociodemográficas, la FR y los antecedentes de HTA/DM por grupos se muestran en la tabla 1.
Características sociodemográficas, función renal y comorbilidad basal por grupos
| Grupo 1 (N=38) | Grupo 2 (N=42) | p | |
| Edad (años) | 80,31±6,35 | 84,45±6,06 | 0,004 |
| Sexo (varón/mujer) | 6/32 | 19/23 | 0,005 |
| Crs basal (mg/dL) | 0,95±0,09 | 1,63±0,51 | 0,000 |
| MDRD basal (mL/min) | 63,56±10 | 40,15±12 | 0,000 |
| Proteinuria (g/24 h) | 0,01±0,02 | 0,31±0,51 | 0,019 |
| Hipertensión (%) | 30 (79%) | 36 (86%) | NS |
| Diabetes mellitus (%) | 14 (37%) | 14 (33%) | NS |
Crs: creatinina sérica; MDRD: Modification of Diet in Renal Disease formula; NS: no significativo.
Grupo 1: Crs≤1,1mg/dL; Grupo 2: Crs>1,1mg/dL.
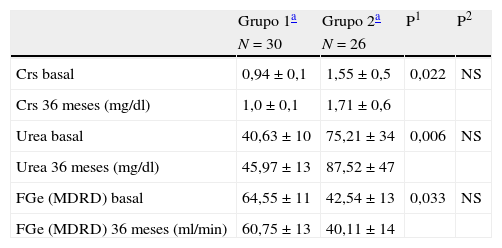
Cincuenta y seis (70%) de los pacientes continúan en el estudio a los 36 meses: 30 del grupo 1 y 26 del grupo 2. Los datos globales de evolución de la FR de estos pacientes que siguen en estudio a los 36 meses fueron (basal versus 36 meses): creatinina (mg/dl): 1,25±0,47 vs 1,36±0,61 (p=0,020); urea (mg/dl): 57,92±30 vs 66,75±40 (p=0,006); MDRD (ml/min): 53,33±16 vs 50,23±17 (p=0,032). La evolución de la FR por grupos se muestra en tabla 2.
Evolución de la función renal por grupos
| Grupo 1a | Grupo 2a | P1 | P2 | |
| N=30 | N=26 | |||
| Crs basal | 0,94±0,1 | 1,55±0,5 | 0,022 | NS |
| Crs 36 meses (mg/dl) | 1,0±0,1 | 1,71±0,6 | ||
| Urea basal | 40,63±10 | 75,21±34 | 0,006 | NS |
| Urea 36 meses (mg/dl) | 45,97±13 | 87,52±47 | ||
| FGe (MDRD) basal | 64,55±11 | 42,54±13 | 0,033 | NS |
| FGe (MDRD) 36 meses (ml/min) | 60,75±13 | 40,11±14 |
NS: no significativo; P1: cambios en el tiempo de seguimiento; P2: diferencias en el cambio en ambos grupos.
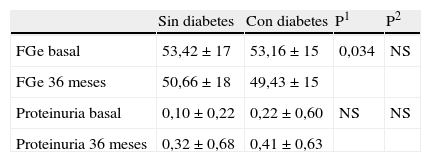
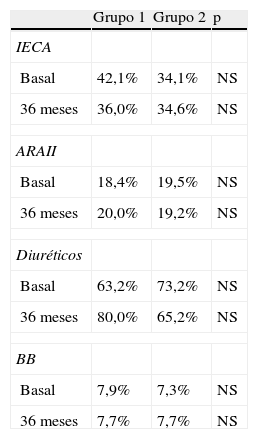
En la figura 1 se muestra la evolución de la creatinina sérica según presencia o no de proteinuria basal. En la tabla 3 se muestra la evolución del FGe y de la proteinuria de acuerdo a presencia o no de DM. En la tabla 4 incluimos información relacionada con los tratamientos en el período basal y a los 36 meses.
Evolución de FGe (MDRD) y proteinuria considerando diabetes mellitus
| Sin diabetes | Con diabetes | P1 | P2 | |
| FGe basal | 53,42±17 | 53,16±15 | 0,034 | NS |
| FGe 36 meses | 50,66±18 | 49,43±15 | ||
| Proteinuria basal | 0,10±0,22 | 0,22±0,60 | NS | NS |
| Proteinuria 36 meses | 0,32±0,68 | 0,41±0,63 |
NS: no significativo; P1: cambios en el tiempo de seguimiento; P2: diferencias en el cambio en ambos grupos.
Tratamientos al inicio y durante el seguimiento
| Grupo 1 | Grupo 2 | p | |
| IECA | |||
| Basal | 42,1% | 34,1% | NS |
| 36 meses | 36,0% | 34,6% | NS |
| ARAII | |||
| Basal | 18,4% | 19,5% | NS |
| 36 meses | 20,0% | 19,2% | NS |
| Diuréticos | |||
| Basal | 63,2% | 73,2% | NS |
| 36 meses | 80,0% | 65,2% | NS |
| BB | |||
| Basal | 7,9% | 7,3% | NS |
| 36 meses | 7,7% | 7,7% | NS |
ARAII: antagonistas de los receptores de angiotensina II; BB: betabloqueantes; IECA: inhibidores del sistema renina angiotensina aldosterona.
Ningún paciente del estudio ha iniciado programa de TSR a los 36 meses. En cambio, un 30% de los ancianos ha fallecido antes de los 36 meses de seguimiento: 8 (21,1%) del grupo 1 y 16 (38,1%) del grupo 2 (p=0,097). Las causas del exitus fueron: 7 por deterioro estado general; 4 por ictus; 3 por tumores y 3 por infecciones, 2 por complicaciones de fracturas, 2 de causas cardiacas y 3 de causa desconocida.
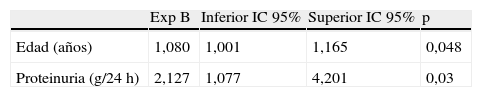
Únicamente la edad y la proteinuria fueron los factores predictores de mortalidad en el análisis de Cox como se muestra en la tabla 5.
DiscusiónEn este estudio nosotros hacemos un seguimiento de una cohorte de pacientes ancianos diagnosticados de ERC analizando la evolución de la FR en el tiempo. En estos pacientes, la FR disminuye progresivamente durante los 36 meses de seguimiento.
Existe un amplio debate acerca del rango normal de FR en el anciano8–10. La presente clasificación de ERC (aplicable a toda la población con el mismo criterio) hace que muchos pacientes ancianos sean etiquetados de ERC debido a un FGe<60ml/min, generando un debate entre los profesionales sanitarios al considerarla como «epidemia».
El estudio longitudinal de Baltimore mostró un descenso en el FG (CCr) a ritmo de 0,75ml/min/año en 254 voluntarios sanos en un seguimiento de más de veinte años11. En este trabajo hemos analizado cómo evoluciona la FR en los ancianos con Crs en rango normal de laboratorio (grupo 1) y en pacientes con FR alterada en el periodo basal (grupo 2) comprobando como en ambos grupos el FGe disminuye de la misma manera: descenso lento de la FR que podría explicarse por el efecto edad.
La clasificación actual de ERC basada en 5 estadios según las manifestaciones de daño renal y el grado de FGe, obtenido generalmente a través de la fórmula matemática MDRD, supone que muchos ancianos «sanos» sean diagnosticados de ERC, basándose únicamente en un FGe reducido8. Así, diversos trabajos han estudiado la prevalencia de la ERC en la población general, obteniendo unos resultados que han permitido considerarla como una verdadera «epidemia»1. En una revisión reciente de 26 estudios se concluye que la ERC es muy común en los ancianos y que varía según el método de estimación del FG empleado: la prevalencia es mayor si se emplea la formula Cockcroft-Gault en lugar de la de MDRD12. Aunque la prevalencia de ERC en los ancianos, estimada con el MDRD, es muy común, los estudios específicos en población añosa destinados a valorar cómo va a ser la progresión de su ERC y su pronóstico a largo plazo, son escasos13. En este trabajo, con una población con una mediana de edad>de 80 años en el periodo de reclutamiento y un seguimiento de 36 meses encontramos que el FG disminuye lentamente, independientemente del grupo de partida.Respecto a los principales pronósticos asociados al diagnóstico de la ERC, en este estudio ningún paciente ha precisado TSR y en cambio un 30% de ellos ha fallecido, sin encontrar diferencias significativas en la mortalidad entre ambos grupos (población de edad avanzada). Por lo tanto, los beneficios teóricos de conocer el FGe de toda la población (utilizando la fórmula MDRD) como screening de la ERC, lo que nos permitiría instaurar medidas para intentar frenar la progresión de la enfermedad renal pueden no estar justificados en los ancianos ya que en esta población, por un lado la progresión es lenta y por otro el riesgo de fallecer es muy superior al de desarrollar ERC terminal/TSR al igual que se describe en otros trabajos14,15.
Por otra parte, la proteinuria es el principal signo del daño renal16. En este trabajo al analizar la evolución de Cr a los 36 meses según la presencia o no de proteinuria, comprobamos como los pacientes proteinúricos presentan una elevación significativa de la Crs. Por tanto, es en los ancianos con proteinuria donde el FGe puede empeorar más rápidamente y por tanto son ellos los que más se pueden beneficiar del seguimiento y los cuidados nefrológicos. Además en nuestro estudio, la proteinuria también es un factor de riesgo independiente de mortalidad, como se muestra en el análisis de Cox, al igual que se comunica en un estudio reciente de Hemmelgarn et al17.
En conclusión, nosotros confirmamos un lento descenso de la FR en el tiempo en nuestra cohorte de pacientes con ERC, pero este deterioro no fue mayor en pacientes con peor FR basal. Sólo la proteinuria basal predice peor evolución del FGe en el tiempo. Estos hallazgos nos permiten dar un mensaje tranquilizar para aquellos pacientes con FGe reducido y sin proteinuria. Las guías actuales deben aplicarse con cautela en los ancianos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.