La hiperfosfatemia asociada a la enfermedad renal crónica (ERC) está implicada en el desarrollo de calcificaciones vasculares y puede considerarse como un factor de riesgo de eventos cardiovasculares adicional a los factores clásicos. Recientemente se ha comercializado un nuevo captor o quelante de fósforo, el carbonato de lantano, siendo un fármaco que rápidamente se ha incorporado al arsenal terapéutico disponible para el tratamiento de la hiperfosfatemia junto con las sales de calcio y el sevelamer. Se han revisado los nuevos datos publicados sobre este fármaco así como los resultados de los principales ensayos. Se trata de un principio activo con perfil de seguridad adecuado, que presenta una alta eficacia a la hora de captar el fósforo procedente de la dieta. Los resultados publicados de los ensayos de eficacia comparada frente a sevelamer muestran una mayor eficacia del carbonato de lantano en la reducción de la fosfatemia. Ambos fármacos podrían ralentizar la progresión de calcificaciones vasculares en enfermos con ERC, diferenciándose de los captores cálcicos. Este hecho, al igual que su posible repercusión positiva sobre la supervivencia en enfermos mayores de 65 años, precisaría ser confirmado con nuevos ensayos comparativos a largo plazo.
Hyperphosphatemia associated with chronic kidney disease (CKD) seems to be involved in the development of vascular calcifications and can be considered as a risk factor for cardiovascular events in addition to classical risk factors. A new phosphate-binding drug, lanthanum carbonate, has recently been marketed and has rapidly been added to the available therapeutic arsenal for hyperphosphatemia together with calcium salts and sevelamer.
We reviewed the new data published on this drug, as well as the results from the main clinical trials. Lanthanum carbonate shows an adequate safety profile and is highly active in terms of binding dietary phosphorus. Results from comparative trials versus sevelamer show a higher efficacy in terms of reduction of serum phosphate in favor of lanthanum carbonate. Both drugs may slow the progression of vascular calcifications in patients with CKD compared with calcium-based binders. This finding, as well as the potential benefit of lanthanum carbonate in increasing life expectancy in CKD patients over 65 years old, needs to be confirmed in new, long-term comparative trials.
La hiperfosfatemia y la elevación del producto fosfo-cálcico dentro de la enfermedad renal crónica (ERC) parecen estar asociados con un mayor riesgo de mortalidad en esta población1. Los pacientes con enfermedad renal crónica en estadios III-IV (filtrado glomerular<60ml/min) podrían tener también un incremento de mortalidad de cualquier origen cuando sus niveles de fósforo en sangre fueran superiores a 3,5mg/dl2, incluso con cifras dentro del límite de la normalidad (< 4,5mg/dl). La elevación del fósforo sanguíneo se detecta en estadios más evolucionados de la enfermedad, describiéndose previamente otras alteraciones metabólicas dentro de lo que actualmente se define como alteraciones del metabolismo mineral y óseo asociadas a la enfermedad renal crónica (AMOM-ERC), tales como elevación del fibroblast growth factor-23 (FGF-23), elevación de la PTH, incremento de la excreción fraccionada de fósforo, sin incremento del fósforo total en orina de 24 horas y descenso de calcitriol.
El porqué del incremento de la mortalidad asociado a la hiperfosfatemia tiene que ver con un aumento de calcificaciones vasculares y valvulares, lo que sin duda conduce a un mayor número de eventos cardiovasculares3–7. También el incremento de FGF-23, que como principal hormona reguladora de la homeóstasis del fósforo se eleva para forzar la excreción urinaria de fosfato, se ha asociado a un incremento de mortalidad, independientemente de los niveles de fósforo8. En este sentido se ha visto como el exceso de FGF-23 se correlaciona con la aparición de hipertrofia ventricular izquierda tanto en pacientes con ERC9 como incluso en población sana añosa10.
El control de hiperfosfatemia se fundamenta en tres actuaciones terapéuticas: dieta hipofosfatémica, fármacos quelantes o captores de fósforo, y diálisis. La dieta hipofosfatémica casi siempre lo es también hipoproteica, lo que hace que a largo plazo sea difícil su cumplimiento. En un estudio de seguimiento de 3 años con 30.075 pacientes con ERC11 se concluye que el grupo de pacientes que siguen dieta con fósforo bajo y proteínas elevadas presenta una mejor supervivencia que cualquiera de los otros 3 grupos (proteínas y fósforo altos, proteínas y fósforo bajos o proteínas bajas y fósforo alto). Esto nos hace reflexionar sobre la necesidad de emplear captores de fósforo, ya en estadios III-IV de ERC, para posibilitar así una ingesta adecuada de proteínas sin que se eleve la fosfatemia. Por otro lado, en los pacientes en diálisis, se ha demostrado que el incremento de la frecuencia de diálisis proporciona un mejor control de la fosfatemia12, si bien el tratamiento diario de hemodiálisis continuo no puede ser asumible por las administraciones por motivos de recursos humanos y económicos.
Los fármacos quelantes de fósforo se agrupan en cálcicos (carbonato cálcico y acetato cálcico) y no cálcicos (sevelamer, lantano y aluminio). En los últimos años se ha incorporado el carbonato de lantano como un nuevo captor, que ha sido rápidamente integrado a la práctica clínica, y del cual continúan apareciendo evidencias científicas. En este artículo pretendemos realizar una revisión actualizada de la farmacocinética, farmacodinamia, eficacia y seguridad del carbonato de lantano, haciendo especial énfasis en los datos de eficacia comparada recientemente publicados.
Farmacocinética y farmacodinamiaEl lantano es un catión trivalente con gran afinidad por el fósforo, y se comercializa como carbonato de lantano. Este se administra durante las principales comidas o inmediatamente después de las mismas en forma de comprimidos masticables de 500, 750 o 1.000mg. Es fundamental que el paciente mastique muy bien el comprimido para conseguir el efecto quelante sobre el fósforo de la dieta. Adicionalmente el comprimido se puede triturar y mezclar el polvo resultante con la comida. En aquellos casos donde el comprimido no se mastica adecuadamente, los restos del comprimido se aprecian en una exploración radiológica rutinaria. La biodisponibilidad en humanos es extremadamente baja (0,00127%) y la pequeña cantidad de lantano absorbido viaja unido en un 99% a la transferrina13. La concentración plasmática media en enfermos renales se ha estimado en 0,5 ng/ml14. No atraviesa la barrera hematoencefálica, según los resultados obtenidos en modelos animales15,16. Se ha detectado lantano en hueso, con una distribución homogénea en todo el tejido óseo, y la concentración media de lantano al año de tratamiento es de 1μg/g de tejido fresco17. Basándose en datos obtenidos de biopsias de pacientes tratados hasta 5 años, se ha estimado que la concentración en hueso a 10 años se mantendría en un equilibrio estable hasta alcanzar los 6,6μg/g de tejido fresco17. En cualquier caso, no se ha relacionado la presencia de lantano en el tejido óseo con ningún efecto deletéreo sobre dicho tejido.
El carbonato de lantano no se metaboliza y es eliminado a través del sistema hepático lisosomal, excretándose a la bilis.
En la cámara gástrica y principalmente en la luz intestinal se forma fosfato de lantano (como consecuencia de la unión del fósforo de la dieta y el desplazamiento del ion carbonato), sal no absorbible y cuyo producto de solubilidad es extremadamente bajo [Psol=2x10−6]. De esta manera, el fósforo captado se elimina como fosfato de lantano en las heces.
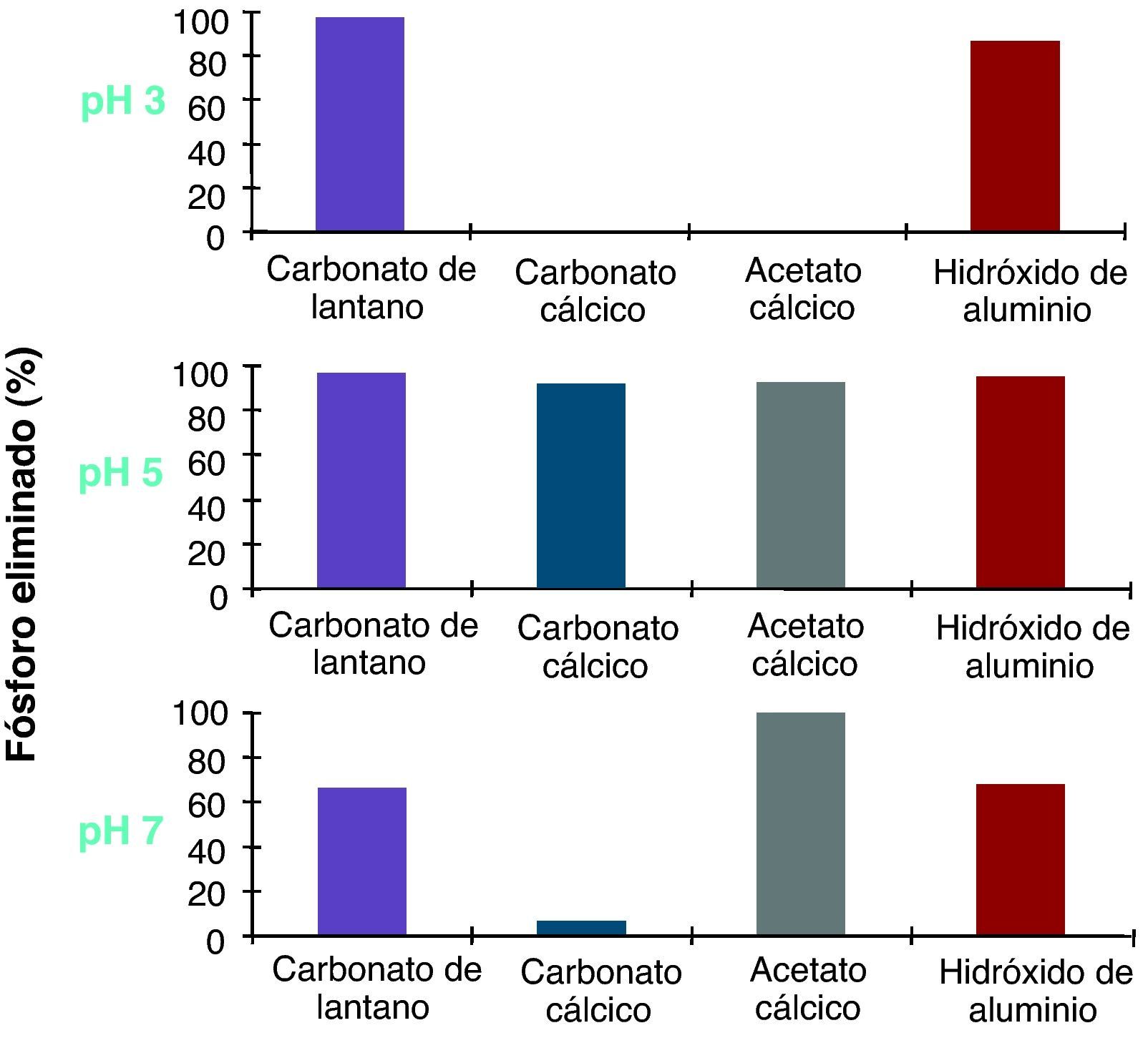
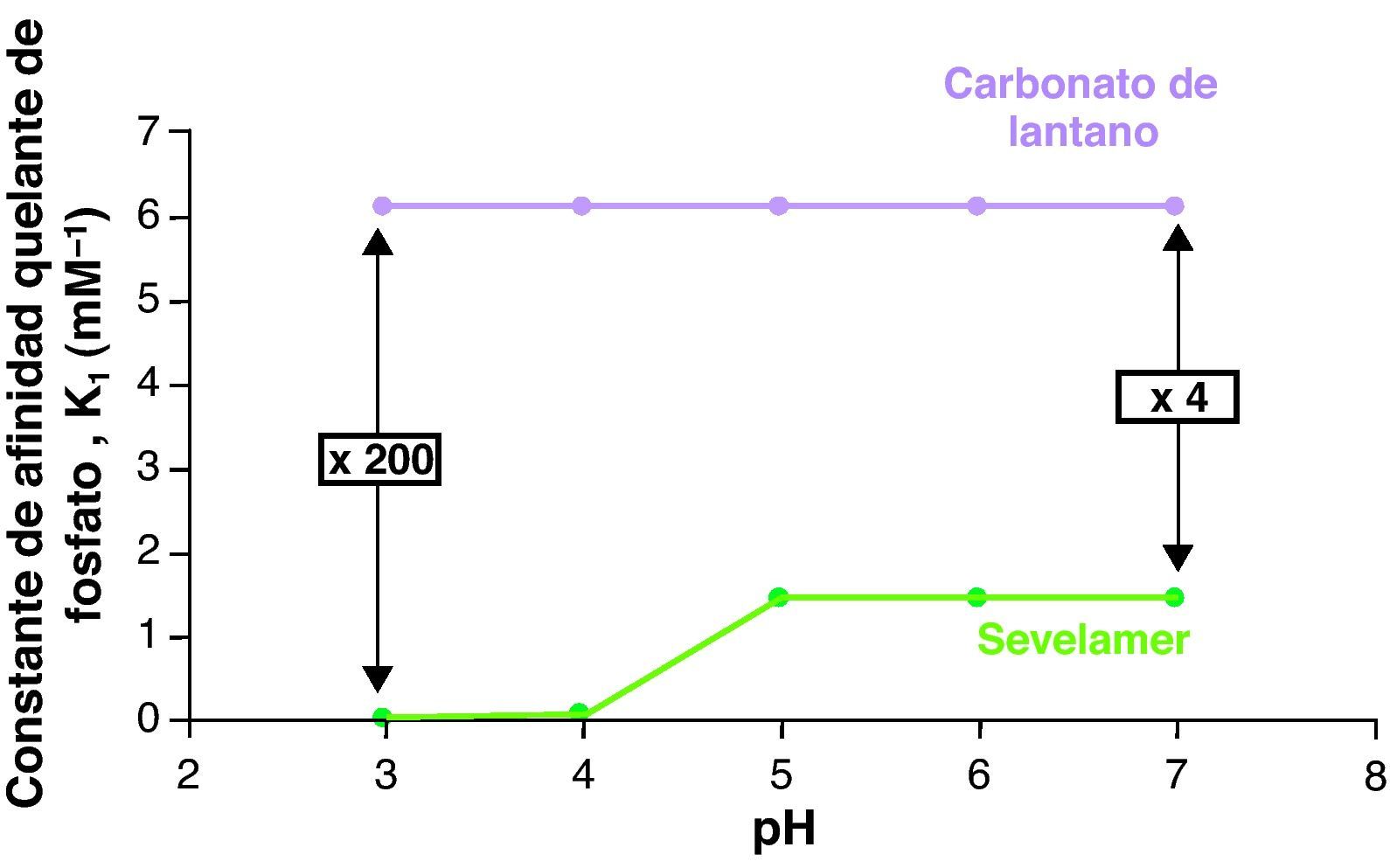
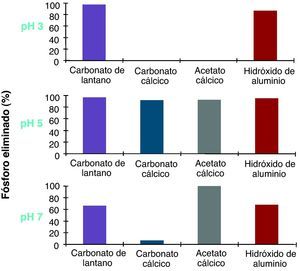
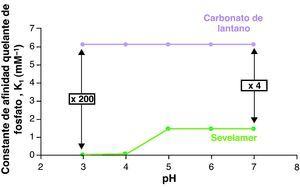
Los resultados publicados de estudios in vitro indican que el lantano capta fósforo en un amplio rango de pH, entre 3 y 7 (alta afinidad quelante independientemente del pH dentro de este rango). Esta característica es compartida con el hidróxido de aluminio18. Los otros quelantes comercializados son eficaces en un rango de pH más estrecho, entre 5 y 7 (figs. 1 y 2). Se ha calculado que la afinidad del lantano por el fósforo (constante de Langmuir, K1) es 200 veces mayor que el sevelamer a pH 3-4, y 4 veces mayor a pH 5-7.
Afinidad de unión al fósforo de los diferentes captores en función del pH. Tanto el carbonato de lantano como el hidróxido de aluminio actúan en un rango de pH de entre 3 y 7. Modificado de Autissier et al18.
Afinidad del carbonato de lantano y del sevelamer por el fósforo expresada por la constante de Langmuir, K1. La afinidad del carbonato de lantano es 4 veces mayor que sevelamer en el rango de pH entre 5 y 7. Modificado de Autissier et al18.
La bajísima solubilidad del fosfato de lantano, en gran medida causada por el tipo de enlace (el enlace iónico del lantano tiene una intensa preferencia por los átomos donantes de oxígeno de los que los ligandos más frecuentes son los grupos carboxilo y fosfato), contrasta con la solubilidad del fosfato de sevelamer (sal resultante al unirse el fósforo de la dieta desplazando al ion cloruro). En presencia de ácidos biliares la unión fósforo-lantano se mantiene estable, a diferencia de la unión fosfato-sevelamer, donde tras 5 horas de incubación con ácidos biliares hasta el 56% del fósforo atrapado es desplazado por ácidos biliares19. La diferencia reside en el tipo de enlace químico, ya que el sevelamer es una resina de intercambio iónico que se une al fósforo con un enlace débil (enlace de intercambio iónico).
El carbonato de lantano no interfiere con la absorción de vitaminas liposolubles. Este hecho tampoco se ha comunicado con la administración de hidróxido de aluminio ni con sales de calcio. Sin embargo, la administración simultánea de carbonato de sevelamer y calcitriol supone una reducción del 57% de la biodisponibilidad de dicha vitamina D activa20.
En 121 enfermos en prediálisis (estadios 3 y 4) el carbonato de lantano disminuyó tanto el fósforo sérico (0,55mg/dl) como la excreción urinaria de fósforo (247mg/dl), con dosis de 750 -1.000mg por comida21. Adicionalmente se comprobó un descenso de la PTH intacta comparado con el grupo placebo control al final de las 8 semanas que duró el tratamiento (p=0,02).
El carbonato de lantano administrado a pacientes en diálisis logra disminuir tanto la fosfatemia (en torno a un 30% respecto a los valores basales) como el producto calcio fósforo22. En cuanto a otros efectos farmacodinámicos adicionales es de destacar la reducción de la calcificación vascular observada en ensayos con modelos animales tratados con lantano frente a sus respectivos controles23–25. Este hecho, que también se ha descrito con sevelamer, puede explicarse al tratarse de captores de fósforo sin calcio, traduciéndose en un posible beneficio protector sobre la formación y progresión de las calcificaciones vasculares.
También se ha documentado en ensayos clínicos de 2 años de duración la mejora de algunos parámetros de actividad ósea, en comparación con los efectos observados sobre dichos parámetros por otros captores, de los cuales la mayoría eran sales de calcio26. Los resultados de las biopsias óseas indicaron un mayor recambio óseo al año de tratamiento con lantano en comparación con los pacientes tratados con otros captores. A los 2 años las biopsias óseas de los pacientes tratados con lantano denotaban un mayor volumen óseo en comparación con el otro grupo.
Recientemente se ha publicado un análisis de supervivencia27 de una población de 1.354 enfermos, tratados durante 2 años con carbonato de lantano u otros captores, incluido clorhidrato de sevelamer. En análisis post hoc de la subpoblación mayor de 65 años (n=336), el 27% (44 de 163) de los tratados con lantano había fallecido frente al 39,3% (68 de 173) de los tratados con terapia estándar (p=0,04). Estos resultados de mejor supervivencia con un captor no cálcico también han sido comunicados para los pacientes mayores de 65 años tratados con sevelamer frente a los pacientes tratados con quelantes cálcicos28,29.
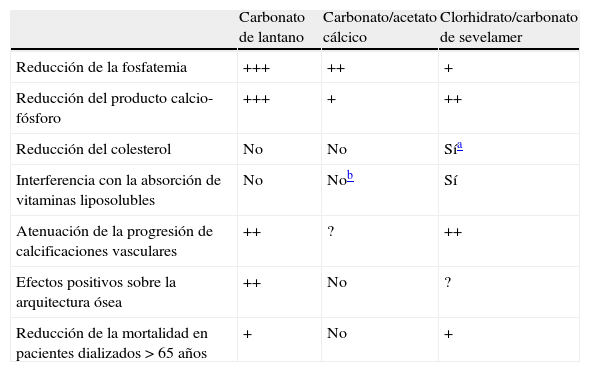
En la tabla 1 se recogen los principales efectos farmacodinámicos de los captores de fósforo aprobados para el tratamiento de la hiperfosfatemia asociada a la ERC.
Efectos farmacodinámicos de los principales quelantes o captores de fósforo
| Carbonato de lantano | Carbonato/acetato cálcico | Clorhidrato/carbonato de sevelamer | |
| Reducción de la fosfatemia | +++ | ++ | + |
| Reducción del producto calcio-fósforo | +++ | + | ++ |
| Reducción del colesterol | No | No | Sía |
| Interferencia con la absorción de vitaminas liposolubles | No | Nob | Sí |
| Atenuación de la progresión de calcificaciones vasculares | ++ | ? | ++ |
| Efectos positivos sobre la arquitectura ósea | ++ | No | ? |
| Reducción de la mortalidad en pacientes dializados > 65 años | + | No | + |
El carbonato de lantano puede administrarse en pacientes con ERC en estadios 3 y 4 que presenten cifras de fósforo elevadas a pesar de la dieta. Como se ha mencionado anteriormente21, el carbonato de lantano en esta población de pacientes a dosis de 2.250-3.000mg/ día logra disminuir la fosfatemia a las 8 semanas (5,28 vs 4,73mg/dl) y la excreción urinaria de fósforo de 24 horas (836,35 vs 588,65mg a las 8 semanas). Estas diferencias fueron estadísticamente significativas con respecto al grupo placebo (fig. 3). También con respecto a este grupo se computa un descenso en las cifras de PTH intacta en el grupo de tratamiento activo, lo que indica que al descender la absorción intestinal de fósforo, la «sobrecarga» de fósforo a la que va a estar expuesto el individuo es menor y la necesidad de una hormona fosfatúrica como lo es la PTH van a ser menores. En este trabajo no se aportan datos sobre la otra hormona fosfatúrica implicada en la homeostasis de fósforo, el FGF23, pero cabría esperar un descenso del mismo por el mismo argumento expuesto.
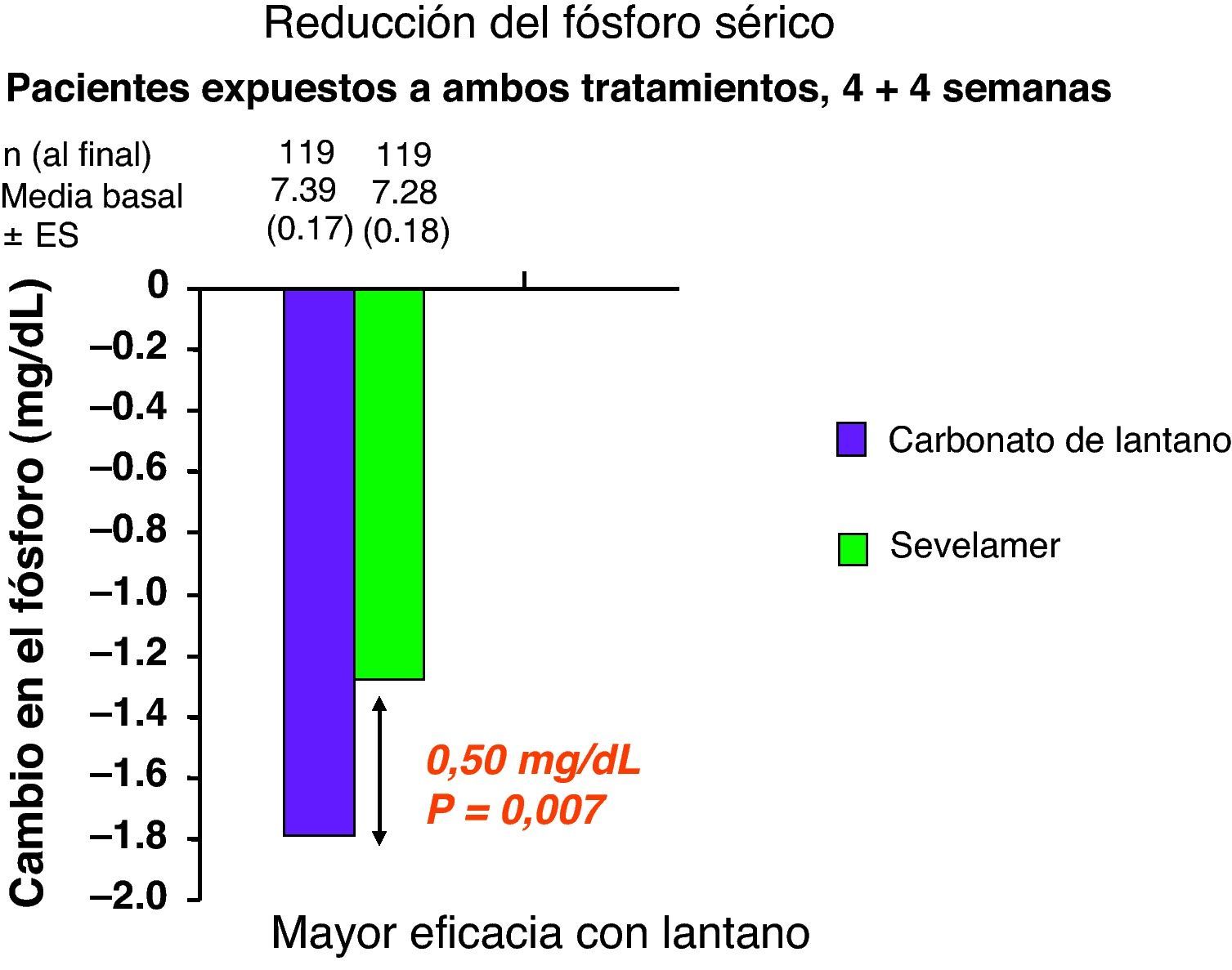
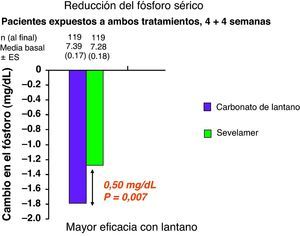
Descensos de la fosfatemia durante los periodos de tratamiento con carbonato de lantano y carbonato de sevelamer. Modificado de Sprague SM et al34.
En cuanto a la seguridad del fármaco en estos pacientes, en este ensayo se comunicó algún evento adverso relacionado con el tratamiento en un 19,3% de los enfermos tratados con carbonato de lantano frente al 16,7% de los tratados con placebo. Ningún acontecimiento adverso serio se relacionó con el tratamiento. Los más frecuentes fueron de índole gastrointestinal, tales como náuseas (9% con lantano y 9,8% con placebo), y vómitos (6,4% vs 2,4%).
Pacientes en diálisisSe realizaron varios ensayos clínicos de fase II y fase III, que mostraban la eficacia y seguridad del captor. Los dos ensayos de fase III de mayor entidad necesarios para el registro fueron el 301 y el 307 al ser los de mayor tiempo de seguimiento y mayor número de pacientes incluidos. El ensayo 301 recoge los resultados de 800 pacientes aleatorizados 2:1 a recibir carbonato de lantano o carbonato cálcico30. Se trata de un ensayo de no inferioridad con el objetivo de comprobar qué porcentaje de pacientes en ambos grupos de tratamiento presentaba a los 6 meses una fosfatemia ≤ 5,58mg/dl. A las 25 semanas de tratamiento el 65,8% de los pacientes que habían recibido lantano y el 63,9% que recibieron carbonato cálcico alcanzaron el objetivo. La dosis más empleada de lantano fue 1.500mg/día, mientras que más del 70% de los pacientes tratados con calcio recibió 3.000mg día o dosis mayores (hasta 9.000mg). Los eventos adversos registrados presentaron una frecuencia similar en ambos grupos de tratamiento, a excepción de los episodios de hipercalcemia que fueron del 0,4% en el grupo de pacientes tratados con lantano frente al 20,2% de los tratados con calcio (p<0,001). De los efectos secundarios más frecuentes cabe destacar por una frecuencia mayor del 5% los vómitos (18,4%), náuseas (15,9%), diarrea (12,6%), hipotensión (7,5%), calambres musculares (7,1%), rinitis (6,9%), estreñimiento (6%) y cefalea (5,1%). En este primer ensayo llama la atención la baja dosis empleada de lantano y la elevada dosis de carbonato de calcio, ya que un 70% de los enfermos fue tratado con una dosis diaria de calcio superior a la máxima recomendada por las guías internacionales, esto es, 1,5g31. Tras los 6 meses, se ofreció a los pacientes continuar en una fase de extensión de 2,5 años, donde fueron tratados exclusivamente con carbonato de lantano. El 69% de los enfermos presentó una fosfatemia ≤ 5,58mg/dl al final del ensayo32.
El segundo de estos ensayos de fase III14 recoge datos de 1.359 pacientes, tratados con carbonato de lantano (n=682) o bien con otros captores (n=677), incluyendo compuestos cálcicos, sevelamer, magnesio y aluminio. Los pacientes fueron estudiados durante 2 años. En el grupo de captores clásicos, los pacientes podían estar tratados con varios fármacos y las dosis oportunas. Tras los 2 años, no hubo diferencias significativas entre la proporción de pacientes con fósforo controlado según protocolo (≤ 5,9mg/dl) en ambos brazos de tratamiento (46% para tratamiento con lantano y 49% para quelantes clásicos). En el grupo de pacientes tratados con lantano la PTH se mantuvo a lo largo de los 2 años en el rango de 150-300 pg/ml, tal y como recomiendan las guías K/DOQI33.
Recientemente también se han comunicado los resultados de un ensayo de fase IIIb comparativo directo entre carbonato de lantano y clorhidrato de sevelamer realizado en pacientes en diálisis34. Este ensayo presentó un diseño de brazos entrecruzados de tratamiento, de tal manera que un grupo de pacientes inicialmente estuvo tratado con lantano durante 4 semanas, seguido de un periodo de lavado de 2 semanas y posteriormente otras 4 semanas de tratamiento de sevelamer. El otro grupo comenzó tratamiento con sevelamer 4 semanas, continuando con un periodo de lavado de 2 semanas para finalizar con 4 semanas de tratamiento con lantano. El objetivo principal fue comparar la reducción de la fosfatemia que se consiguió durante cada periodo de tratamiento con cada fármaco. Las dosis empleadas fueron en la primera semana de cada periodo 2.250mg/día de lantano y 4.800mg/día de sevelamer. En las semanas 2, 3 y 4 de cada periodo se compararon dosis mayores para cada fármaco: 3.000mg/día de lantano frente a 6.400mg/día de sevelamer. En total 119 enfermos realizaron correctamente el tratamiento con ambos fármacos y acudieron a todas las visitas y extracciones de analíticas. Al final del periodo del tratamiento con lantano la fosfatemia se redujo en 1,8mg/dl, mientras que al finalizar el periodo de tratamiento con sevelamer esta descendió 1,3mg/dl. La diferencia de 0,5mg/dl al final de los periodos de tratamiento fue estadísticamente significativa (p=0,007), favorable al lantano (fig. 3). Los eventos adversos notificados fueron sobre todo del área gastrointestinal, sin encontrarse diferencias estadísticamente significativas entre ambos periodos de tratamiento.
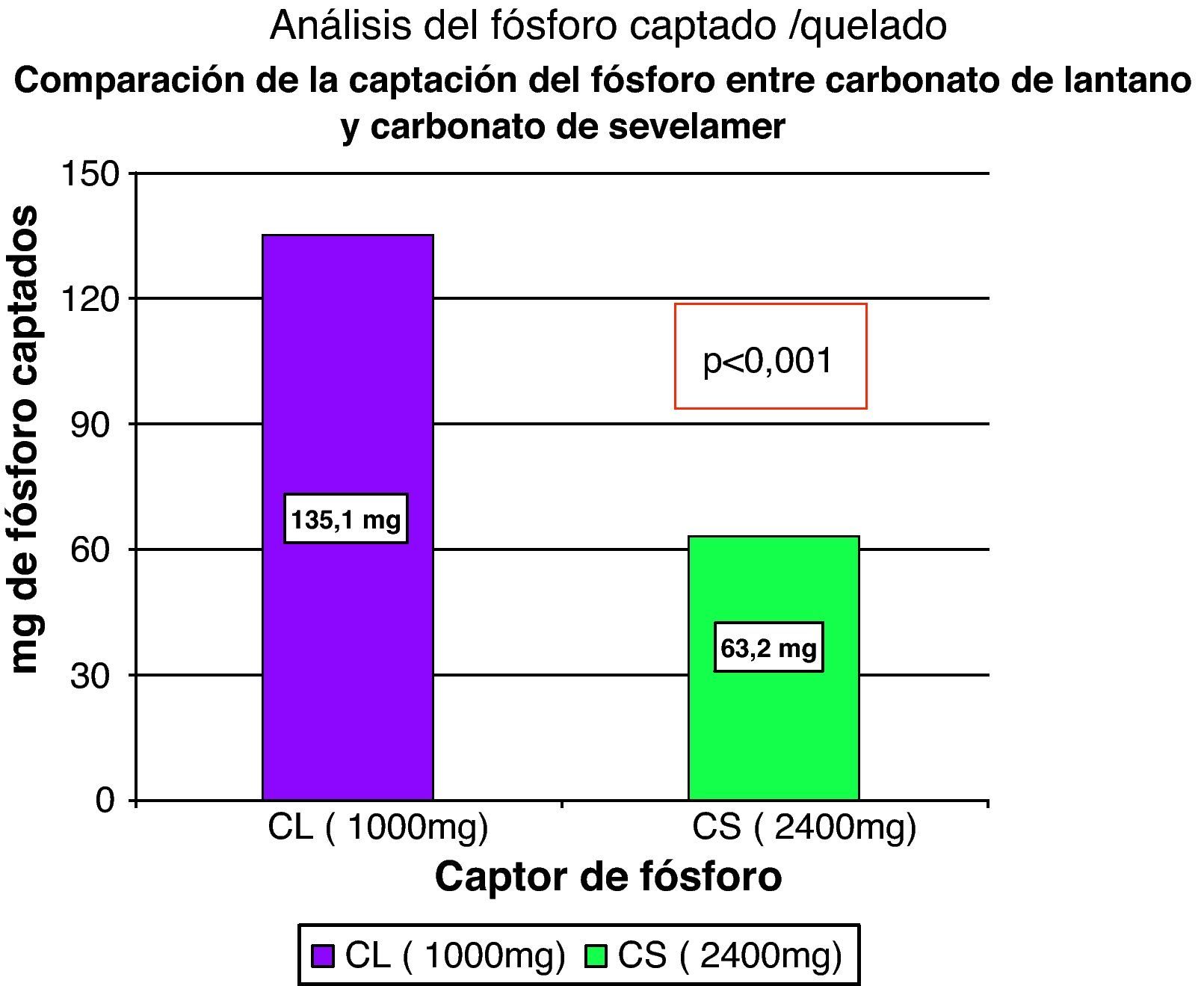
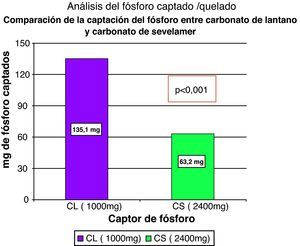
Otros estudiosMerece la pena destacar la comunicación de los resultados de un ensayo comparativo de balance metabólico de fósforo, llevado a cabo en voluntarios sanos35. Se trata de un ensayo fase I aleatorizado, abierto, de brazos cruzados, donde los sujetos eran asignados a 4 secuencias de tratamiento: 1.000mg de carbonato de lantano y dieta, 2.400mg de carbonato de sevelamer y dieta, solamente dieta o ayuno. La secuencia de ayuno fue asignada en todos los casos en último lugar. Un total de 18 sujetos efectuaron correctamente todas las secuencias. Se estudió la absorción de fósforo y la captación del mismo en la luz intestinal por los fármacos captores. Los sujetos ingresaron en la unidad de ensayos de fase I en 4 ocasiones, administrándoles una cena líquida el día 1 del ingreso. Cuatro horas antes de la comida pautada se les realizó un lavado gastrointestinal con sonda nasogástrica con 3 litros de manitol. Diez horas después de la comida (y la dosis única de fármaco si les correspondía) se procedió a un nuevo lavado con manitol. El fósforo absorbido solo con dieta, dieta+carbonato de sevelamer y dieta+carbonato de lantano fue respectivamente 281,7mg, 221,8mg y 156mg. La absorción fue significativamente menor con la dieta asociada a quelantes que cuando solo se administró la dieta. La menor absorción registrada al administrar lantano que cuando se pautó sevelamer (65,8mg) fue estadísticamente significativa p<0,001. Complementariamente también se estudió el fósforo captado por ambos fármacos, aplicando la siguiente fórmula: P captado=P en el lavado gastrointestinal (comida+quelante) – P en el lavado gastrointestinal tras solo comida. Se encontró que 1.000mg de carbonato de lantano atraparon 135,1mg de fósforo y 2.400mg de carbonato de lantano 63,2mg, siendo la diferencia (71,9mg) estadísticamente significativa (p<0,001) (fig. 4). No hubo diferencias significativas en términos de frecuencia de eventos adversos, entre ambos tratamientos, ninguno fue considerado grave y todos habían sido descritos previamente.
Diferencias de la captación de fósforo con la administración de 1g de carbonato de lantano o 2,4g de carbonato de sevelamer. Modificado de Poole et al35.
La hiperfosfatemia asociada a la ERC está implicada en la progresión de calcificaciones vasculares. La hiperfosfatemia es un potente estímulo para la liberación de 2 hormonas fosfatúricas, tales como el FGF-23 y la PTH. El exceso de FGF23 se correlaciona con un incremento de la incidencia de hipertrofia ventricular y mortalidad.
Tanto el carbonato de lantano como el sevelamer son captores de fósforo no cálcicos que podrían ralentizar la progresión de las calcificaciones vasculares en pacientes con ERC. La utilización de estos dos fármacos frente a captores cálcicos en poblaciones mayores de 65 años podría aportar una ventaja en términos de supervivencia, si bien se precisan ensayos aleatorizados a más largo plazo para confirmar este hecho.
El carbonato de lantano es un fármaco captor de fósforo selectivo y eficaz en el control de la fosfatemia tanto en pacientes en prediálisis como en diálisis. Su eficacia a la hora de atrapar el fósforo de la dieta es mayor que la de sevelamer. A diferencia de este último quelante el lantano no interfiere con la absorción intestinal de vitamina D.
Su perfil de seguridad, con datos publicados a 6 años de seguimiento, es muy semejante al de sevelamer y al de los captores cálcicos, si bien con la ventaja de provocar menores episodios de hipercalcemia con respecto a estos últimos.