Los cambios producidos en la definición, el diagnóstico y el tratamiento de la enfermedad mineral y ósea han obligado a revisar las guías de práctica clínica, entre ellas las de la Sociedad Española de Diálisis y Trasplante, realizada en el año 2003. Hoy en día, en 2010, más que de «osteodistrofia» se habla de alteraciones del metabolismo mineral en relación con la enfermedad renal crónica. Estas alteraciones tienen un papel importante en la patogenia de las calcificaciones extraesqueléticas, vasculares y no vasculares. Su presencia está directamente relacionada con las complicaciones cardiovasculares y la mortalidad de los pacientes renales.
Major recent changes in the definition, diagnosis and treatment of mineral and bone disease require the update of prior recommendations for clinical practice guidelines. Today, the term renal osteodystrophy has been replaced by (CKD-MBD-chronic kidney disease-mineral bone disease). To reflect the multiple abnormalities in bone and mineral metabolism associated with chronic kidney disease. These alterations play a key role in the pathogenesis of extraskeletal calcifications, both vascular and soft tissue. Their appareance is directly related to cardiovascular complications and the high mortality of renal patients.
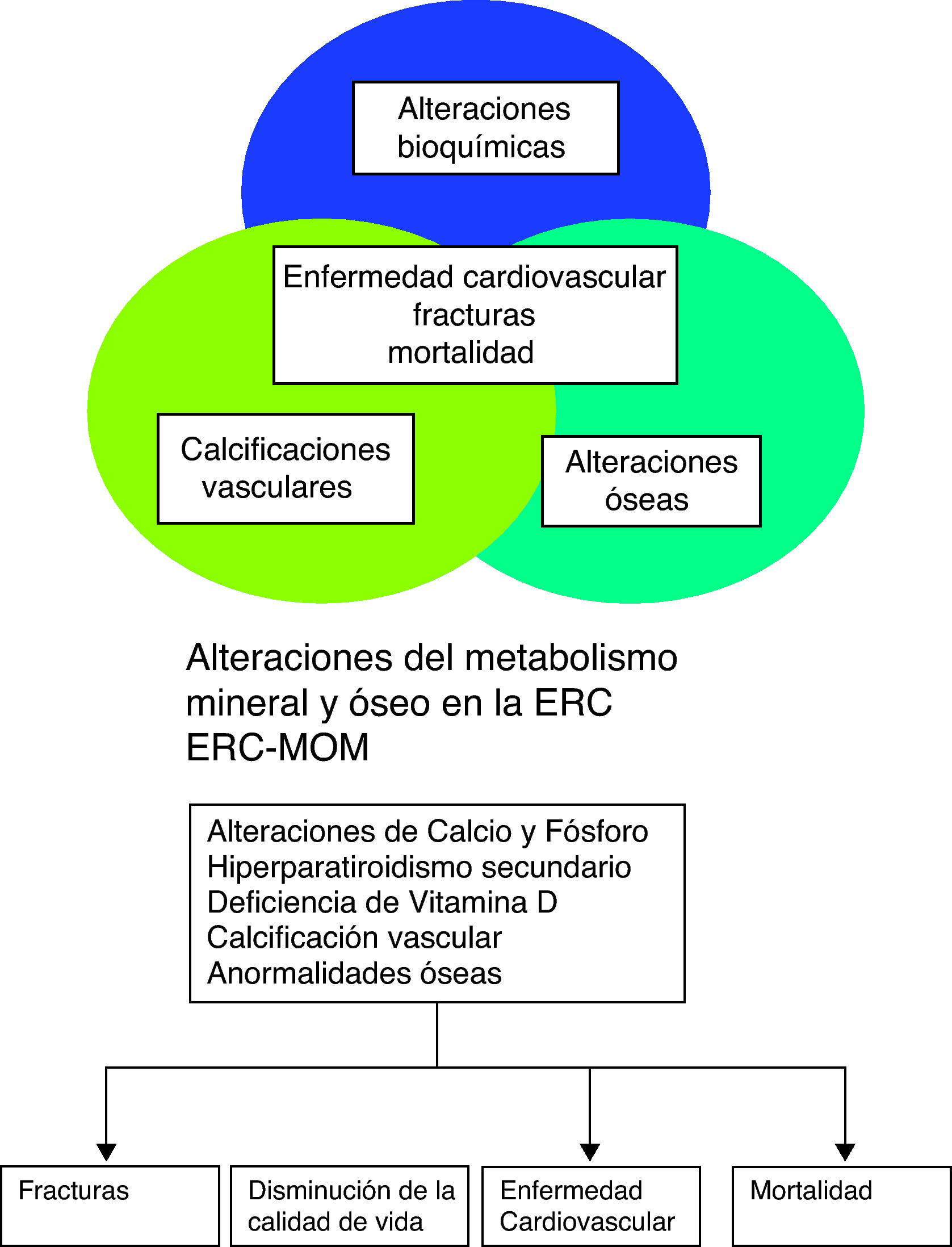
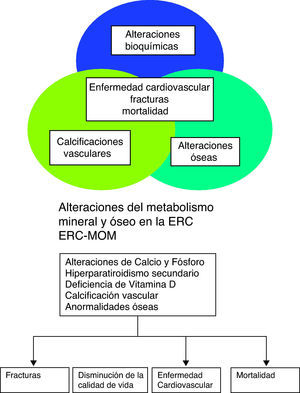
El hiperparatiroidismo secundario (HPT 2.°) representa una complicación grave de la insuficiencia renal crónica (IRC) y constituye la forma más conocida, aunque no la única, de alteración ósea asociada a la misma. Hasta la última década del siglo XX el problema de la osteodistrofia renal estaba enfocado sólo hacia las alteraciones óseas, ya que los pacientes presentaban importantes dolores musculares, deformidades óseas, fracturas y en los niños se añadía falta de crecimiento estatural, conociendo esta alteración como enanismo renal. Hoy día más que de osteodistrofia se habla de alteraciones del metabolismo mineral y óseo en relación con la enfermedad renal crónica (ERC). Estas alteraciones tienen un papel fundamental en la patogénesis de las calcificaciones extraesqueléticas, tanto vasculares como de tejidos blandos. Su aparición está directamente relacionada con las complicaciones cardiovasculares y con la mortalidad de los pacientes renales1–10. Está integrado por las alteraciones bioquímicas, esqueléticas y las calcificaciones extraesqueléticas que ocurren como consecuencia de las alteraciones del metabolismo mineral en la ERC11 (fig. 1). Se manifiesta por una o la combinación de las siguientes alteraciones:
- 1.
Alteraciones del calcio, fósforo, PTH y vitamina D.
- 2.
Alteraciones en el remodelado, mineralización, volumen, resistencia y crecimiento longitudinal de los huesos.
- 3.
Calcificaciones vasculares o de otros tejidos blandos.
El término osteodistrofia renal queda restringido a las alteraciones de la morfología y arquitectura óseas, propias de la ERC, evidenciadas a través de la biopsia ósea.
Actualmente existe un enfoque integral5,11 del metabolismo óseo y mineral en el paciente con ERC. De este modo los métodos diagnósticos ya no se pueden ver por separado, se deben ver en forma conjunta, esto es, los resultados de laboratorio, las anormalidades óseas y las calcificaciones vasculares no se valoran ya de forma aislada, y ello permite tomar decisiones terapéuticas más acertadas.
Hormona paratiroideaLa insuficiencia renal progresiva se acompaña de una incapacidad de eliminar la carga de fósforo, con el consiguiente aumento de fósforo plasmático, especialmente en estadios tardíos de la IRC. El fósforo puede acumularse en el tejido renal inhibiendo la 1 alfa-hidroxilasa12, que es la enzima encargada de transformar el 25-(OH)-colecalciferol, sintetizado en el hígado, en 1,25-(OH)2-colecalciferol o calcitriol. Los aumentos de fósforo pueden causar una disminución de los niveles de calcitriol a través de la inducción de la fosfatina FGF23 que no sólo inhibe la 1-alfa-hidroxilasa renal, sino que también aumenta la expresión de la 24-hidroxilasa, la enzima que degrada tanto al calcitriol como a la 25-hidroxi-vitamina D-colecalciferol.
El calcitriol es el metabolito final en la activación biológica de la vitamina D. El calcitriol es el metabolito natural más activo de la vitamina D y se comporta como una hormona esteroidea que actúa sobre el receptor de la vitamina D (VDR) que se encuentra distribuido no solo en las glándulas paratiroides, intestino, huesos y riñón, sino en muchos otros tejidos como la piel, el sistema inmune, las células beta o las células del músculo liso y las células endoteliales de los vasos sanguíneos13.
Los niveles de 25-(OH)-colecalciferol son un buen marcador del estatus de vitamina D de los pacientes. Esta primera hidroxilación se produce en el hígado a partir del precursor (colecalciferol) que se sintetiza en la piel mediante la acción de los rayos solares y varía según las razas, las latitudes y la estación del año14. En los pacientes de edad que toman poco el sol y llevan una vida poco activa en el exterior, estos niveles pueden estar muy reducidos. Este hecho es de especial relevancia teniendo en cuenta que la edad media de los pacientes en diálisis es avanzada15,16.
Mientras que el colecalciferol es prácticamente inactivo, el 25-hidroxicolecalciferol puede unirse al VDR y activarlo. Aunque su potencia de activación es 200 veces inferior a la del calcitriol, su concentración en la circulación es mil veces superior, y su vida media en la sangre es de alrededor de 2-3 semanas comparadas con las 4-7 horas de vida media del calcitriol.
El calcitriol tiene un doble efecto: el primero es inhibir directamente la síntesis de PTH en las glándulas paratiroides, actuando sobre sus receptores específicos, y el segundo es actuar sobre los receptores intestinales de calcio, favoreciendo la absorción activa del mismo y regulando por tanto, a su vez, la producción de PTH. Cuando bajan los niveles de calcitriol disminuye el efecto inhibidor sobre los receptores de vitamina D de las glándulas paratiroides (que a su vez son más escasos a medida que avanza la IRC) y se estimula la producción de PTH y el crecimiento glandular. Al mismo tiempo, el menor efecto sobre los receptores intestinales de calcio favorece la aparición de hipocalcemia, que estimula también la producción de PTH17.
El sensor del calcio es un receptor acoplado a la proteína G situado en la superficie celular y que responde directamente a las concentraciones de calcio extracelular. Se trata del primer receptor iónico descrito y se encuentra en las glándulas paratiroides y otros tejidos como el riñón, el cerebro, las células tiroideas y el tracto gastrointestinal. A nivel de paratiroides regula la producción de PTH, mientras que en el riñón regula la excreción de calcio y otros iones divalentes18.
Para completar el fenómeno de estimulación se sabe que el fósforo actúa directamente sobre las glándulas paratiroides y aumenta la síntesis y secreción de PTH por un mecanismo postranscripcional19,20, y también se habla hoy de la posible existencia de un sensor del fósforo.
Finalmente, la hipertrofia glandular, es decir, el incremento del tamaño de las células sin aumento del número de las mismas, es una primera fase del hiperparatiroidismo que se considera reversible21, mientras que cuando aumenta el número de células (hiperplasia glandular), y sobre todo cuando estas células pasan del estadio policlonal al estadio monoclonal22, se considera que el crecimiento es autónomo e irreversible23. Se ha descrito en la IRC una disminución de la expresión del sensor del calcio en las glándulas hiperplásicas24, así como del receptor de la vitamina D23–26.
Métodos diagnósticosAlteraciones bioquímicas y hormonalesLas alteraciones óseas de la insuficiencia renal crónica se diagnostican en primer lugar por las alteraciones bioquímicas características, como son los niveles de calcemia y fosforemia, la fosfatasa alcalina total y la fracción ósea de la fosfatasa alcalina, los niveles de parathormona intacta (PTH-i) y los niveles de 25-(OH)-colecalciferol y 1,25-(OH)2-colecalciferol o calcitriol25. Estas determinaciones se deben hacer desde estadios tempranos; desde el estadio 3 de la enfermedad renal ya podemos encontrar alteraciones evidentes26. El producto fosfocálcico tradicionalmente se ha considerado útil, puesto que esta combinación puede ser responsable de la formación de cristales de hidroxiapatita y de los depósitos extraóseos de los mismos. Hoy día sabemos que la calcificación es también por procesos activos de la transformación de las células musculares lisas en osteoblastos, y al producto fosfocálcico sólo se concede cierta importancia en los pacientes en hemodiálisis.
Calcificaciones vascularesPara su diagnóstico podemos utilizar:
- 1.
Radiología simple, concretamente los índices de Adragao y de Kauppila. Ambos son métodos cuantitativos.
El índice de Adragao27,28 se hace con radiografías de manos y pelvis, ambas se dividen en 4 cuadrantes, el score va de 0 a 16, la presencia de calcificación vascular en cada cuadrante vale un punto. Este score es predictor de morbimortalidad de origen cardiovascular28.
El índice de Kauppila29 se mide sobre una radiografía de perfil de abdomen que debe incluir las dos últimas vértebras torácicas y las dos primeras sacras. La arteria aorta debe ser identificada como una estructura tubular por delante de la cara anterior de la columna. Sólo se considera el segmento de la aorta desde la primera a la cuarta vértebra lumbar. La puntuación va de 1 a 3 por calcificación (de leve a severa) según la gravedad de la calcificación por la cara anterior y la posterior de cada vértebra. La puntuación va de 0 a 24. Se ha demostrado una buena correlación entre las calcificaciones vasculares diagnosticadas por Kauppila y las calcificaciones coronarias diagnosticadas por EBCT30.
- 2.
Ecocardio: para ver calcificaciones valvulares. Algunos autores creen que la radiografía es capaz de detectar más frecuentemente las calcificaciones vasculares y que la ecocardio podría servir para las calcificaciones valvulares, si bien el poder predictivo de las valvulares es muy bajo31,32.
- 3.
Otras: ecografía carotídea, TAC helicoidal, velocidad onda pulso y angioTAC.
- 4.
EBCT: es la mejor técnica para diagnosticar calcificaciones, pero es muy cara.
Se considera razonable tener en cuenta los resultados a la hora de cambiar el tratamiento.
Alteraciones óseasRadiología óseaTuvo su importancia en el diagnóstico de las lesiones óseas, sobre todo en los años en que la bioquímica estaba poco desarrollada. Eran características las alteraciones óseas de los metacarpianos y falanges distales, el adelgazamiento de corticales de huesos largos, el cráneo en sal y pimienta, así como las alteraciones de la lámina dura dentaria. Hoy en día se les da menos valor, ya que se encuentran alteraciones bioquímicas y hormonales que preceden a la aparición de las alteraciones radiológicas características y, por tanto, se inician muchas veces terapias de prevención antes de que aparezcan dichas lesiones óseas. Por otra parte las variaciones radiológicas son muy lentas, por tanto son técnicas poco útiles para el seguimiento de la evolución de las lesiones, así como de la respuesta a los distintos tratamientos33,34.
Gammagrafía óseaSe utiliza para el diagnóstico de la situación del turnover óseo. Sirve para hacer un rastreo de la extensión de la afectación ósea en todo el esqueleto. Puede ser útil también para detectar captación de trazador en partes blandas que, en ausencia de afectación ósea, es un signo indirecto de la presencia de una enfermedad ósea adinámica. En algunos casos ha permitido diagnosticar la presencia de calcificaciones metastásicas extraesqueléticas.
Densitometría óseaResulta poco útil para el diagnóstico y seguimiento de las lesiones de hiperparatiroidismo secundario. Traduce más la osteopenia de la zona estudiada. Puede ser útil en los casos en los que hay fracturas óseas o aplastamientos vertebrales, y se utiliza para el control de la osteoporosis corticoidea en pacientes después del trasplante renal.
Biopsia ósea34–37Es el gold standard en el diagnóstico del tipo de afectación ósea. Su uso fue muy extendido para iniciar el conocimiento de las diversas alteraciones óseas en la insuficiencia renal, y como respuesta a los tratamientos que se han propuesto a lo largo de las últimas décadas. Por su carácter cruento, que dificulta el poderlas repetir de forma seriada, su uso se ha ido haciendo menos frecuente y queda en la actualidad como una técnica útil para diagnosticar casos difíciles en los que exista controversia entre los datos clínicos y las demás exploraciones, o en los que hay una respuesta anómala al tratamiento.
No obstante, ha sido la técnica de elección para establecer los distintos tipos de afectación ósea y proponer su tratamiento. La principal alteración en el hiperparatiroidismo secundario es la osteítis fibrosa.
Osteítis fibrosaEs la principal consecuencia del hiperparatiroidismo secundario. Se caracteriza por la destrucción progresiva de las trabéculas óseas debido a la estimulación de los osteoclastos por la hormona paratiroidea37. Este aumento del turnover óseo no va acompañado de la suficiente aposición ósea por parte de los osteoblastos, existe un aumento de su número, al igual que el de osteoclastos, por lo que la formación de nuevas trabéculas va a una velocidad inferior a la destrucción, y esto lleva a la pérdida de continuidad entre las corticales, debilitando la estructura ósea. Este fenómeno se acompaña de una fibrosis de la médula, que a su vez produce una disminución de la formación de elementos formes de la sangre, responsable en parte de la anemia del paciente renal.
En el paciente que vuelve a diálisis tras un trasplante renal estas alteraciones pueden asociarse a la osteopenia producida por un tratamiento prolongado con corticoides, lo que puede debilitar todavía más las ya escasas y delgadas trabéculas óseas. En estos casos se ha demostrado el efecto beneficioso del tratamiento con vitamina D38.
Estudio de la glándula paratiroideaGammagrafía paratiroideaLa gammagrafia de sustracción con talio-tecnecio o con sestamibi puede ser de utilidad en la localización de las glándulas más hiperplásicas o autónomas, y sobre todo para descartar la presencia de glándulas ectópicas intratímicas o mediastínicas. Se aconseja realizarla antes de la paratiroidectomía para decidir cuáles son las glándulas más desarrolladas y/o más activas y, por tanto, cuáles son las que se deben extirpar y en ningún caso criopreservar. Evita recidivas precoces cuando existen glándulas ectópicas que podrían quedar no detectadas.
Ecografía de paratiroidesSe recomienda como técnica de imagen previa a la paratiroidectomia para valorar tamaño glandular, situación y posible presencia de glándulas ectópicas. Importancia la experiencia del radiólogo observador. La ecografía de las paratiroides, asociada a gammagrafía muestran una importante sensibilidad y especificidad.
Manifestaciones clínicas asociadas a la enfermedad mineral y ósea en la enfermedad renal crónica- 1.
Depósitos extraóseos.
- 2.
Calcifilaxis.
- 3.
Anemia.
- 4.
Hipertensión arterial.
La presencia de unos niveles elevados de PTH en estadios avanzadas de la insuficiencia renal, y especialmente tras iniciar tratamiento renal sustitutivo, puede asociarse a hipercalcemia. Si esta hipercalcemia se asocia a unos elevados niveles de fósforo conduce a un producto fosfocálcico elevado, que puede dar lugar a la presencia de depósitos extraóseos de cristales de hidroxiapatita. Estos depósitos tienen lugar en las partes blandas, en diversos órganos y en los vasos39, dando lugar a una verdadera osificación activa vascular. Cuando estos fenómenos tienen lugar en pequeños vasos de las extremidades pueden dar lugar al fenómeno de la calcifilaxis40. Si se depositan en las arterias coronarias pueden dar lugar a fenómenos isquémicos cardíacos41.
Ambos contribuyen a aumentar la mortalidad cardiovascular, que es la principal causa de mortalidad en el paciente en diálisis42,43.
Hoy se sabe que el fósforo, así como otros numerosos factores como el AMPc, el TGF beta, el colesterol, los AGES, etc. pueden transformar las células de músculo liso vascular en células semejantes a osteoblastos, conduciendo finalmente al depósito en ellas de cristales de hidroxiapatita44.
La anemia de la ERC es parcialmente consecuencia de la fibrosis medular secundaria. Se asocia a otras causas de anemia de la IRC, como es la disminución de la producción de eritropoyetina, y puede ser responsable de la resistencia al tratamiento con eritropoyetina (EPO) exógena. La mejoría del hiperparatiroidismo se traduce en una mejor respuesta a las mismas dosis de EPO y en unos mejores niveles de hemoglobina y hematocrito.
La hipertensión arterial es una complicación asociada del hiperparatiroidismo secundario y parece estar relacionada con las alteraciones del metabolismo del calcio, así como con el poder vasoconstrictor (agudo) de la PTH en su acción sobre el endotelio vascular45. Se debe tener en cuenta la relación de la vitamina D con el sistema renina-angiotensina-aldosterona.
Control y tratamiento en la enfermedad mineral y ósea asociada a la enfermedad renal crónicaA medida que avanza la ERC disminuye la respuesta calcémica a la acción de la PTH, y al mismo tiempo disminuyen el número de receptores de vitamina D y de sensores del calcio en las glándulas paratiroides46–48. Estos hechos conducen a la necesidad de unos niveles más elevados de PTH para conseguir mantener normal el recambio óseo. Por tanto, en esta fase, la elevación de niveles de PTH puede ser inicialmente un mecanismo compensador. Si los niveles de PTH-i se llevan hasta la normalidad puede producirse una disminución progresiva del recambio óseo hasta frenarlo totalmente, dando lugar a la enfermedad ósea adinámica. Esta alteración se caracteriza por la ausencia de celularidad y también por una mayor tendencia a la hipercalcemia y a un bajo recambio óseo en los pacientes que reciben suplementos de calcio y/o vitamina D, ya que dicho calcio no se incorpora al hueso (al estar prácticamente abolido el turnover óseo) y se deriva hacia otros órganos, como los vasos o partes blandas, pudiendo favorecer las temidas calcificaciones metastásicas.
A partir del estadio 3 de ERC se deben determinar los valores séricos de calcio, fósforo, FA, PTH, bicarbonato y vitamina D.
Como objetivos de tratamiento debemos tener el prevenir la hiperfosfatemia, evitando la hipofosfatemia, prevenir las calcificaciones vasculares y la progresión de la enfermedad renal.
Es aconsejable un tratamiento individualizado. A pesar de ello, podemos recomendar las siguientes pautas orientativas en función del grado de ERC.
Guía actual para el tratamiento de la enfermedad mineral y óseaPrimeraDebe establecerse el tipo de riesgo cardiovascular que presenta el paciente, valorando la presencia de calcificaciones, especialmente en los mayores de 60 años; en este caso es aconsejable la realización de radiología simple y la determinación de los índices Adragao27,28 y de Kauppila29. Además habrá que tener en cuenta presencia de diabetes, cardiopatía isquémica, tipo de enfermedad renal, duración de la misma, edad, sexo, tratamientos concomitantes (corticoides, anticalcineurínicos, anticomiciales, etc.).
Debe realizarse un control de calcemia, fosforemia, fosfatasa alcalina y PTH-i y si es posible de 25-(OH)- colecalciferol y de 1,25-(OH)2-colecalciferol.
Estos datos nos marcarán las pautas a seguir y la frecuencia de controles a realizar.
Pautas a seguir según el grado de insuficiencia renal- •
Pacientes con FG superior a 60ml/min/1,73m2.
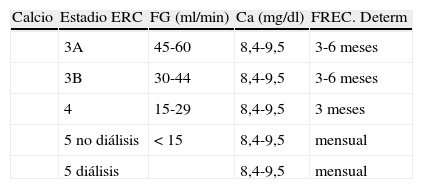
Objetivos: conseguir unos niveles de PTH-i normales, teniendo en cuenta el método utilizado, calcemia entre 8,4 y 9,5mg/100ml, fosforemia inferior a 4,6mg/100ml (tabla 1) (calcio y fósforo normales). Pauta a seguir: a) si la primera determinación es normal se harán controles una vez al año. No existe evidencia de que la adopción de medidas en esta fase sea útil para la prevención del HPT secundaro; y b) si la primera determinación está alterada se deberá aconsejar reducir moderadamente los niveles de ingesta proteica49, controlar los niveles de fosfaturia y la creatinina en orina. Existe evidencia de que en estadios precoces de la insuficiencia renal existe una disminución de los niveles de calcitriol, en ausencia de PTH elevada. En estos casos se ha demostrado el beneficio de tratar con dosis bajas de calcitriol o alfacalcidol38. Incluso se podría considerar el uso de activadores selectivos de la vitamina D (paricalcitol) al que, en diversos estudios se le asocian efectos pleiotrópicos tales como el control de la proteinuria especialmente en diabéticos y probablemente relacionado con su efecto antirrenina, aunque los resultados de estos estudios son todavía preliminares.
Tabla 1.Valores de Ca, P, PTH y vitamina D aconsejables en cada una de los estadios de ERC
Calcio Estadio ERC FG (ml/min) Ca (mg/dl) FREC. Determ 3A 45-60 8,4-9,5 3-6 meses 3B 30-44 8,4-9,5 3-6 meses 4 15-29 8,4-9,5 3 meses 5 no diálisis < 15 8,4-9,5 mensual 5 diálisis 8,4-9,5 mensual Fósforo P (mg/dl) 3A 45-59 2,7-4,6 3-6 meses 3B 30-44 2,7-4,6 3-6 meses 4 15-29 2,7-4,6 3 meses 5 no diálisis < 15 2,7-5 Mensual 5 diálisis 3,5-5 Mensual PH-i PTH (pg/ml) 3A 45-59 Valor normal método 6-12 meses 3B 30-44 Valor normal método 6-12 meses 4 15-29 2 veces valor normal 3-6 meses 5 no diálisis < 15 2-5 veces valor normal 3 meses 5 diálisis 2-5 veces valor normal 3 meses Vit D 25 OH (ng/ml) 3A 45-59 Hasta 20* 6-12 meses 3B 30-44 Hasta 20* 6-12 meses 4 15-29 Hasta 20* 6-12 meses 5 no diálisis < 15 Hasta 20* 6-12 meses 5 diálisis Hasta 20* 6-12 meses *Valor de 25-0H superior a 20 ng/ml, según INSTITUTES OF MEDICINE (IOM) en su Consensus Report de 30 de Noviembre del 2010. Dietary Reference Intakes for Calcium and Vitamin D, Disponible en Internet.
http://www.iom.edu/Reports/2010/Dietary-Reference-Intakes-for-Calcium-and-Vitamin-D.aspx.
http://www.iom.edu/Reports/2010/Dietary-Reference-Intakes-for-Calcium-and-Vitamin-D/DRI-Values.aspx.
Si los niveles de 25-hidroxi-vitamina D están descendidos se aconseja la utilización de colecalciferol, a dosis diarias de 2.000-4.000 UI/día, que no presenta riesgo alguno o calcifediol o hidroferol cuya administración semanal de la dosis oral completa (0,260 mg) podría provocar acumulaciones de 25-hidroxicolecalciferol que superen el límite superior de lo normal (150 ng/ml) hasta normalizar niveles. Como se ha dicho el 25-hidroxicolecalciferol (hidroferol) podría activar directamente al receptor intestinal de la vitamina D induciendo la absorción intestinal de calcio. El fraccionamiento de la ampolla de hidroferol en 4 o 5 tomas consecutivas reduciría el riesgo de estimulo de la absorción de calcio a límites de riesgo y permitiría normalizar rápidamente los niveles circulantes en cinco días. Recordar que la calciuria es un mejor indicador de sobredosis de vitamina D que la calcemia en estadios tempranos de la enfermedad renal.
- •
Pacientes con FG entre 30 y 60ml/min.
Objetivos: similares a los del apartado anterior (tabla 1). Pauta a seguir: a) si las determinaciones basales son normales se realizará un control analítico cada 6 meses. En estadio 3B con aclaramientos entre 30 y 45ml/min los controles pueden ser cada 6 meses. En cualquier caso, si se inicia tratamiento los controles deben ser cada tres meses. Con menos de 45ml/min de aclaramiento (estadio 3B de ERC) se debe recomendar como primera medida para el control del fósforo la dieta, con un aporte de fósforo de 700mg/día. La reducción del fósforo en la dieta contrarresta uno de los elementos fundamentales en el desarrollo del hiperparatiroidismo secundario. Debemos aportar una adecuada nutrición para conseguir un balance adecuado de fósforo sin llegar a producir hipofosforemia50,51.
- i.
Control del fósforo
Cuando la dieta no sea suficiente y los valores de fósforo estén en los valores altos de la normalidad se indica el uso de quelantes. Se ha demostrado que los niveles elevados de fósforo se asocian a una mayor mortalidad, independientemente de los niveles de PTH50–58.
El quelante que debemos utilizar debe ser el adecuado en función de los niveles de fósforo, pero debemos tener en cuenta cómo están los niveles de calcio, la PTH y los tratamientos que esté recibiendo el paciente54.
Al inicio el quelante de elección debe ser el cálcico54–57. Aunque debemos tener en cuenta que con el uso de ellos se podría acelerar la evolución de la enfermedad renal, además el calcio total a administrar no debe ser superior a los 2g, incluyendo el aporte de calcio en la dieta.
El riesgo de hipercalcemia e hiperfosforemia es mayor si, además de los quelantes cálcicos, se aportan derivados de la vitamina D o activadores no selectivos del receptor de la vitamina D, ya que los activadores selectivos del receptor de la vitamina D son menos hipercalcemiantes e hiperfosforemiante.
Aunque el hidróxido de aluminio tiene mayor poder quelante que los anteriores, su uso no es aconsejable por el riesgo de sobrecarga que puede suponer2–5,10,58.
- ii.
Control del hiperparatiroidismo secundario1–8
En este estadio se debe realizar al menos una determinación de los niveles de 25-hidroxi-vitamina D, especialmente si los niveles de PTH tienen tendencia a aumentar. Los niveles de 25-hidroxi-vitamina D en todas los estadios de la enfermedad renal deben llegar hasta 20 ng/ml. El tratamiento con vitamina D nativa se debe iniciar cuando estos niveles no sean los adecuados, o antes en caso de pacientes añosos, diabéticos o malnutridos.
El tratamiento con calcitriol, análogos o activador selectivo del receptor de la vitamina D se debe hacer cuando los niveles de PTH estén por encima del valor considerado como normal según el método utilizado, de forma persistente o cuando se corrijan los factores que puedan contribuir a su aumento (hiperfosfatemia, hipocalcemia o déficit de 25-hidroxi-vitamina D). La dosificación se refleja en la tabla 2.
Tabla 2.Tratamiento con vitamina D en estadios precoces de ERC
Estadio 3A* 25-hidroxi-vitamina D Hidroferol** Hasta normalizar niveles Estadio 3B* 1,25 OH vitamina D Calcitriol 0,25 mcg/48 h Análogos Alfa-Calcidiol 0,5 mcg/24-48 h Activador selectivo del receptor de la vitamina D Paricalcitol 1 mcg/24-48 h Estadio 4* 1,25 OH vitamina D Calcitriol 0,5 mcg/24-48 horas Análogos Alfa-Calcidiol 0,5-1 mcg/24-48 horas Activador selectivo del receptor de la vitamina D Paricalcitol 1-2 mcg/24-48 horas - i.
- •
Pacientes con FG inferior a 30ml/min (estadio 4 y estadio 5 no diálisis de ERC)
Objetivos similares al apartado anterior (tabla 1). El control del metabolismo fosfocálcico se hará cada tres meses en estadio 4 de ERC para el calcio y fósforo, cada 3-6 meses la PTH y para el estadio 5 no diálisis mensual el calcio y fósforo, cada 3 meses la PTH. La 25-hidroxi-vitamina D cada 6 o 12 meses en todos los casos1–10.
Pauta a seguir: control del fósforo; si a pesar de la dieta existe hiperfosforemia con niveles de calcio normales o bajos se pueden administrar quelantes portadores de calcio hasta normalizar la fosforemia.
Si los niveles de calcio están en el rango alto de la normalidad, o están francamente altos, deberá administrarse quelantes no cálcicos (sevelamer o carbonato de lantano)59. En épocas anteriores se ha utilizado el hidróxido de aluminio, pero hoy día sólo se aconseja si existe intolerancia a los anteriores y nunca se debe sobrepasar los 6 meses de tratamiento con él.
Si los niveles de 25 hidroxicolecalciferol están bajos se debe aportar vitamina D nativa, colecalciferol (vitamina D Berenguer) o el primer producto de activación, 25-hidroxicalciferol (hidroferol) a la dosis reflejada en la tabla 2. Con el cuidado en el caso del hidroferol de evitar sobredosis por acumulación y prevenir los aumentos de absorción intestinal de calcio fraccionando la ampolla.
Si observamos una tendencia a aumentar los valores de PTH, hasta 2-5 veces el valor considerado normal, según método, se puede administrar pequeñas dosis de vitamina D o activadores selectivos del receptor de la vitamina D (AsRVD) por vía oral (tabla 2). Se ha referido que el paricalcitol en capsulas ha sido bien tolerado y ha reducido eficazmente las concentraciones de PTHi con un efecto mínimo o nulo sobre las concentraciones de calcio, el balance de fósforo y la función renal en los pacientes con ERC en estadio 3 o 460.
En cualquiera de los casos debe controlarse el producto calcio-fósforo para que no supere la cifra de 55mg2/dl2. Si, a pesar de las medidas tomadas sigue aumentando la PTH, podríamos incluir en el tratamiento un calcimimético, pero en este estadio, está contraindicado, al menos temporalmente por la FDA, por producir en los estudios realizados en el 80% de los casos tratados hipocalcemia, a pesar de que ayuda a controlar la PTH.61
Pacientes en tratamiento sustitutivo renal1–5,11Objetivos: En este estadio se aconseja mantener el fósforo entre 3,5 y 5mg/dl. La PTH puede estar hasta 2-5 veces su valor normal. El calcio y fósforo se deberán determinar cada mes, la PTH cada tres meses y la 25 hidroxi-vitamina D una o dos veces al año, como mínimo.
Pauta a seguir: control del fósforo: en este estadio la restricción de fósforo debe ser de 800 a 1.000mg/día25 ajustada al peso del paciente y a sus necesidades proteicas. Es importante una orientación dietética adecuada. Sería conveniente contar con un especialista en nutrición en la unidad1–5,15.
Cuando la dieta no es suficiente y el fósforo es mayor de 5mg/dl se deben utilizar quelantes.
Existen quelantes cálcicos (carbonato y acetatato), solos o asociados con magnesio, y quelantes no cálcicos (sevelamer, carbonato de lantano). Todos se deben tomar en mitad de las comidas salvo los cálcicos que debe ser ingerido al inicio de la comida.
En lo que respecta a los cálcicos es preferible el acetato al carbonato porque aporta menos calcio elemento con igual poder quelante54–57; en cualquier caso el aporte total de calcio elemento no debe ser mayor de 1,5 g/día. Si incluimos el calcio de la dieta el aporte total de calcio no debe exceder los 2g/día25,54–57.
Se recomienda evitar el uso de los quelantes cálcicos y la utilización de quelantes sin calcio ante la sospecha de enfermedad ósea adinámica y en las siguientes situaciones:
- 1.
Ca corregido > 10mg/día a pesar de usar baño de diálisis de 2,5mEq/l de Ca.
- 2.
Hiperfosfatemia persistente y mantenida > 6,5mg/dl.
- 3.
Aparición de calcificaciones extraóseas.
- 4.
Calcifilaxis.
- 5.
PTH < 150 en dos tomas consecutivas.
En el caso de hiperfosfatemia mantenida > 5mg/dl se debería indicar la asociación de quelantes no cálcicos.
El clorhidrato de sevelamer es una resina captadora del fósforo, que no lleva sales de calcio ni aluminio. A su efecto beneficioso sobre la fosforemia sin representar un riesgo para los depósitos de cristales de hidroxiapatita en los vasos centrales y periféricos y en las válvulas cardiacas se añade su poder hipolipemiante que podría contribuir a reducir la placa de ateroma y a disminuir el riesgo cardiovascular62,63. Hay estudios que parecen indicar un aumento de la supervivencia en los pacientes tratados con dicho quelante. Su inconveniente por el momento es que se precisan dosis elevadas del producto y su indicación no está reconocida en prediálisis o diálisis peritoneal por producir acidosis. El carbonato de sevelamer, de eficacia similar, no se asocia a acidosis metabólica, por lo que se puede utilizar en prediálisis y diálisis peritoneal64.
El carbonato de lantano65 es una tierra rara, su poder quelante es alto. Es eficaz en monoterapia. La dosis diaria habitual es de 2.250mg. Se pude utilizar hasta una dosis máxima de 4,5 g por encima de la cual no se ha demostrado que no se deposite en huesos e hígado.
En cuanto al carbonato de magnesio se puede utilizar con niveles de magnesio normal y requiere monitorización de sus niveles en sangre66. Aun hay pocos trabajos controlados y los que hay son con un número escaso de pacientes.
No existe evidencia hoy día para recomendar un tipo único y específico de quelante para todos los pacientes57,58,62.
Las dosis elevadas de diálisis han demostrado ser efectivas en el control del fósforo67.
A las medidas anteriores podemos añadir variaciones en el contenido de calcio del líquido de diálisis lo que nos permitirá reducir el aporte de calcio y controlar más fácilmente el producto fosfocálcico. La concentración en el baño de diálisis debe ser individualizada de acuerdo a los parámetros del metabolismo fosfocálcico del paciente. En los casos de bajo recambio óseo y calcio sérico normal o si existe hipercalcemia independientemente de los niveles de PTH se debe utilizar con preferencia el calcio de 2,5mEq/l, siempre con control estricto de la PTH68.
Control de la PTHLos valores de la PTH deben estar entre 2 y 5 veces su valor normal, según el método utilizado. Valores por debajo de ese rango sugieren, con alta sensibilidad y especifidad la presencia de bajo remodelado óseo en la biopsia ósea y valores por encima sugieren alto remodelado. Es más recomendable ver la tendencia de los valores de la PTH a ver el valor absoluto de un momento puntual, debido a la secreción pulsátil de la PTH.
Una vez corregido los niveles de P se puede iniciar tratamiento con vitamina D
La vitamina D se puede administrar de forma IV al final de la sesión de hemodiálisis u oral.
Respecto a la activación del RVD las opciones terapéuticas de que disponemos en España son el calcitriol, el alfacacidiol y los activadores selectivos del receptor de la vitamina D (AsRVD), como el paricalcitol, el cual activa selectivamente el receptor de la vitamina D a nivel de las células paratiroides, osteoblastos, de la pared intestinal y células musculares lisas vasculares, por lo que puede ser menos hipercalcemiante e hiperfosforemiante que los otros. La elección de cualquiera de ellos debe estar influida por los valores de calcio y fósforo del paciente. No hay estudios prospectivos, aleatorizados que valoren el resultado del uso de la vitamina D, sus análogos o el AsRVD (paricalcitol) sobre la hospitalización y la morbimortalidad de los pacientes; no obstante, y teniendo en cuenta los resultados en modelos animales y otros estudios, es aconsejable que en los pacientes con calcificaciones vasculares, se debería recomendar el uso del paricalcitol69–77. La evidencia reciente sugiere que los AsRVD se asocian a una ventaja en la supervivencia en los pacientes con ERC, con un efecto más favorable con los ARVD selectivos (paricalcitol) que con los no selectivos70. Se ha descrito que paricalcitol, un ARVD selectivo, ejerce efectos específicos sobre la expresión génica en diversos tipos celulares que intervienen en la calcificación vascular y el desarrollo de la enfermedad arterial coronaria75.
El cinacalcet78–83 es un calcimimético que se une al receptor del calcio de la glándula paratiroidea y lo modifica alostéricamente haciéndolo más sensible a la acción del calcio extracelular, reduce la PTH, el calcio y el fósforo.
El problema puede ser la hipocalcemia que produce, pero se pude contrarrestar con el uso combinado con AsRVD.
Los calcimiméticos pueden ser de ayuda en este tipo de pacientes para prevenir la aparición de hipercalcemia y permitir administrar mayores cantidades de metabolitos de la vitamina D, si bien se desarrolla o se atenúa las calcificaciones vasculares, por ello, se postula administrar paricalcitol, ya que en las ratas urémicas no provoco calcificación en la capa media aórtica69,84,85.
Según el estudio Advance en los pacientes tratados con cinacalcet se ha observado una disminución del tamaño glandular e incluso una mejoría de la supervivencia, aunque de forma retrospectiva86.
Aunque son necesarios nuevos estudios clínicos comparativos, así como una caracterización fármacodinámica, para comprender por completo los efectos diferenciales de los ARVD selectivos, los ARVD no selectivos y los calcimiméticos; los datos actualmente existentes sugieren que el tratamiento con ARVD selectivos y calcimiméticos es probablemente el más prometedor para mejorar los resultados a largo plazo, incluida la supervivencia, en los pacientes con ERC87.
Paratiroidectomia en la ERC5Si a pesar del tratamiento siguen aumentando los niveles de PTH y su repercusión clínica, debe recurrirse a la paratiroidectomía88 después de la localización de las glándulas mediante gammagrafía. En la literatura existe discusión sobre cual es el mejor método: la subtotal, la total con reimplante o la total sin reimplante. En cualquiera de los casos la recidiva del hiperparatiroidismo es fácil y deben aplicarse las mismas medidas de prevención que al inicio de la enfermedad renal25,54.
En nuestros días la eficacia de los fármacos de que disponemos, en especial los calcimiméticos y los activadores selectivos del receptor de la vitamina D han permitido reducir drásticamente la necesidad de este tipo de intervenciones78.
La última recomendación de las guías KDIGO publicadas en 2009 indican54: «Sugerimos que los pacientes con enfermedad renal crónica estadios 3-5 con hiperparatiriodismo severo que no respondan de forma adecuada al tratamiento medico/farmacológico deben ser paratiroidectomizados».
Clínicamente serian aquellos casos con PTH no controlada y repercusión clínica con: Hipercalcemia, hiperfosforemia sostenidas (calcio > 10,6mg/dl; fosforo > 6,0mg/dl), PTH que no responde a la vit D ni a los calcimiméticos, además de alteraciones óseas (dolor óseo severo), y calcificaciones cardiovasculares o de tejidos blandos, prurito intratable, anemia refractaria, calcifilaxis.
Valoración preoperatoria: ecografía que puede ser explorador dependiente y la gammagrafia MIBI, que no solo permite localizar las glándulas y su tamaño sino descartar la existencia de ectópicas.
Calcifilaxis (arteriolopatía isquémica calcificada)5Se trata de una calcificación vascular con necrosis isquémica de los tejidos blandos y de la piel que afecta a los pacientes con ERC.
Aparece sobre todo en pacientes en hemodiálisis y trasplantados
Factores de riesgo: concentraciones séricas elevadas de calcio y fósforo. Hiperparatiroidismo secundario. Hipoalbuminemia. Obesidad. Altas dosis de metabolitos de vitamina D. Warfarina.
Las lesiones son nódulos subcutáneos y placas equimóticas muy dolorosas sobre una base de eritema moteado. Progresa en pocos días y se forman úlceras necróticas.
El diagnóstico se hace con radiografía con técnica de mamografía o con gammagrafía ósea con Tc-99. La biopsia de las lesiones se debe de evitar.
El tratamiento consiste en:
- 1.
Curas tópicas.
- 2.
Cámara hiperbárica.
- 3.
Normalizar los niveles de calcio y fósforo.
- 4.
Calcimiméticos.
- 5.
Paratiroidectomía.
- 6.
Bisfosfonatos:
- a)
alendronato: 70mg/oral/semana;
- b)
risendronato: 35mg oral, semana;
- c)
pamindronato 60mg, dosis única al final de la sesión de hemodiálisis, y
- d)
Ibandronato 150mg oral mensual o 2mg IV al final de la sesión de hemodiálisis.
- a)
- 7.
Tiosulfato sódico en solución al 25% a pasar durante una hora al final de la diálisis y hasta la resolución del cuadro.