El síndrome hepatorrenal (SHR) se caracteriza por ser una insuficiencia renal funcional y, por ello, reversible, ya que no conlleva ninguna alteración estructural del riñón.
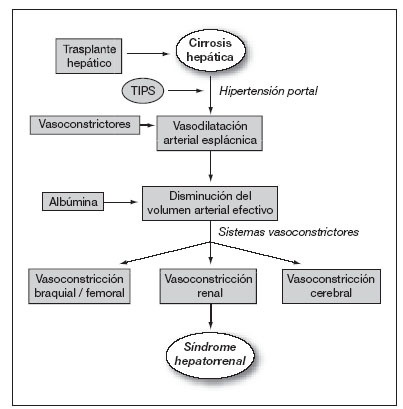
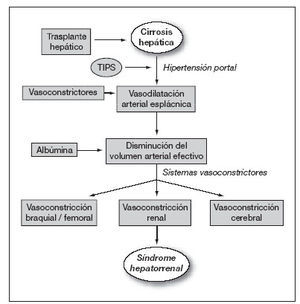
FisiopatologíaLa característica más importante del SHR es la vasoconstricción renal intensa1,2. El mecanismo por el cual se produce esta vasoconstricción es multifactorial y no del todo conocido. A medida que la enfermedad hepática avanza, empeora la disfunción circulatoria que ha determinado, en etapas más tempranas, la aparición de ascitis. En la circulación sistémica, y particularmente en el área esplácnica, hay una vasodilatación arterial que da lugar a hipovolemia arterial efectiva. En los riñones, los mecanismos vasoconstrictores compensadores de la hipovolemia (activación del sistema renina-angiotensina-aldosterona, el sistema nervioso simpático y la vasopresina) predominan sobre el efecto de las sustancias vasodilatadoras (prostaglandinas, péptidos natriuréticos, oxido nítrico). Este desequilibrio entre ambos sistemas (vasoconstrictores y vasodilatadores) en favor de los primeros da lugar a una vasoconstricción renal extrema con disminución del filtrado glomerular1,2 (fig. 1). En los últimos años se ha propuesto que, además de la vasodilatación arterial, habría una disfunción cardíaca que participaría en la alteración circulatoria que se asocia al SHR3-5. Los estudios que han dado origen a esta hipótesis han observado que el empeoramiento de la alteración circulatoria no sólo se relaciona con la progresión de la vasodilatación arterial, sino también con una incapacidad del corazón para aumentar el gasto cardíaco en respuesta a una disminución de la precarga. Al examen anatomopatológico, los riñones presentan aspecto normal, si bien se ha descrito anormalidades mínimas que no justifican la disfunción observada.
DiagnósticoEl diagnóstico de SHR se realiza por exclusión de otras etiologías. En 1996, el Club Internacional de Ascitis enunció los criterios diagnósticos para definir el SHR6. Se consideró criterios diagnósticos mayores y criterios adicionales. Para definir SHR era necesario que se cumplieran todos los criterios mayores, mientras que los adicionales, si estaban, sólo reforzaban el diagnóstico (tabla I). Recientemente, el Club Internacional de Ascitis realizó una reunión de expertos para tratar de redefinir el SHR (Congreso de la American Association for the Study of the Liver Diseases [AASLD]; San Francisco, 2005). En dicha reunión se revisaron los criterios mayores y los menores. En ese sentido se demostró que la sensibilidad y la especificidad de los criterios menores son muy bajas y que, por lo tanto, no son necesarios para definir SHR. De los criterios mayores, se discutió la necesidad de definir SHR concomitante a infección, como la insuficiencia renal que aparece en pacientes cirróticos infectados sin shock, en los que la fisiopatología de la alteración renal es igual que la del SHR. Recientemente se han publicado los nuevos criterios diagnósticos para definir el SHR (tabla II)7. El SHR tiene dos formas clínicas, el SHR tipo 1 y el SHR tipo 2. El SHR tipo 1 se define como un aumento en la creatinina sérica hasta un valor > 2,5 mg/dl o una disminución en el aclaramiento de creatinina < 20 ml/min en menos de 2 semanas. Generalmente, el SHR tipo 1 ocurre en pacientes con una función hepática muy deteriorada y frecuentemente se produce después de exposición a un factor desencadenante (peritonitis bacteriana espontánea, paracentesis evacuadora sin expansión del volumen plasmático o hemorragia digestiva). El pronóstico de estos pacientes es muy malo, con una supervivencia media de 15 días. El SHR tipo 2 se caracteriza por un aumento moderado en la creatinina sérica (> 1,5 mg/dl) que permanece estable durante meses. La supervivencia media de estos pacientes es de 3 meses. Es importante diferenciar estos dos tipos de SHR, ya que implican diferencias muy importantes en cuanto a evolución y tratamiento.
Figura 1. Patogenia del síndrome hepatorrenal según la teoría de la vasodilatación arterial. TIPS: derivación portosistémica transyugular intrahepática.
Tabla I. Criterios antiguos de diagnósticos del síndrome hepatorrenal
Tabla II. Criterios actuales de diagnóstico de síndrome hepatorrenal
TratamientoTrasplante hepáticoEl trasplante hepático es el único tratamiento definitivo para el SHR. Sin embargo, es bien conocido que los pacientes con SHR trasplantados presentan una mayor morbimortalidad perioperatoria que los pacientes trasplantados sin SHR, a pesar de tener una supervivencia a largo plazo similar8. Además, los pacientes con SHR tipo 1 difícilmente llegan a recibir el trasplante debido a la rápida progresión de la insuficiencia renal. Por lo tanto, hay que intentar el trasplante en un estadio previo al desarrollo de este síndrome. El principal problema del trasplante hepático en el SHR tipo 1 es su aplicabilidad. Debido a que la supervivencia es extremadamente corta, la mayoría de los pacientes mueren antes del trasplante. Para los pacientes en lista de espera, la introducción de la puntuación MELD9,10, que incluye creatinina sérica, bilirrubina e INR, ha resuelto parcialmente este problema colocando a los pacientes con SHR en los primeros lugares de la lista. Un estudio reciente ha demostrado que el SHR debe ser tratado antes de realizar el trasplante hepático, ya que la recuperación del SHR disminuye la morbilidad temprana y la mortalidad después del trasplante y prolonga la supervivencia a largo plazo11.
VasoconstrictoresEn la actualidad los vasoconstrictores son el tratamiento farmacológico de elección para revertir el SHR. Hasta ahora varios estudios han utilizado distintos vasoconstrictores que han demostrado ser efectivos para revertir el síndrome12-17. El primer estudio, publicado en 1997, utilizó ornipresina, un vasoconstrictor análogo a la vasopresina18. La elección de la ornipresina se explica porque, teóricamente, tiene mayor efecto vasoconstrictor esplácnico con menor efecto sistémico. Teniendo en cuenta la fisiopatología del SHR, este vasoconstrictor podría ser eficaz, además de tener, supuestamente, una incidencia muy baja de efectos adversos. En ese estudio se trató a 16 pacientes; 8 de ellos recibieron la medicación durante 3 días y los 8 restantes, durante 15 días. La ornipresina se administró combinada con un expansor de volumen plasmático, la albúmina. Los resultados beneficiosos en la función renal se observaron sólo en los pacientes que recibieron el tratamiento prolongado; sin embargo, en la mitad de estos pacientes el tratamiento tuvo que suspenderse por efectos isquémicos de la medicación. En vista de las complicaciones que presentaba la ornipresina, se comenzó a utilizar la terlipresina, otro análogo de la vasopresina utilizado ampliamente en el tratamiento de la hemorragia por varices esofágicas y con muchos menos efectos adversos. El primer estudio publicado incluyó a 9 pacientes con SHR, 6 de tipo 1 y 3 de tipo 2. La administración de terlipresina y albúmina revirtió el SHR en 7 pacientes. En ningún paciente hubo que suspender la medicación por complicaciones de tipo isquémico19. Posteriormente, Ortega et al20 publicaron un estudio en el que trataron a 21 pacientes, 13 con terlipresina y albúmina y 8 con terlipresina sola. En 10 pacientes que recibieron el tratamiento combinado se obtuvo una normalización de la función renal, pero esto se produjo sólo en 2 de los que recibieron terlipresina sola. Además, la albúmina fue el único factor predictivo de respuesta completa. Por tanto, estos resultados indicaban que la albúmina tiene un papel importante en revertir el SHR. Finalmente, Moreau et al21 publicaron un estudio retrospectivo en el que incluyeron a 99 pacientes con SHR tipo1. El SHR se revirtió en el 58 % de los pacientes. Si bien este estudio incluye una gran serie de pacientes, que sea retrospectivo y multicéntrico hace que haya diferencias en cuanto al tiempo de tratamiento y la dosis administrada. Posteriormente, otros autores han evaluado la eficacia de la terlipresina en revertir el SHR, aunque ninguno de ellos estaba diseñado para evaluar la supervivencia22-25. Recientemente 2 estudios multicéntricos aleatorizados y controlados se han publicado en forma de resúme-26,27. El primer trabajo es un estudio multicéntrico realizado en Estados Unidos, prospectivo, aleatorizado y a doble ciego, que incluyó a 112 pacientes; 56 recibieron terlipresina y 56, placebo. No hubo diferencia en la supervivencia medida a los 2 meses. Sin embargo, la reversión del SHR fue significativamente superior en el grupo que recibió terlipresina26. El segundo trabajo27 es un estudio multicéntrico español, prospectivo y aleatorizado, que incluyó a 45 pacientes con cirrosis hepática y SHR que se aleatorizó a recibir terlipresina y albúmina (n = 23) o albúmina sola (n = 22) durante un máximo de 15 días. Los objetivos principales del estudio fueron la mejoría de la función renal y la supervivencia a los 3 meses. La mejoría de la función renal ocurrió en 9 (39 %) pacientes del grupo a terlipresina y albúmina, en comparación con sólo 2 (9 %) del grupo de albúmina (p < 0,05). Los factores predictivos independientes de mejoría de la función renal fueron la diuresis basal y el tratamiento con terlipresina y albúmina. La diferencia en supervivencia a los 3 meses no fue estadísticamente significativa entre los dos grupos (terlipresina y albúmina, el 26 % y albúmina, el 18 %). No obstante, la mejoría de la función renal se asoció a una supervivencia más prolongada (supervivencia mediana, 70 y 14 días en pacientes con y sin mejoría de la función renal, respectivamente; p < 0,05). Estos resultados indican que los pacientes con SHR, especialmente los candidatos a un trasplante hepático, deben ser tratados con terlipresina y albúmina, por dos motivos; primero, en los pacientes que responden al tratamiento el aumento en la supervivencia es muy importante para poder llegar al trasplante, y segundo, está demostrado que los pacientes con SHR tratados y trasplantados con función renal normal presentan una morbimortalidad tras el trasplante idéntica a la de los pacientes trasplantados sin SHR11. También se ha utilizado los fármacos simpaticomiméticos como otras sustancias vasoconstrictoras. Angeli et al28 evaluaron el efecto de la administración oral de un agonista alfa-1, la midodrina, en pacientes con SHR tipo 1. En ese estudio se evaluó el efecto de la midodrina junto con albúmina y octreotida, y se lo comparó con el efecto de albúmina y dopamina. Todos los pacientes que recibieron el tratamiento combinado con midodrina presentaron una mejoría importante de la función renal. Por otro lado, los pacientes que recibieron albúmina y dopamina mostraron un empeoramiento progresivo de la función renal. Finalmente, Duvoux et al29 describieron que la administración de noradrenalina también es eficaz en el tratamiento del SHR.
Derivación intrahepática percutánea portosistémicaTeniendo en cuenta la fisiopatología del SHR, el procedimiento de derivación intrahepática percutánea portosistémica (conocido como TIPS) podría ser un buen método para revertir el SHR. Hasta ahora sólo dos estudios publicados han evaluado el efecto del TIPS en el SHR30,31. Guevara et al31 evaluaron el efecto del TIPS en 7 pacientes con SHR tipo 1. La colocación del TIPS produjo una disminución en la actividad de los sistemas vasoconstrictores endógenos y, en 6 de los 7 pacientes, una mejoría significativa de la función renal, sin llegar a normalizarla. No se observó una incidencia elevada de complicaciones a pesar de la avanzada enfermedad hepática y renal. Posteriormente, Brensing et al30 evaluaron el efecto de la TIPS en 31 pacientes con SHR (14 pacientes con SHR tipo 1 y 17 con SHR tipo 2). Los pacientes con SHR tipo 1 tuvieron una supervivencia significativamente menor que los pacientes con SHR tipo 2. Sin embargo, comparando a los pacientes con SHR tipo 1 a los que se colocó un TIPS con aquellos a quienes no se colocó por estar en hemodiálisis de urgencia, los primeros presentaron una mayor supervivencia. Sin embargo, cabe destacar que los pacientes a los que no se colocó el TIPS estaban clínica-mente peor que los que recibieron este tratamiento. Uno de los puntos de interés en el tratamiento del SHR tipo 1 con vasoconstrictores y albúmina intravenosos o con TIPS es la observación de que, a pesar de que hay una marcada supresión de la actividad de renina plasmática y noradrenalina, lo que indica una mejoría importante en la función circulatoria, persiste un filtrado glomerular escaso. La razón de este retraso en la normalización es desconocida, pero podría deberse a un componente de la insuf iciencia renal que no responde a los cambios de la función circulatoria o al hecho de que el volumen arterial efectivo no se normaliza con la terapia farmacológica. Un estudio reciente de Wong et al32 estudia esta hipótesis. El tratamiento con TIPS en pacientes que responden a fármacos (midrodina, octreotida y albúmina) se asoció a normalización del filtrado glomerular en la mayoría de los casos. Por tanto, el efecto del TIPS en la normalización del filtrado glomerular se debió a la corrección de la vasodilatación arterial, un incremento en la precarga cardíaca y función ventricular o ambos, aspectos que todavía hay que investigar más. Respecto al SHR tipo 2, el TIPS disminuye la ascitis, pero no prolonga la supervivencia y se asocia a un mayor número de episodios de encefalopatía severa.
Otros métodos terapéuticosLa hemodiálisis se usa frecuentemente en el manejo del SHR tipo 1 en muchos centros, particularmente en pacientes candidatos a trasplante hepático. Sin embargo, los efectos beneficiosos de este procedimiento en el SHR no han sido demostrados convincentemente.
Los fármacos vasodilatadores, tales como la dopamina las prostaglandinas, se han usado durante muchos años en el manejo del SHR sin eficacia comproba33. Algunas publicaciones de casos aislados señalan el efecto beneficioso de octreotida; sin embargo, un estudio reciente, aleatorizado y controlado, con 50 µg/h en infusión de octreotida no mostró un efecto positivo34. Finalmente, en una pequeña serie de pacientes, se demostró que la N-acetilcisteína a dosis de 300 mg/12 h era eficaz, pero estos resultados requieren confirmación en series con mayor número de casos35.
Sistema molecular recirculante absorbente (MARS)Se ha descrito que la diálisis extracorpórea de albúmina, un sistema que usa un dializado con albúmina que recircula y se perfunde a través de columnas, carbón e intercambiadoras de aniones, mejora la función renal y la supervivencia en pequeñas series de pacientes con SHR36. No obstante, se requiere más estudios para validar esta modalidad terapéutica.
Prevención del SHRHay dos situaciones en que se ha demostrado que la aparición de SHR puede prevenirse. Éstas son la peritonitis bacteriana espontánea (PBE) y la hepatitis alcohólica aguda37,38. Esto ha sido demostrado en dos estudios aleatorizados y controlados que han incluido a un número considerable de pacientes. En el primer estudio, en pacientes con PBE se demostró que la administración de albúmina junto con cefotaxima disminuye de forma significativa la aparición de SHR respecto a los pacientes que recibieron sólo el antibiótico. En el segundo estudio, la administración de pentoxifilina (un inhibidor del factor de necrosis tumoral) disminuyó de forma significativa la aparición del SHR en pacientes con hepatitis alcohólica aguda. Además, también se redujo la mortalidad intrahospitalaria.
ConclusionesEl SHR es la complicación de la cirrosis hepática con ascitis con peor pronóstico. Aparece con frecuencia en la cirrosis hepática avanzada y se caracteriza por insuficiencia renal junto con una notoria alteración de la hemodinámica sistémica y la actividad de los sistemas vasoactivos endógenos. El diagnóstico del SHR actualmente está basado en la exclusión de causas no funcionales de insuficiencia renal. El trasplante hepático es la mejor opción en pacientes seleccionados, pero no siempre es aplicable debido a la corta supervivencia. Algunos tratamientos introducidos en los últimos años, como la TIPS y, en particular, los fármacos vasoconstrictores con efecto preferente en la circulación esplácnica (agonistas de los receptores V1 de la vasopresina), mejoran la función renal y revierten el SHR en una proporción considerable de casos. No obstante, estos pacientes finalmente deben recibir trasplante hepático. El desarrollo del SHR después de la peritonitis bacteriana espontánea puede prevenirse de forma eficaz con la administración de albúmina combinada con el tratamiento antibiótico.
No existe conflicto de intereses.
La autora M. Guevara recibe una beca del Fondo de Investigación Sanitaria (Fis 01/3045 y Fis 02/0273).
Correspondencia: Dra. M. Guevara. Unidad de Hígado. Hospital Clínic de Barcelona. Villarroel, 170. 08036 Barcelona. España. Correo electrónico: mguevara@clinic.ub.es
Recibido el 26-7-2007; aceptado para su publicación el 10-8-2007.