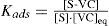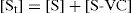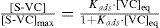One of the most urgent concerns in the development of our societies is water management. Being water a scarce resource, it is important that students of different environmentally oriented careers understand wastewater treatment processes as well as their underlying physico-chemical background. Many of them are not chemistry majors, so it is important to develop relatively simple experiments, easy to perform but challenging for discussions, to study crucial chemical phenomena, keeping in mind concrete technological applications. Among the various available water treatment techniques, adsorption is a good teaching example because it is one of the most efficient methods to remove contaminants from wastewater due to its simplicity, low cost and easy operation conditions. We present a simple and inexpensive adsorption experiment, related to water treatment techniques, to show how a natural sorbent such as diatomite can be used to remove dyes from wastewater.
El aumento continuo de la población mundial, fundamentalmente concentrada en megaciudades, y el cambio climático global que ha alterado los patrones de temperaturas, lluvias y sequías, introducen desafíos cada vez mayores en cuanto al abordaje de la problemática del agua. Ya no podemos considerar al agua como algo dado, sino que debe ser cuidada. Esta valoración de la importancia del manejo del recurso agua está íntimamente vinculada con el cambio general con que la sociedad percibe las cuestiones ambientales. En muchas universidades se han desarrollado carreras o especialidades para formar profesionales que, con enfoques muy variados, sean capaces de enfrentar la complejidad de estos problemas. En esta coyuntura, la formación en química de estudiantes de carreras de orientación ambiental juega un rol no menor. Aunque en muchos casos es posible que la química no sea el eje central de la formación, como futuros profesionales, deberán conocer y entender conceptos químicos en sus trabajos. Desde este punto de vista, resulta importante el desarrollo de actividades experimentales en las cuales el énfasis esté puesto en conceptos químicos sobre problemas relevantes ambientalmente y que den lugar a discusiones interesantes en clase. Por otra parte, es necesario que estas actividades sean lo suficientemente robustas como para que los datos experimentales muestren claramente el fenómeno a estudiar, a pesar de ser obtenidos por estudiantes de carreras no químicas.
En las carreras que estudian problemáticas ambientales, un tema particularmente importante es el tratamiento de efluentes industriales. Entre las diversas técnicas empleadas, la adsorción, que puede definirse como la acumulación de una sustancia o un material en la interfase entre una superficie sólida y una solución con la que está en contacto (Stumm, 1992), se encuentra entre las más usadas en la remoción de contaminantes de aguas residuales debido a su simplicidad, bajo costo y fácil operación. Resulta particularmente atractivo el empleo de adsorbentes de origen natural (Nandi y otros, 2009). En este trabajo presentamos una experiencia de laboratorio con enfoque ambiental que pretende ejemplificar algunos conceptos vinculados al fenómeno de la adsorción. Si bien en la literatura especializada se describen diversos experimentos de adsorción (Guiraldo y Ayllón, 2011; Skopp, 2009; Potgieter, 1991; Fernandes y otros, 2005), en la mayoría de los casos éstos han sido pensados para estudiantes de Fisicoquímica, que poseen un considerable manejo de laboratorio. En el caso de esta propuesta, el experimento se diseñó simplificando todo lo posible las operaciones de laboratorio para asegurar la obtención de resultados confiables, a pesar de ser realizados por estudiantes que, si bien tuvieron cursos previos de Química con una fuerte carga experimental, en ninguno de ellos se enfatizó la adquisición de la manualidad típica de los estudiantes de carreras de Química.
El sistema a estudiarEl adsorbente seleccionado para este experimento son las tierras de diatomeas o diatomita, una roca sedimentaria de origen biogénico en cuya composición predomina la sílice amorfa que proviene de los esqueletos de organismos acuáticos llamados diatomeas. Este material presenta una estructura muy compleja, con numerosos poros microscópicos, cavidades y canales, por lo que posee una gran superficie específica, alta permeabilidad, elevada porosidad y baja densidad. Además presenta la ventaja de ser abundante y de bajo costo, por lo que se ha explorado su uso como adsorbente (Sari y otros, 2010; Gürü y otros, 2008), siendo una buena alternativa al empleo del carbón activado. La producción mundial de este material en el año 2007 fue de unas 2.050.000 toneladas, siendo los usos más difundidos su empleo como medio filtrante (incluyendo la purificación de cervezas, licores y vino, por ejemplo), con un 51% de la producción mundial; también se lo emplea como ingrediente en la fabricación de cemento Portland, y como adsorbente de derrames industriales y para el cuidado de la higiene de mascotas (Crangle, 2011).
Por otra parte, los colorantes sintéticos son ampliamente utilizados en diversas industrias, incluyendo la producción textil y de papel. A principios del siglo xxi, la producción mundial de colorantes alcanzaba las 7 × 105 toneladas anuales; se estima que un 10–15% del total de esta producción se pierde en los efluentes industriales provenientes de procesos de teñido. Si además tenemos en cuenta que el teñido es un proceso que demanda cantidades de agua muy elevadas, resulta relevante disponer de sistemas de tratamiento adecuados para estos efluentes (Al-Ghouti, 2003).
De lo presentado hasta aquí se desprende que el sistema colorantes-diatomita es de interés para estudiantes de ciencias ambientales, pues es un ejemplo de un problema real en el cual la adsorción se constituye en una herramienta fundamental para el tratamiento de efluentes de procesos de teñido. Por otro lado, desde la perspectiva docente, posee una serie de ventajas. En cuanto al adsorbente, la diatomita es barata y fácil de conseguir en cualquier supermercado, ya que se comercializa como “piedritas sanitarias para mascotas”. La selección de un colorante como segundo componente de este sistema adsorbente/sorbato se basa en la necesidad de tener un método analítico sencillo y rápido para determinar la concentración de la sustancia a ser adsorbida. La información clave para estudiar un proceso de adsorción es la concentración del sorbato en solución una vez que entra en contacto con el adsorbente. Para que el experimento refleje condiciones reales y se pueda evaluar la eficiencia del adsorbente, en general se trabaja con concentraciones bajas; ello implica que se requiere de técnicas analíticas de sensibilidad elevada. La espectrofotometría visible es una herramienta sumamente adecuada para este fin pues es una técnica robusta, y que permite obtener un número considerable de datos en poco tiempo, por lo que los colorantes (con absortividades molares del orden de 104–105 cm2·mol–1), resultan un modelo sumamente adecuado de contaminantes coloreados. Además es posible seleccionar colorantes con características específicas (carga, solubilidad, color, etc.).
En esta experiencia de laboratorio se propone el uso del colorante Violeta Cristal: es un colorante catiónico, fácilmente soluble en agua, que se emplea como componente de tintas azules y negras en bolígrafos, impresoras de chorro de tinta y otros usos. Para un ensayo cualitativo anexo, se sugiere el empleo del Rojo Ponceau 4R, un colorante aniónico muy soluble en agua que es utilizado como colorante de alimentos (Código Alimentario Argentino).
Procedimiento experimentalEste trabajo fue diseñado para ser realizado en dos sesiones de laboratorio de unas dos horas cada una, en dos semanas consecutivas. La sugerencia de dividir el trabajo experimental en dos etapas se basa en el hecho de que las mediciones de absorbancia se deben realizar una vez que el sistema químico alcance el equilibrio. Dado que un agitador mecánico no siempre está disponible en un laboratorio de enseñanza, dejar transcurrir una semana entre la preparación de las mezclas del adsorbente y del colorante y la medición de la absorbancia (con alguna agitación ocasional durante este lapso), suele ser suficiente para asegurar resultados reproducibles. Desde ya, en caso de disponer de un agitador mecánico, se recomienda su uso, pudiéndose acortar notablemente el tiempo de espera para que se alcance el equilibrio. Todas las experiencias se realizaron a temperatura ambiente (24°C).
Etapa 1: preparación de las muestrasMoler suavemente en un mortero una porción de diatomita para asegurar la homogeneidad del sólido. En 7-10 frascos limpios, colocar diferentes masas (entre 5 y 100 mg, pesadas a la décima de mg) de diatomita y agregar a todos ellos 100 mL de una disolución madre de Violeta Cristal (C25H30ClN3, Mr 407,979 g·mol–1) cuya absorbancia sea cercana a 2. En este caso se utilizó una disolución acuosa de Violeta Cristal 2,43 × 10–5M. Preparar un blanco de reactivos colocando en un frasco la disolución de Violeta Cristal, pero sin el adsorbente, para evaluar las pérdidas del colorante por adsorción en las paredes del recipiente. Si se dispone de un agitador mecánico, agitar durante 24 horas y luego dejar en reposo para que el sólido decante; si no se cuenta con esta herramienta, agitar los frascos ocasionalmente y dejar en contacto sólido y solución durante un tiempo mayor (una semana, por ejemplo).
En esta sesión se recomienda además preparar un ensayo cualitativo, en el cual se tienen dos frascos, conteniendo cada uno 100 mL de una disolución de un colorante aniónico como el Rojo Ponceau 4R (C20H11N2Na3O10S3; Mr 604,47 g·mol–1); a uno de ellos se agregan unos 100 mg de diatomita y el otro se deja como referencia.
Etapa 2: obtención de resultados de la adsorciónPreparar disoluciones de Violeta Cristal de concentración conocida y obtener la curva de calibración a 590 nm (figura 1). Medir y registrar las absorbancias de las soluciones sobrenadantes preparadas en la Etapa 1. En este caso es posible evitar la filtración o centrifugación previa del sólido si se tiene el cuidado de no agitar los frascos al tomar la alícuota del sobrenadante.
Análisis de los resultados y discusionesDependiendo de los intereses del curso, se presentan algunas sugerencias de aspectos del trabajo de laboratorio para ser discutidos en clase después de la realización del mismo.
¿Será eficiente este sistema para remover cualquier colorante de la disolución?Se observa que mientras la disolución de Rojo Ponceau 4R en contacto con el adsorbente prácticamente no ha variado su concentración, la del Violeta Cristal, con la misma masa de adsorbente (100 mg en ambos casos), se ha decolorado casi por completo. Los grupos Si–OH y Al–OH en la superficie de la diatomita están involucrados en la adsorción. Cuando la diatomita se coloca en agua destilada (el pH de la suspensión resultante es aproximadamente 8.15), la carga negativa (Si–O– y Al–O–) sobre el sólido atraerá a especies de carga positiva tales como el Violeta Cristal, mientras que el colorante aniónico Rojo Ponceau 4R será repelido debido a estar cargado negativamente (Al-Ghouti, 2003). Como resultado, la dolomita retiene eficientemente al Violeta Cristal mientras que el Rojo Ponceau 4R permanece en disolución.
¿Por qué agitamos los frascos?Los experimentos de adsorción deben realizarse bajo condiciones de equilibrio (Sparks, 2003): la sustancia a ser adsorbida deberá ser transportada desde el seno de la disolución hasta la superficie del sólido, donde podrá ser retenida, hasta que se alcance una concentración límite en disolución, correspondiente a las condiciones de equilibrio. Existen diversos mecanismos de transporte de materia: por difusión (respondiendo a un gradiente de concentraciones), por convección (cuando hay agitación mecánica) o por migración en un campo eléctrico. En este caso serán la convección y la difusión las responsables del transporte. Como la difusión es un proceso lento, la agitación del sistema favorece la interacción entre la disolución y el sólido, acelerando el establecimiento de las condiciones de equilibrio. Para observar claramente el transporte de materia por difusión, se puede preparar un frasco más con disolución de Violeta Cristal y unos 100 mg del adsorbente, y dejar en reposo sin agitar. Se verá la formación de un gradiente de color en la disolución, estando ésta prácticamente incolora cerca del sólido, en el fondo, mientras que la parte superior de la disolución permanecerá de color violeta (claramente, el gradiente de color muestra la existencia de un gradiente de concentración de Violeta Cristal). Si el tiempo de contacto fuera lo suficientemente largo, se llegará a la misma situación de equilibrio que en caso de agitar y el aspecto final del sistema será homogéneo.
Si agregara más masa de adsorbente, ¿qué pasaría con la cantidad de colorante en la disolución?La figura 2 muestra que a medida que se incrementa la masa del adsorbente disminuye la cantidad de colorante remanente en la disolución.
Como el colorante se unirá a sitios localizados sobre el sólido, con un aumento de la masa del sólido habrá mayor cantidad de sitios disponibles, por lo que se tendrá menos colorante en disolución. Este gráfico también muestra que cuando se desee implementar un proceso de tratamiento de efluentes, donde el costo del adsorbente es un parámetro importante en el diseño, es importante estimar la cantidad de adsorbente que debe utilizarse teniendo en cuenta los volúmenes a tratar, y las concentraciones inicial y final de las sustancias a remover del efluente tratado.
¿Cómo se evalúa la eficiencia de un adsorbente?Una isoterma de adsorción muestra cómo se reparte una dada sustancia entre la superficie de un sólido y la disolución, una vez que el sistema alcance la situación de equilibrio a una temperatura determinada. Como ejemplo, la figura 3 muestra la isoterma de adsorción del Violeta Cristal sobre diatomita a 24°C. Su utilidad radica en la posibilidad de interpretar los resultados mediante diversos modelos, cuantificando este reparto según sean las condiciones experimentales, y proveer información que se pueda emplear en el modelado de situaciones de interés.
Entre los diversos modelos que se pueden utilizar para interpretar las isotermas obtenidas experimentalmente, probablemente los más difundidos sean el modelo de Langmuir y el de Freundlich (Stumm, 1992; Shawabkeh, 2003). Se debe tener en cuenta que las isotermas son descripciones macroscópicas de los datos y que no brindan información sobre el mecanismo del proceso de adsorción en sí. Por lo tanto, el hecho de que se puedan describir mediante algún modelo en particular, no implica que esa descripción sea única.
A continuación describiremos los modelos de Langmuir y de Freundlich, usando como ejemplo la adsorción de Violeta Cristal (VC) sobre diatomita. El modelo de Langmuir supone que los sitios de adsorción S en la superficie del sólido pueden ser ocupados por el adsorbato VC, inicialmente presente en la disolución, según una estequiometría 1:1 para generar un sitio ocupado S-VC:
Planteando la constante para este equilibrio y el balance de masa para los sitios totales St, se tiene:
donde las concentraciones de sitios [St], [S] y [S-VC] se expresan en moles de sitios (totales, vacíos u ocupados por Violeta Cristal, respectivamente) por gramo de sólido, y [VC] en moles de Violeta Cristal por litro de disolución sobrenadante, en contacto con el sólido.A partir de las ecuaciones (1) y (2) se obtiene la ecuación (3) que muestra la relación entre la cantidad de adsorbato depositado en la superficie [S-VC] (número de moles de VC unidos al adsorbente, por gramo de sólido) y la concentración del soluto en la solución [VC]eq:
La ecuación (3) describe el modelo de Langmuir, que se basa en la premisa de que una vez que se ocupen todos los sitios en la superficie ([S-VC]máx= [St]), se habrá formado una monocapa de Violeta Cristal sobre la superficie del sólido, y éste se encuentra saturado. Debemos tener en cuenta que otra de las suposiciones de este modelo es que la energía de adsorción es independiente del grado de cobertura del sólido y que todos los sitios en la superficie del sólido son equivalentes. A pesar de partir de suposiciones bastante restrictivas, el modelo es sencillo y presenta las ventajas didácticas de que la ecuación de la isoterma se puede deducir fácilmente, y que tanto la pendiente de la zona lineal inicial como el valor de saturación se vinculan directamente con la máxima cobertura del sólido en forma de monocapa ([S-VC]máx) y con la constante de adsorción Kads (L·mol–1). En la figura 3 se observa que para concentraciones de Violeta Cristal en disolución mayores a 1 × 10–5 M, la masa de colorante adsorbido tiende a una constante ([S-VC]máx), indicando que aunque se siga incrementando la cantidad de colorante en disolución, los sitios del sólido ya están saturados, no pudiéndose retener mayor cantidad de Violeta Cristal.
Por otra parte, el modelo de Freundlich es empírico, proponiéndose la ecuación
donde Kf (Lb.mol–b.g–1) y b (en general menor que 1, adimensional) son constantes empíricas. Este modelo no implica ninguna suposición o restricción: a diferencia del modelo de Langmuir, los sitios en la superficie del sólido no tienen que ser necesariamente idénticos. Es más, este modelo no predice la formación de una monocapa límite para la adsorción, permitiendo una mayor incorporación del adsorbato, aunque la adsorción se vaya haciendo progresivamente más dificultosa a medida que se va acumulando adsorbato sobre el sólido (vanLoon y Duffy, 2002).Ajustes y aplicación de modelosHoy en día es posible ajustar matemáticamente los datos de las isotermas con facilidad; sin embargo, consideramos que un análisis gráfico sencillo, utilizado aún ampliamente en la literatura científica, es adecuado para obtener los parámetros de las isotermas sin que distraiga la atención de los estudiantes con el procedimiento matemático en sí. Para esto, las ecuaciones que describen las isotermas de ambos modelos se pueden presentar de una manera ligeramente diferente, obteniendo las expresiones de rectas. En el caso del modelo de Langmuir, simplemente se emplea la inversa de la ecuación (3), resultando:
Empleando los datos de la isoterma que corresponden al régimen inicial, o sea, de la zona en la que no haya saturación del adsorbente y representándolos gráficamente según 1/[S-VC] vs. 1/[VC]eq, se obtendrá una recta con ordenada al origen ([S-VC]máx)–1 y de cuya pendiente se puede estimar el valor de Kads.
El gráfico de la forma lineal de la ecuación del modelo de Freundlich, en cambio, puede obtenerse aplicando logaritmos a la ecuación (4):
del gráfico que muestre ln [S-VC] vs. ln [VC]eq, se obtendrá b de la pendiente y Kf de la ordenada al origen.
La figura 4 presenta los datos experimentales de la isoterma, según la linealización de Langmuir (4.a) y la de Freundlich (4.b).
De la figura 4 se desprende que, si bien el coeficiente de correlación es más cercano a uno en la linealización según el modelo de Freundlich, observándose un mejor ajuste de los datos experimentales a una recta, la linealización según el modelo de Langmuir también puede ser aplicada. La tabla 1 reúne los parámetros de adsorción aplicando ambos modelos al mismo sistema experimental.
En algunos casos se puede utilizar el ámbito lineal de la isoterma de adsorción, con bajos recubrimientos (figura 3) y definir un coeficiente de partición Kp; este parámetro es una medida de la relación entre el material adsorbido y el que se encuentra en disolución, dentro de ámbitos de concentración más restringidos. Es de utilidad en el análisis de procesos de adsorción–desorción reversibles, pequeños cambios de temperatura, ausencia de competencia entre adsorbatos, por ejemplo. El coeficiente de partición corresponde a la pendiente de la porción lineal del adsorbente según: [S-VC] = Kp × [VC], o sea, para b = 1 en el modelo de Freundlich (ecuación 4) o cuando Kads × [VC] << l en el modelo de Langmuir (ecuación 3).
¿Estimar la superficie específica del adsorbente?Brina y De Battisti (1987) proponen estimar superficies de sólidos mediante experimentos de adsorción. Cuando los datos se pueden ajustar con el modelo de Langmuir, como en este caso, se puede estimar el número de sitios totales por unidad de masa ya que se puede suponer que el adsorbato forma una monocapa sobre el sólido. Es posible estimar la superficie específica del adsorbente conociendo el área de una molécula de Violeta Cristal (225 Å2) y la capacidad de retención del colorante por gramo de diatomita (calculado a partir de la linealización de Langmuir, 1,1×10–4 mol/g, tabla 1). La superficie específica es una propiedad física importante de los minerales, que dependerá de su estructura y composición química. En el caso de las tierras de diatomeas usadas en el trabajo de laboratorio se obtuvieron valores de 149 m2/g. Este valor es del orden de las superficies específicas de minerales tales como la vermiculita (50-800 m2/g), los óxidos de aluminio (100-220 m2/g) (Sparks, 2003). Kaufhold y cols. (2008) informan que la superficie específica de las diatomitas puede llegar hasta unos 100 m2/g.
ConclusionesEsta propuesta de laboratorio ha sido utilizada con éxito en cursos de Química Ambiental como ejemplo del fenómeno de adsorción y como disparador de discusiones sobre diferentes metodologías de tratamiento de efluentes industriales. La decoloración de las disoluciones en presencia de cantidades crecientes de adsorbente es apreciable a simple vista, por lo que este trabajo de laboratorio resulta atractivo aún como ejemplo demostrativo. El empleo de materiales de alta capacidad adsorbente, pero que sean de bajo costo y posean importancia económica y que sean producidos localmente tales como la diatomita, acerca a los estudiantes a situaciones de tratamientos de efluentes reales, despertando su interés en el trabajo. Esta propuesta, sencilla de llevar a la práctica aún con estudiantes de carreras no químicas, presenta múltiples aspectos para ser discutidos en clase. En estas discusiones se pone en evidencia el vínculo estrecho entre los conceptos químicos y respuestas a problemas ambientales que son críticos para la sociedad.