A collection of interesting facts about arsenic and its compounds is presented. Its intermediate behavior between metallic and non-metallic is invoked when describing the elemental state and some of its natural forms. Mention is given of the most famous arsenic compounds used by mankind for different applications, particularly since the 18th century to current days.
De entrada, cualquier persona que oiga la palabra arsénico, piensa en un veneno, pero es casi seguro que ella misma ignore que el arsénico ha formado parte de varios fármacos: algunos que a mediados del siglo 20 contribuyeron a la casi erradicación de la sífilis y otros que en la actualidad se utilizan con bastante éxito en el tratamiento de ciertos tipos de cáncer. Entonces: ¿veneno o medicina?
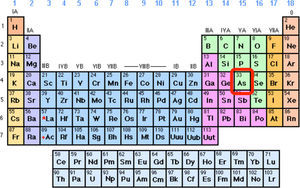
Independientemente de su carácter tóxico o benéfico para la salud, el arsénico es un elemento químico sorprendente por la gran variedad de formas en las que se le puede encontrar, ya sea en sus compuestos naturales o en compuestos sintéticos y aun en el estado elemental. El arsénico se encuentra en el centro del bloque p de la tabla periódica. Mientras que en todos los otros bloques —s, d y f— sólo encontramos elementos metálicos, en el bloque p hay de todo: metales típicos como el plomo, gases tan inertes como el helio, no-metales tan reactivos y peligrosos como el flúor o tan estables y manejables como el carbono. El arsénico se encuentra justo en el centro, justo a la mitad de la diagonal que divide a los metales de los no metales: es el elemento “más intermedio” de todos (figura 1).
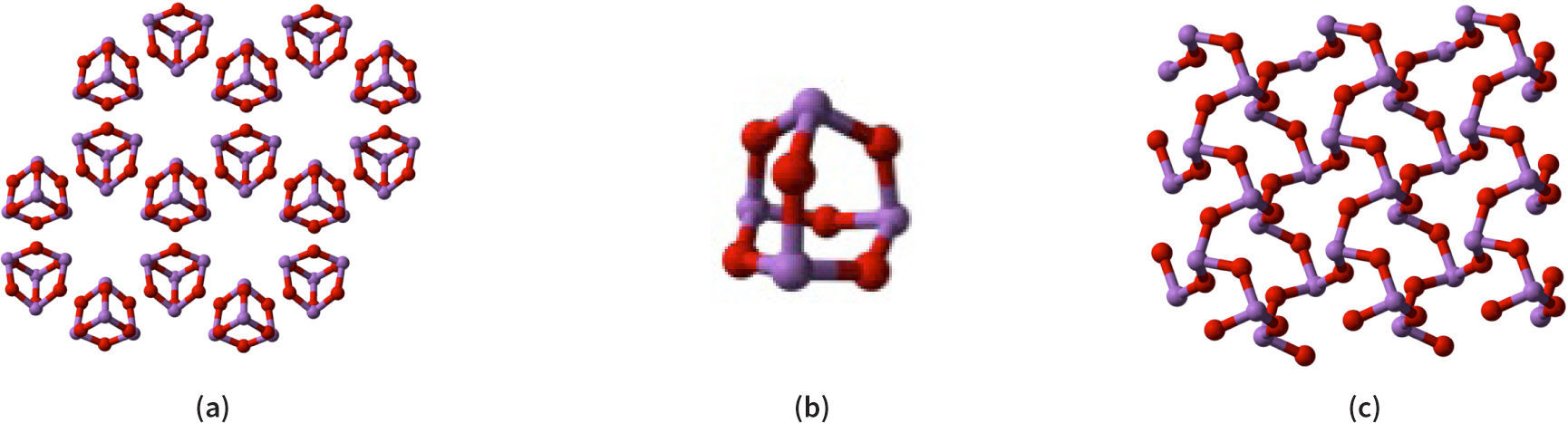
El arsénico efectivamente se comporta en unas ocasiones como un metal típico y en otras como un típico no metal. Tiene varias formas alotrópicas: la gris, la amarilla y la negra (figura 2). El alótropo gris tiene la misma estructura cristalina que su vecino de abajo en la tabla periódica, el metal antimonio, y una conductividad eléctrica muy respetable de 3.45 × 106 S/m, valor que se encuentra entre el que presentan el bario y el plomo, que son elementos típicamente metálicos. Por otro lado, el alótropo amarillo de este elemento está formado por moléculas tetraédricas As4, totalmente análogas a las que forma su no-metálico vecino de arriba en la tabla, el fósforo, en su alótropo blanco. Por su parte el alótropo negro del arsénico tiene una estructura equivalente a la del fósforo rojo.
En los compuestos químicos naturales del arsénico, también se deja ver la ambivalencia de este elemento; hay minerales de arsénico en los que éste se encuentra como catión, formando óxidos y sulfuros como cualquier metal y hay minerales en los que se encuentra, como los no-metales, formando diferentes tipos de aniones, desde oxoaniones como arseniatos y arsenitos hasta diferentes tipos de arseniuros.1
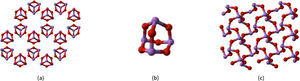
La ambivalencia no para ahí, ya que existe un compuesto aparentemente simple, el trióxido de arsénico (fórmula mínima As2O3) que se puede encontrar presente en la naturaleza de varias formas. Una, conocida como el mineral arsenolita, es isomórfica con el trióxido de fósforo, y como es típico de los óxidos de los no-metales, está formado por moléculas discretas, en este caso de fórmula As4O6. En la figura 3 se muestra tanto el arreglo cristalino como la unidad molecular. Y también existe en la naturaleza otro tipo de As2O3, con el nombre mineral de claudetita, que forma redes, en forma semejante a la de los óxidos metálicos.
Las principales fuentes minerales de arsénico son los sulfuros: el realgar (As4S4) y el orpimento (As2S3) descubiertos y apreciados desde hace milenios, tal vez porque ambos presentan bellas formas cristalinas, rojo sangre el primero y amarillo dorado el segundo (la palabra orpimento viene de Aurum pigmentum). Como puede apreciarse en la figura 4, también en los sulfuros persiste la ambivalencia de este elemento entre formar compuestos moleculares, como un no metal, o reticulares, como un metal.
Durante milenios, estos sulfuros u óxidos de arsénico fueron utilizados como medicamentos para tratar padecimientos tan diversos como las enfermedades venéreas, el asma, la tuberculosis o la diabetes, y recomendados tanto como antisépticos, sudoríficos, sedantes o tónicos. Por ejemplo, se tiene registro de que estos sulfuros eran recetados por Aristóteles e Hipócrates (siglo 4 a. C.) como remedios para úlceras de la piel y otros padecimientos.
En 1775 el notable químico sueco Carl Wilhelm Scheele, además de haber aislado por primera vez a los elementos oxígeno y cloro y haber identificado por primera vez a otros cuatro —bario, manganeso, molibdeno y tungsteno— preparó un pigmento verde que tuvo bastante aceptación en la época y al que se le conoció como verde de Scheele, cuya fórmula es CuHAsO3, o arsenito ácido de cobre. Este pigmento se utilizó ampliamente en pinturas, así como para teñir telas y papel, incluyendo papel tapiz. Poco después, a principios del siglo 19, el verde de Scheele se sustituyó por otro compuesto con una mejor retención, pero que también estaba hecho a base de cobre y arsénico, al que se le daba el nombre de verde de París (Cu(AcO)2 ⋅ 3Cu(AsO2)2 o aceto arsenito de cobre) y que siguió utilizándose en la fabricación de pinturas hasta el siglo 20 (figura 5).
El papel tapiz fabricado con el verde de Scheele se produjo masivamente; se estima que en 1830 la producción en el Reino Unido era de un millón de rollos al año y que para 1870 la producción anual ya llegaba a los 30 millones de rollos. El famoso químico alemán, Leopold Gmelin (1788-1853) intentó sin éxito llevar a cabo una campaña para prohibir estos pigmentos, al notar que el papel tapiz despedía un desagradable olor al humedecerse.
Estos pigmentos también fueron ampliamente utilizados en las artes plásticas, especialmente por los impresionistas, y se cree que contribuyeron a las causas de la ceguera de Monet, la diabetes de Cézzane y los desórdenes neurológicos de Van Gogh (aunque no hay que darle todo el crédito al arsénico, estos artistas usaban también como pigmentos, una gran variedad de compuestos de plomo y de mercurio cuya toxicidad hoy en día es bien reconocida).
Por otro lado, ya en el siglo 18 el empleo de arsénico como medicamento se intensificó gracias al invento del tónico de Fowler (figura 6). Éste consistía en una solución al 1% de arsenito de potasio, sal que se obtiene al disolver el óxido de arsénico (III) con una disolución de carbonato de potasio. En el manual Materia Medica 1899 de Merck, se indica el uso de arsénico para tratar padecimientos tan dispares como la malaria, la diabetes y la bronquitis, así como neuralgias, gastralgias y desórdenes uterinos, y menciona la solución de Fowler como el medio más conveniente de administración de este “fármaco”, actualmente utilizado únicamente como raticida.
Las referencias a la toxicidad del arsénico son abundantes, tanto en la historia como en la literatura. Por ejemplo, durante el siglo 1 a. C., se promulgó en el Imperio Romano la Lex Cornellia, que hacía ilegal el comercio y empleo de sustancias venenosas aun como castigo a prisioneros; entre éstas ya se contaba el óxido de arsénico, que era muy apreciado por su falta de color, olor y sabor. Alrededor del siglo 15 llegó a conocerse como el polvo de la sucesión, en la época en que varios miembros de la familia Borgia se especializaron en deshacerse de sus enemigos políticos o económicos utilizándolo.
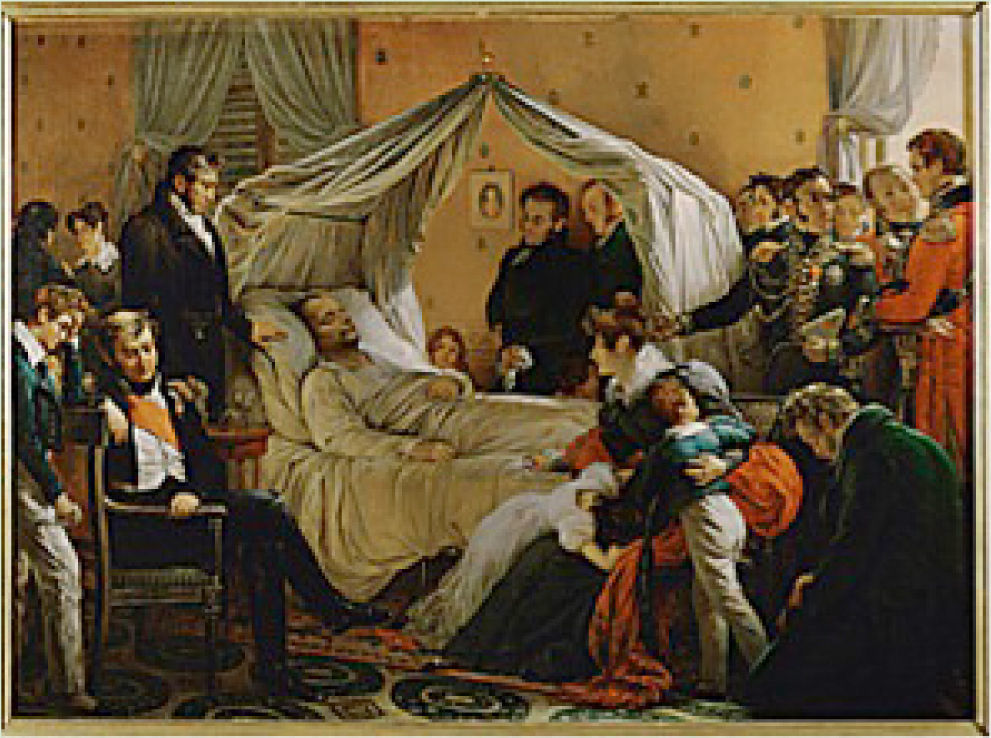
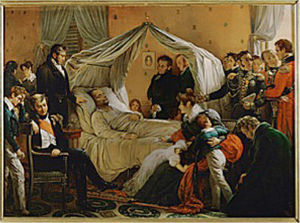
Mucho se ha elucubrado sobre el posible envenenamiento de Napoleón durante su exilio de 1821 en la remota isla de Santa Elena en el Atlántico sur.
La versión oficial fue que murió de cáncer estomacal, pero existe la propuesta de que Napoleón murió por envenenamiento con arsénico posiblemente intencional o posiblemente accidental. Está bien documentado que tanto en el cáncer estomacal como en el envenenamiento por arsénico, se presentarían cuadros de agudos dolores abdominales, como los que se sabe sufrió Napoleón en sus últimos días.
La propuesta del envenenamiento tomó fuerzas al haberse encontrado cantidades elevadas de arsénico en muestras de cabello del emperador. Se sabe que dada la gran afinidad del arsénico por el azufre, al ingresar a un ser vivo, este elemento tiene una gran tendencia a asociarse con los grupos sulfhidrilo (-SH) presentes en muchas proteínas, particularmente en la queratina, que conforma el pelo y las uñas.
En cuanto a la proveniencia del arsénico, hay quienes piensan que fue intencionalmente envenenado por sus captores británicos, mientras que otros historiadores argumentan que la intoxicacion pudo haber sido accidental. Se piensa que el papel tapiz de su recámara, coloreado con algún pigmento a base de arsénico, puede haber despedido arsina gaseosa (AsH3) o algún derivado metilado de arsénico ya que en un ambiente húmedo como el de Santa Elena, se favorece la proliferación de una gran variedad de hongos y bacterias, algunos de los cuales podrían haber sido capaces de producir transformar químicamente al arsénico contenido en los pigmentos como el verde de Scheele o el verde de París.
Sin embargo en el año 2008, un equipo de científicos italianos obtuvieron interesantes resultados al realizar unas detalladas mediciones de los contenidos de arsénico en muestras de cabello de Napoleón durante varias etapas de su vida, así como de su primera esposa Josefina y de su hijo Napoleón II (Clemenza, 2008).
Las pruebas se hicieron utilizando la sofisticada técnica de activación por neutrones. Esta técnica consiste en irradiar una muestra con neutrones térmicos (o lentos) para producir un isótopo radiactivo del elemento que se desea cuantifícar. Este isótopo emite una radiación gamma característica cuya intensidad depende del número de núcleos radiactivos generados. Si se cuenta con una muestra de concentración conocida del elemento cuya concentración se requiere conocer, por comparación puede conocerse el contenido de ese elemento en la muestra problema, que puede ser del orden de partes por billón (Iturbe, 2003).
En todas las muestras analizadas, los niveles de arsénico resulta ron ser muy semejantes entre sí, aunque aproximadamente 100 veces por encima del contenido promedio encontrado en los cabellos de personas vivas en la actualidad. Con este estudio quedó descartada la propuesta de muerte por envenenamiento accidental, pero se confirmó que la presencia de arsénico ambiental hace dos siglos, era mucho mayor que la actual.
En la literatura hay numerosas referencias al arsénico como veneno, como en la famosa novela Madame Bovary de Gustave Flauvert (1856), donde la protagonista se suicida con esta sustancia. Y ya en el siglo 20, la prolífica autora de novelas de misterio, Agatha Christie, recurre al envenenamiento en un gran número de sus novelas; el arsénico aparece mencionado en la cuarta parte de ellas (Gerald, 1993).
Para completar toda esta propaganda, en 1944 Hollywood sacó a la luz el gran éxito de taquilla “Arsenic and Old Lace”, una comedia de humor negro protagonizada por Cary Grant (figura 7). Esta película está basada en una obra de teatro que se ha vuelto un clásico, ya que ha sido representada en cientos de versiones alrededor del mundo aun hasta nuestros días, contribuyendo considerablemente a la gran popularidad del arsénico.
Los químicos sintéticos del siglo 18 descubrieron que el arsénico podía combinarse para formar una gran variedad de compuestos orgánicos. La primera referencia que se encuentra es la de Louis Claude Cadet en 1760, que hizo reaccionar al óxido de arsénico con acetato de potasio para obtener un líquido al que Berzelius llamó “cacodilo”, que proviene del griego kakodes y significa mal oliente. Si concedemos que el arsénico puede considerarse un metal, este compuesto probablemente fue el primer compuesto organometálico (compuesto que contiene un enlace metal-carbono) en ser descrito.2 La composición química de este apestoso líquido fue elucidada como CH3-As-As-CH3 hasta 1843 por Robert Bunsen, quien aparte de inventar el mechero que lleva su nombre y descubrir varios elementos, hizo mucha química.
Más tarde, a principios del siglo 20 el célebre bacteriólogo alemán Paul Ehrlich (premio Nobel de Medicina 1908), introdujo al mercado un fármaco conocido como salvarsán, arsfenamina, o “606”, que tuvo un enorme éxito comercial en todo el mundo ya que fue el primer compuesto sintético específico para el tratamiento de la sífilis. La arsfenamina es un compuesto organoarsénico que fue el único tratamiento empleado contra esta enfermedad hasta la introducción de la penicilina en los años 50. Aún en los años 60 podían verse en muchísimas esquinas de todo México, los anuncios del 606.
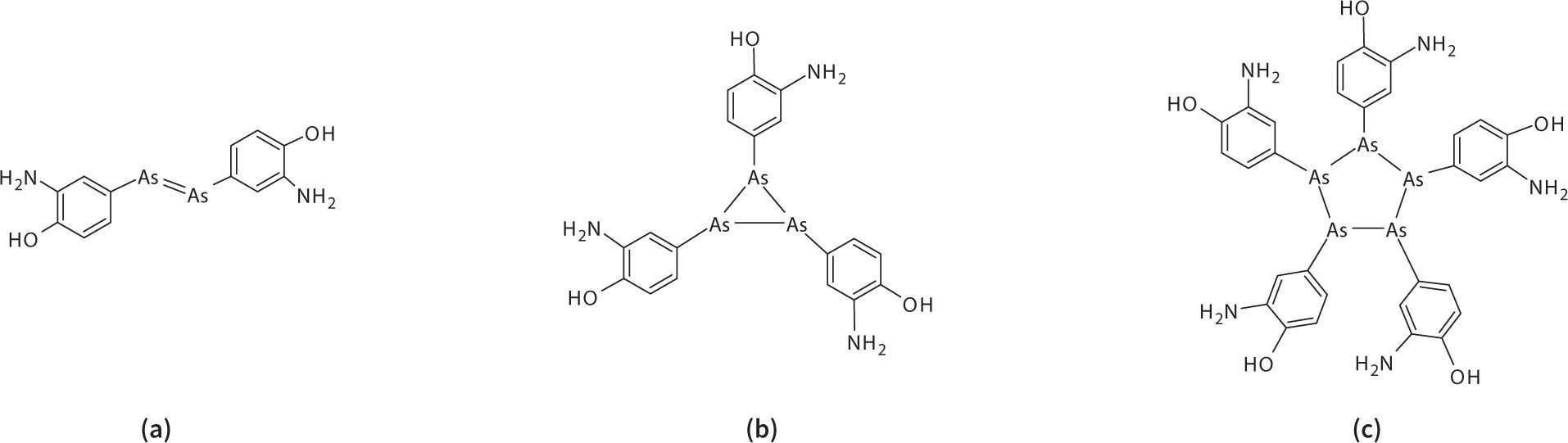
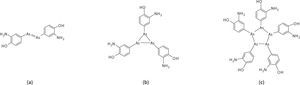
Por cierto, la fórmula con la que Ehrlich publicó este compuesto, y que es la que aparece en múltiples referencias y farmacopeas hasta la fecha, no es la correcta. Él propuso un doble enlace arsénico-arsénico, semejante a los compuestos azo de nitrógeno formando un dímero de C6H6NOAs, figura 8(a). Con el gran desarrollo de la química (orgánica, inorgánica, organometálica u organo-no-metálica) que se dio durante el siglo 20, la posibilidad de un doble enlace —As=As— fue muy cuestionada. Actualmente se sabe que los dobles enlaces entre átomos del tercer o cuarto periodo (Si, P, S, Ge, As, Se) del bloque p son poco probables debido al muy débil traslape ð que puede darse entre orbitales 3p o Ap, debido a su mucho mayor tamaño y menor densidad electrónica comparados con los orbitales 2p, con los que se forman estos enlaces en el los compuestos de átomos más pequeños, como el carbono, el nitrógeno y el oxígeno. Basado en esta hipótesis, y apoyado por la espectrometría de masas de alta resolución, el grupo del profesor Brian Nicholson ha elucidado, sin lugar a duda, que el fármaco que se administraba con el nombre de salvarsán era realmente la mezcla de dos formas, un trímero y un pentámero, figuras 8 (b) y (c) (Lloyd, 2005).
Es entonces notable que en la actualidad, en pleno siglo 21, cuando la toxicidad del arsénico tiene una celebridad que rebasa el ambiente científico gracias a la literatura, el cine y el teatro, se ha vuelto a emplear el óxido de arsénico como medicamento, en esta ocasión, para el tratamiento de cierto tipo de leucemias.
El arsénico blanco u óxido de arsénico As2O3 ha sido empleado en la medicina tradicional china desde hace más de 2000 años, para curar diversos padecimientos, pero en los últimos años, su uso farmacéutico ha retomado un gran auge. En 1992, un grupo de médicos chinos publicaron el uso del As2O3 para tratar la leucemia promielocítica aguda (LPA) logrando índices de curación superiores al 90%. Estos notables resultados motivaron a médicos en los Estados Unidos a realizar sus propios estudios y a comprobar la eficacia de esta venenosa sustancia en el tratamiento de esta enfermedad.
En los últimos 10 años se ha venido incrementando el uso de As2O3 para tratar esta leucemia con buenos resultados, pero aún se conoce muy poco sobre el mecanismo de acción.
En abril del 2010, un grupo de investigadores chinos publicó en la revista Science un interesante trabajo en el que describen como el arsénico, al unirse a los grupos sulfhidrilo (parte del aminoácido cisteína) de una proteína fundamental para en el crecimiento de las células malignas de LPA, acaba prácticamente con ellas (Zhang, 2010).
Arsénico y bacteriasLas bacterias son organismos unicelulares que existen en prácticamente cualquier lugar de nuestro planeta. Existen variedades de bacterias capaces de vivir en medios que para la mayoría de los organismos vivos resultarían hostiles, por ejemplo, a elevadas temperaturas (cerca de fuentes geotérmicas), altísimas presiones (en el fondo del mar) o en condiciones de elevada acidez o alcalinidad.
En 1998, se publicó el descubrimiento de un par de especies de bacterias capaces de prosperar en un ambiente químico muy alcalino y con una concentración de arsénico más de 2000 veces mayor al límite comúnmente considerado como aceptable. Estas bacterias son capaces de “respirar” arsénico, es decir, obtienen energía de reacciones en las que se reduce el As(V) a As(III) de manera análoga a como muchos organismos la obtienen de la reducción de oxígeno molecular a agua.
La publicación de este descubrimiento no tuvo ninguna repercusión más allá de los medios especializados; sin embargo, en diciembre de 2010, unos astrobiólogos de la NASA publicaron en la prestigiosa revista Science, un artículo que causó un gran revuelo ya que llegó a los noticieros de televisión y con ellos, a todo el mundo (Wolfe-Simon, 2011).
Estos científicos aseguraron que, al cultivar a estas bacterias en un medio rico en arsénico, al que se le hubiera eliminado totalmente el fósforo, éstas son capaces de incorporar el arsénico como constituyente del ADN, mediante la sustitución de grupos arseniato por los grupos fosfato que normalmente contribuyen a enlazar los eslabones de esta molécula maestra. Esta nota llevó inmediatamente a los medios a extrapolar que la NASA había declarado que se había demostrado que existen otras posibles formas de vida distintas a las conocidas en este planeta, basadas en la química de otros elementos.
La reacción no se hizo esperar. Este artículo fue publicado en línea por la revista Science el día 2 de diciembre de 2010. Dos días después aparecieron en el blog de una profesora canadiense de microbiología los primeros cuestionamientos, lo que disparó inmediatamente un alud de comentarios que ponían en duda los resultados de la NASA. Estas primeras objeciones estaban basadas principalmente en la falta de pruebas para asegurar contundentemente que el arsénico que se identificó en una muestra de ADN de esas bacterias se encuentre precisamente ocupando el lugar del fósforo en la molécula maestra, y no como una impureza de la muestra. Ante la unión de una gran cantidad de especialistas escépticos, a la científica de la NASA no le quedó más remedio que dar otra entrevista, publicada en Science el 20 de diciembre, en la que pide a la comunidad científica internacional tiempo y paciencia, para realizar una nueva serie de determinaciones, ahora apoyada por una gran cantidad colaboradores recién adquiridos que ofrecieron su saber y su tener para contribuir a aclarar esta controversia.
Las celdas solares (o celdas fotovoltaicas) son dispositivos que convierten la energía del sol directamente en energía eléctrica. En ellas. los fotones de la luz solar son absorbidos por un material semiconductor, típicamente silicio en estado elemental. Ante este estímulo, algunos de los electrones de material se desprenden, pudiendo fluir creando una corriente eléctrica. En la actualidad, se realiza mucha Investigación en todo el mundo, haciendo va naciones en el material semiconductor para lograr celdas solares más eficientes, ya que las que se encuentran en el mercado actualmente tienen baja eficiencia.
Estas variaciones van desde utilizar al silicio en diferentes formas-como monocristal, como material policristalino, como película delgada -hasta combinarlo o sustituirlo con otros materiales a base de otros elementos químicos. Entre los materiales que se han desarrollado y probado para estas aplicaciones, se encuentran algunos que combinan elementos del grupo 13 con elementos del grupo 15 de la tabla periódica. El silicio se encuentra en el grupo 14, en los materiales nuevos se combinan elementos que tienen un electrón de valencia menos que el silicio (como aluminio, galio, indio) con elementos que tienen un electrón de valencia más (como fósforo, arsénico, antimonio).
De estos nuevos materiales, el arseniuro de gallo (GaAs) es el que más se está empleando en la actualidad. Tiene mejor eficiencia que el silicio, pero es considerablemente más caro. Su éxito más notorio ha sido su empleo para la generación de energía eléctrica en los satélites artificiales donde su elevado costo sí se justifica por su mayor eficiencia.
Este material también se encuentra formando parte fundamental de dispositivos como nuestros teléfonos celulares, i-Pods y reproductores de CD. Así, este elemento que tan mala fama tiene, en la actualidad contribuye cada día más, de una silenciosa manera, a nuestro bienestar.
Y así durante esa espera, salió a la luz en la revista Chemical Biology (publicada por la American Chemical Society) el 11 de enero, un artículo donde los autores le dan a la microbióloga de la NASA una clase de química, informándole que está bien documentado que mientras los enlaces fósforo-oxígeno en la molécula de ADN son cinéticamente de los más inertes conocidos, ya que se hidrolizan con unos tiempos de vida media de 30,000,000 años3 los enlaces análogos arsénico-oxígeno, se rompen en medio acuoso y a temperatura ambiente ¡con apenas una vida media de 0.06 segundos! (Ferky, 2011).
Y finalmente para acabar de enterrar este asunto Mikael Elias y Alon Wellner, del Weizmann Institute of Science en Israel, publicaron a finales del 2012 un finísimo estudio que prueba cómo es que las bacterias son capaces de asimilar fosfato entre un mar de arseniato (Elias, 2012).
Estos investigadores utilizaron en su estudio cinco diferentes proteínas bacterianas encargadas de transportar fosfato hacia las células, enlazándose directamente con este anión. Para probar qué tan efectivas son éstas para discriminar entre fosfato y arseniato, a cada una de ellas la colocaron en disoluciones con una misma cantidad de fosfato y cantidades variables de arseniato.
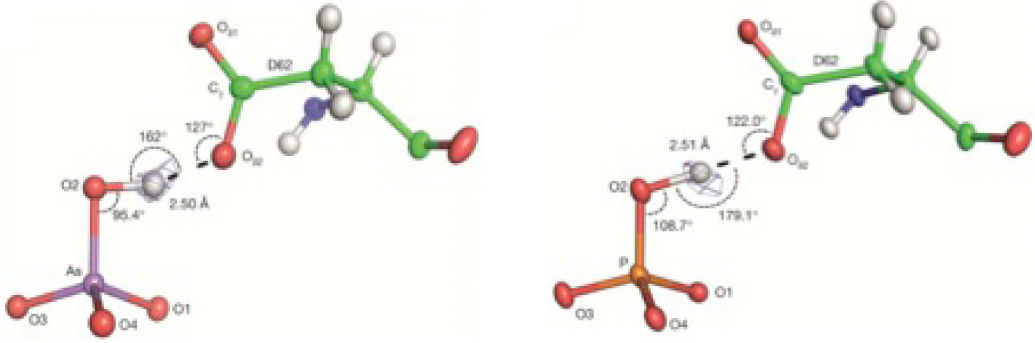
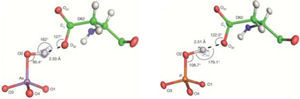
Encontraron que aun en disoluciones en las que había 500 veces más arseniato que fosfato todas las proteínas estudiadas se enlazaban preferentemente con el fosfato; en particular la proteína de la bacteria de Mono Lake incorporó selectivamente al fosfato habiendo 4,500 veces más arseniato en el medio. Lograron, sin embargo, obtener a la proteína unida al arseniato para comparar su estructura con la que se une al fosfato. El detallado análisis de las estructuras de rayos X (figura 10) de estas dos especies reveló que la diferencia del 4% en el volumen del arseniato y del fosfato, es capaz de establecer —o no— una eficiente red de enlaces de hidrógeno, responsables de esta notabilísima selectividad.
Esto no prueba que el arseniato no se pueda incorporar a las proteínas de las bacterias, solo muestra cómo éstas son capaces de extraer el fosfato del medio aun en circunstancias marcadamente desventajosas para éste.
Entre estos últimos, destaca la sperrylita o arseniuro de platino PtAs2, con estructura isomorfa a la pirita común (FeS2), que es el único mineral formado simplemente por un compuesto binario de este tan noble metal.
Dorothy C. Hodgkin obtuvo el premio Nobel de química en 1964 por sus estudios de elucidación de estructuras cristalinas de biomoléculas complejas, entre ellas la vitamina B12. Entre otras cosas, encontró que en la vitamina B12, existe un enlace Co-C, lo que convierte a este compuesto en un organometálico, preparado por la naturaleza mucho tiempo antes que los mencionados.
Esto significa que son necesarios 30 millones de años para que se rompa la mitad de los enlaces fósforo-oxígeno en una muestra de adn.