The majority of science teachers believe that familiarity with scientific methods through numerous laboratory practices is a priority objective of science education, as important or more than the acquisition of conceptual knowledge. However, a great number of investigations indicate that it is not true. Educational research has revealed serious errors in the orientation of practical work and in the teachers' conceptions of the nature of the underlying scientific work they carry out. Now it looks as if the issue regarding learning in and from the science laboratory — in teaching and learning Chemistry — is still relevant. Based on Hodson's analysis of the experimental work, we reviewed some of the proposals to diversify and reconceptualize practical teaching, so we designed and tested an experiment and a practical exercise. The goal of the first is to promote the construction of the kinetic molecular model of matter and of the second is the issue of limiting reactant.
A un cuando la mayoría de los profesores de ciencias opinan que la familiarización con los métodos científicos, mediante la realización de abundantes prácticas de laboratorio, constituye un objetivo prioritario de la educación en ciencias, tan importante o más que la adquisición de conocimientos conceptuales, un gran número de investigaciones indican que no es así. A este respecto, la investigación didáctica ha puesto en evidencia graves errores en la orientación de los trabajos prácticos1 y en las concepciones de la naturaleza del trabajo científico que subyacen en los docentes (Gil et al., 1991).
Los profesores de ciencias seguimos pensando que las actividades de laboratorio son instrumentos básicos para el aprendizaje y la evaluación del conocimiento en las clases de ciencias (Caballer y Oñorbe, 1997) y estamos convencidos de que el laboratorio es el espacio ideal para el desarrollo de las habilidades intelectuales de aplicación, manipulación de materiales e instrumentos, manejo de datos y fórmulas, aprendizaje de técnicas de laboratorio, construcción de conceptos, análisis de datos, identificación de variables y de las correlaciones entre ellas, etc.
Afirmamos también que las actividades experimentales nos permiten poner en marcha mecanismos intelectuales necesarios en el aprendizaje científico como son: la aplicación de conceptos y desarrollo de procedimientos de inferencia, la generalización y la abstracción, la preparación y justificación de investigaciones, la emisión de hipótesis, la reestructuración y acomodación de las redes de conceptos individuales que permiten dar significado a lo que se aprende, el conocimiento de las concepciones alternativas del alumnado y el planteamiento del conflicto entre las ideas personales y los modelos científicos.
A fines del siglo XX, Hodson (1994) hizo un análisis muy crítico de la enseñanza experimental que se hacía hasta ese momento y consideramos que ese documento es un parte aguas en la historia de la educación de las ciencias experimentales y en la percepción que del trabajo científico tenemos los docentes. En la introducción del artículo, Hodson menciona lo que nos parece la paradoja de la enseñanza práctica: El trabajo práctico ha sido periódicamente desacreditado, muchas veces calificado como una pérdida de tiempo y, sin embargo, la idea predominante en el profesorado de ciencias es que la experiencia práctica es la esencia del aprendizaje científico.
Su investigación se basa en identificar si realmente los trabajos prácticos son útiles en cada una de las cinco categorías generales en las que agrupa los motivos por los cuales los docentes de ciencias proponen a sus alumnos la realización de este tipo de actividades:
- •
motivación,
- •
aprendizaje de técnicas de laboratorio,
- •
aprendizaje de conocimientos científicos,
- •
conocimiento del método científico y su uso, y
- •
desarrollo de actitudes científicas.
Los resultados son interesantes y, en algunos casos, sorprendentes.
Respecto a lo motivante que es el trabajo práctico, encuentra que normalmente los estudiantes disfrutan de él, pero no todos de la misma forma. En una investigación que él mismo realizó en una escuela de Auckland, Nueva Zelanda, con una muestra de estudiantes de 13 a 16 años que presentaban buena disposición hacia el trabajo práctico, encuentra que el 40% de ellos comenta que éste les gusta cuando saben lo que están haciendo, pero que prefieren hacer sus propios experimentos y no les gusta cuando salen mal. Propone que el debate está en el tipo de trabajos prácticos que diseñamos para los estudiantes, ya que habitualmente a los más jóvenes les dejamos realizar trabajos más libres y, conforme van ascendiendo en el nivel escolar, los trabajos son más dirigidos y estructurados.
En relación a si la enseñanza experimental propicia el aprendizaje de técnicas de laboratorio, Hodson dice que hay evidencias de que después de muchos años de enseñanza práctica, los alumnos no son capaces de llevar a cabo, en forma precisa y comprendiendo lo que hacen, tareas experimentales sencillas como montar un circuito eléctrico o diseñar una técnica de filtración simple. Afirma que la adquisición de técnicas o destrezas experimentales tiene poco valor por sí misma, ya que éstas son un medio, no un fin. El trabajo práctico no es necesario para que los alumnos adquieran ciertas técnicas de laboratorio, es al revés: los alumnos deben aprender técnicas de laboratorio para desarrollar con éxito el trabajo experimental.
Acerca del aprendizaje de conocimientos científicos, menciona que si bien los datos en la literatura especializada son poco concluyentes, no se puede afirmar que el trabajo práctico sea superior a otros métodos y, en ocasiones, parece ser menos útil en la construcción de conocimientos en forma significativa.
Lo mismo sucede con lo que aprenden los alumnos acerca de la naturaleza de la ciencia. En este renglón, Hodson hace referencia a la dañina herencia que la propuesta de aprendizaje por descubrimiento ha dejado: una visión inductivista de la ciencia, una metodología centrada en el alumno y el énfasis puesto en el experimento como un modo de tomar decisiones inequívocas sobre la validez o falsedad de las teorías. En este renglón, es importante tener presente las concepciones alternativas que los docentes tienen al respecto, generadas por sus propias experiencias de aprendizaje y, finalmente, lo cómodo que resulta la creencia en un solo algoritmo preciso, director de las investigaciones científicas.
Respecto al desarrollo de actitudes científicas, menciona que acciones como el cuchareo de datos experimentales, usadas algunas veces por los docentes para asegurar la conformidad con los resultados esperados o los reportados en los libros, y la imagen estereotipada del científico manejada por la sociedad y por varios profesores, dan mala cuenta de la promoción de este aspecto. Es frecuente que el trabajo práctico se revele contraproducente y dé lugar a ° una comprensión incoherente y distorsionada de la metodología científica y de las actitudes que se promueven en su desarrollo.
Con base en la investigación del autor, el trabajo práctico presenta ventajas sólo respecto al desarrollo de técnicas de laboratorio. No así en relación con conceptos adquiridos, comprensión de metodología científica, desarrollo de actitudes o valores científicos o motivación.
En resumen, el trabajo práctico se utiliza de una manera irreflexiva ya que, es sobreutilizado; las prácticas se usan como algo normal y no como algo extraordinario e infrautilizado; sólo en contadas ocasiones se explota completamente su auténtico potencial.
Frente a esta situación, Hodson recomienda reconceptualizar y diversificar el trabajo práctico y, como respuesta a esta solicitud, nuevamente la literatura tiene propuestas muy interesantes.
Sobre la reconceptualización de los trabajos prácticosLa reconceptualización de la enseñanza experimental debe estar enmarcada en una reflexión profunda sobre cuáles son los objetivos de la educación científica y del trabajo experimental de cara a las exigencias educativas del siglo xxi, y con base en ello, decidir cuáles son las estrategias más útiles y diseñarlas para estos propósitos. La evaluación de los resultados debe estar en concordancia con estos objetivos.
Hasta hace algunos años, las investigaciones en didáctica de las ciencias trataban en forma separada el aprendizaje de conceptos y la construcción de modelos, de la resolución de problemas y de los trabajos prácticos, a pesar de que estos tres tipos de aprendizaje se desarrollan en forma paralela en la investigación científica. Las nuevas tendencias de educación en ciencias experimentales, apuntan a lo vano de dicha diferenciación y la propuesta entonces es trabajar en la integración de estos tres aspectos (Garritz e Irazoque, 2004).
Por otro lado, la visión moderna de la educación científica concibe el aprendizaje de las ciencias no sólo como un cambio conceptual, como tradicionalmente se venía haciendo, sino también metodológico, actitudinal y valoral. Daniel Gil y colaboradores (1999) afirman que la transformación efectiva de la educación habitual de las ciencias requiere algo más que el simple reconocimiento de sus carencias más visibles o de la introducción de innovaciones puntuales restringidas a un solo aspecto. Es necesario un replanteamiento global de todo el proceso enseñanza-aprendizaje de las ciencias que integre coherentemente los distintos aspectos hasta ahora estudiados en forma separada.
Para poder cumplir con este propósito de integración, la enseñanza experimental debe perfilar los trabajos prácticos con base en tres finalidades: aprender ciencias, aprender qué es la ciencia y aprender a hacer ciencia. Cada uno de estos propósitos determina objetivos particulares que requieren estrategias específicas para ser alcanzados.
Mercé Izquierdo y colaboradoras (1999), por su parte, afirman que los experimentos escolares son poco eficaces porque se diseñan teniendo como referente lo que hacen los científicos, cuando deberían ser como un guión especialmente diseñado para aprender determinados aspectos de las ciencias, con su propio escenario (aula, laboratorio escolar, unos alumnos, un material), muy diferente del de una investigación. Las autoras le reconocen al trabajo experimental finalidades diversas: familiarización con los fenómenos, ilustrar conceptos científicos, desarrollar actividades prácticas, contrastar hipótesis e investigar. Dichas finalidades condicionan el diseño de los diferentes tipos de trabajos prácticos, útiles en general en el aprendizaje de procesos científicos. Sin embargo, las prácticas diseñadas para la investigación son las menos frecuentes en las aulas, aunque son las que más ayudan a aprender.
Las autoras ponen el acento en dos investigaciones recientes: el modelo cognitivo de ciencia escolar (MCCE), que procede de la filosofía de la ciencia postkuhniana, y la transposición didáctica, que procede de la nueva didáctica de las ciencias. Éstas sugieren la posibilidad de actuar con mayor autonomía en la escuela, diseñando nuevas estrategias, estrechamente vinculadas al aprendizaje de hechos, procedimientos y actitudes, para el aprendizaje del pensamiento científico, teórico y “no superficial”.
Sobre la diversificación del trabajo prácticoHodson (1994) entiende por trabajo práctico toda aquella metodología de aprendizaje que exija a los estudiantes el ser activos: actividades con computadoras, análisis de casos, entrevistas, debates y representación de papeles, escribir tareas de diversos tipos, hacer modelos, carteles y álbumes de recortes, investigar en la biblioteca, tomar fotografías y hacer videos.
Si bien no todos los autores están de acuerdo con estas distinciones, nuevamente la literatura especializada es rica en propuestas de diversificación (Woolnough y Allsop, 1985; Gott, Welford y Foulds, 1988; Sanmartí, Márquez y García, 2002). En particular, nos parece interesante e incluyente la clasificación que propone Aureli Caamaño (2004) al diferenciar los trabajos experimentales en cuatro tipos:
- •
experiencias,
- •
experimentos ilustrativos,
- •
ejercicios prácticos e
- •
investigaciones.
Las experiencias son actividades que propician la familiarización perceptiva de los estudiantes con los fenómenos; como ejemplos se mencionan: el experimentar la fuerza de una liga al estirarla, percibir el olor de un gas, etc.
Los experimentos ilustrativos están dirigidos a interpretar un fenómeno, ilustrar un principio o mostrar una relación entre variables. Se mencionan como ejemplos de esta categoría: la observación de la combustión de una vela dentro de un vaso rodeado de agua, la diferente viscosidad de los alcoholes en relación con la intensidad de las fuerzas intermoleculares, entre otros. El autor comenta también la pertinencia del uso de sensores para tener una observación más inmediata de la interrelación de las variables experimentales.
Los experimentos de aula (chemical demonstrations), tan comunes en la literatura, son ejemplo de estos dos tipos de trabajos prácticos, en función del manejo que se les dé. Talesnick (1993) las define como demostraciones de experimentos útiles para el conocimiento científico, que deben ser sencillas de presentar y atractivas, deben generar la curiosidad de los estudiantes y motivar el razonamiento “hands on, mind on” y, algo que consideramos fundamental, la diversión o la vistosidad no deben ser el único objetivo, por lo que todos los experimentos de aula deben aterrizar en algún concepto importante o en un tema ubicado en el currículo.
Hernández y colaboradoras (2010) hicieron una selección de treinta experimentos de aula, con los que desarrollan una propuesta que considera a este tipo de trabajos prácticos como un proceso y no como un hecho puntual. Las metodologías que proponen brindan a los alumnos la oportunidad no sólo de ver un cambio químico sorprendente, sino también se propicia la familiarización perceptiva con los fenómenos, el análisis de las relaciones entre las variables experimentales, se promueven explicaciones razonadas de los experimentos y la formulación de hipótesis, entre otras habilidades científicas.
Las actividades POE (predecir-observar-explicar) quedarían también circunscritas en estos dos renglones. Champagne y colaboradores (1980) presentaron un instrumento de evaluación diagnóstica (preinstruccional) para conocer las concepciones alternativas de los alumnos sobre el movimiento y le llamaron prueba doe (demostración, observación y explicación). Este instrumento se enriqueció con las aportaciones de otros educadores como Gunstone y White (1981), y evolucionó a lo que ahora se conoce como prueba poe (White y Gunstone, 1992).
Dicha estrategia consiste en describir a los alumnos el experimento que se va a realizar y pedirles que escriban su predicción (P) sobre lo que ellos creen que ocurrirá, después se realiza el experimento y se pide a los alumnos que anoten sus observaciones (O) y, finalmente, que las expliquen (E) tomando en cuenta la hipótesis que propusieron.
Los ejercicios prácticos son actividades que propician el desarrollo de habilidades prácticas (medición o manipulación de aparatos, entre otras), estrategias de investigación (control de variables, diseño de experimentos, etc.), habilidades de comunicación (saber seguir instrucciones o comunicar los resultados por medio de un informe) o procesos cognitivos en un contexto científico (observación, clasificación, inferencia, emisión de hipótesis, etc.). Ejemplos de este tipo de trabajos prácticos son, entre muchos otros, separar las sustancias que forman una mezcla, clasificar los sólidos según sus propiedades y la redacción de un informe sobre los resultados de una investigación.
Por último, las investigaciones son actividades que se diseñan con el fin de dar a los estudiantes la oportunidad de trabajar como los científicos o los tecnólogos en la resolución de problemas. Pueden ser investigaciones dirigidas a la resolución de un problema teórico como encontrar la carga eléctrica de un ión o encontrar la relación P-V de un determinado gas.
Un mismo trabajo práctico puede caer en una u otra de las categorías, en función de los objetivos didácticos y la orientación que se le dé a la actividad. Otro aspecto importante de tomar en cuenta en las diversas categorías de trabajos prácticos es el grado de apertura de los mismos, ya que las propuestas de mayor apertura, acercarán a los alumnos a problemas prácticos más reales y a la toma de decisiones razonadas, críticas y argumentadas científicamente. Los aspectos que habrá que cuidar para propiciar esta característica son: la diversidad de soluciones, que depende del problema propuesto, la diversidad de estrategias de solución, el grado de dirección del profesor y el grado de participación del alumno.
El esquema de clasificación que describimos proporciona un marco integrador útil para el estudio de la diversidad de trabajos prácticos publicados en la literatura especializada y nos ofrece también la posibilidad de diseñar actividades escolares que valoren la importancia de los experimentos de aula como trabajos prácticos.
Con base en lo anterior, diseñamos y probamos un ejemplo de un experimento ilustrativo y de un ejercicio práctico; el primero tiene como objetivo didáctico el propiciar que los alumnos construyan el modelo cinético corpuscular de la materia y el segundo trata el tema de reactivo limitante.
Experimento ilustrativo: naturaleza corpuscular de la materiaEl modelo cinético corpuscular de la materia (MCCM) es sumamente importante para la comprensión de fenómenos como cambios de fase y reacción química. Por esta razón nos pareció necesario explorar si los estudiantes de primer semestre (18-20 años), de la Facultad de Química de la Universidad Nacional Autónoma de México (UNAM), entienden dicho modelo. A lo largo de muchos años de experiencia docente nos hemos percatado de que la mayoría de los alumnos de este nivel si bien hablan de átomos y moléculas, en realidad no han asimilado el modelo, lo cual se ve reflejado en sus explicaciones o ilustraciones de ideas como las antes mencionadas.
Por esta razón diseñamos una secuencia de actividades cuyo objetivo es propiciar en los estudiantes la construcción del MCCM. Se trabajó con un grupo de 75 estudiantes de la asignatura de Química General, que forma parte del tronco común de las carreras que se imparten en dicha Facultad.
La secuencia elaborada consistió de seis etapas:
- 1.
Detección de ideas previas con respecto a la naturaleza corpuscular de la materia.
- 2.
Construcción de un primer modelo de la naturaleza corpuscular de los gases.
- 3.
Resolución de problemas relativos al mccm.
- 4.
Explicación de las propiedades de los gases, utilizando el modelo.
- 5.
Reflexión sobre la posibilidad de aplicar este modelo a líquidos y sólidos.
- 6.
Aplicación del modelo.
A continuación se describe cada una de las actividades realizadas.
1. Detección de ideas previas con respecto a la naturaleza corpuscular de la materiaCon el objeto de detectar algunas de las ideas que tienen los estudiantes respecto a la constitución de la materia y ver hasta qué punto utilizan argumentos del mccm en la formulación de sus explicaciones a los fenómenos que observan, se realizó un experimento poe, metodología que ha sido utilizada ampliamente por las autoras (Hernández y López, 2011).
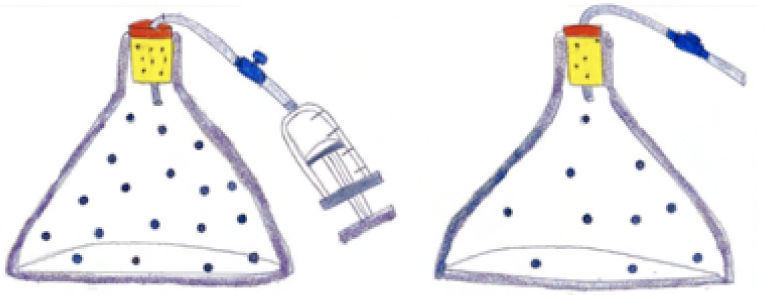
El experimento consiste en colocar unos cuantos mililitros de agua en un matraz (que puede ser Erlenmeyer o de bola de fondo plano), llevarlos a ebullición y dejarlos hervir por uno o dos minutos. Una vez hecho esto, se retira la fuente de calor, se coloca un globo en la boca del matraz y se introduce en un recipiente con hielo.
Antes de introducir el matraz en un baño de hielo, se les pidió a los alumnos elaboraran una predicción sobre lo que sucedería. El 97% de ellos dijo que el globo se inflaría y la sorpresa fue general al observar que, en vez de eso, el globo se introdujo al matraz (figura 1).
Una vez que revisamos sus respuestas, encontramos que la mayoría de los estudiantes no explicaron el fenómeno en función de partículas, sino de propiedades macroscópicas como la presión y la temperatura. Varios de ellos no dieron explicación, sino que describen el fenómeno. También parece estar muy difundida la idea de que el vacío jala al globo y que las partículas se expanden o se comprimen, como se puede observar en algunas de las respuestas que dieron los alumnos: Cuando se calienta, el matraz retiene el vapor cuando se tapa con el globo, y un cambio brusco de temperatura causa un aumento de presión… Cuando se calienta el agua del matraz, las moléculas se alteran y creo que el globo debió haberse inflado aunque sea un poco pero al momento de introducirlo al hielo, las moléculas se enfrían y esto hace que se encojan o compriman y las pocas moléculas de oxígeno que se liberaron en el globo, hicieron que éste se introdujera. El globo se comprimió por el vapor que quedó dentro del matraz … se comenzó a condensar al estar en contacto con el hielo y creó como un vacío que jaló al globo.
La segunda actividad se tituló el perfume del zorrillo. El objetivo de ésta fue que los alumnos elaboraran un modelo, aunque parcial, de la constitución de los gases. Para esto se les planteó lo siguiente: Supongan que un zorrillo se acerca a la puerta del salón; aun sin verlo, todos se enterarían de su presencia debido a que perciben el olor característico de este animal. Construyan un modelo del aire, que permita explicar por qué percibimos el olor del zorrillo aun cuando éste se encuentre a una distancia considerable de nosotros. Una vez que tengan su explicación, formen equipos de cuatro personas, comparen sus modelos y elaboren uno nuevo de común acuerdo.
En sesión plenaria se presentaron las respuestas y se trabajó en la construcción de un modelo para los gases. Algunos alumnos mencionaron que para explicar el fenómeno, los gases estarían formados por partículas pequeñas, en movimiento y con grandes espacios entre ellas. Otros plantearon la idea de que el aire acarrea a las partículas del perfume.
Enseguida, tomando en cuenta el modelo recién elaborado, se pidió que explicaran nuevamente lo que observaron en el experimento del globo.
En esta etapa, encontramos que las explicaciones de los estudiantes son más cercanas al modelo, pues ya hablan de partículas y de su relación con la presión. Algunas de las respuestas que se obtuvieron se muestran a continuación: Al enfriar el matraz, el vapor de agua se condensa y entonces el número de partículas sobre el líquido disminuyen, por lo que disminuye la presión… Yo pienso que al momento de calentar el agua y llegar a la ebullición, se van liberando un gran número de partículas porque al momento de tapar el matraz las partículas se quedan en el globo pero como la presión atmosférica es mayor que la que hay en el globo, entonces por eso se mete al matraz … Porque todas las partículas liberadas se condensan y por lo tanto se deja un vacío por eso ocupa el globo todo el interior del matraz. Al colocar el globo primero se infla por las partículas que aún no disminuyen su presión. Pero cuando se comienza a aplicar hielo y al estar cerrado el sistema, la presión disminuye, por consiguiente la cantidad de partículas y eso hace que el globo se contraiga y parezca que se infla, pero lo que pienso que pasa es que la presión busca un equilibrio.
La tercera actividad fue tomada de Martínez, J. et al. (1997) y tiene como objetivo observar si los alumnos tienen ya una mejor comprensión de la constitución de los gases, de forma que puedan hacer esquemas en función de partículas aplicando los postulados del MCCM. Las instrucciones que se dieron fueron las siguientes:
- a.
El matraz A de la figura contiene aire, parte del cual es extraído con una jeringa. Suponiendo que las partículas se pudieran ver, dibuja cómo se vería el contenido del matraz antes (A) y después (B) de haber extraído el aire.
- b.
Al calentar el matraz de la siguiente figura, el globo se infla. Representa el aire antes y después de calentar. Explica qué es lo que hace que el globo se infle.
- c.
Si se calienta el aire del matraz que se ve en la siguiente figura, los globos se inflan. Dibuja cómo piensas que se verían esos globos inflados.
Como se muestra en las figuras 2 a 4, algunos alumnos presentan dibujos que indican que han comprendido el modelo corpuscular.
Para saber si habían comprendido el MCCM, pedimos a los alumnos que explicaran algunas de las propiedades de los gases como compresibilidad, difusión y presión, en función de dicho modelo.
En esta etapa, los alumnos hablaron de partículas, de su movimiento y del espacio entre ellas. Explicaron que como hay mucho espacio libre entre las partículas de un gas, los gases son altamente compresibles debido a que los espacios se reducen cuando se someten a altas presiones. La difusión fue explicada en función del movimiento de las partículas y de la existencia de espacios vacíos entre ellas. Y la presión se entendió como la fuerza que ejercen las partículas por unidad de área, por lo que al aumentar el volumen, ésta disminuye y al aumentar el número de partículas aumenta la presión.
5. Reflexión sobre la posibilidad de aplicar este modelo a líquidos y sólidosCon la finalidad de aplicar el MCCM a más fenómenos, se preguntó a los estudiantes si dicho modelo podría aplicarse a los líquidos y a los sólidos. La primera respuesta obtenida, casi unánime, fue que este modelo no explicaría las propiedades de los líquidos o sólidos. Se pidió entonces que pensaran en los aspectos en los que se parecían los tres estados de la materia y empezaron a hablar de dilatación y cambios de estado, por ejemplo. Se mostró al grupo que una gota de colorante se difunde a través del agua (figura 5) y que un cristal de permanganato de potasio, que se coloca en la superficie de un cubo de hielo, también presenta el fenómeno de difusión, esto con el objeto de que los estudiantes pensaran en que también existen espacios vacíos en sólidos y líquidos.
Finalmente, retomando sus modelos, los resultados de las demostraciones experimentales y recordando las diferencias nanoscópicas identificadas entre líquidos, sólidos y gases, se llegó a la conclusión de que la materia está formada por partículas en movimiento, entre las que existen fuerzas de atracción y espacios vacíos, cuyas dimensiones dependen del estado de agregación.
6. Aplicación del modeloPara que los alumnos usaran los argumentos del modelo en la explicación de fenómenos, se les presentaron dos experimentos.
El primero de ellos consistió en colocar varias pipetas beral dentro de un vaso de poliestireno con nitrógeno líquido. Se observan varios fenómenos interesantes: la ebullición del nitrógeno al vaciarlo en el vaso, la aparición de un líquido dentro de las pipetas, el aumento de volumen de éstas a medida que transcurre el tiempo y la formación de cristales de tanto en la parte externa del vaso como en el tallo de las pipetas. Al sacarlas y colocarlas en el piso, las pipetas salen “disparadas” a una gran velocidad ante el asombro de los alumnos.
Se pidió a los estudiantes que explicaran estos fenómenos tomando en cuenta el modelo que han venido construyendo con las observaciones y análisis de las diferentes actividades hasta ahora realizadas. Al finalizar esta secuencia, sus explicaciones son notoriamente más completas e incluyen más argumentos moleculares. Los siguientes son algunos ejemplos. Al meter la pipeta, el aire que se encuentra dentro de ella se condensa debido a la baja temperatura del nitrógeno. Se hace más líquido adentro porque por el orificio de la pipeta, al paso del tiempo, el aire continúa entrando y se sigue condensando. Las partículas disminuyen su velocidad… El aire de la pipeta se condensa… Se forman cristales porque el agua que se encuentra en el aire se congela… El nitrógeno está a una temperatura muy baja y al introducir las pipetas en el nitrógeno éstas se enfrían haciendo que el aire que contienen se condense… La pipeta salió disparada debido a que al ponerla a temperatura ambiente la presión aumentó… las partículas se mueven con mucha mayor velocidad … y todo el aire que había introducido, salió a una presión muy grande.
Un segundo experimento consistió en introducir un globo inflado en nitrógeno líquido. Al hacer esto, el globo se desinfla y aparece una cantidad muy pequeña de líquido en su interior (apenas unas gotas). Cuando se saca el globo del nitrógeno, empieza a inflarse de inmediato sorprendiendo nuevamente a los alumnos.
El 90% de los estudiantes describen de forma adecuada estos fenómenos, ya que se expresan en función de las partículas que constituyen el aire y del aumento o disminución de los espacios entre ellas, lo cual da lugar a los cambios de estado. Algunas de sus explicaciones se muestran a continuación: Al sumergir el globo en el nitrógeno, disminuye la temperatura y se comprime el espacio que hay entre las partículas, por lo cual el globo se hace más chico. Al elevarse la temperatura, el espacio entre las partículas se expande y el globo recupera su forma original. Al entrar al nitrógeno, el oxígeno y nitrógeno del aire se condensan… Al introducir el globo en el nitrógeno líquido, los gases que contiene se condensan. Como es un sistema cerrado, no entran partículas y como las paredes son flexibles y la presión externa es mayor, el globo se desinfla. Al sacarlo del nitrógeno, sufre un aumento de temperatura, los gases se expanden volviendo a su estado original.
Consideramos que después de todas las actividades realizadas en esta secuencia se logra que la mayoría de los alumnos comprendan el modelo cinético corpuscular y lo apliquen correctamente en la explicación de los fenómenos observados en las actividades experimentales anteriormente descritas. Los alumnos que lo aprendieron mejor, lograron aplicarlo en otros temas del curso, como por ejemplo para explicar qué pasa a nivel de partículas en una reacción química.
Ejercicio práctico: reactivo limitanteComo ejemplo de ejercicio práctico en la categorización que propone Caamaño (2004), presentamos los resultados al trabajar con una actividad experimental semiguiada, en la que los alumnos tienen que proponer algún diseño experimental para comprender el concepto de reactivo limitante. De acuerdo con la clasificación de Herron (1971), ésta es una actividad con nivel de indagación 2, ya que se proporciona o delimita el problema de estudio y toca a los alumnos elegir los experimentos más adecuados para darle respuesta.
En esta secuencia de actividades se pretende además que los alumnos obtengan varios sólidos insolubles en agua para comparar algunas de sus propiedades, que aprendan a realizar un análisis gravimétrico, que trabajen colaborativamente en el diseño de experimentos y que desarrollen habilidades del pensamiento científico, como por ejemplo: predecir, argumentar, controlar variables, comunicar resultados en forma oral y escrita, construir e interpretar gráficas, etc.
A continuación se describe la metodología seguida al trabajar con dos grupos de 20 alumnos que cursaban el segundo semestre (19-20 años) de las carreras de Química en la unam.
El concepto de reactivo limitanteAunque la mayoría de los alumnos definen al reactivo limitante como aquel que se termina primero en una reacción, cuando resolvieron un problema en el que debían indicar cuál era a partir de cantidades y concentraciones iniciales, encontramos que un 55% de ellos pensaba que el reactivo limitante es del que inicialmente hay un menor volumen o masa.
Para corregir esa concepción errónea, resolvieron los ejercicios propuestos por Wood y Breyfogle (2006), revisamos grupalmente las respuestas e hicimos énfasis en que el reactivo limitante se determina considerando los moles iniciales de cada reactivo y los coeficientes estequiométricos de la ecuación química balanceada.
Luego se comunicó al grupo que la pregunta central para la siguiente actividad era: Teniendo diferentes cantidades iniciales de reactivos, ¿qué cantidad de producto(s) se obtiene(n) en una reacción química de precipitación?
Para ayudarlos a encontrar respuestas, a cada alumno se le entregó un documento breve que incluye una introducción respecto al problema planteado, el listado de materiales y reactivos que pueden usar y algunas pistas o sugerencias que los orientarían en su investigación. Se muestra una parte del mismo: Una de las formas de estudiar el concepto de reactivo limitante, es mediante la medición de la masa de precipitado que se forma como producto en una reacción química entre dos disoluciones acuosas. Para ello, el compuesto insoluble debe ser una sustancia que no se descomponga con la luz, con la temperatura o con el aire, además de ser un sólido que se pueda filtrar con facilidad.
Una vez que cada alumno tuvo su respuesta, se formaron equipos de tres o cuatro integrantes para llegar a una propuesta consensuada con la cual responder la pregunta central. Fue notorio que en cada equipo se establecieron objetivos de aprendizaje específicos; a continuación se muestran algunos ejemplos.
Objetivos:
- •
Aprender qué es un reactivo limitante.
- •
Identificar de manera práctica el reactivo limitante en una reacción, mediante la medición de la masa del precipitado.
- •
Escoger una reacción química de las propuestas para llevarla a cabo, tomando en cuenta la toxicidad de reactivos y de productos que se pudieran formar durante ésta.
- •
Plantear un procedimiento experimental, considerando ya sea: dejar fija la cantidad de uno de los reactivos y aumentar la del otro o variar sistemáticamente las cantidades de ambos reactivos (ir aumentando de uno y disminuyendo del otro).
- •
Determinar en una reacción de precipitación, cuál de los reactivos se transforma completamente en producto por utilizar uno de los reactivos en exceso.
- •
Analizar experimentalmente el concepto de reactivo limitante, el cual determinará las cantidades (masa) de los productos que se forman, en una reacción química de precipitación.
En esta etapa, cada equipo trabajó colaborativamente en el diseño e implantación de su propia metodología, para dar respuesta a la pregunta central. Eligieron con qué reacción trabajar, escribieron ecuaciones químicas balanceadas, decidieron a qué sustancia le darían seguimiento (reactivos o productos) y qué medirían en cada ensayo. En el diseño experimental consideraron qué disoluciones preparar, en qué concentración, qué variable sería la dependiente y cuál la independiente, la toxicidad y facilidad de manejo de las sustancias, cómo era más conveniente secar los precipitados y qué tratamiento darían a los residuos que se generaran. Además propusieron qué volúmenes ocuparían de cada disolución, para hacer evidente el reactivo limitante en cada ensayo.
Para ayudarlos en esta etapa, se les dio la siguiente información: A continuación se indican pares de sustancias que al reaccionar forman precipitados. Debes realizar ensayos cualitativos y seleccionar aquel precipitado que consideres más adecuado para realizar un experimento que te ayude a comprender el concepto de reactivo limitante: Sulfato de cobre (II) y sulfuro de sodio Hidróxido de sodio y sulfato de níquel (II) Nitrato de plata y cloruro de sodio Hidróxido de sodio y cloruro de magnesio Ácido oxálico y sulfato doble de amonio y hierro Fosfato de sodio y nitrato de cinc Sulfato de cobre (II) e hidróxido de sodio Carbonato de sodio y cloruro de calcio Sulfato de cobre (II) y fosfato de sodio Nitrato de aluminio e hidróxido de sodio Cloruro de hierro (III) e hidróxido de sodio Yoduro de potasio y nitrato de plomo (II) Nitrato de plomo (II) y cromato de potasio
Como primera parte, deberás elegir y hacer cinco reacciones de la lista anterior y, después de manipular los precipitados resultantes, decidir con cuál trabajarás. Considera factores como toxicidad, facilidad de filtración y estabilidad durante el proceso de secado. No olvides investigar qué tratamiento debes dar a los residuos que se generen.
Cada equipo realizó sus reacciones usando técnicas de microescala para conocer y manipular los diferentes precipitados. Reportaron resultados y observaciones como los que se muestran en el cuadro 1.
Resultados del análisis de los precipitados obtenidos por los alumnos.
| Precipitado | Características y resultados de las pruebas. |
|---|---|
| PbCrO4 | Sólido amarillo; baño maría favorable para la reacción; filtración rápida; secar a 55° – 60°C. |
| Ni(OH)2 | Sólido verde gelatinoso; el baño maría ayuda a la reacción; filtración lenta; secar a 60° – 65°C. |
| AgCl | Sólido blanco; baño maría desfavorable para reaccionar pues el sólido se pone gris; filtración rápida; secar a 50° – 60°C. |
| CuS | Sólido negro; baño maría favorable para reaccionar; filtración no tan rápida; olor fuerte y desagradable; secar a 60° – 70°C. |
| PbI2 | Sólido amarillo dorado; baño maría favorable para reaccionar; filtración rápida; secar a 60° – 70°C. |
| FeC2O4 | Sólido amarillo pálido; baño maría necesario para la reacción; secar a 60° – 70°C. |
Cabe mencionar que de acuerdo con la facilidad para filtrar, enjuagar y secar los precipitados, los sólidos seleccionados por la mayoría fueron: Ni(OH)2 (reacción b), Cu(OH)2 (reacción g), CaCO3 (reacción h), Fe(OH)3 (reacción k) y PbI2 (reacción l). Hubo una preferencia notoria por los sólidos coloridos.
Los equipos que tuvieron más claridad en el objetivo de estos experimentos, propusieron variar los volúmenes de los reactivos que usarían, pues de esa manera estarían modificando las cantidades de las sustancias que pondrían a reaccionar.
Formulación de hipótesisLa formulación de hipótesis es una parte muy importante en el trabajo científico, y en la enseñanza de las ciencias es una actividad que obliga al alumno a usar sus conocimientos previos en la anticipación de los resultados experimentales. Una vez que cada equipo eligió con qué precipitado trabajar, establecieron las hipótesis que pretendían probar con sus experimentos. Las siguientes son algunas de las hipótesis que redactaron: De acuerdo con la siguiente reacción de precipitación: 2KI(ac) + Pb(NO3)2(ac) → PbI2(s) + 2KNO3(ac), ya que la ecuación está estequiométricamente ajustada, si utilizo 2 mL de KI 1M y 1 mL de Pb(NO3)21M, entonces reaccionarán totalmente obteniendo así la máxima cantidad de precipitado. Cuando la estequiometría de la reacción es uno a uno, una mol de sulfato de cobre (II) reacciona con una de sulfuro, lo que hace muy fácil reconocer al reactivo limitante, simplemente será el que se encuentre en menor proporción. Aquel experimento en el que se obtenga la masa máxima de precipitado, nos indicará los volúmenes en el punto de equivalencia de nuestra reacción. Ahí ninguno de los reactivos será el limitante. Si en cada experimento vamos obteniendo cada vez más precipitado, entonces el reactivo que estemos aumentando será el que limita la reacción.
Para orientarlos en sus predicciones respecto a la cantidad de precipitado que se formaría en cada ensayo, les sugerimos realizar los cálculos necesarios para obtener los datos que se piden en el cuadro 2. Estas estimaciones numéricas también fueron presentadas como hipótesis por algunos equipos, ya que eran sus predicciones respecto a la masa de precipitado que esperaban obtener.
Predicciones respecto a la masa de precipitado que se obtendría en una reacción.
| Ecuación química para la reacción de precipitación elegida: | |||||||
|---|---|---|---|---|---|---|---|
| Ensayo n° | Volumen del reactivo 1 (mL) | Volumen del reactivo 2 (mL) | Cantidad de sustancia, reactivo 1 (mol) | Cantidad de sustancia, reactivo 2 (mol) | Cantidad de sustancia, precipitado (mol) | Masa del precipitado (mg) | |
| TEO | EXP | ||||||
| 1 | |||||||
| 2 | |||||||
| 3... | |||||||
La construcción e interpretación de gráficas es parte importante en el análisis de los resultados de una investigación, por ello se pidió a cada equipo que graficaran los valores teóricos y experimentales de la masa del precipitado obtenido y que analizaran las tendencias encontradas. Al revisar grupalmente dichos gráficos, los equipos notaron qué tan cuidadoso fue su trabajo respecto al de los demás y si la construcción de su gráfica (escalas, ubicación de las variables en cada eje) fue adecuada. En la figura 6 se muestran dos de las gráficas construidas por los alumnos.
Al analizar gráficas como las anteriores, es posible saber qué alumnos trabajaron con más cuidado y recuperaron todo el precipitado que obtuvieron, como es el caso en la figura 6b. En ambos casos las curvas teóricas se tiene un punto de inflexión que indica el ensayo en el que se tienen las cantidades estequiométricas de los reactivos y por lo tanto la masa máxima que se puede obtener del precipitado.
Comunicación de resultadosCada equipo expuso ante el resto del grupo la metodología de trabajo que siguió y cuáles fueron sus resultados. En esta sesión plenaria, los alumnos pudieron percatarse de posibles mejoras a la técnica experimental que emplearon, de que fuente de error como: la medición de los volúmenes o el tiempo de secado, son significativas para algunos equipos pero no para otros, y qué tipo de gráfica se obtiene al mantener fijo el volumen de una de las disoluciones e ir variando el de la otra. Se revisaron además conceptos relacionados con el tema como son: disolución, cantidad de sustancia, unidades de concentración, métodos de separación, propiedades y toxicidad de sustancias, ecuaciones químicas balanceadas, solubilidad en agua, concepto de reacción química a nivel macroscópico, submicroscópico y simbólico, modelo cinético corpuscular, cálculos estequiométricos, etc.
Elaboración y revisión de los informes de investigaciónPara desarrollar las habilidades de escritura, argumentación y comprensión de contenidos, solicitamos a cada equipo que elaborara un informe que incluyera sus objetivos, procedimiento experimental, hipótesis, resultados (incluyendo el tratamiento de residuos), análisis de resultados y conclusiones.
Enseguida, de acuerdo con la propuesta de Walker et al. (2011), se intercambiaron los informes, de tal manera que cada equipo leyó y comentó el de algún otro. Este ejercicio fue una experiencia interesante ya que permitió que los alumnos discutieran entre ellos y nos dimos cuenta de cómo recibían las críticas y de los argumentos que usaban en su defensa o al señalar a sus compañeros lo que consideraban que estaba mal. Algunos alumnos se mostraron incómodos con las críticas que recibieron; sin embargo, la mayoría del grupo reconoció que fue provechoso pues se les señalaron aspectos con los que sus informes podrían mejorar mucho.
Se devolvieron los reportes revisados entre pares y cada equipo hizo las correcciones necesarias para después entregarlos a su profesora para la revisión final. La evaluación de estos informes consideró el formato, la redacción y el contenido.
ConclusionesCon base en los resultados que hemos obtenido, en esta investigación y a lo largo de varios años de docencia en química experimental, consideramos que los trabajos prácticos sí son de utilidad en la enseñanza de la química, debido a que permiten que los alumnos construyan conocimientos conceptuales y procedimentales fundamentales en la comprensión y práctica de esta ciencia, a pesar de que se les sigue señalando como la parte costosa y menos redituable pedagógicamente hablando.
Pickering (en Hofstein, 2004) afirma que el objetivo de los cursos de laboratorio es proporcionar la experiencia de hacer ciencia; aunque el propósito no siempre es fácil de alcanzar, los obstáculos son más bien de organización y no inherentes a la enseñanza misma, lo cual es afortunado porque significa que los cambios son posibles y no hacen falta grandes fortunas para mejorar la mayoría de los programas, lo que se necesita es una planeación más cuidadosa y mayor claridad en los objetivos que se persiguen. Ofreciendo experiencias genuinas y directas, un curso de laboratorio puede hacer de un alumno un mejor observador, un pensador más crítico y meticuloso en la resolución de problemas y en la toma de decisiones responsables y científicamente fundamentadas. De eso es de lo que realmente trata la educación.
Ya que cada tipo de trabajo práctico responde a un objetivo particular, se pueden seleccionar en función de los objetivos de enseñanza que se tengan. A este respecto, nos parece que la diversificación de las actividades experimentales ha sido una propuesta muy enriquecedora y es necesario ser docentes más creativos para conseguir que los alumnos logren desarrollar diferentes aprendizajes y habilidades de pensamiento científico.
Por ejemplo, de acuerdo con los resultados obtenidos con las estrategias descritas en este trabajo, los experimentos de aula resultan especialmente útiles en la enseñanza y aprendizaje de la química, ya que permiten, a través de discusiones en sesiones plenarias, el desarrollo de habilidades indispensables en el trabajo científico como son: la observación, la formulación de hipótesis, la argumentación y la comunicación de ideas.
Los ejercicios prácticos, como el que presentamos para el tema de reactivo limitante, son actividades en las que los alumnos desarrollan habilidades científicas básicas como la medición, el aprendizaje de técnicas de laboratorio o el manejo de aparatos científicos y, en función de cómo se conciban, podrán propiciar también el desarrollo de habilidades superiores como son el diseño de experimentos, la correlación entre las variables experimentales, la toma de decisiones razonadas, la inferencia y la emisión de hipótesis, entre otras.
Es importante tener presente que cualquier trabajo práctico propuesto debe procurar el desarrollo de las habilidades de comunicación y, como se describe en el cuerpo de este artículo, solicitar a los alumnos que sigan instrucciones y elaboren un informe sobre el trabajo desarrollado. Finalmente, consideramos que la diversificación de los trabajos prácticos proporciona a los alumnos una actitud más autónoma y participativa ante su propio aprendizaje, les da la oportunidad de contrastar sus saberes con hechos concretos y con lo que piensan sus pares.
De acuerdo con Luis del Carmen (2000), el término trabajos prácticos se refiere a las actividades de enseñanza de las ciencias en las que se utilizan procedimientos específicos para resolverlas, mismos que están relacionados con el trabajo de campo o en un laboratorio y, en un sentido más amplio, pueden incluir la resolución de problemas científicos o tecnológicos.