Despite of the importance of practical work for learning science as well as the nature of science, labwork often transmits an atheorical and empiricist view of scientific research and it is framed like a cookbook-style lab, that is, as a sequence of instructions students must follow with serious shortcomings from the methodological point of view, (i.e.: lacking of hypothesis, absence of inductive and deductive critical thinking). We show how this situation might be overcome by a guided-inquiry-based chemistry education where different kinds of practical work can be integrated in a coherent way within the learning of concepts, models and “paper and pencil” problems. As an example, we transform a conventional “labwork sheet” about the rate of a chemical reaction (sodium thiosulfate with hydrochloric acid) in a problematized sequence of activities, including detailed educational comments for each one of them.
La finalidad de la ciencia es la elaboración de teorías sobre lo real cada vez más universales y coherentes (las que mejor encajan los hechos conocidos en un momento dado) y con capacidad para predecir nuevos hechos y preguntas que permitan la mejora continua (Chalmers, 1992). Aunque aspiramos a explicar lo real, sabemos que la ciencia no avanza de un modo inductivo, mediante la generalización de observaciones minuciosas y directas de “lo que es”. Por el contrario, es la interacción entre los “objetos reales” y los “objetos teóricos” lo que hace posible un conocimiento cada vez mejor de lo real. Dicho de otro modo, aunque el trabajo de los científicos se “inspire” (al menos, en los inicios) en lo real, requiere la elaboración de “objetos teóricos” (conceptos, hipótesis, modelos, …) que facilitan la utilización de la lógica hipotético-deductiva y el uso de las matemáticas para obtener consecuencias contrastables —de la manera más creativa y exigente que podamoscon los “objetos reales” (Holton, 2001; Matthews, 1994). El conocimiento científico no es, pues, el fruto de un mero consenso social (una “forma de hablar” de la comunidad científica), sino el fruto de un proceso de planteamiento de preguntas o problemas sobre lo real, y de invención de hipótesis y/o modelos, cuya validez (existencia) es juzgada por el comportamiento del mundo real.
Afortunadamente, la naturaleza no es una esponja que pueda adoptar cualquier forma que acordemos, por lo que las ideas científicas son independientes de la persona que las elabora (como señala Ogborn, 2011, p. 15): “Podemos pensar lo que queramos sobre las cosas, pero no hacer lo que queramos con ellas”), de modo que la comunidad científica, al someter a pruebas sus invenciones para obtener evidencias empíricas y responder a todas las objeciones que puedan plantearse, va generando una concepción del mundo racional y robusta (Longbottom y Butler, 1999), que aunque sea susceptible de mejora continua, produce —al menos en los campos “maduros”— verdades: estamos seguros, es verdad, que existen los átomos, que la estructura del ADN es una doble hélice; que la naturaleza está cuantizada,… y que existían aun cuando no habían sido “descubiertos”.
Dada, pues, la importancia de la confrontación de nuestras ideas con lo real para caracterizar la ciencia, el trabajo práctico, las “prácticas”, juegan un papel esencial en el aprendizaje con comprensión (aquel que podemos justificar) de las ciencias y de la naturaleza del conocimiento científico.
Los profesores somos conscientes de esta importancia y cuando hemos indagado sobre qué objetivos les gustaría conseguir con sus alumnos con las prácticas de laboratorio hemos obtenido una lista como la siguiente:
- –
Ayudar a comprender los conceptos, ideas, modelos (“ligar teoría y práctica”);
- –
Familiarizar con la forma en que se producen y aceptan los conocimientos científicos (metodología científica) y a tomar conciencia de las relaciones CTSA;
- –
Motivar hacia el aprendizaje (las prácticas como generadoras de actitudes positivas);
- –
Adquirir destrezas en el manejo del instrumental y en procedimientos básicos en el laboratorio (instrumentos básicos, filtrar, preparar disoluciones rápidamente, medir,…), y
- –
Adquirir autonomía para realizar una investigación de tipo práctico (mucho más frecuente en el nivel universitario).
¿En qué medida se consiguen dichos objetivos? Desde hace más de 20 años disponemos de evidencias que muestran que la gran mayoría de los trabajos prácticos se llevan a cabo como recetas de manipulación, que suelen pretender ilustrar lo ya visto en teoría (normalmente en Bachillerato) o, incluso, en momentos desfasados del desarrollo del tema que se está impartiendo (normalmente en el nivel universitario). Estas secuencias de instrucciones contradicen características esenciales de la metodología y epistemología científicas. Así, Payá (1991, pp. 73 a 88), tras un análisis de los trabajos prácticos propuestos en 75 libros de texto afirmaba que sólo un 15% de ellos hacían referencia a las hipótesis; menos de un 8% proponían que fueran los alumnos los que formularan hipótesis o pensaran un diseño experimental, y sólo un 30% hacía referencia al problema que daba “sentido” a lo que se pedía que hicieran los alumnos.
En el nivel universitario, González (1994, p. 144-145), realizó un análisis de 100 guías de laboratorio de primer curso universitario en la asignatura de Física, encontrando que en 83 de ellas se trataba de verificar o ilustrar una relación ya establecida en clase de teoría o en la mera aplicación de una técnica; en el 75% no se mencionaban siquiera hipótesis y en un 14% se presentaban escritas en la guía. También analizó los informes de las prácticas de laboratorio ya realizadas que entregaban estudiantes universitarios de física para ser evaluados y las correcciones escritas que tenían dichos informes cuando eran devueltos a sus autores (suponiendo que quizás en la interacción verbal en el laboratorio se trataran aspectos que no estaban en las guías, pero que los alumnos debían contemplar al elaborar la memoria del trabajo realizado). El 95% de los informes de los estudiantes comenzaban planteando el trabajo a realizar como una verificación o ilustración de relaciones ya establecidas; el 80% no mencionaba hipótesis o predicciones de ningún tipo y sólo un 10% expresaba alguna idea de forma tentativa; el diseño del experimento era la reproducción de la guía o texto (sólo un 5% contenía algún aporte a un diseño no completo en la guía). Menos de un 5% contenía alguna crítica, hacía mención a nuevos problemas o a las relaciones ctsa. Sin embargo, 71% de los informes recibieron correcciones sobre las mediciones o el tratamiento de los datos; casi un 40% sobre una transcripción incorrecta de los contenidos o instrucciones de la guía, y un 26% sobre el tratamiento gráfico. Ningún informe recibió comentario alguno sobre el planteamiento del problema, la formulación de hipótesis, el análisis de resultados en relación con las hipótesis o la necesidad de elaborar diseños alternativos, comparar resultados con otros equipos o fuentes, etcétera.
Más recientemente, en un gran proyecto europeo, Séré et al. (1998) constataron que el modelo de organización más común es el de pequeños grupos de estudiantes trabajando con materiales/objetos reales siguiendo instrucciones muy precisas sobre métodos y análisis dados por un profesor o una guía de laboratorio. Encontraron revelador el análisis de 165 guías de laboratorio no sólo por lo que se pedía a los alumnos que hicieran, sino por lo que no se les pedía: “En bachillerato, los estudiantes generalmente tienen que utilizar procedimientos estándar, medir, y registrar las observaciones directamente. No tienen que presentar o hacer objetos, probar predicciones, elegir entre dos o más explicaciones y aspectos de este tipo. Incluso, en la universidad, es raro que los estudiantes tengan que probar una predicción hecha a partir de una conjetura o de una teoría. (…)”.
Afirman, además, que los estudiantes pasan muy poco tiempo hablando de la base conceptual y teórica de las actividades de laboratorio. Y respecto de los procedimientos (todo trabajo de laboratorio implica procedimientos), encontraron que suelen estar embebidos en las instrucciones e instrumentos relatados en las guías de laboratorio, pero que no suelen ser enseñados explícita y adecuadamente. Paradójicamente uno de los objetivos genuinos de las prácticas de laboratorio (aprender “qué habría que hacer para…”) no suele recibir la atención necesaria para que los estudiantes puedan alcanzar la autonomía; es decir, para que puedan planificar investigaciones en situaciones novedosas. Resultados análogos se han obtenido al analizar las guías de laboratorio de los cursos universitarios de química (González de la Barrera, 2003).
Sin necesidad de más datos estadísticos, en nuestras clases con profesores de Bachillerato en formación (físicos y químicos), los alumnos reconocen que gran parte del trabajo práctico realizado durante su carrera universitaria habría sido perfectamente prescindible y que en la mayoría de las prácticas buscaban los informes de compañeros de cursos anteriores para “reproducirlos” (hay que reconocer, sin embargo, que los químicos se refieren a “hacer manos” como un objetivo que sí consiguen).
Creemos que podemos afirmar que pese a su importancia, las prácticas de laboratorio continúan siendo un problema por resolver desde el punto de vista didáctico. Un problema cuya solución requiere superar concepciones empiristas y ateóricas sobre la ciencia e integrar las prácticas de laboratorio, de forma articulada y justificada, dentro de toda la actividad de enseñanza de las ciencias. Se pueden encontrar excelentes revisiones en Lunetta et al. (1998, 2007). En este artículo nos centraremos en la posibilidad de transformarlos para que contribuyan de un modo coherente con el resto de actividades de enseñanza a conseguir los objetivos pretendidos. Trataremos de hacer esto desde el modelo de “enseñanza por investigación guiada en torno a problemas fundamentales”. Para ello, en primer lugar presentaremos la hipótesis fundamental de los modelos de enseñanza por investigación y las implicaciones que tiene sobre la estructura de los temas (y los cursos o grandes fragmentos de ellos) y la integración de las prácticas de laboratorio (y otras actividades prácticas) en ellos. En segundo lugar, presentaremos un trabajo práctico convencional, extraído de una guía de laboratorio, y procederemos a su transformación, a modo de ejemplo.
2La hipótesis de los modelos de enseñanza por investigación y sus implicaciones sobre las prácticas de laboratorioMientras que en la enseñanza convencional (transmisión de conocimientos en su estado final) la familiarización con la metodología científica, o la comprensión sobre la naturaleza de la ciencia, aparecen como objetivos autónomos y separados del aprendizaje conceptual, una característica de los modelos de enseñanza por investigación es que la familiarización con la metodología científica, un objetivo siempre pretendido en todos los currícula y por los profesores de Ciencias, o la comprensión de la naturaleza de la Ciencia, no aparecen de manera autónoma, separada del objetivo de aprender conocimientos científicos o de generar actitudes positivas hacia las Ciencias y su aprendizaje. Como afirmaba Hodson (1996), en el número monográfico de la revista Int. Jour. of Sc. Edu., p. 757, la reciente investigación didáctica está mostrando que: “…los estudiantes pueden aprender ciencia y pueden aprender más sobre la ciencia llevando a cabo investigaciones científicas bien diseñadas, bajo la mirada vigilante (recogiendo, debatiendo y apoyando la reflexión sobre el progreso realizado) de un profesional experto”.
El siguiente esquema representa la hipótesis básica de estos modelos:
El aprendizaje de los conocimientos científicos supone una evolución (y, en ocasiones, cambio) de las ideas espontáneas a las científicas. Pero las ideas espontáneas son fruto de una forma de producir y aceptar conocimientos también espontánea, mientras que las ideas científicas son fruto de una forma de producir y aceptar conocimientos —la epistemología científica— que supuso una adquisición cultural de la Humanidad, una forma distinta de la cotidiana. Por tanto, las personas sólo verán “mejores” las ideas científicas que las espontáneas si el cambio conceptual va acompañado del cambio epistemológico. Dicho de otro modo, el aprendizaje “sólido” de conocimientos científicos exige el desarrollo simultáneo de procesos de producción y aceptación típicos del trabajo científico. Dicho cambio no fue fácil históricamente y no puede serlo para los alumnos: investigar requiere implicación personal que afecta a valores, compromisos ontológicos y epistemológicos, aguantar la tensión de la incertidumbre, etc.; cabe esperar, pues, que sólo si se presta una atención explícita a generar y cultivar la implicación afectiva de los alumnos será posible el cambio conceptual y epistemológico.
Cabe resaltar que no se trata de dar prioridad al aprendizaje de “destrezas de pensamiento” (Plantear problemas, formular hipótesis o modelos, diseñar estrategias, analizar resultados, comunicar eficazmente,…) frente al aprendizaje de hechos y conceptos. En la ciencia no existe esa separación, los conceptos son invenciones que se elaboran para avanzar en el planteamiento y solución de problemas, y que sólo adquieren el estatus de “fundamentales” porque han contribuido al avance en la solución de problemas fundamentales. Sabemos que los intentos de enseñar destrezas de pensamiento sin una fuerte base de conocimientos factuales no promueven la capacidad de resolver problemas ni apoyan la transferencia a nuevas situaciones (Bransford et al., 2000, p. 23) y que las capacidades de los estudiantes para adquirir conjuntos organizados de hechos y destrezas se ven realmente intensificadas cuando ambas están conectadas e integradas en actividades de solución de problemas con sentido, y cuando son ayudados a comprender por qué, cuándo y cómo esos hechos y destrezas son relevantes (Bransford et al., 2000).
Las diferencias entre los distintos modelos de enseñanza por investigación estriban en el tipo de problemas que se seleccionan para organizar la enseñanza a partir de ellos y en el grado de guía del profesor. Por supuesto, los problemas o preguntas que se seleccionan para la etapa primaria no son los mismos que los que se deben seleccionar para secundaria, aunque actualmente estamos viendo las propuestas de organizar la enseñanza de las ciencias, incluso en el nivel primario y en países anglosajones, en torno a los core concepts (Michaels et al., 2008, p. 59) o a las grandes ideas de la ciencia (Harlen, 2010). En nuestro caso, desde principios de los 80 (Gil, 1983; Gil y Martínez Torregrosa, 1983; Gil et al., 1991; Gil, 1993), trabajamos en el desarrollo de un modelo de enseñanza por investigación guiada para alumnos de 13/14 años en adelante (de secundaria a universidad, Martínez Torregrosa et al., 1999; Becerra et al., 2011), tratando de convertirlo en una alternativa global y coherente a la enseñanza convencional. En el camino, hemos debido transformar todos los aspectos básicos de la enseñanza de la física y la química: prácticas de laboratorio, la resolución de problemas de lápiz y papel, la evaluación, la actividad del aula y, finalmente, la introducción de conceptos y modelos y la propia estructura de los temas y cursos (Martínez Torregrosa et al., 1994, 1997, 1999; Verdú et al., 2002; Verdú y Martínez Torregrosa, 2004). Hemos de añadir, que buscamos los problemas fundamentales de las ciencias (aquellos que están en el origen de las grandes ideas de la ciencia), los problemas “estructurantes”, para organizar la enseñanza en torno a ellos.
Puesto que nuestro objetivo es contextualizar y ubicar las prácticas de laboratorio en el desarrollo de los temas, es necesario tratar sucintamente cómo es su estructura. Una breve idea de cómo son estos temas puede obtenerse de la tabla 1 que muestra la transformación de los títulos habituales en los títulos interrogativos de los temas del primer curso de química (para alumnos de 13/14 o de 14/15 años) (Martínez Torregrosa et al., 1997).
Transformación de los títulos habituales en los títulos interrogativos de los temas del primer curso de química.
| Títulos habituales | Título como problema | Secuencia de temas (problemas más concretos) |
|---|---|---|
| • Volumen, Masa, Densidad • Modelo corpuscular • Electrostática • Estructura de las sustancias • Reacciones químicas • Estructura del átomo | ¿Cómo están formadas las cosas “por dentro”? ¿Son totalmente distintas o tienen algo en común? | Las cosas son muy distintas, pero ¿existen propiedades comunes a todas ellas? (Propiedades generales de la materia) |
| Si tienen propiedades comunes, ¿existe una estructura común a todas las cosas? (Modelo corpuscular) | ||
| ¿Qué es lo que hace que haya gases, líquidos y sólidos?(Otra propiedad general: la carga eléctrica) | ||
| ¿Cómo es posible que desaparezcan sustancias y aparezcan otras distintas? | Si hay propiedades y una estructura comunes, ¿por qué hay sustancias tan diversas? ¿Cómo pueden desaparecer unas sustancias y aparecer otras distintas? (Estructura de las sustancias y cambio químico) | |
| ¿Cómo son los átomos por dentro? ¿Si sólo hay tres partículas distintas, por qué hay tantos elementos distintos? (Estructura de los átomos) |
La estructura de un tema dentro de un curso o gran fragmento coherente del mismo puede verse en la figura 1 y sus características principales son:
- 1.
El título es una pregunta con sentido (como en la tabla 1). El inicio es el planteamiento de un problema o un subproblema que se necesita tratar para avanzar en un problema fundamental, incluyendo actividades para que los alumnos tomen conciencia de su interés, y lo sientan como propio.
- 2.
El índice consiste en un plan o posible estrategia para avanzar en su solución, es decir, en un “plan de investigación”, que, aunque diseñado por el profesor (mejor, equipo de profesores) debe ser comprensible y lógico para los alumnos (al menos los primeros pasos). Este plan constituye el hilo conductor del tema y debe hacerse un esfuerzo especial para favorecer que los alumnos se sientan “partícipes del plan”, de modo que en todo momento estén orientados (sepan dónde están y qué se busca).
- 3.
Los conceptos y los modelos deben introducirse, por alumnos y profesor, de una manera tentativa, a modo de hipótesis, condicionando su aceptación a que permitan avanzar en la solución del problema. Dichos conceptos y/o modelos, pues, serán sometidos a pruebas (y, muy probablemente, reelaborados o cambiados) de distintas formas: buscando evidencias para probar las predicciones realizadas con ellos, poniendo a punto su capacidad predictiva en situaciones muy simples e idealizadas (habitualmente “ejercicios”) para ponerlos a prueba en situaciones más cercanas a la realidad (problemas abiertos de lápiz y papel), viendo en qué medida pueden predecir nuevos hechos, dar lugar a objetos o procesos útiles, o permiten unir ideas o campos que antes parecían desconexos (coherencia y universalidad). La elaboración y puesta a prueba de modelos, pues, es una parte crucial del plan (en la ciencia y en la enseñanza), coincidiendo con la importancia que tienen para el aprendizaje de las ciencias (Guevara y Valdez, 2004; Chamizo, 2006; Rubilar e Izquierdo, 2011).
- 4.
Prever, algo que consideramos esencial, la realización de recapitulaciones periódicas (nosotros las llamamos “recapitulaciones problematizadas”), sobre lo que se ha avanzado en el problema inicial, los obstáculos e ideas que se han debido superar y lo que queda por hacer. La estructura problematizada, favorece que la evaluación sea vista como recapitulación de la empresa científica, como una ayuda para el avance, sobre terreno firme, del plan de investigación.
Toda esta estructura constituye una forma de trabajo que favorece la explicitación de las propias ideas y su confrontación con las de otros, en un ambiente hipotético-deductivo, rico en episodios de argumentación y justificación, no amenazador. Se pretende crear un ambiente que favorezca simultáneamente la implicación afectiva y la racionalidad científica de todos los implicados (profesor y alumnos) en la resolución de los problemas. Por supuesto, esto exige una cuidadosa planificación de la tarea por el profesor, mediante programas de investigación concretados en una secuencia de actividades debidamente engarzadas, y dejar tiempo en el aula para que los alumnos piensen, argumenten y actúen. Más adelante veremos un fragmento de una secuencia de actividades comentadas.
Como puede verse, las prácticas de laboratorio aparecen dentro de esta estructura como situaciones donde se van a poner a prueba los conceptos y/o modelos mediante la manipulación de objetos, interaccionando con lo real. Necesariamente deben estar integradas en el desarrollo de los temas: la familiarización con la metodología científica es un objetivo de toda la enseñanza y no tiene sentido separar entre teoría, prácticas, problemas, que es una división artificial debido a causas organizativas, de gestión de recursos y/o a una concepción transmisiva de la enseñanza. No obstante, sí que proponemos la realización de distintos tipos de actividades prácticas con distinta finalidad, que indicamos a continuación:
1. Actividades prácticas para generar preguntas que sirvan para problematizar el inicio del tema. Por ejemplo:
- –
Al comienzo del tema sobre corriente eléctrica, darles a los alumnos, en grupos pequeños, una pila, cables y dos bombillas, para que monten todos los circuitos posibles y anoten preguntas que les surjan.
- –
Producir una reacción reversible para plantear preguntas sobre el cambio químico: ¿cómo es posible que desaparezcan unas sustancias y aparezcan otras con propiedades diferentes?; más aún, ¿cómo es posible que lo que había desaparecido se pueda recuperar? (al menos en algunas ocasiones).
2. Trabajos prácticos para poner a prueba conceptos y modelos durante el proceso de su elaboración. Son los trabajos prácticos “fundamentales” a los que nos hemos referido. Deben estar integrados en el desarrollo del tema, haciéndose en el momento adecuado. Si, por alguna causa no se puede ir al laboratorio a tomar los datos, es preferible grabar en video el proceso de medida, seguir en clase el plan previsto, incluyendo el video, y dar a los alumnos los datos obtenidos para continuar en el aula.
3. Trabajos prácticos de “lápiz y papel”. Sirven para focalizar la atención en uno o muy pocos objetivos que se consiguen con las prácticas (una de las causas de la poca efectividad de los trabajos prácticos para aprender, es tratar de conseguir demasiados objetivos en una sola práctica). Por ejemplo:
- –
Dar por escrito las hipótesis y los datos obtenidos en un experimento y pedir que los analicen y argumenten sobre la validez de las hipótesis.
- –
Hacer el cálculo de imprecisiones a partir de datos directos (simulando una parte de lo que se debería hacer en cualquier trabajo práctico).
- –
Utilizar sensores, en el aula, que representan gráficamente los datos en tiempo real en una situación relacionada con el tema que se esté tratando y pedir que analicen las gráficas.
- –
Darles una hipótesis, una serie de datos y pedirles que los analicen con una hoja de cálculo, explicando lo que hacen.
4. Fabricación de objetos/prototipos; explicación del funcionamiento de objetos o presentación de hechos llamativos explicándolos con las ideas desarrolladas en el tema que se está tratando.
5. Prácticas con “sentido en sí mismas”. Suelen ser instrumentales, útiles para el trabajo práctico en general. Pueden hacerse independientemente del tema que se esté tratando. Por ejemplo:
- –
- –
Hacer una curva de calibrado de la concentración de una sustancia en disolución a partir de alguna propiedad física.
6. Proyectos autónomos. Trabajos prácticos propuestos a un grupo de alumnos que, por su cuenta, debe llegar a conclusiones. La probabilidad de éxito debe ser elevada, por lo que sólo deben hacerse si se han suministrado las oportunidades necesarias para que exista transferencia desde los trabajos prácticos ya hechos. El factor que más influye en la transferencia es haber aprendido con comprensión la situación desde la que se desea transferir, especialmente saber el porqué de los procedimientos empleados. Por ejemplo:
- –
Después de haber realizado el trabajo práctico sobre la dependencia de la fuerza elástica que ejerce un muelle con el estiramiento producido (ley de Hooke), pedirles que estudien de qué depende (y como) la constante elástica, K, de un muelle.
- –
Después de haber realizado la práctica sobre “velocidad de una reacción”, proponed que hagan el estudio de otra distinta (más sencilla).
7. Pequeñas demostraciones hechas por el profesor. Todos conocemos a muchos profesores que llevan objetos, dispositivos, hacen reacciones llamativas, etc., durante el desarrollo de sus clases. Si se hace bien, en el momento oportuno, permite mantener el diálogo entre lo real y lo imaginado durante el desarrollo del tema.
A continuación, nos centraremos en los trabajos prácticos “fundamentales” (aquéllos en los que se ponen a prueba conceptos, hipótesis o modelos “fundamentales”), presentando la hoja de laboratorio habitual y procediendo a su transformación.
3Un ejemplo de transformación de las prácticas de laboratorio habituales: el estudio de la velocidad de reacciónEl guión de laboratorio mostrado en el recuadro inferior representa un caso típico de lo que se suele encontrar en los laboratorios habitualmente, como hemos mostrado en el primer apartado de este artículo. No dedicaremos espacio a criticarlo (algo muy conveniente, que dejamos para el lector), sino a transformarlo.
ESTUDIO DE LA VELOCIDAD DE REACCIÓN
TP HABITUAL
1. IntroducciónEl objeto de esta práctica es estudiar los factores de que depende la velocidad de reacción y hacer ver a los estudiantes que las transformaciones químicas no tienen lugar instantáneamente, sino a velocidades que con frecuencia pueden medirse. Como comprobaremos, la velocidad de reacción se ve afectada por: a) el grado de división de las sustancias que reaccionan; b) las concentraciones de los reactivos; c) la temperatura a la que tiene lugar la reacción, y d) la presencia de catalizadores
2. Efecto del Tamaño de Las PartículasVamos a estudiar la reacción entre el ácido clorhídrico y unos trozos de carbonato cálcico con diferente grado de división. El transcurso de la reacción es seguido observando el cambio de peso que acompaña al desprendimiento de carbónico. Poner 40 cm3 de HCl 2M en un erlenmeyer de 250 cm3; añadir 20 g de trozos de mármol y colocar un tapón poco oprimido de algodón en el cuello del erlenmeyer, para impedir que salgan nieblas de ácido que podrían estropear la balanza. Se pesará todo el aparato, y en el momento en que se conozca su peso, se pondrá en marcha el cronómetro. Anotar el peso cada minuto, durante diez minutos. Se construye un gráfico en el que se representa la pérdida de peso en función del tiempo. La pendiente del gráfico da la velocidad de reacción en el momento representado por dicho punto. Hallar la pendiente de la sección central de la gráfica.
Repetir el experimento con 20 g de trozos de mármol triturado hasta formar fragmentos de tamaño mucho menor. Comparar las pendientes de las gráficas en sus secciones centrales. ¿Qué podemos deducir?
3. Influencia de la ConcentraciónPara estudiar el efecto de la concentración de los reactivos, vamos a estudiar la velocidad de reacción entre el tiosulfato de sodio y el ácido clorhídrico:
Se miden 50 cm3 de disolución de Na2S2O3 0,2 M, pasándola al erlenmeyer o a un vaso de precipitados. Se le añade 5 cm3 de HCl 2 M; al mismo tiempo, se pone el cronómetro en marcha. Después se puede dar un movimiento giratorio al matraz o vaso, una o dos veces, antes de colocarlo sobre un trozo de papel blanco en el que se ha marcado una cruz con un lápiz. Se mira la cruz a través de la disolución y se anota el tiempo que transcurre hasta que desaparece.
Repetir el experimento usando 40, 30, 20 y 10 cm3 de la disolución de tiosulfato, diluyendo en todos los casos hasta 50 cm3 con agua destilada.
Constrúyase una gráfica en que se represente:
- a)
La concentración de tiosulfato en función del tiempo. La concentración puede medirse como volumen de disolución original tomada o como peso de tiosulfato presente en 50 cm3 de disolución diluida.
- b)
La concentración de la disolución de tiosulfato en función de la inversa del tiempo (1/tiempo) ya que la inversa del tiempo es una medida de la velocidad de reacción
Interpretar los resultados del experimento. ¿Qué significa el resultado?
4. Influencia de la TemperaturaPara comprobar la influencia de la temperatura, trabajaremos con la misma reacción que en el apartado anterior. Se miden 10 cm3 de disolución de tiosulfato en el erlenmeyer y se añaden 40 cm3 de agua, calentando la disolución suavemente si es necesario hasta que alcance una temperatura de 20 °C . Después se añaden 5 cm3 de HCl 2M y se toma la temperatura de la mezcla, se pone en marcha el cronómetro y se imprime un movimiento de rotación, procediendo como en el apartado anterior. Repetir con 30, 40 y 50 °C.
El trabajo sobre la velocidad de reacción, en un nivel de bachillerato, puede integrarse dentro de un problema fundamental (¿Cómo es posible el cambio químico —que desaparezcan unas sustancias y aparezcan otras diferentes, e, incluso, que en ocasiones se puedan recuperar las iniciales—? ¿Cómo es posible “el cambio y la permanencia”?), cuya solución requiere la invención de un modelo (el cinético molecular) que es fundamental en la química y en el aprendizaje de la química. Dicha integración hace que el trabajo práctico adquiera sentido y contribuya a dar coherencia a la teoría atómicomolecular. Además de enriquecer la estructura conceptual del campo, su integración puede (y debe) hacerse de un modo coherente con la metodología científica (de hecho, recordemos, todo el tema es un problema).
Hacemos un breve resumen del contexto del tema con la finalidad de transmitir cómo es posible realizar dicha integración y transformación: (…) Según nuestro concepto de sustancia y nuestro modelo de reacción, la desaparición de unas sustancias y la aparición de otras nuevas en un cambio químico se debería a la rotura de los enlaces entre átomos de unas moléculas (las que forman las sustancias-reactivos), y a la reorganización de dichos átomos formando “paquetes” (moléculas) diferentes (las que forman las sustancias-productos). Se trata de un primer modelo (sencillo, como debe ser en estos niveles) que podemos someter a prueba mediante la realización de predicciones contrastables. Al comienzo del tema habíamos indicado preguntas sobre las reacciones químicas que tendría interés estudiar (por ejemplo: ¿qué cantidad de reactivos se necesitan para conseguir una cantidad deseada de producto? ¿De qué depende que una reacción transcurra más o menos rápida? ¿Cuánto calor y trabajo podemos conseguir de una reacción? ¿Cuándo se detendrá?…). Ahora que disponemos de un modelo de reacción (un “objeto teórico”) podemos abordar teóricamente dichas preguntas y, al mismo tiempo, someter a pruebas la validez del modelo (…).
A continuación presentamos la secuencia de actividades, con comentarios didácticos para el profesor (en un tipo diferente como éste), en la que se desarrolla la práctica de laboratorio.
¿De qué dependerá la velocidad de una reacción? (fragmento dentro de un tema o grupo de temas sobre cambio químico)
A1. Utilizad el modelo cinético-molecular de colisiones para formular hipótesis sobre de qué dependerá lo rápido que transcurre una reacción química. Concretad para la reacción I2(g) + H2(g) 2⇋HI(g).
C.A1 Los alumnos deben dibujar cómo imaginan que ocurrirá el cambio químico (en el nivel molecular, como si pudieran ver las moléculas antes, durante y después del choque), y formular hipótesis basándose en dicho modelo. Sin muchas dificultades, aluden a la cantidad de moléculas de cada uno de los reactivos (“cuanta más cantidad de moléculas de iodo y de hidrógeno haya, más frecuentes serán los choques y, por tanto, más cantidad de nuevas moléculas se formarán”) y a la temperatura (“cuanto mayor sea la temperatura, más rápidas irán las moléculas, los choques serán más intensos y se romperán más moléculas”). El profesor intenta que los alumnos profundicen sobre la influencia de la temperatura: “¿Es que cualquier choque que se produzca no dará lugar a nuevas moléculas? ¿Por qué?”. Los alumnos dicen que no, que dependerá de la “intensidad” de los choques y que habrá choques que no producirán rotura de enlaces. El profesor insiste sobre cómo imaginan la naturaleza de dicha unión (qué tipo de fuerzas mantienen unidos a los átomos) y va surgiendo la idea de que las moléculas no son cuerpos macizos sino átomos unidos por atracción eléctrica, con sus electrones alrededor de los núcleos, donde existen protones.
El profesor agranda el dibujo de la pizarra, dibujando las moléculas grandes señalando los núcleos de los átomos, con carga positiva, y una nube electrónica con carga negativa que engloba a los núcleos. “Reelabora” lo que dicen los alumnos, expresando que la temperatura está relacionada con la energía cinética media de las partículas y que habrá, para una temperatura dada, una gran variedad en los valores de Ec de los millones de millones de millones de moléculas. Y que, en efecto, parece lógico pensar que sea necesaria una Ec mínima para que se produzca un acercamiento entre las moléculas tal que la distancia sea tan pequeña entre ellas (superando la repulsión entre las nubes electrónicas que forman el exterior de las moléculas) que las fuerzas eléctricas puedan debilitar unas uniones eléctricas y formar otras nuevas (enlaces). Aparece así la idea de energía umbral, asociada a la elaboración del modelo cinético de reacción. Lógicamente dicho umbral de energía dependerá de las sustancias que reaccionen, y una elevación de temperatura equivaldrá a que haya un mayor número de choques que puedan superar dicho umbral.
No suelen aludir al grado de división (están pensando en moléculas libres que chocan: hemos puesto un ejemplo en fase gaseosa) ni, por supuesto, a los catalizadores. Tampoco se imaginan que la reacción pueda ocurrir en el sentido inverso. El profesor hace pensar a los alumnos sobre qué pasaría si una de las sustancias fuera un sólido y la otra un gas o una sustancia disuelta en agua (como mármol y ácido clorhídrico; zinc y clorhídrico; un “trozo de manzana” y el oxígeno del aire; etc.), dibujando en la pizarra una estructura sencilla de un trozo de sólido (zinc: filas y columnas ordenadas y compactas de átomos iguales, en tres dimensiones) y moléculas libres3 de cloruro de hidrógeno, añadiendo que habría miles de millones de millones de moléculas. Tras un breve tiempo, aparecen ideas sobre la necesidad de que las moléculas o átomos puedan chocar, lo que no ocurre con los átomos en el interior del trozo de zinc. Por tanto, según el modelo, cuando uno de los reactivos sea un sólido, la velocidad de reacción no será la misma si es un único trozo que si está pulverizado, pues cuanto mayor sea el grado de división mayor será la superficie “de contacto”, es decir, mayor el número de átomos y moléculas que pueden chocar, y, en consecuencia, el número de choques.
El profesor se refiere a la posibilidad de que ocurran choques entre las moléculas de productos que pueden dar lugar a la reacción inversa. No habla aquí de catalizadores, dejándolo para cuando esté más afianzado el modelo de reacción (dentro de este mismo tema). Igualmente, debe considerar la conveniencia de abordar aquí o en la siguiente actividad la idea espontánea según la cual la velocidad de una reacción depende del “número de moléculas” y no del “n° de moléculas por unidad de volumen”. En cualquier caso, el profesor tiene previsto hacer que los alumnos imaginen que podemos tener varias piscinas de distinta capacidad (desde unos pocos litros a cientos de miles) llenas de la misma mezcla de reactivos que reaccionan muy lentamente produciendo una sustancia que precipita y se va al fondo…
Al final de esta puesta en común, el profesor escribe en la pizarra: “Según NUESTRO modelo de reacción, la velocidad de una reacción debe depender de: …” y pide a los alumnos que completen la lista. En todo momento utiliza la primera persona del plural, dramatizando, generando un clima de implicación personal, como si se tratara de un equipo de investigadores que están “metidos” en un problema apasionante.
A2. Algunas de las predicciones del modelo —como la naturaleza de las sustancias que reaccionan y que un mayor grado de división de los sólidos aumentará la velocidad de la reacción— se pueden comprobar cualitativamente de manera rápida. Proponed ejemplos o diseñad un experimento para probar que ocurre así.
A3. Si deseamos probar de un modo cuantitativo la influencia de los factores predichos en la velocidad de una reacción, necesitaremos medir su valor. ¿Cómo podríamos medir la velocidad de una reacción? Por ejemplo: A + B ⇌ C + D.
C.A3 Según nuestro modelo de reacción, una magnitud que se ajustaría a lo que intuitivamente imaginamos como la rapidez de una reacción sería el número de moléculas de uno de los reactivos / productos que se rompen / forman por segundo (y por unidad de volumen, ver el final de C.A1). El profesor manifiesta, no obstante, que no podemos ver las moléculas —contraponiendo lo que nos imaginamos a nivel molecular y lo que observamos macroscó-picamente— concretando en algún ejemplo. Y recuerda que sí podemos contar las moléculas (ya se trabajó el concepto de cantidad de sustancia y de su unidad, el mol, el n° de Avogadro, estequiometría), y que una disminución / aumento del n° de moléculas por unidad de volumen y por segundo, en el nivel macroscópico equivale a una disminución / aumento del n° de moles por unidad de volumen y por segundo, es decir al cambio en la concentración
molar por unidad de tiempo. De este modo, la magnitud que concuerda operativamente con lo que pensamos sobre la velocidad de una reacción sería el cambio en la concentración molar de uno de los reactivos o uno de los productos por unidad de tiempo: donde vA y vB serán negativas y vC y vD positivas.Según el objetivo pretendido con el tema, el profesor puede hacer más o menos cuantitativo el desarrollo de esta secuencia de actividades (no es lo mismo un estudio sobre la velocidad de reacción para someter a pruebas el modelo de reacción, que un tema sobre cinética química). ¿Qué ocurriría si la ecuación química fuera A + 3B⇌2C + D? En ese caso, como por cada mol de A que desaparece se forman 2 moles de C, macroscópicamente mediríamos que [C] varía el doble que [A] en el mismo tiempo, es decir: vc = –2vA. Haciendo el mismo razonamiento, tendríamos: vB = 3vA y vD = –vA. Para evitar que la velocidad de una reacción dependa de la sustancia elegida, se acordó definirla de un modo general comov=−1aΔAΔt=−1bΔBΔt−−1cΔCΔt=−1dΔDΔt, de modo que siempre tendrá d (t un valor positivo y único para la reacción: aA + bB⇌cC + dD.
Una vez inventada una magnitud que nos indica la velocidad de una reacción —midiendo la rapidez con que cambia la concentración de alguna de las sustancias (reactivos o productos)— hace falta pensar en los problemas técnicos para medirla realmente. Si queremos hallar cuánto cambia la concentración de una de las sustancias por unidad de tiempo, de un modo general, eso supondrá medir la concentración de la sustancia elegida en distintos instantes después de que empiece la reacción. El cambio en el valor de la concentración a lo largo de un intervalo de tiempo nos daría la velocidad (media) de la reacción en dicho intervalo. Si nos interesa la velocidad instantánea entonces deberíamos representar la concentración en función del tiempo, dibujar la gráfica, y las pendientes de las tangentes en cada uno de los puntos nos darían el valor de la velocidad de reacción en ese instante.
¡Pero no es fácil hacer eso! En clase hemos preparado disoluciones de sustancias de una concentración determinada. Y lo hemos hecho utilizando la balanza o la probeta para tomar la cantidad de sustancia (el “n° de moles”) que necesitábamos y añadiendo agua hasta obtener el volumen de la disolución deseada. Pero pensemos, por ejemplo, en la reacción de A3. ¡Tenemos que medir la concentración de una sustancia que está mezclada con otras tres en distintos momentos desde que empieza la reacción! (el profesor transmite la sensación de que está viviendo esa situación). Una posible solución sería tomar pequeñas muestras de la mezcla reaccionante en distintos instantes y, después de “paralizar” la reacción en cada muestra, analizarlas para determinar la concentración de la sustancia elegida en cada uno de ellos. Esto no es siempre posible, y en todos los casos es muy laborioso o requiere un instrumental no disponible en el laboratorio escolar. Mejor que esto es medir una propiedad física del sistema reaccionante, que dependa de la concentración de una de las sustancias, en función del tiempo. Existen algunas reacciones en las que ocurre esto y cuya evolución, por tanto, es relativamente fácil de seguir. Algunos ejemplos serían:
- –
Aquéllas en que sólo una de las sustancias-producto es un gas insoluble que escapa o puede extraerse del reactor. Esto hace que la reacción tenga sólo un sentido (no hay reacción inversa porque faltan las moléculas de una de las sustancias) y puede medirse la cantidad química de gas producido (midiendo la pérdida de masa, o el volumen del gas a P y T determinadas, por ejemplo),
- –
Reacciones en disolución acuosa en que sólo uno de los reactivos o productos es insoluble en agua, por lo que precipita o forma una disolución coloidal, produciendo turbidez. En este último caso, si la turbidez estuviera relacionada con la cantidad de sustancia, podríamos utilizarla para obtener medidas “indirectas” de su concentración.
- –
Reacciones en las que sólo uno de los reactivos o productos es coloreado. Estas sustancias absorben la luz de un determinado color, por lo que haciendo pasar un haz de luz de ese color a través de la disolución y midiendo la disminución de intensidad que experimenta, con un aparato llamado colorímetro o espectrofotómetro, se puede obtener la concentración de la sustancia coloreada (previamente se debe haber hecho una curva de calibrado, es decir, ensayos con concentraciones conocidas de la sustancia coloreada para ver la absorbancia para cada concentración). Con un colorímetro se puede medir la absorbancia en distintos momentos y, con la curva de calibración, transformar dichas mediciones en valores de la concentración de la sustancia coloreada.
Para probar nuestras hipótesis tenemos que elegir, pues, una reacción fácil de seguir, que pertenezca a alguno de los tipos anteriores. En nuestro caso, vamos a utilizar la del tiosulfato de sodio (Na2S2O3) con ácido clorhídrico, que reaccionan con bastante lentitud produciendo azufre (coloidal, genera turbidez) y dióxido de azufre4 (gaseoso, bastante soluble en agua), según la siguiente ecuación química:
Se ha comprobado experimentalmente que las sales y el ácido clorhídrico están disociados en iones y que [Na+] y [Cl–] no experimentan cambios, por lo que la ecuación anterior queda de la forma:
Se trata, por tanto, de una reacción que transcurre lentamente en un solo sentido y en la que podemos obtener medidas indirectas de la concentración de azufre a partir de la turbidez.
A4. Concretad nuestras hipótesis para la reacción elegida, es decir, ¿de qué dependerá la velocidad de esa reacción? Haced un esfuerzo para justificar las hipótesis en el modelo cinético-molecular de reacción química.
C.A4 Los alumnos suelen afirmar que la velocidad dependerá de las concentraciones de los reactivos y de la temperatura, de un modo rápido. El profesor debe pedirles que argumenten dichas creencias a partir del modelo cinético-molecular de reacción, imaginando con dicho modelo cómo transcurre la reacción a nivel submicroscópico (como si pudieran ver las partículas). Al final de la puesta en común, la imagen sobre cómo transcurre la reacción queda del siguiente modo:
- •
Nos imaginamos que, en cada instante, en 1 cm3, habrá miles de miles de millones de iones tiosulfato y de iones hidronio, algunos de los cuales estarán chocando y otros no. Como los iones tienen energías cinéticas diferentes y los choques entre ellos pueden tener orientaciones y zonas de impacto muy variadas, algunos choques producirán especies distintas —de azufre, entre ellas— y, en cambio, otros no serán efectivos (“rebotarán o se desviarán” simplemente). Todo esto está ocurriendo en todo el volumen de reacción. Como parte de las moléculas de SO2 escapan de la mezcla y los átomos de S se van uniendo formando las partículas que enturbian la disolución, ocurrirán muchos menos choques que puedan dar lugar a reacción inversa. La reacción continuará mientras haya iones de ambos reactivos, y su velocidad irá disminuyendo con el tiempo, pues, cada vez, habrá menos choques.
- •
En el nivel macroscópico, esto se traducirá en que se irán formando nuevas sustancias, aumentando, pues, su concentración con el tiempo y disminuyendo la de los reactivos. El azufre, al producirse por todo el volumen de reacción, va enturbiando la mezcla. Cuanto mayor sea la concentración de azufre, mayor será la turbidez. Precisamente, hemos elegido esta reacción porque esta propiedad del azufre nos permitirá seguir la evolución de la reacción con cierta facilidad.
Y las hipótesis quedan formuladas en los siguientes términos:
- •
v dependerá de la concentración de tiosulfato de sodio y de ácido clorhídrico, ya que al aumentar o disminuir la concentración de cualquiera de ellos, según nuestro modelo, cabe esperar que aumente o disminuya el número de choques por unidad de volumen en cada segundo. También v deberá depender de la temperatura, aumentando al aumentar ésta, ya que según nuestro modelo cinético-corpuscular, está relacionada con la energía cinética media de los iones, por lo que los choques deberán ser más “intensos” al aumentar la temperatura y mayor será la probabilidad de que las fuerzas eléctricas entre átomos pudieran romper enlaces y formar otros diferentes.
- •
Respecto a la forma de la dependencia, los alumnos suelen pensar en términos de proporcionalidad directa: si la concentración de uno de los reactivos aumenta al doble, la v deberá aumentar también el doble. Si se redujera a la mitad, la reacción procedería más lentamente, reduciéndose también la v a la mitad. Si la concentración de uno de los reactivos tendiera a cero, la reacción iría cada vez más lenta (si faltara uno de los reactivos, v deberá ser cero). Respecto a la temperatura, también suelen inclinarse por una dependencia lineal (“a doble temperatura, doble velocidad”). Así, el tipo de dependencia esperada para la velocidad de reacción es:
El profesor puede añadir que a una expresión de ese tipo, se le llama ley de velocidad de una reacción, y que, en general, toman la forma de: v = k(T) [A]m [B]n. El conocimiento de la ley de velocidad de una reacción es muy importante para poder controlarla y para conocer el mecanismo detallado de cómo se produce, lo que permite optimizar el procedimiento para conseguir más sustancias en menos tiempo, evitar explosiones, enlentecer reacciones no deseadas, etc. A m y n se les denomina orden parcial de reacción respecto a A y B, y a (m + n) orden total de la reacción. En nuestro caso, los estudiantes han hipotetizado que la reacción es de primer orden respecto al tiosulfato de sodio y, también, respecto al ácido clorhídrico. Deseamos resaltar que este tránsito de lo particular (tiosulfato + hidronio) a lo general (A + B) y al revés, facilita la transferencia a nuevas situaciones.
A5. Proponed un diseño experimental para contrastar las hipótesis. Pensad, primero, en un plan lógico general y, posteriormente, en los problemas técnicos concretos que se tendrán que resolver para llevar el diseño a la práctica.
C.A5 Los alumnos —para quienes no es éste su primer trabajo práctico— saben que para probar la influencia de cada una de las tres variables en v hay que variar sólo una de las variables, dándole los valores que deseemos (variable independiente), dejando las otras dos fijas (variables controladas), y medir el valor que toma v en cada caso (variable dependiente). Es útil reflejar este plan lógico general en una tabla como la siguiente:
Es decir, por ejemplo, si queremos estudiar la influencia de [S2O3 2–] en v, tendremos que medir v para distintos valores de [S2O32–], manteniendo iguales los valores de T y de [H+]. ¿Pero cómo podemos hacer esto si en la reacción cambia la concentración de ambos reactivos? ¡Si, precisamente la [S2O32–] cambia porque cambia [H+]!
El profesor debe resaltar que esta situación es habitual en la investigación: una cuestión es qué habría que hacer lógicamente para poder obtener conclusiones y otra lo que podemos hacer. Esto obliga a buscar procedimientos que, aun no siendo “perfectos”, nos permitan acercarnos al diseño ideal y a buscar caminos diferentes para ver en qué medida convergen hacia los mismos resultados. En este caso, nos encontramos con los siguientes problemas:
- 1.
¿Cómo mantener constante la [HCl] y variar la [Na2S2O3]? (Y viceversa)
- 2.
¿Cómo variar la T manteniendo constantes [HCl] y [Na2S2O3]?
- 3.
¿Cómo medir la velocidad de reacción, v, en el instante en que la concentración o la temperatura tienen el valor deseado?
Ante el problema 1, en vez de pensar en una sola reacción que está transcurriendo (lo que conduce a problemas prácticos insolubles), podemos iniciar diferentes reacciones partiendo de [HCl] iguales, a igual temperatura, pero con distintas [Na2S2O3], y medir la velocidad inicial de reacción. Podríamos obtener así una tabla de la velocidad para distintas [Na2S2O3] en condiciones de [HCl] y T constantes. ¿Cómo medir las velocidades iniciales? Como el S es la sustancia que nos sirve para seguir la evolución de la reacción, tendremos que medir el cambio de la [S] disperso por unidad de tiempo. Una estimación de la velocidad inicial podríamos hacerla midiendo el tiempo, t*, que tarda la [S] en pasar de cero a un valor determinado, [S]* . La velocidad media, desde t = 0, hasta t = t*, sería
Esta velocidad media sería una buena estimación de la velocidad en t = 0 si:
- a)
v fuera constante (si no dependiera de la concentración, vm= v) (en nuestra hipótesis afirmamos lo contrario).
- b)
aunque v varíe, la reacción es tan lenta que, si t* es pequeño, v habrá variado muy poco y el valor de vm será muy cercano a la velocidad inicial.
Precisamente, una de las razones para elegir la reacción que estamos utilizando es su lentitud, que permite una buena estimación de la velocidad inicial a partir de la vm.
El profesor debe hacer conscientes a los alumnos de que medir exactamente la [S] requeriría mucho trabajo e instrumental adecuado (por ejemplo, un espectrofotómetro, para medir la absorbancia y obtener la concentración; esto, a su vez, requiere la realización previa de una curva o tabla de calibrado —lo cual puede ser una excelente y útil práctica de laboratorio con sentido en sí misma—), y que si solo queremos conocer la forma de dependencia de la velocidad con la concentración (o con la temperatura), podemos utilizar el tiempo, t*, que tarda en producirse una determinada concentración de azufre, y utilizar 1/ t, como una estimación de la vm, pues es proporcional a ella (1/ t* = vm/ [S]), véase ecuación 1).
A6. Haced un ensayo con la reacción y pensad alguna forma sencilla de medir el tiempo que tarda la [S] en alcanzar un valor determinado.
C.A6 El aspecto visible del S es la turbidez que produce en la disolución, que debe estar relacionada con su concentración. Si admitimos que un valor determinado de turbidez corresponde a un valor determinado de concentración de S, se trataría de medir el tiempo que se tarda en alcanzar siempre la misma turbidez. Una forma de hacer esto con bastante precisión es colocar el erlenmeyer sobre un papel blanco en el que hemos dibujado una marca (X) con un lápiz (tenue, para que el tiempo sea pequeño) y medir el tiempo que tarda en desaparecer. El observador deberá colocarse sobre el matraz (¡no muy cerca! y con gafas; véase la nota al pie n° 2) y la altura del líquido que atraviesa la luz procedente de la marca hasta nuestros ojos debe ser siempre la misma (para que el tiempo sólo dependa de la concentración, no de la profundidad del líquido); así pues, deberemos usar siempre el mismo tipo de matraz y el mismo volumen total de mezcla. Podremos comparar la velocidades iniciales de distintas reacciones comparando los tiempos (más exactamente, las inversas de los tiempos) que tarda en desaparecer la misma marca, es decir, en formarse la misma concentración de S.
A7. Teniendo en cuenta los condicionantes anteriores, proceded a diseñar con detalle cómo determinar la relación entre la velocidad de reacción y la [Na2S2O3]. Preparad las tablas necesarias para registrar los datos obtenidos al llevar a cabo el diseño previsto.
A8. Pensad cómo debería ser la gráfica si se cumpliera nuestra hipótesis y preparad los ejes para representar los datos del experimento.
A9. Lo mismo que en A7 y A8 con la [HCl].
A10. Lo mismo que en A7 y A8 con la temperatura.
C.A7, A8, A9 y A10 En A7 se trataría de comenzar distintas reacciones con una concentración de tiosulfato conocida y diferente para cada una de ellas y la misma concentración de clorhídrico, manteniendo constante la temperatura (puede ser la del ambiente). Hemos de tener en cuenta, además, que el volumen total de la mezcla debe ser el mismo en cada caso. Haremos que el volumen total sea de 100 mL, por ejemplo, lo que exige que el volumen de disolución de tiosulfato y el volumen de la de clorhídrico que hacemos reaccionar sumen 100 mL.
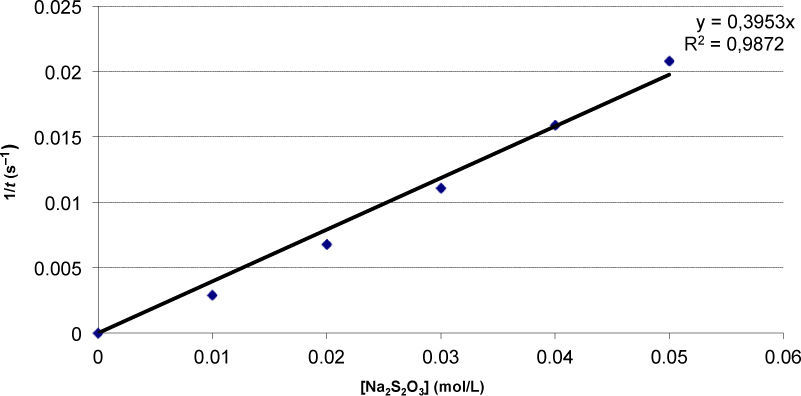
Podemos tener ya preparados 0,5 litros de disolución de tiosulfato 0,1 M, y 0,5 litros de clorhídrico 1 M, para preparar, a partir de ellos, muestras de 50 mL de concentración conocida de tiosulfato y de 50 mL (todos iguales) de ácido clorhídrico 0,2 M. Llevaremos a cabo, al menos, cinco reacciones, con una [Na2S2O3] de 0,01, 0,02, 0,03, 0,04 y 0,05 M.
Se les debe plantear a los alumnos (que ya han hecho problemas de estequiometria) cómo preparar la primera muestra de tiosulfato, asegurándonos de que se hace con comprensión (sin aplicar mecánicamente fórmulas), y proponiendo “automatizar” el proceso, elaborando una tabla similar a la tabla 2.
Preparación de muestras de tiosulfato con la concentración deseada.
| Tubo de ensayo con [Na2S2O3] n° … (50 mL) | [Na2S2O3] deseada en los 100 mL de la mezcla inicial | Cantidad necesaria de Na2S2O3 (n° de moles) | Volumen de la disolución concentrada (0,1 M) que hemos de tomar |
|---|---|---|---|
| 0 (ensayo piloto) | 0,01 moles/L (M1) | n1 = Vmezcla·M1 = = 0,1·0,01 = 10–3 moles de Na2S2O3 | Debemos tomar un volumen, Vc, que contenga un n° de moles igual a n1, es decir: Vc·Mc = n1 → Vc = n1/Mc = 10–3/0,1 = 10–2 litros (10 mL) |
| 1 | 0,01 moles/L (M1) | n1 = Vmezcla·M1 = 0,1·0,01 = 10–3 moles de Na2S2O3 | 10 mL |
| 2 | 0,02 moles/L (M2) | n2= | 20 mL |
| 3 | 0,03 | 30 mL | |
| 4 | 0,04 | 40 | |
| 5 | 0,05 | 50 |
Lo mismo haríamos en A9 y A10. Es importante que los alumnos lleven al laboratorio preparadas las tablas donde poner los datos que van a medir. Y, lógicamente, deben hacer algún “ensayo piloto” inicial para que mejoren el procedimiento (particularmente la medida del tiempo que tarda en desaparecer la marca), antes de empezar la toma de datos de la serie. Incluso, puede ser aconsejable hacer “pruebas de extremos”, con una concentración elevada y otra muy pequeña (aquí no se hizo). En nuestro caso, desde el principio de curso (donde se desarrolló una “aproximación al trabajo científico”) saben que es necesario tomar, al menos, tres medidas y, si no hay mucha dispersión, tomar la media y como imprecisión la sensibilidad del instrumento de medida. Según el nivel de los alumnos, saben hallar imprecisiones de magnitudes indirectas (como 1/t). Una posible tabla sería la tabla 3.
Toma de datos para el estudio de la influencia de la concentración de tiosulfato en la velocidad de reacción ([HCl]) y T constantes).
| Na2S2O3 inicial (moles/L) | t* (s) (tiempo que tarda en desaparecer la marca) (tres medidas, indicando la sensibilidad del instrumento) | t* (s) (Tiempo que tarda en desaparecer la marca) (media de las tres medidas con su imprecisión) | 1/t* (s–1) (cantidad proporcional a vm) |
|---|---|---|---|
| 0,01 | |||
| 0,02 | |||
| 0,03 | |||
| 0,04 | |||
| 0,05 |
En A8, los alumnos deben recordar la hipótesis formulada y pensar cualitativamente sobre ella. Inmediatamente dicen que la representación gráfica de la velocidad inicial (o de 1/t), al mantener el resto de variables constantes en todas las reacciones, en función de la [Na2S2O3] debe ser una recta que pase por el origen: v = k’[S2O32-]. El profesor les incita a expresar esa relación cualitativamente (“a doble concentración, doble velocidad” o, mejor, “un incremento dado de concentración, siempre producirá el mismo incremento de velocidad: ΔvΔS2O82-=k′″”. El profesor escribe en la pizarra que eso ocurrirá con cualquier reacción de orden uno respecto a un reactivo, y pregunta qué pasaría si el orden parcial fuera cero o dos, escribiendo las leyes de velocidad correspondientes. Lo hace con reactivos genéricos (A, B, C) y dibujan las gráficas esperadas en cada caso.
Al final de A8, los alumnos tienen preparadas en sus cuadernos las tablas, cómo serían las gráficas para un orden parcial de cero, uno y dos, la gráfica que esperan obtener para el caso del tiosulfato, y unos ejes para representar los datos de la tabla.
En ese momento, el profesor debe decidir si ir al laboratorio a tomar los datos sobre el tiosulfato o acabar A9 y A10 e ir a tomar los datos sobre las tres variables.
A11. Realizad los experimentos diseñados, recogiendo los datos en las tablas preparadas.
C.A11 Debe resaltarse que, puesto que el trabajo práctico está integrado en el tema, toda la discusión anterior puede realizarse en el desarrollo habitual de las clases —con los alumnos en pequeños grupos trabajando sobre las actividades propuestas— con la única ayuda de dos disoluciones de tiosulfato y clorhídrico para que el profesor pueda dramatizar las dificultades que se han ido planteando, produciendo la reacción a estudiar cuando sea necesario.
Cuando el grupo de alumnos va al laboratorio (en nuestro caso, hemos llegado a 40 alumnos, en último curso de bachillerato), van únicamente a preparar las muestras previstas, realizar las reacciones y tomar los datos, con la “guía” de su cuaderno. Una vez tomados los datos, las representaciones gráficas y el análisis de las mismas se hacen, de nuevo, en el aula. A lo largo de muchos años de experiencia, nuestros alumnos han entrado al laboratorio a “poner en práctica” un plan previsto y discutido. Esto hace que estén orientados (saben qué van a hacer, por qué y para qué) y dirijan su atención a la tarea, disminuyendo las distracciones típicas en grupos de adolescentes en el laboratorio, y que es una de las causas citadas por los profesores para utilizar menos el laboratorio escolar.
A12. Analizad los resultados obtenidos e interpretarlos, viendo en qué medida apoyan nuestras hipótesis.
C.A12 Aquí mostramos alguna de las gráficas (gráficas 1, 2 y 3) obtenidas por los alumnos, en condiciones análogas a las previstas en las actividades anteriores. Preferimos, inicialmente, que utilicen papel milimetrado si no utilizan bien el programa correspondiente o no comprenden —al menos, intuitivamente, lo que es un ajuste por mínimos cuadrados de la recta de regresión—. En otro caso, utilizan el ajuste gráfico automáticamente, sin pensar con el modelo, admitiendo la ecuación del computador (porque “da una centésima mejor el coeficiente de correlación”) frente a otra que corresponde mucho mejor a las hipótesis formuladas a partir del modelo. La incorporación con sentido de las posibilidades de los computadores es, por supuesto, uno de los objetivos de la enseñanza de las ciencias actualmente, pero deberíamos evitar formar personas que no podrían hacer nada sin ellos.
Los resultados obtenidos para el tiosulfato (véase gráfica 1) concuerdan con lo esperado: se trata de una línea recta que —prácticamente— pasa por el origen (el punto (0, 0) es teórico). “A doble concentración, doble velocidad”. Algunos alumnos y el profesor utilizan el programa Excel para probar el ajuste de distintos tipos de funciones, obteniéndose la ecuación que se muestra en la gráfica 1 con el correspondiente coeficiente de correlación. No obstante, el profesor insiste en que piensen si ocurre lo que predecía el modelo: al aumentar la [S2O32–] aumentará el número de choques, habrá más choques que superen la energía umbral, y, en consecuencia, mayor número de nuevas moléculas por unidad de volumen y de tiempo. Más aún, los estudiantes habían predicho una proporcionalidad directa entre la concentración de tiosulfato y la velocidad, lo cual se cumple. El orden parcial de la reacción respecto al S2O32– es uno.
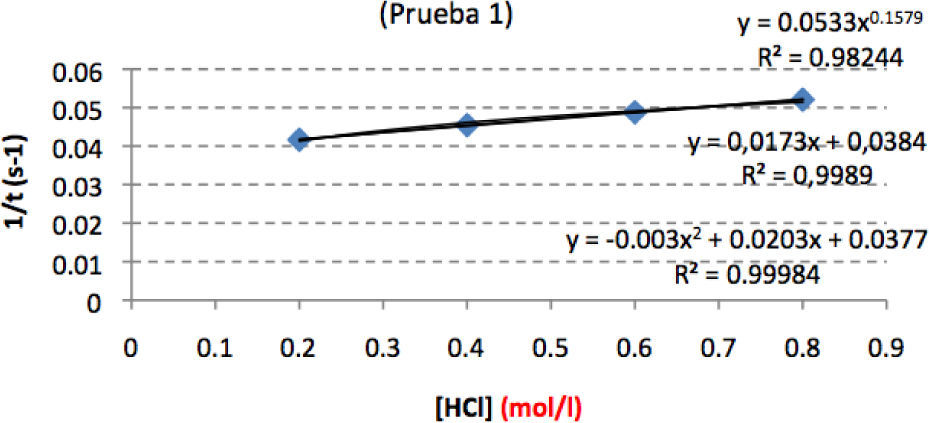
Respecto al ácido clorhídrico, la gráfica 2 es un ejemplo de la obtenida por un grupo de alumnos (que no incluyeron el (0,0)). Cuando los alumnos estaban tomando las medidas con el HCl, expresaban que “no influía o influía muy poco”, pero al ver la representación inmediatamente han dicho que al ser una recta el orden era también uno. El profesor señala que la supuesta recta no pasa por el origen (algo que necesariamente debe ocurrir), y que, según los valores de la tabla, a doble concentración no se produce doble velocidad (p. ej.: de 0,4 a 0,8 M). Además, utiliza el computador —que ya algunos alumnos habían utilizado— para ajustar tres funciones diferentes, cuyas ecuaciones y coeficientes se muestran en la gráfica 2, para poner en evidencia que casi siempre es posible ajustar alguna función (especialmente polinómica) a una serie de datos, pero que —como vemos— con esa información no podemos decidir cuál es mejor. Además resalta que, en ese intervalo de concentraciones, más bien se acerca a una reacción de orden 0 respecto al clorhídrico, una recta paralela al eje x, y que esta gráfica ofrece tantas dudas que es necesario repetir otra serie de medidas. Les hace poner a los alumnos “prueba 1” en la gráfica. La “prueba 2” deciden realizarla con concentraciones muy diferentes, partiendo de disoluciones muy diluidas, de manera que si influye la [HCl] se noten las diferencias. En la gráfica 3 se muestran los resultados de esa segunda prueba, con concentraciones unas diez veces menores que en la primera.
Al ampliar el rango de concentraciones se manifiesta que [HCl] influye en la velocidad de reacción cuando sus valores son muy pequeños. Los datos sorprenden a los alumnos, que no esperaban estos resultados. En todo caso, que influya más la [HCl] en la velocidad de reacción a bajas concentraciones que a altas no encaja con las previsiones que habíamos hecho con el modelo. Podría dejarse para un proyecto el estudio detallado de la influencia del HCl en la velocidad de reacción con diferentes valores iniciales de [Na2SO3], analizando la curva correspondiente para cada valor. Pueden consultarse los trabajos pioneros de los químicos de las universidades de Columbia, Harvard y el Trinity College sobre esta reacción (Dinegar, et al., 1951; Davis, 1958).
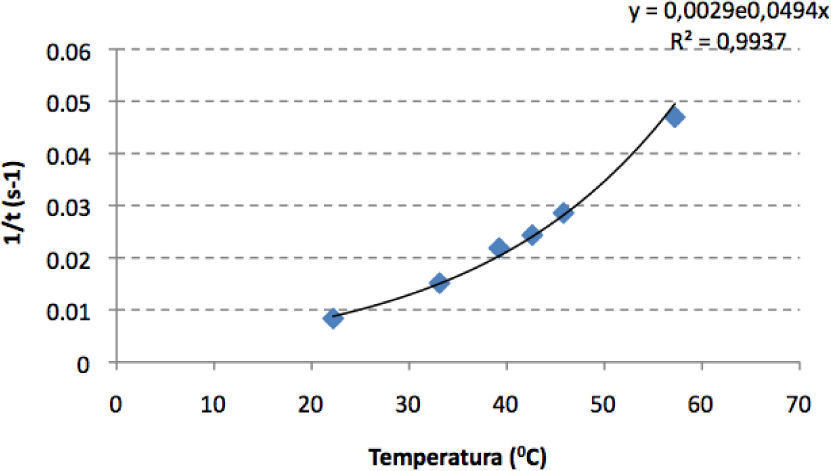
Sobre la influencia de la temperatura (gráfica 4), se ve claramente que se confirma nuestra hipótesis de que al aumentar aumentará la velocidad de reacción, aunque no lo hace linealmente (aquí no hay duda), sino que un cambio de 10° produce mucho más aumento en la velocidad si ocurre de 40 a 50 °C, que si lo hace de 10 a 20 °C.
Según la planificación del curso y el nivel de los alumnos, puede profundizarse en cinética química, tratando el cálculo del orden de reacción, la energía de activación, vida media, etc. También es ahora posible proponer a los alumnos, como un proyecto para pequeños grupos, que determinen el orden de reacción parcial y total de una reacción más sencilla que la tratada en clase.
A13. Elaborad un informe en el que se recoja el trabajo realizado para someter a pruebas las predicciones del modelo cinético de reacción sobre la velocidad de las reacciones. Se debe prestar especial atención a discutir en qué medida los resultados obtenidos apoyan las hipótesis o no. En caso en que se haya obtenido algún resultado “anómalo” ¿cómo afecta a nuestro modelo inicial de reacción? ¿Debemos descartarlo?
C.A13 Se ha dirigido el énfasis del informe hacia uno de los aspectos menos tratados con los alumnos, que suelen creer que cuando un modelo o teoría no explica algún fenómeno o dato, ésta se abandona. En el informe, si se hace desde el principio, debería resaltarse como conclusión que las predicciones del modelo cinético se cumplen en la práctica totalidad (naturaleza de las sustancias, grado de división, influencia de la temperatura y de la concentración), si bien en el caso del HCl, la influencia de su concentración tiene un comportamiento sorprendente. Además, el modelo, como veremos, tiene un gran éxito en otros campos. Parece lógico, y así actúa la comunidad científica, pensar que el modelo inicial debe ser modificado de modo que, manteniendo el éxito donde lo tiene, pueda explicar casos como el del HCl en la reacción estudiada (que también ocurren en otras reacciones). El profesor debe hacer una puesta en común sobre este aspecto, expresando que el proceso de “choque-rotura-formación” de enlaces tan sencillo como el de nuestra partida (un solo choque) ha ido enriqueciéndose y haciéndose más complejo para poder explicar lo que se obtiene empíricamente. Puede referirse, por ejemplo, a que no sólo es cuestión de superar la energía umbral sino también de la orientación de las moléculas en el momento del choque y, especialmente, a que al resultado final (los productos) puede llegarse en varias etapas (reacciones intermedias) con velocidades diferentes cada una de ellas. De este modo, puede ocurrir que una de las etapas condicione el rendimiento de las otras (y la velocidad de toda la reacción). El profesor puede utilizar alguno de los excelentes simuladores de mecanismos de reacción disponibles en internet, y hablar en este momento sobre la existencia de catalizadores (sustancias que macroscópicamente parecen no participar en la reacción, pero que sí lo hace en alguna o algunas de las etapas intermedias), poniendo ejemplos. Puede aludirse también al avance tecnológico para “fotografiar” las reacciones a nivel molecular cuando están ocurriendo, utilizando pulsos de láser a intervalos de tiempo comparables a los de duración de los choques (http://cnho.wordpress.com/2009/08/29/espectacular-imagende-una-molecula/). El estudio de cómo transcurre a nivel molecular una reacción (el estudio de los “mecanismos de reacción”) es una de las áreas más activas de la química.
A14. La siguiente tabla contiene los datos obtenidos con la finalidad de hallar la ley de velocidad de la reacción…. Hallad los órdenes parciales de los reactivos y escribir la ley de velocidad de esta reacción.
C.A14 Este tipo de trabajos prácticos de “papel y lápiz” son muy útiles para focalizar el trabajo de los alumnos en solo uno de los aspectos que suelen ser comunes a todas las prácticas de laboratorio (análisis de los resultados, cálculo de las imprecisiones, o elaboración de diseños experimentales, por ejemplo). Los informes completos de trabajos fundamentales requieren tiempo y atención y solemos hacer unos 3 o 4 en un curso de bachillerato.
4A modo de conclusión: la necesaria integración de los trabajos prácticosLa separación entre aprendizaje conceptual y metodológico no puede más que debilitar el aprendizaje de ambos, y contribuir a visiones deformadas de la ciencia (Fernández, et al., 2002). Sólo se justifica en la tradición, universitaria, basada en la gestión de recursos (profesores, laboratorios, comodidad,…), y en una concepción de la enseñanza como transmisión de conocimientos ya hechos. La integración de los trabajos prácticos “fundamentales” es, como hemos visto, posible y necesaria. El seguimiento de instrucciones pormenorizadas, como es habitual en los laboratorios, es poco probable que conduzca al aprendizaje con comprensión. Sin duda, es mejor hacer menos prácticas de laboratorio (en el nivel universitario) y tratar con detenimiento y profundidad sólo unas pocas, integrándolas en el desarrollo del tema correspondiente.
Sí que hay aspectos en los que el trabajo práctico es insustituible para reflexionar sobre la naturaleza del conocimientos científico: la elaboración de diseños experimentales lógicos y la contrastación con “lo que se puede hacer”, lo que exige creatividad: resolver problemas de tipo técnico, elegir los objetos (reacciones) a estudiar y los procedimientos factibles; el análisis de datos para extraer conclusiones basadas en la evidencia conseguida y en las hipótesis; el tratamiento de las imprecisiones de las medidas, … . No obstante, la consideración de los distintos tipos de actividades prácticas, expresadas en el apartado 2, a lo largo de todo un curso o más, pueden cubrir estos aspectos.
En secundaria y bachillerato, aparte de los cruciales factores relativos a la formación y compromiso de los profesores, las condiciones limitantes son los temarios sobrecargados y, por tanto, superficiales, el tiempo del que disponen los profesores para preparar las tareas y su consideración social: no es esperable (¡aunque hay casos heroicos!) que un profesor (mejor, un equipo de profesores) pueda llevar a cabo la transformación propuesta si debe impartir 30 o más horas semanales de clase para poder vivir dignamente.
Dependiendo del curso y/o de lo hecho anteriormente con los alumnos, se pueden dibujar iones de H+ (o de H3O+ con tres moléculas de agua pegadas), y de Cl–. Ahora, lo importante es centrar la atención en el modelo cinético de reacción.
Realícese la reacción con todas las medidas de seguridad adecuadas. El dióxido de azufre es tóxico. Realizar la reacción con gafas, en campana de gases o en ambiente ventilado (abanicando la boca del matraz). Las personas con asma u otros problemas respiratorios no deben realizar esta reacción. Utilícense concentraciones diluidas o trabajo en microescala.











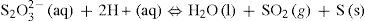
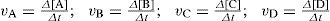
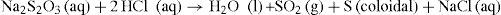
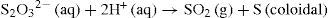
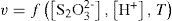
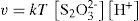
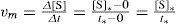
![Velocidad (1/t) de reacción en función de [Na2S2O3]. (Condiciones: Tª ambiente = 22 °C; [HCl] = 1 mol/L.) Velocidad (1/t) de reacción en función de [Na2S2O3]. (Condiciones: Tª ambiente = 22 °C; [HCl] = 1 mol/L.)](https://static.elsevier.es/multimedia/0187893X/00000023000000S1/v1_201712310522/S0187893X1730143X/v1_201712310522/es/main.assets/thumbnail/fx1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Velocidad (1/t) de reacción en función de [HCl] (representación de los alumnos). Velocidad (1/t) de reacción en función de [HCl] (representación de los alumnos).](https://static.elsevier.es/multimedia/0187893X/00000023000000S1/v1_201712310522/S0187893X1730143X/v1_201712310522/es/main.assets/thumbnail/fx2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Velocidad (1/t) de reacción en función de [HCl]. (Condiciones: [Na2SO3] = 0,05 M; Tª ambiente = 22 °C; volumen de la mezcla final = 100 mL.) Velocidad (1/t) de reacción en función de [HCl]. (Condiciones: [Na2SO3] = 0,05 M; Tª ambiente = 22 °C; volumen de la mezcla final = 100 mL.)](https://static.elsevier.es/multimedia/0187893X/00000023000000S1/v1_201712310522/S0187893X1730143X/v1_201712310522/es/main.assets/thumbnail/fx3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
