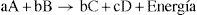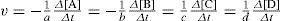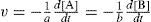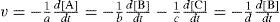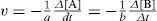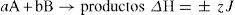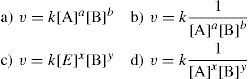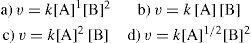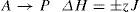It has been assumed for years that teacher's conceptions and classroom practice are related, and that in prospective teachers, the conceptions are the fruit of the many years they themselves spent at school. In this context, we study the contributions of a constructivist teaching sequence in the learning of procedures and concepts about chemical kinetics in a BA program for prechemistry teachers.
Aunque existen varias investigaciones desarrolladas en el campo de la formación de profesores de ciencias en el ámbito internacional, sobre la importancia del estudio de las concepciones que poseen profesores en formación y en ejercicio frente a ciencia, enseñanza y aprendizaje (Porlan, et al., 1996; Erazo, 1999; Gallego, Perez y Torres, 2004), aún se requieren mayores esfuerzos para la implementación de trabajos de investigación que intervengan de una manera fundamentada en la práctica de la formación de profesores de ciencias y en particular de química.
Si bien las investigaciones citadas han dejado claro que las concepciones de los profesores orientan sus prácticas de enseñanza, otros estudios sugieren (Mellado, 1996; Mellado y González, 2000), que la caracterización de dichas concepciones no es suficiente, ya que en muchas ocasiones puede diferir lo que piensa el profesor frente a ciencia, enseñanza y aprendizaje, de aquello que realmente hace en el salón de clases.
En este sentido, profesores de ciencias y en particular de química pueden hablar asertivamente del proceso de enseñaza constructivista dando a entender que poseen una concepción pertinente para orientar el trabajo con sus estudiantes; sin embargo, cuando se estudia lo que realmente hacen en el salón de clases se puede evidenciar prácticas tradicionales de enseñanza que contradicen la ideas expresadas por ellos mismos (Mellado, 1996; Maldaner, 2000).
Pese a la formación pedagógica y didáctica adquirida por profesores en su formación inicial; ellos resultan enseñando contenidos científicos (químicos), sin usar aquellos fundamentos epistemológicos, didácticos y pedagógicos que “aprendieron”, sino por el contrario, al parecer enseñan reproduciendo la forma como les enseñaron a ellos los contenidos; parece plausible hablar que una cosa es la manera como los profesores enseñan y otra cosa es lo que dicen frente a cómo enseñar.
Esa reflexión permanente de qué, cómo y cuándo enseñar es fundamental en la formación inicial de profesores de química (FIPQ), siendo necesario tener en cuenta dos elementos esenciales: el conocimiento de la disciplina objeto de enseñanza, tanto en sus aspectos sustantivos, como en sus aspectos sintácticos (Mellado y González, 2000) y la elaboración de estrategias didácticas fundamentadas en aspectos epistemológicos, pedagógicos y didácticos.
En el contexto de la FIPQ, este trabajo tiene como objetivo presentar el diseño, desarrollo y evaluación de una estrategia didáctica constructivista sobre conceptos básicos de cinética química. Para evaluar los efectos de esta estrategia se elaboró y se aplicó un instrumento tanto a un grupo de futuros profesores de química participantes de la estrategia constructivista, como a un grupo de profesores en formación que participaron de una enseñanza convencional.
2MetodologíaLa investigación se realizó en el Departamento de Química de la Universidad Pedagógica Nacional, Bogotá-Colombia, específicamente en el marco del Proyecto curricular experimental de Licenciados en Química (Departamento de Química-UPN, 2000). Dicho proyecto tiene como preocupación central la formación de profesores en química para los diferentes niveles del sistema educativo colombiano.
La investigación se desarrolló con futuros profesores de química participantes de la materia Teorías Químicas III, ofrecida en el ciclo de fundamentación del proyecto. El estudio fue llevado a cabo con dos grupos de estudiantes del mismo semestre, uno de ellos conformado por 20 estudiantes, denominado grupo participante de la estrategia constructivista (gpec), y otro grupo conformado por 19 estudiantes que no participaron de la estrategia constructivista (gnpe).
La metodología cualitativa se desarrolló en dos partes interdependientes. En la primera se estructuró e implementó la estrategia didáctica con el gpec y en la segunda parte se evaluaron las contribuciones de esta estrategia en el aprendizaje de conceptos y procedimientos de cinética química a través de un instrumento con ítems conceptuales sobre cinética química aplicado tanto al gpec como al gnpec.
2.1Caracterización del grupo participante de la estrategia constructivista (gpec) y del profesor enseñanteEl gpec había estudiado previamente, en el espacio académico de Teorías Químicas II, conceptos básicos de termodinámica química y una pequeña introducción a la cinética química que comprendía establecer diferencias entre cinética y termodinámica, sin haber trabajado formalmente los conceptos básicos de cinética química.
Antes de implementar la estrategia didáctica se caracterizaron algunas ideas previas de los estudiantes sobre aspectos básicos de cinética química, a través de las siguientes preguntas: 1) ¿Qué significado tiene para usted la rapidez de reacción?; 2) ¿Qué factores influyen en la rapidez de reacción?, y 3) ¿Cómo podría determinar la rapidez de reacción?
Frente a la primera pregunta, la mayoría de estudiantes respondieron que la rapidez de reacción se relacionaba con la variación de la concentración de productos y reactivos, y otros pocos estudiantes la consideraron como la rapidez con que se forman nuevos productos teniendo en cuenta las propiedades y características de cada sustancia.
Con respecto a la segunda pregunta la mayoría de estudiantes indicaron que la rapidez de reacción se afecta por “factores externos como tiempo, volumen, temperatura, presión e indicadores”; otro número significativo de estudiantes consideraron que se afecta por “factores internos como concentración, estado de la materia, el tipo de enlace, las fuerzas intermoleculares y catalizadores”.
Frente a la tercera pregunta un bueno número de estudiantes consideron que la rapidez de reacción podría determinarse “midiendo el tiempo”o a través de la “estequiometría”.Un número inferior de estudiantes consideraron que la rapidez podría medirse por la “naturaleza de los reactivos, condiciones de presión y temperatura o con la molaridad en función del tiempo”.
Las ideas previas identificadas en los tres cuestionamientos fueron construidas a partir de los procesos de enseñanza y aprendizaje vivenciados por los estudiantes durante el año y medio de permanencia en el programa de Licenciatura en química, dado que ellos no estudiaron cinética en la secundaría y el tema es inusual en espacios no escolares.
Las respuestas obtenidas pueden interpretarsen siguiendo a Carrascosa (2005) como ideas asociadas al pesamiento cotidiano de los estudiantes relacionado con cierta tendencia a contestar rápidamente sin analizar los cuestionamientos.
Con respecto al profesor enseñante de este grupo (autor de este trabajo), contaba con formación plena en Licenciatura en Química y se encontraba desarrollando su investigación de maestría de Docencia de la Química sobre las contribuciones de una estrategia de enseñanza constructivista en el aprendizaje de conceptos de cinética química en futuros profesores de química.
2.2Elaboración e implementación de la estrategia didácticaLa estrategia didáctica fue planeada, desarrollada y evaluada en conformidad con el construvismo didáctico (Coll et al., 2000; Gil et al., 1999; Marin et al., 1999), siguiendo la tesis que los sujetos construyen conocimientos en determinados contextos sociales y culturales, de acuerdo con complejos y continuos cambios; así, el conocimiento no es mera información trasmitida pasivamente al sujeto.
La estrategia fue estructurada a partir de actividades de iniciación, desarrollo y evaluación (Erazo, 1995; Campanario, 1999; Sanmartí, 2000). Las actividades de iniciación estuvieron constituidas tanto por preguntas de discusión que buscaron problematizar el conocimiento, como por el abordaje conceptual y metodológico de problemas orientados a la cuantificación de la rapidez de reacción, exigiendo de los futuros profesores el desarrollo de consultas, planteamiento de hipótesis y diseño de una metodología experimental.
En las actividades de desarrollo se trabajaron textos, construidos por el autor, sobre la evolución histórica de los conceptos de cinética química, además se propusieron ejemplos y actividades concretas para la construcción de conceptos fundamentales de este tema. Las actividades de finalización abarcaron ejercicios de lápiz y papel y análisis de situaciones problema.
Los tres tipos de actividades descritos se organizaron en un módulo de trabajo del profesor de química en formación inicial (pqfi) que puede consultarse en Martínez (2006), estando conformado por cuatro fases. Estas fases fueron desarrolladas durante ocho sesiones de trabajo, organizadas en dos encuentros para cada fase; cada una de estas sesiones contó con un tiempo de aproximadamente tres horas para su desarrollo, los aspectos más importantes que se exponen de las cuatro fases se constituyeron a partir de registros consolidados en portafolios realizados por los estudiantes durante todas las sesiones.
En conformidad con los registros constituidos en los portafolios de los estudiantes en la primera fase se realizó un estudio individual y grupal de los conceptos básicos de cinética química, comprendiendo conceptos de rapidez promedio e instantánea de reacción; además, se discutieron aspectos estequiométricos involucrados en cinética química. La segunda fase se centró en el estudio de las ecuaciones de rapidez, diferenciando el tratamiento para la ecuación de rapidez diferencial e integral de reacción; en cada caso se abordó el significado de orden de reacción y la constante específica de rapidez; para finalizar esta fase se propuso un trabajo experimental para determinar la rapidez de reacción de la descomposición de H2O2. Este trabajo fue orientado a través de un microproyecto de investigación en donde se pidió a los estudiantes construir un marco teórico y un diseño experimental viable que les permitiera medir la rapidez de descomposición del peróxido de hidrógeno.
En la tercera fase se trabajó el modelo de colisiones y el modelo de estado de transición principalmente mediante la presentación de tres vídeos didácticos que fueron elaborados para favorecer la construcción de representaciones simbólicas de la rapidez de reacción submicroscopicamente. Para esto se simuló el proceso de colisiones y la formación de un compuesto intermediario.
Para producir los vídeos1 se tuvieron en cuenta aspectos didácticos, funcionales y técnicos. En el primer vídeo se simuló la descomposición química del peróxido de hidrógeno, teniendo en cuenta que los estudiantes habían realizado micro-proyectos de investigación para medir la rapidez de descomposición de esta sustancia y que este trabajo había sido significativo para ellos. En el vídeo se ilustraron los conceptos de rapidez promedio e instantánea de reacción, ecuación diferencial e integral de rapidez y orden de reacción relacionando aspectos macroscópicos y microscópicos de la cinética abarcada en estos conceptos.
En el segundo vídeo se simuló la reacción entre el hidrógeno y el nitrógeno para producir amoniaco como un ejemplo para ilustrar el modelo de colisiones y en el último vídeo se presentó la formación de clorometano para exponer aspectos básicos de la teoría del estado de transición.
Los vídeos fueron sometidos a juicio de expertos antes de su presentación, de acuerdo con un formato de evaluación adaptado de Marqués (2001) en donde se valoraron aspectos funcionales, técnicos, estéticos, expresivos, pedagógicos y didácticos, obteniendo una valoración buena de los mismos. Por último, en la cuarta fase se estudió la catálisis química, tanto homogénea como heterogénea.
3Evaluación de la estrategia de enseñanza constructivistaPara la evaluación de la estrategia implementada se consideró pertinente diseñar un cuestionario con opciones únicas y algunos ítems con opción múltiple, la construcción de este tipo de instrumento fue hecha en términos de la revisión realizada de la literatura en investigación en enseñanza de la química. Instrumentos de esta naturaleza para evaluar ideas sobre el tema equilibrio químico y algunos aspectos de cinética química en estudiantes universitarios pueden consultarse en Banerjee (1991); Quílez y Solaz (1995); Quílez (1998) y Raviolo et al. (2001). Otra razón que justificó el uso de este tipo de instrumento, fue la pretensión de comparar aprendizajes del gpec con un gnpec.
Para el diseño del instrumento usado para evaluar la estrategia (ver anexo 1) se tuvieron en cuenta cuatro categorías: C1) comprensión gráfica del concepto de rapidez de reacción (ítems 1 y 2); C2) diferenciación y representación matemática del concepto rapidez de reacción (ítems 3, 4 y 5); C3) compresión de ecuaciones de rapidez (ítems 6, 7, 8, 9, 10, 11 y 12) y C4) factores que afectan la rapidez de la reacción (ítems 13, 14 y 15). De los 15 ítems comprendidos en el instrumento, cuatro de ellos poseen dos opciones correctas (ítems 3, 4, 5 y 14).
El instrumento fue validado con una prueba piloto con 10 estudiantes de cuarto semestre del programa de Licenciatura en química, que previamente habían estudiado el tema de cinética química. Los resultados de esta prueba permitieron ajustar algunos ítems del instrumento y determinar los tiempos apropiados para su aplicación; además, fue sometido a evaluación de dos profesores especialistas en la materia.
El instrumento fue aplicado al grupo que participó de la estrategia constructivista (gpec) y a un grupo voluntario de 19 futuros profesores de química que estudiaban la misma materia bajo la orientación de otro profesor (gnpec).
3.1Caracterización del grupo no participante de la estrategia constructivista (gnpec) y el profesor enseñante de este grupo.Para la caracterización de este grupo se pidió a estos estudiantes que respondieran las siguientes preguntas que permitirían conocer los contenidos trabajados durante la materia, sus percepciones frente a las estrategias usadas por el profesor que orientó el aprendizaje de los mismos y las dificultades que ellos tuvieron para aprender: pregunta 1 (P1) ¿qué aspectos o conceptos estudió de cinética química?; pregunta 2 (P2) describa brevemente ¿cómo el profesor orientó la enseñanza del tema cinética?; pregunta 3 (P3) ¿qué aprendió de cinética química?; pregunta 4 (P4) ¿explique cuáles fueron los conceptos que se le dificultaron aprender de cinética química y por qué?
P1, P2, P3 fueron respondidas por 17 estudiantes y P4 por 16 estudintes respectivamente, de acuerdo con las respuestas obtenidas frente a P1 se estableció que la mayoría indicaron haber estudiado los siguientes conceptos: rapidez de reacción, factores que afectan la rapidez de la reacción y orden de reacción. Otro número menor de respuestas muestran que estudiaron los conceptos de vida media, constante de rapidez k, ecuación de rapidez y ecuación de Arrhenius.
De las 17 respuestas emitidas por los pqfi frente a P2, 11 describen la enseñanza del profesor sin realizar un juicio valorativo frente al proceso desarrollado por el mismo; es decir, que no indican aceptación o rechazo frente a las estrategias usadas en clase. En este sentido las respuestas indicaban de diferentes maneras que el docente explicaba (socializaba, daba cátedra y mostraba) los conceptos o temas y después de esto pedía la realización de ejercicios, problemas, consultas en casa o la realización de un laboratorio.
Las seis respuestas restantes expresaban claramente un juicio valorativo de aceptación y reconocimiento de la enseñanza desarrollada por el profesor, indicando que éste ofreció explicaciones claras, rápidas, puntuales, perfectas y fluidas. Tan sólo una de estas respuestas manifiesta el uso de ejercicios y problemas en las actividades de la materia.
En cuanto a P3 se establecieron 10 respuestas que indicaban el aprendizaje de varios conceptos de cinética química rapidez de reacción, orden de reacción, ecuaciones de rapidez, vida media, uso de gráficas y factores que influyen en la rapidez de la reacción. Cuatro respuestas expresan aprendizajes de procedimientos tales como: determinación de constantes de rapidez, cálculo de vida media, concentraciones, rapidez media e instantánea. Tres respuestas indicaron haber aprendido relaciones de la cinética con su entorno o cotidianidad y otras dos expresan haber aprendido a valorar la importancia que tiene el estudio del tema.2
Frente a las dificultades expresadas en las respuestas de los estudiantes en P4 se determinaron ocho de éstas asociadas a procedimientos como determinación del orden de la reacción, interpretación de gráficas, determinación de la rapidez de una reacción, cálculo de constantes y establecimiento de ecuaciones. En cuanto a dificultades de conceptos se encontraron cuatro respuestas que expresan problemas en la comprensión de formulas, órdenes de reacción, rapidez de reacción y energía de activación. Por último tres respuestas indican no haber dificultades y una expresa dificultad en relacionar los conceptos aprendidos con la vida cotidiana.
Además de caracterizar contenidos, tipo de enseñanza y dificultades de aprendizaje sobre el tema cinética química, según la opinión de los estudiantes, se estructuraron cuatro preguntas para el profesor responsable de la materia,3 con el propósito de comparar sus apreciaciones con las ofrecidas por los estudiantes; de esta forma se concretaría la caracterización del qué y cómo fueron enseñados y evaluados los conceptos de cinética química del gnpec. Así podría evaluarse las contribuciones de esta enseñanza en el aprendizaje de conceptos y procedimientos tanto en este grupo como en el gpec, de acuerdo con metodologías de enseñanza diferentes.
Frente a la respuesta obtenida del profesor sobre ¿cuáles fueron los conceptos de cinética química que enseñó? Indicó haber enseñado mecanismos, avance de reacción, cinética (método integral orden 1 y 2 y método diferencial), cinética enzimática (mecanismo de Michaelis-Menten), ecuación de Arrhenius y catalizadores.
Para la pregunta ¿de qué manera enseñó los conceptos de cinética química?, el docente señaló que fue de forma procedimental, para que a partir de ejercicios manejaran los conceptos y los pusieran en un contexto práctico.
En cuanto al cuestionamiento ¿de qué forma evaluó el aprendizaje de los conceptos de cinética química enseñados?, el profesor indicó que básicamente utilizó la parte cualitativa de cinética, además de pedir a los estudiantes argumentar con artículos de revistas internacionales acerca del tema y desarrollo de laboratorios con base en un artículo.
Por último, el docente frente a la pregunta ¿cuáles cree fueron las principales dificultades que tuvieron los estudiantes para aprender los conceptos fundamentales de cinética química?, respondió: “los estudiantes tienen un abismo entre la teoría y la práctica y si a esto le añadimos falacias en la parte teórica el problema se agudiza más”.
3.2Análisis de la caracterización del grupo no participante de la estrategia constructivista (gnpec) y de su profesor enseñanteDe los resultados constituidos a partir de las preguntas realizadas a estudiantes pertenecientes al gnpec y del profesor responsable del mismo, podemos decir, en primer lugar, que fueron estudiados los conceptos básicos de cinética química que también fueron trabajados en el gpec, lo que permitía evaluar los aprendizajes conceptuales de los dos grupos de estudiantes expuestos a estrategias de enseñanza diferentes.
En segundo lugar, las respuestas del profesor y estudiantes del gnpec evidenciaron algunas características de una enseñanza técnica (Fernández y Elortegui, 1996) dado que el padrón seguido en las clases parece obedecer a una racionalidad instrumental (Carr y Kemmis, 1988) en la medida en que el profesor ofrece explicaciones de la teoría de diversas formas para luego orientar la realización de ejercicios o aplicaciones prácticas. En esta metodología de trabajo predominan las explicaciones del profesor acompañada de una participación del estudiante para colocar en práctica lo que fue enseñado sea a través de consultas, aplicaciones a la vida cotidiana o elaboración de laboratorios; como fue indicado por los estudiantes, sin existir una problematización tanto de las ideas previas de los estudiantes como de la naturaleza histórica y epistemológica del contenido científico objeto de enseñanza.
Una enseñanza técnica no ofrece mayores problemas en los estudiantes, como se evidencia en las respuestas que fueron expuestas, ya que su lógica de construcción está fundamentada en la eficacia de alcanzar los objetivos propuestos reflejados en aprendizaje de los contenidos explicados por el profesor; asimismo, genera una cultura de facilidad y superficialismo donde se cree que no hay mayores dificultades para aprender determinados contenidos. Esto se evidencia en las respuestas de los estudiantes que en una buena parte consideran no haber enfrentado mayores dificultades en la apropiación de los conceptos de cinética química trabajados en clase, sin embargo, en este estudio veremos que estos estudiantes al enfrentar situaciones que buscan evaluar sus aprendizajes conceptuales presentan apuros.
3.3Resultados y análisis de aplicar el instrumento usado para evaluar la estrategiaUna vez analizado el tipo de enseñanza vivenciado por el gnpec y teniendo en cuenta la enseñanza constructivista desarrollada en el gpec, se aplicó a los dos grupos el instrumento anexo a este artículo, pretendiendo a través de éste evaluar los efectos de los dos tipos de enseñanza en términos de situaciones conceptuales y procedimentales expuestas en los 15 ítems del mismo.
Los resultados obtenidos se muestran en la figura 1, observando que el gpec obtiene mejores desempeños frente a los ítems propuestos en el instrumento que el gnpec, especialmente se evidencia un rendimiento bajo, de este segundo grupo, en los ítems 8, 11 y 12 correspondientes a aspectos conceptuales y procedimentales relacionados con el concepto orden de reacción.
Teniendo en cuenta que existe un mayor porcentaje de profesores de química en formación inicial (pqfi) del gpec que lograron un mejor desempeño en 14 ítems del instrumento en relación con aquellos que participaron de una enseñanza con características técnicas, evidenciase la pertinencia de este tipo de enseñanza, para el abordaje de cinética química. Sin embargo, no puede decirse que es la solución a los problemas de enseñanza de aspectos conceptuales y procedimentales de aspectos relacionados con este contenido; por el contrario, a pesar de los avances constituidos en esta perspectiva de enseñanza hay que señalar que el aprendizaje de contenidos químicos encierra una verdadera complejidad y dificultades en los estudiantes que de hecho puede evidenciarse en los porcentajes obtenidos en el gráfico 1 para el gpec.
Si bien la estrategia de enseñanza constructivista desarrollada contenía actividades diversificadas, incorporando los aportes de la investigación en didáctica de la química,4 es claro que la comprensión de conceptos químicos abarca dificultades en los estudiantes que deben continuar siendo objeto de investigación en la enseñanza desarrollada en las diferentes materias que estudian los pqfi, dado que es en estos espacios que los profesores van adoptando un determinado modelo de enseñanza que después van a desenvolver.
Observando la figura 1 podemos ver que pqfi pertenecientes al gpec, identifican adecuadamente el sistema cerrado como condición necesaria para definir la rapidez de reacción (ítem 1), además, consideran que a medida que la reacción avanza en el tiempo, la concentración de reactivos disminuye mientras que la concentración de productos aumenta (ítem 2). No obstante, se observa que un 10% de los pqfi piensan que al avanzar la reacción tanto la concentración de reactivos y productos disminuye.
Frente a la diferenciación y representación matemática del concepto rapidez media e instantánea de reacción (C2) se encontró un considerable porcentaje (40%) de respuestas incorrectas en los ítems 3 y 5, lo que evidencia dificultades en el aprendizaje de este tópico.
Con respecto al significado que tiene la ecuación de rapidez de reacción, se observa una importante comprensión del concepto de orden de reacción dado que sólo un 10% y 5% de pqfi responden incorrectamente los ítems 6 y 7; sin embargo, se aprecia la evidente dificultad procedimental asociada a este concepto dado que se reporta un 45% y 15% de estudiantes que no logran resolver los ítems 8 y 9. Esta dificultad se evidencia en menor grado en los ítems 9, 10, 11 y 12 cuando los estudiantes resuelven situaciones que implican sólo interpretación de gráficos para determinar el orden de reacción.
La dificultad para comprender el concepto de orden de reacción por parte de los pqfi pertenecientes al gnpe es evidente dado el alto porcentaje de respuestas incorrectas identificadas en los ítems 6 y 7, donde los estudiantes responden incorrectamente evidenciando confusión entre orden de reacción y coeficientes estequiométricos de la ecuación química. Pese a que estos estudiantes fueron expuestos al desarrollo de varios ejercicios al trabajar el tema cinética química como fue mostrado en sus respuestas, un 95% y 58% de ellos no logran resolver correctamente los ítems 8 y 9, lo que apoya la idea de que existe una mayor dificultad en aspectos procedimentales que en conceptuales en situaciones de aprendizaje asociadas a la ecuación de rapidez. Aunque estos dos aspectos se encuentren relacionados, se podría decir que no es suficiente con una comprensión del concepto de ecuación de rapidez, requiriéndose de actividades de enseñanza que articulen la apropiación de conceptos y procedimientos.
Las dificultades de los pqfi pertenecientes al gnpe en relación con interpretación de gráficos para determinar el orden de un reacción es evidente en conformidad con el significativo porcentaje de ellos que no resuelven correctamente los ítems 10, 11 y 12.
Sobre los factores que afectan la rapidez de reacción (C4) se encontró que un buen porcentaje de pqfi pertenecientes al gpec establece relaciones adecuadas entre temperatura, concentración y variación de la rapidez de reacción. Sin embargo, un porcentaje (20%) considerable de pqfi no identifican los factores cinéticos asociados a la formación de moléculas (ítem 13), la dificultad para identificar estos factores también es registrada en los pqfi del gnpec registrando un 58% de respuestas incorrectas, además de evidenciar significativas dificultades para identificar la influencia de la concentración en el aumento de la rapidez de reacción.
4Consideraciones finalesLa fipq comprendida desde el análisis de las prácticas del docente, requiere del desarrollo de estrategias didácticas que favorezcan un mejor aprendizaje de los conceptos estructurantes de la química, teniendo en cuenta que la formación en química que reciben los futuros profesores puede constituirse en un modelo de referencia de su actividad profesional, en este sentido la calidad de esta formación inicial se constituye en un elemento fundamental.
Así parece pertinente optimizar la fipq a través del desarrollo de diferentes estrategias de enseñanza que favorezcan mejores aprendizajes conceptuales y procedimentales de contenidos científicos, lo que exige un riguroso conocimiento tanto de los contenidos objeto de enseñanza, como de las dificultades de aprendizaje que pueden presentar los pqfi frente a dichos contenidos, sin duda mejorar la comprensión de estos contenidos no es una tarea fácil teniendo en cuenta la complejidad de los conceptos y procedimientos propios de la química.
Estrategias constructivistas para la enseñanza de conceptos y procedimientos químicos exigen una permanente reflexión del profesor sobre la naturaleza histórica, psicológica y didáctica del contenido científico objeto de enseñanza, fruto de esta reflexión se hace necesario incorporar otras herramientas a la enseñanza, como el uso de la nuevas tecnologías de la información y la comunicación (por ejemplo uso de vídeos didácticos por computador, entre otros) que puedan favorecer una mejor comprensión de conceptos químicos de difícil visualización por su naturaleza abstracta. Además de profundizar en las constribuciones de la historia y filosofia de la química para compreender la construcción de modelos en cinética química (Justi y Gilbert, 1999a).
En conformidad con los datos constituidos, a lo largo de esta investigación; una estrategia constructivista para la enseñanza y aprendizaje de conceptos de cinética química, resulta ser más favorable para la apropiación de conceptos referidos a esta temática, que una enseñanza convencional con algunas características técnicas, sin embargo, en ambos tipos de ense ñanza se registran mayores dificultades por parte de los pqfi en la apropiación de procedimientos que conceptos en cuanto a los temas que fueron estudiados de cinética química.
Las dificultades detectadas en cuanto a la apropiación de procedimientos, en varios casos se relacionan a problemas de razonamiento matemático articulado con la comprensión de conceptos químicos asociados a un determinado procedimiento. Esto fue evidenciado, por ejemplo, en la determinación del orden de reacción.
Como han registrado varios trabajos (Treagust, Chittleborouhg y Mamiala, 2003; Garnett, Garnett y Hackling, 1995; Cakmakci, Leach y Donnelly, 2006) la comprensión abstracta y compleja de la química no es una tarea fácil para el estudiante, dadas las dificultades en la comprensión de los niveles de representación macroscópica y submicroscópica usados en química.
Conviene continuar investigando sobre abordajes didácticos actuales para la enseñanza y aprendizaje de conceptos de cinética química, como los referentes al uso de modelos, analogías y experimentación (Justi y Gilbert, 1999b; Justi, 2002), como un camino para superar las dificultades detectadas.
La siguiente ecuación química representa la reacción de dos sustancias denominadas A y B para producir C y D
De acuerdo con esta representación responda del numeral 1 al 3, de acuerdo con la ecuación 1.
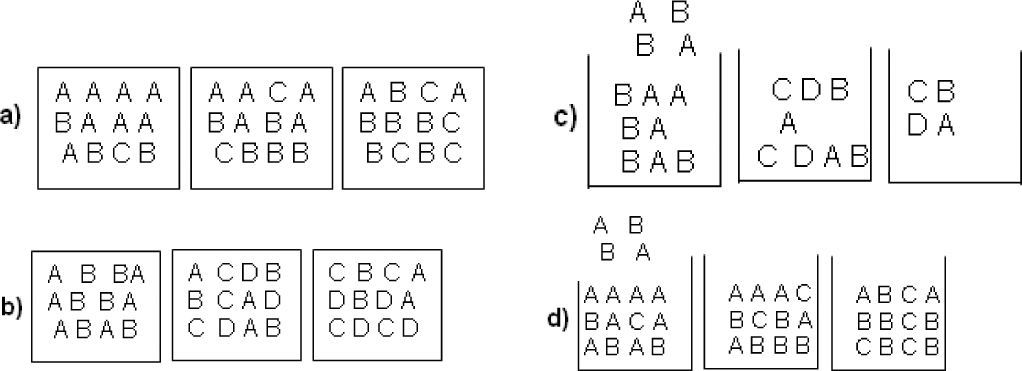
1. La figura que mejor representa la rapidez de reacción es:
2. La gráfica que mejor representa la rapidez de reacción es:
3. La rapidez de la reacción puede ser expresada como (en este ítem puede seleccionar más de una opción):
- a)
Variación de concentración de A y B por unidad de tiempo.
- b)
Variación de concentración de C y D por unidad de tiempo.
- c)
Variación de concentración sólo de A y sólo de B, por unidad de tiempo.
- d)
Todas las anteriores.
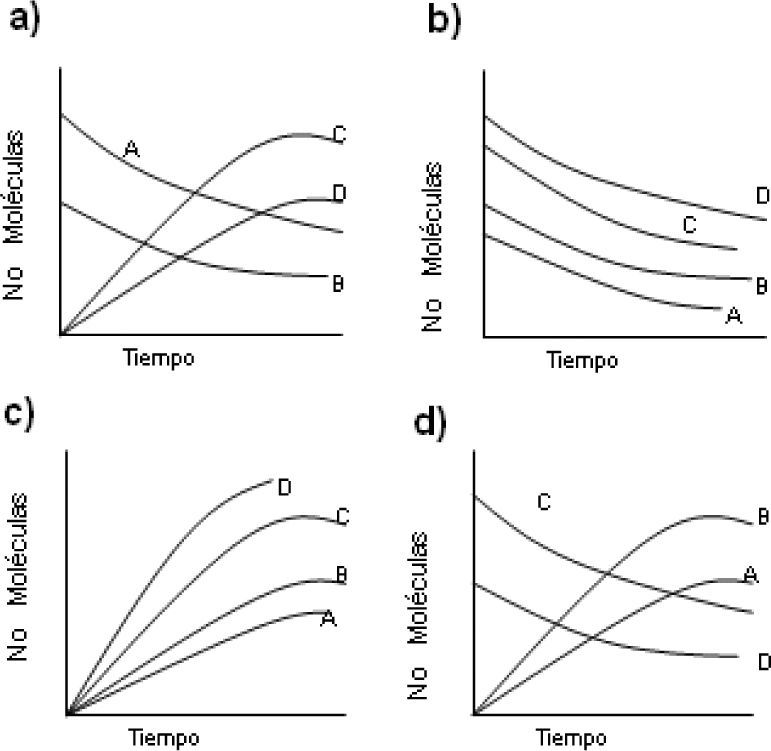
4. En un trabajo experimental se determinó el cambio de concentración de A, B, C y D por unidad de tiempo, a una temperatura determinada. Los datos obtenidos se grafica ron en la figura 1. Teniendo en cuenta esta gráfica puede decirse que la mejor manera de expresar la rapidez de reacción es (en este ítem puede seleccionar más de una opción):
- a)
Cambio de concentración de cualquier sustancia por un intervalo de tiempo, es decir, que:
- b)
Cambio de concentración de cualquier sustancia por un intervalo de tiempo, es decir, que:
- c)
Tangentes a cada curva, con las cuales puede hallarse la rapidez instantánea de reacción.
- d)
Tangentes a cada curva, con las cuales puede hallarse la rapidez media de reacción.
5. Si sólo se tiene en cuenta la reacción de A y B para formar C y D, puede expresarse la rapidez de reacción como (en este ítem puede seleccionar más de una opción):
- a)
Tangentes a las curvas de A y B, la cuales definen la rapidez de reacción para un tiempo específico. Usualmente puede representarse esta rapidez como:
- b)
Tangentes a las curvas de A, B, C y D, las cuales definen la rapidez de reacción para un tiempo específico. Usualmente puede representarse esta rapidez como:
- c)
Tangentes a la curva de A y B, las cuales definen la rapidez de reacción para un tiempo específico. Usualmente puede representarse esta rapidez como:
- d)
Tangentes a la curva de A y B, las cuales definen la rapidez de reacción para un tiempo específico. Usualmente puede representarse esta rapidez como:
La siguiente ecuación química, representa la reacción de dos sustancias A y B para dar productos:
De acuerdo con esta representación responda del numeral 6 al 9, seleccionando el ítem adecuado.
6. En trabajos experimentales se ha evidenciado que al aumentar la concentración de A y B la rapidez de reacción aumenta, por lo cual, puede decirse que la mejor representación para la rapidez de reacción es:
7. Lo más probable es que el orden total de la reacción sea:
8. En la tabla 1 se muestran concentraciones y velocidades iniciales de A y B, en tres experimentos de laboratorio, teniendo en cuenta que 1/2A + 2B→PΔH=±zJ y la información de la tabla; se puede decir que, la ecuación de velocidad para la reacción es:
9.55Esta situación es adaptada de un problema conceptual, planteado por: Masterton, W.L.; Hurley, C.N. Química: principios y reacciones. España: Thomson. 2003
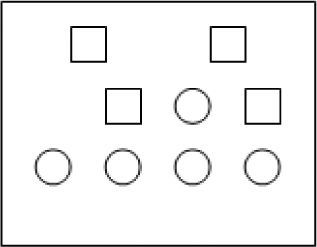
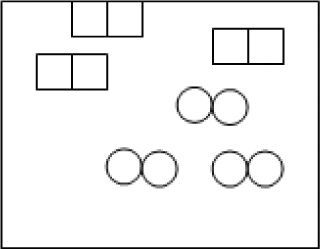
Suponga que el orden de reacción para A es dos y para B es uno. Considere que el recipiente de la figura 2 presenta un volumen de 1 litro y contiene cuadrados y círculos; donde cada cuadrado representa 1 mol de A y cada círculo representa 1 mol de B, de acuerdo con esto, puede decirse que la rapidez de reacción en función de k es:La siguiente ecuación química, representa la reacción de una sustancia denominada A para producir productos.
De acuerdo con esta representación responda del numeral 10 al 12; seleccionando el ítem adecuado.
10. Para determinar la concentración de A en un determinado tiempo, se requiere:
- a)
Una ecuación de rapidez para, un orden específico de reacción (1, ½, 2…n); que relacione la concentración inicial de A para un tiempo cero, con la concentración de A para un tiempo específico.
- b)
Basta con saber la ecuación de rapidez.
- c)
Basta con saber que v = k[A].
- d)
Todas las anteriores.
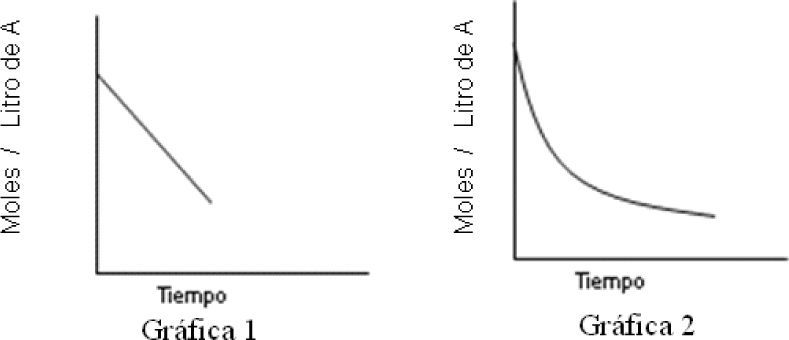
11. A partir de datos experimentales, se construyeron las siguientes gráficas, de las cuales, puede decirse que el orden de reacción:
- a)
Para el caso de la grafica 1 la reacción es de orden cero y para el caso de la gráfica 2 no puede determinarse el orden.
- b)
Para el caso de la grafica 1 no puede determinarse el orden y para el caso de la gráfica 2 la reacción es de orden cero.
- c)
Para el caso de la de la grafica 1 la reacción es de orden uno y para el caso de la gráfica 2 la reacción es de orden 1.
- d)
A partir de ninguna gráfica puede determinarse el orden de la reacción.
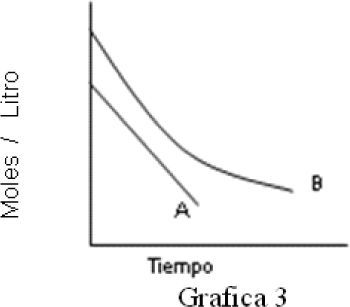
12. A partir de resultados experimentales se graficó la concentración de A y B en función del tiempo, como puede apreciarse en la grafica 3. De acuerdo con la figura puede decirse que los órdenes de reacción de las especies A y B son:
Considere el recipiente que se presenta en la figura 3 con un volumen de 1 litro y una temperatura x. Suponga que los cuadrados representan 1 mol de moléculas diatómicas de una sustancia A y los círculos representan 1 mol de moléculas biatómicas de una sustancia B. De acuerdo con esta representación resuelva del punto 13 al punto 15.
13. ¿Qué se requiere para que dichas moléculas puedan formar productos?
- a)
Se requiere una energía inicial que permita que el proceso pueda empezar, presentándose la formación especies activas de A y B que chocan frecuentemente, con una orientación adecuada que posibilita la formación de nuevos enlaces y por lo tanto de nuevas moléculas.
- b)
Choques con adecuada orientación que puedan romper los enlaces químicos presentes en las moléculas A y B y a su vez, puedan contribuir a la formación de nuevos enlaces.
- c)
Choques frecuentes que permitan romper los enlaces químicos presentes en las moléculas A y B y a su vez, puedan contribuir a la formación de nuevos enlaces.
- d)
Ninguna de las anteriores.
14. En el recipiente de la situación anterior, al aumentar la temperatura, lo más probable que puede suceder es (en este ítem puede seleccionar más de una opción):
- a)
Que la rapidez de la reacción aumente, por el incremento de choques entre las formas activas de A y B.
- b)
Que la rapidez de reacción aumente, debido al incremento de la energía cinética de las moléculas, lo cual produce más choques entre las formas activas de A y B.
- c)
Que la rapidez de la reacción disminuya, por el incremento de choques entre A y B.
- d)
Que la rapidez de reacción disminuya, debido al incremento de la energía cinética de las moléculas, lo cual deviene en más choques entre A y B.
15. Si se aumenta el número de moléculas de A y B, permaneciendo constante la temperatura, es probable que:
- a)
La rapidez de la reacción aumente, por el incremento de choques entre A y B.
- b)
Que la rapidez de reacción aumente, debido al incremento de la energía cinética de las moléculas.
- c)
Que la rapidez de la reacción disminuya, por el incremento de choques entre A y B.
- d)
Que la rapidez de reacción disminuya, debido al incremento de la energía cinética de las moléculas.
Los tres vídeos que fueron construidos durante la investigación están organizados en un VCD adjunto al trabajo de maestría de Martínez (2006).
Al sumar el número de respuestas para esta pregunta contamos 19 respuestas, correspondientes a 17 PQFI. Esto se debe a que una de las respuestas hace relación tanto el aprendizaje de un concepto determinado como las relaciones de éste con su cotidianidad y otra indica tanto el aprendizaje de un procedimiento como su respectiva relación con la vida diaria.
Este profesor contaba con formación plena en Química y maestría en Química.
Problematización tanto de las ideas previas de los estudiantes como de la naturaleza histórica y epistemológica de la cinética química a través de uso de situaciones problemas, prácticas de laboratorio como microproyecto de investigación y uso de vídeos didácticos.
Esta situación es adaptada de un problema conceptual, planteado por: Masterton, W.L.; Hurley, C.N. Química: principios y reacciones. España: Thomson. 2003