This paper describes an alternative approach to the teaching of topics related to atomic and molecular structure of matter at the college level. Traditional chemistry courses in this area focus on describing what we know about the basic characteristics and properties of atoms and molecules. We claim that a better educational approach would be to teach students how to think using submicroscopic models of matter to solve relevant problems. A concrete example of the proposed curricular approach is presented in the paper.
Para comprender las propiedades químicas de la materia parece fundamental entender su estructura atómica y molecular, razón por la cual este tema se considera imprescindible en los cursos introductorios a nivel universitario en diversas partes del mundo (Lloyd, 1992). Así, los planes y programas de estudio contemplan, entre otros, el aprendizaje de algunos conceptos e ideas básicas como son la ecuación de Schrödinger, la cuantización de la energía, los orbitales atómicos, la configuración electrónica y la formación de orbitales híbridos y moleculares. Sin embargo, en los cursos que impartimos es común presentar estas ideas y conceptos desconectados de su utilidad y de su posible aplicación práctica. Adicionalmente, es tradicional describir los diversos modelos de la materia a nivel submicroscópico sin establecer conexiones claras con la evidencia experimental en la que se sustentan, y sin reflexionar sobre el proceso de interpretación y argumentación a través del cual se generan (Gillespie, Spencer y Moog, 1996).
Desde la perspectiva de la disciplina puede resultar conveniente la idea de exponer el conocimiento acumulado en los últimos 150 años sobre la estructura atómica y molecular de la materia apelando entonces a su desarrollo histórico (Cruz-Garritz, Chamizo y Garritz, 1986). O bien, ante la presión de los apretados currículos mostrar algunos datos aislados de forma descontextualizada, con la esperanza de que los estudiantes construirán el contexto cuando lo necesiten en sus cursos avanzados de química orgánica, analítica, bioquímica o fisicoquímica. Los profesores frecuentemente pensamos que la información que le damos a los alumnos será utilizada más adelante cuando podrán darle algún sentido; sin embargo, desde el punto de vista educativo hay evidencia que indica que esta manera de organizar la enseñanza de la química no promueve el aprendizaje significativo y es altamente desmotivadora para un porcentaje considerable de los estudiantes (Gilbert, 2006). Es por ello que en este artículo quisiéramos reflexionar sobre una manera alternativa de conceptualizar y contextualizar la enseñanza de los temas centrales sobre estructura de la materia. En particular, quisiéramos resaltar las ventajas potenciales de un enfoque curricular centrado en aprender a contestar preguntas y analizar evidencia experimental para generar modelos. No es nuestra intención presentar un programa alternativo detallado para un curso sobre estos temas, sino ilustrar con algunos ejemplos como se podría modificar el enfoque educativo.
Un enfoque con base en preguntasTradicionalmente las disciplinas científicas se enseñan guiadas por una filosofía educativa que asume que la meta central de la enseñanza es comunicar a los estudiantes el conocimiento científico acumulado a través de los años. Hay debates continuos sobre cuáles son los conceptos o ideas centrales que debemos enseñar, pero el énfasis constantemente está en la identificación de aquello “que sabemos”, buscando seleccionar las cosas que pensamos le serán de utilidad a los estudiantes en su vida personal, académica o profesional. Es así que acordamos incluir, o no, la discusión sobre orbitales moleculares en un curso de química introductorio, y decidimos, o no, utilizar parte del tiempo para describir lo que hemos aprendido sobre la relación entre el uso de clorofluorocarbonos y el adelgazamiento de la capa de ozono.
Una manera alternativa de seleccionar y organizar contenidos se basa en enfocarse menos en comunicar “lo que sabemos” y más en reflexionar sobre los conceptos e ideas que nos permitan enseñar “cómo pensamos”. Esto es, diseñar un currículum que ayude a los estudiantes a usar las teorías, los modelos y las formas de experimentar en química para poder predecir y explicar las propiedades y el comportamiento de algunos sistemas que se consideren relevantes (Talanquer, 2009; Talanquer & Pollard, 2010). Por ejemplo, más que interesarnos en que los estudiantes entiendan con todo detalle el fenómeno de cuantización de la energía en el modelo de Bohr para el átomo de hidrógeno, quizá podríamos invertir más esfuerzo en ayudarle a entender cómo el modelo de cuantización energética en átomos y moléculas nos permite hacer predicciones y generar explicaciones sobre el comportamiento de los gases invernadero en la atmósfera, o desarrollar estrategias experimentales para detectar la presencia de metales pesados en la sangre (Gilbert, 2006). Cuando el énfasis se desplaza de describir “lo que sabemos” a modelar “cómo pensamos”, el problema curricular no es tanto el de escoger qué temas cubrir sino el de identificar el tipo general de preguntas que sería significativo que los estudiantes aprendieran a responder (AAAS, 1993; Wiggins & McTighe, 2005). Una vez que se identifican las preguntas, entonces podemos comenzar la tarea de seleccionar las herramientas intelectuales y experimentales necesarias para ayudar a los estudiantes a desarrollar la manera de pensar que nos interesa. Por ejemplo, si aprender a dar respuesta a la pregunta ¿cómo determinamos la estructura molecular de una sustancia? se considera importante, entonces deberemos discutir tanto las técnicas experimentales que nos permiten explorar la estructura, como las teorías y modelos que nos guían en la generación e interpretación de los resultados. Es importante recordar que preguntar requiere por parte de quien lo hace la acción de movilizar conocimientos y habilidades, lo cual nos permite reconocer la profundidad del saber. El filósofo de las ciencias Gaston Bachelard lo dijo así (1979, p.16): Y dígase lo que se quiera, en la vida científica los problemas no se plantean por sí mismos. Es precisamente este sentido del problema el que indica el verdadero espíritu científico. Para un espíritu científico todo conocimiento es una respuesta a una pregunta. Si no hubo pregunta, no puede haber conocimiento científico. Nada es espontáneo. Nada está dado. Todo se construye.
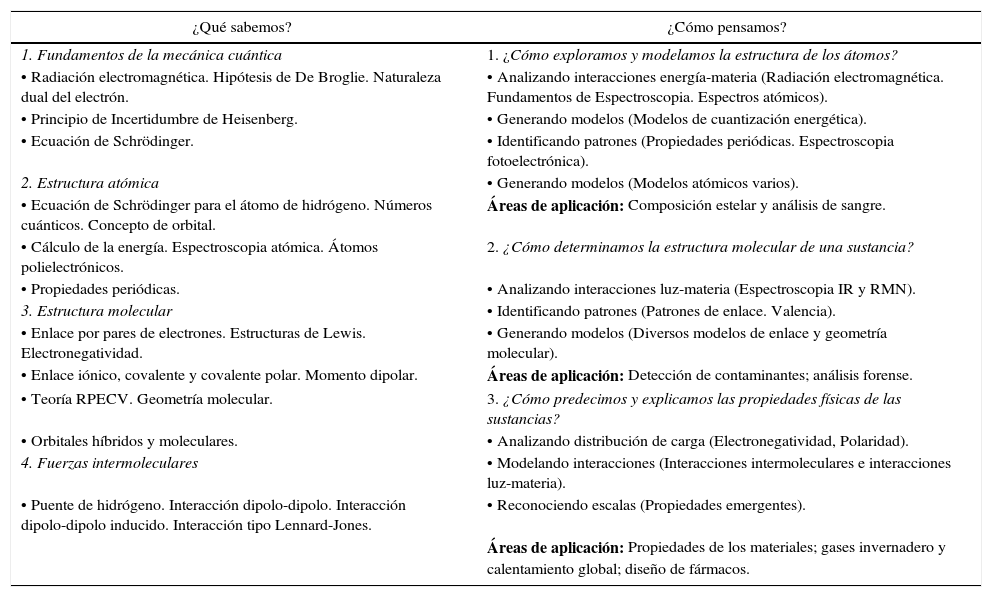
Para ilustrar de manera más concreta la diferencia entre un abordaje curricular centrado en “lo que sabemos” versus uno centrado en “cómo pensamos”, en la tabla 1 presentamos la secuencia curricular de un curso de Estructura de la Materia de los que suelen impartirse en las escuelas y facultades de química, junto con una propuesta alternativa organizada alrededor de preguntas.
Propuestas curriculares alternativas para el curso de Estructura de la Materia.
| ¿Qué sabemos? | ¿Cómo pensamos? |
|---|---|
| 1. Fundamentos de la mecánica cuántica | 1. ¿Cómo exploramos y modelamos la estructura de los átomos? |
| • Radiación electromagnética. Hipótesis de De Broglie. Naturaleza dual del electrón. | • Analizando interacciones energía-materia (Radiación electromagnética. Fundamentos de Espectroscopia. Espectros atómicos). |
| • Principio de Incertidumbre de Heisenberg. | • Generando modelos (Modelos de cuantización energética). |
| • Ecuación de Schrödinger. | • Identificando patrones (Propiedades periódicas. Espectroscopia fotoelectrónica). |
| 2. Estructura atómica | • Generando modelos (Modelos atómicos varios). |
| • Ecuación de Schrödinger para el átomo de hidrógeno. Números cuánticos. Concepto de orbital. | Áreas de aplicación: Composición estelar y análisis de sangre. |
| • Cálculo de la energía. Espectroscopia atómica. Átomos polielectrónicos. | 2. ¿Cómo determinamos la estructura molecular de una sustancia? |
| • Propiedades periódicas. | • Analizando interacciones luz-materia (Espectroscopia IR y RMN). |
| 3. Estructura molecular | • Identificando patrones (Patrones de enlace. Valencia). |
| • Enlace por pares de electrones. Estructuras de Lewis. Electronegatividad. | • Generando modelos (Diversos modelos de enlace y geometría molecular). |
| • Enlace iónico, covalente y covalente polar. Momento dipolar. | Áreas de aplicación: Detección de contaminantes; análisis forense. |
| • Teoría RPECV. Geometría molecular. | 3. ¿Cómo predecimos y explicamos las propiedades físicas de las sustancias? |
| • Orbitales híbridos y moleculares. | • Analizando distribución de carga (Electronegatividad, Polaridad). |
| 4. Fuerzas intermoleculares | • Modelando interacciones (Interacciones intermoleculares e interacciones luz-materia). |
| • Puente de hidrógeno. Interacción dipolo-dipolo. Interacción dipolo-dipolo inducido. Interacción tipo Lennard-Jones. | • Reconociendo escalas (Propiedades emergentes). |
| Áreas de aplicación: Propiedades de los materiales; gases invernadero y calentamiento global; diseño de fármacos. |
En esta secuencia alternativa, las teorías y modelos fundamentales sobre estructura atómica y molecular se presentan o construyen con base en la necesidad de dar respuesta a la pregunta guía, así como en la evidencia experimental que motivó su desarrollo. Adicionalmente, su utilidad se demuestra a través de la aplicación en la comprensión o resolución de problemas en áreas de interés común, como vida y salud, nuevos materiales, medio ambiente y recursos energéticos (Áreas de aplicación en la tabla 1). Antes de discutir con más detalle cómo implementar esta propuesta en el salón de clases, es conveniente reflexionar sobre la importancia de los modelos y el modelaje en el pensamiento científico.
Los modelosLa palabra modelo es polisémica; se ha empleado y se emplea aun con sentidos diversos. Por un lado es ejemplar, es decir indica aquellas cosas, actitudes o personas que se propone imitar. La valentía de un guerrero, la inteligencia de un sabio, la solidaridad de un médico, la velocidad de un corredor o la belleza de una persona son ejemplos de modelos en este sentido. En el presente texto se emplea la palabra modelo en su otro y también generalizado sentido. Así, continuando con lo establecido en un trabajo anterior (Chamizo, 2010): Los modelos (m) son representaciones, basadas generalmente en analogías, que se construyen contextualizando cierta porción del mundo (M), con un objetivo específico (op. cit. p. 27).
En esta definición todas las palabras son importantes: las representaciones son fundamentalmente ideas, aunque no necesariamente ya que también pueden ser objetos materiales. Las representaciones no son por sí mismas, y valga la redundancia, auto-identificantes. Las representaciones lo son de alguien (ya sea una persona, o un grupo, generalmente este último) que las identifica como tales. Una analogía está constituida por aquellos rasgos o propiedades que sabemos similares en m y M, que se construyen contextualizando (Chamizo e Izquierdo, 2005). Los modelos remiten a un tiempo y lugar históricamente definido, lo que además enmarca la representación; cierta porción del mundo indica su carácter limitado; por lo tanto, los modelos son respecto al mundo (M) parciales. Un objetivo específico establece su finalidad, general pero no necesariamente, el explicar, y sobretodo predecir. Hay que recordar que la explicación es una de las más significativas características de las ciencias (Bailar-Jones, 2002), pero que en determinados casos aun sin poder del todo explicar una buena parte de su prestigio radica en predecir.
Los modelos (m) son representaciones, basadas generalmente en analogías (Achinstein, 1987; Clement, 2008). Así pueden ser semejantes a esa porción del mundo que representan, generalmente más sencillos, pero no enteramente, de manera que se pueden derivar hipótesis (y/o predicciones) del mismo y someterlas a prueba. Los resultados de esta prueba dan nueva información sobre el modelo. Los modelos pueden ser: mentales y materiales.
Los modelos mentales (Greca y Moreira, 1998; Clement y Rea-Ramirez, 2008) son representaciones plasmadas en la memoria episódica (aquella de largo plazo, explícita y declarativa) construidos por nosotros para dar cuenta de (dilucidar, explicar, predecir) una situación. Son los precursores de las conocidas “ideas previas” (Kind, 2004) o concepciones alternativas y en ocasiones pueden ser equivalentes.
Los modelos materiales (que también pueden ser identificados como prototipos) son a los que tenemos acceso empírico y han sido construidos para comunicarse con otros individuos. Los modelos materiales pueden ser a su vez:
- •
Simbólicos.
- •
Experimentales.
- •
Icónicos.
Los modelos materiales son los modelos mentales expresados (Gilbert, Boulter y Elmer, 2000) a través de un lenguaje específico, como el de las matemáticas o la química. Hablamos entonces de modelos materiales simbólicos y que son, cuando los símbolos corresponden a las matemáticas, aquellas ecuaciones construidas para describir precisamente la porción del mundo que se está modelando. Los modelos materiales simbólicos (matemáticos) representan las regularidades que las comunidades científicas en diversos momentos de su historia identifican en cierta porción del mundo (M) y que conocidas como leyes son la manera más común, que no la única, de explicar en la tradición científica (Suppe, 1989). Otro ejemplo de modelo material simbólico es con el que los químicos representamos elementos, compuestos y reacciones (Hoffmann y Lazlo, 1991).
Los modelos materiales también pueden ser experimentales (Pérez Tamayo, 2005) como las ratas macho Sprague-Dawley que se utilizan de manera estandarizada en las investigaciones biomédicas para modelar enfermedades o la acción de posibles remedios para las mismas (piénsese en ellas como una especie de maqueta robot no construida por nosotros). Modelos materiales experimentales también lo son los aparatos, como el famoso de Urey-Miller (sobre las condiciones originales de la atmósfera terrestre que permitieron la generación de aminoácidos) o el tokomac (en los que se estudian las reacciones de fusión que se producen en las estrellas) con los que se realizan experimentos que simulan un determinado aspecto del mundo (M). Algunos de los modelos materiales experimentales, en particular aquellos derivados del experimento químico pueden modificar el mundo real (Chamizo, 2010).
La construcción de un modelo, el modelaje, es un compromiso entre las analogías y las diferencias que tienen con la porción del mundo que se está modelando. Así, cuando el modelo no encaja con los datos empíricos obtenidos puede ser ampliado y corregido (figura 1). Los modelos se desarrollan a través de un proceso iterativo en el cual la evidencia empírica permite revisar y modificar los presupuestos básicos de los mismos. Un modelo es generalmente uno, en una secuencia histórica en un área particular del saber (por ejemplo sobre los modelos materiales de los gases ver Atkins, 1982, p. 47) y ésta generalmente se reconoce a lo largo del tiempo. La historia de la ciencia es rica en ejemplos de cómo las comunidades científicas han desarrollado modelos para explicar el mundo real y cómo éstos han ido evolucionando para ir acomodando la evidencia empírica acerca de los hechos observados. El modelo atómico de Dalton es más sencillo que el modelo atómico de Thomson (una vez que éste considera la existencia de los electrones) o que el de van't Hoff (ya que considera al átomo de carbono tetraédrico), y éstos a su vez que los de Rutherford o de Bohr (ya que ambos consideran, además de la existencia de los electrones, la del núcleo). Hay que hacer notar que los modelos son útiles para alguien en particular (generalmente una comunidad, ya sea ésta científica o escolar) y se desarrollan en un contexto específico. Así, un modelo sencillo como el modelo atómico de Lewis (que considera la existencia del núcleo y de los electrones pero asume que estos últimos están fijos en los vértices de un cubo) es muy conveniente para discutir mucha de la química de los compuestos orgánicos, en lugar del mucho más complejo modelo cuántico atómico (Chamizo, 2010).
Aprender a utilizar los conceptos, las ideas y los modelos de la química para responder preguntas de interés requiere tener una idea clara de cómo se generan las ideas y los modelos, lo que nos lleva a discutir el rol que el modelaje debe jugar en nuestros cursos de estructura de la materia.
Un enfoque centrado en los modelosHace 15 años, Gillespie y sus colaboradores publicaron cuatro artículos en los que mostraron una nueva forma de enseñar estructura atómica a partir de la información experimental disponible y con los modelos más simples que son capaces de explicarla (Gillespie et al.,1996). Desde entonces ellos ya pensaban que con la discusión descontextualizada de temas como la ecuación de Schrödinger o los orbitales atómicos, lo que hacíamos era tornar a la química más misteriosa, abstracta y esotérica de lo necesario. Por ejemplo, en la Facultad de Química de la unam, la ecuación de Schrödinger es parte del curso de Estructura de la Materia descrito en la tabla 1, una asignatura del tronco común que se les presenta a todos los estudiantes durante el segundo semestre de la carrera. Por lo general, muchos de los jóvenes que toman este curso no manejan con soltura la idea de una función matemática y su representación. Así, cuando les decimos que tenemos “una función de onda” muchos de ellos no entienden a qué nos referimos (Taber, 2002a, 2002b, 2005; Tsaparlis, 1997). Cuando les afirmamos que los químicos a la “función de onda” le llamamos “orbital”, creemos que les queda todo clarísimo pero desconocemos qué se imaginan. El resultado es que muchas veces los obligamos a memorizar conceptos e ideas que no entienden, sin jamás demostrarles cuál es su utilidad y sin discutir la evidencia experimental en la que se sustentan. Esta situación no es única y particular de nuestros alumnos como quedó manifiesto hace pocos años cuando fue reportado en la portada de Nature, una de las revistas de ciencias más importantes del mundo, que se habían observado los orbitales (Zuo et al., 1999). Las objeciones no tardaron en llegar dado que desde la perspectiva de la mecánica cuántica los orbitales no tienen realidad física y los autores de dicho artículo estaban confundiendo la densidad electrónica con un modelo material: el modelo del orbital (Scerri, 2000, 2001). De manera más general se puede decir que muchos de los conceptos utilizados frecuentemente en la enseñanza de la estructura atómica no existen de manera tangible. Mas allá de su evidente uso generalizado no hay tal cosa como orbitales híbridos ni orbitales moleculares ni orbitales s o p. Lo que hay son modelos simbólicos construidos por físicos o químicos en un determinado momento histórico, por medio de la aplicación de restricciones computacionales a la ecuación de Schröedinger para explicar determinado fenómeno del que sí hay evidencia experimental.
Desde nuestra perspectiva, esta manera de enseñar química debe modificarse para que los estudiantes comprendan los fundamentos y el poder de la forma de pensar de los que nos dedicamos a la química. Los cursos de química deben, por ejemplo, ayudar a los estudiantes a entender que todo modelo se desarrolla con el fin de dar sentido a los resultados de uno o más experimentos. Mostrar un modelo salido de la nada no sólo promueve una visión incorrecta del trabajo científico sino que demanda un nivel de abstracción innecesario. Nadie se sienta a construir un modelo sin datos experimentales que requieran ser explicados o fenómenos que se deseen predecir. Si esto es así, enseñémoslo así. El desarrollo de conceptos e ideas en el salón de clases haciendo uso de la información experimental disponible nos permitirá eliminar la presentación de conceptos misteriosos que confunden a los estudiantes. Así podremos ilustrar cómo se construyen los modelos en las ciencias. Para ejemplificarlo, consideremos con más detalle las ideas de Gillespie (1999) y sus colaboradores, así como las ideas de Spencer, Bodner y Rickard (2000) sobre cómo abordar el tema de la estructura atómica, pero con una modificación importante. En lugar de describir el conocimiento que uno obtiene al usar la información experimental y los modelos, trataremos de explicar cómo usar la información experimental con los estudiantes para que ellos construyan los modelos. Para eso, el enfoque basado en preguntas es de gran utilidad. Consideremos, por ejemplo, cómo podríamos trabajar con los estudiantes para dar respuesta a la pregunta ¿Cómo exploramos y modelamos la estructura de los átomos?
Información sobre la interacción energía-materiaEn la propuesta educativa de Gillespie la discusión sobre estructura atómica siempre comienza con el análisis de la información experimental que el modelo que se tenga sobre los átomos debe ayudarnos a entender (Gillespie et al., 1996). Por ejemplo, los experimentos de Rutherford sugieren la existencia de un núcleo masivo con carga eléctrica positiva. El descubrimiento de los rayos catódicos en 1897 sugirió la existencia de partículas subatómicas con carga eléctrica negativa. La atracción entre cargas positivas y negativas en un átomo nos permite comprender por qué es necesario suministrar energía para ionizarlo, mientras que el análisis de este costo energético (energía de ionización, EI) para diferentes átomos puede darnos información sobre la estructura interna de estos sistemas. Toda esta información se obtuvo a través de experimentos que contemplan la interacción energía-materia. En este artículo vamos a centrarnos en el experimento de la energía de ionización. El análisis de esta información experimental será utilizada por los estudiantes en el salón de clases para construir un modelo material del átomo que permita explicarla (modelo de capas).
El trabajo puede iniciarse proporcionando información a los estudiantes sobre los radios atómicos y la EI de varios átomos como función del número atómico. Estos datos pueden presentarse en forma tabular, solicitando a los estudiantes que los grafiquen, o directamente en forma gráfica (figura 2). El trabajo de los estudiantes debe enfocarse en generar un modelo material icónico de estructura atómica que permita darle sentido a estos resultados experimentales. En este proceso se espera que los estudiantes reconozcan las variaciones periódicas en las propiedades analizadas y que discutan cómo los cambios en radio atómico y EI pueden estar relacionados. Con base en lo aprendido en cursos pasados, los estudiantes deben poder establecer que la fuerza de interacción entre dos cargas depende del tamaño de la carga y de la distancia que las separa. A mayor distancia, menor interacción; a mayor tamaño de las cargas, mayor interacción. En este proceso, es importante que reconozcan que mayor energía de ionización significa que la interacción entre el núcleo positivo y el electrón que ha de ionizarse es mayor.
Identificando patronesEl análisis de la información condensada en la figura 2 revela que el valor de EI aumenta al pasar del átomo d e hidrógeno al de helio, pero después al pasar al litio vuelve a disminuir. Se encuentran valores máximos en el He, el Ne, el Ar, etcétera, y valores mínimos en la familia del litio. ¿Cómo lo explicamos?
Generando modelosLos alumnos pueden sugerir, por ejemplo, que los electrones en el átomo de helio están más fuertemente atraídos por el núcleo de helio dado el incremento en la carga nuclear. Si esto es así, ¿cómo explicamos la disminución en EI al pasar al átomo de litio, cuando sabemos que la carga nuclear del litio es mayor que la del helio? El modelo debe modificarse para considerar la posibilidad de que no todos los electrones se encuentran a la misma distancia del núcleo. Este modelo se refuerza con información experimental sobre los radios atómicos (figura 2). El trabajo de análisis y discusión en clase lleva a los estudiantes a reconocer que la información experimental disponible es consistente con un modelo de capas. Por ejemplo, uno de los estudiantes con los que se ha trabajado este material escribió: “La energía de ionización es mayor si los electrones están más cerca del núcleo, en las capas más cercanas, y es menor cuando se encuentran en las capas más lejanas. Mientras que en los átomos de H y He tenemos una capa donde se localizan los electrones, en el átomo Li tenemos dos capas. El electrón en el proceso de ionización de este átomo debe salir de la segunda capa que está más lejos del núcleo que la primera (la distancia entre las cargas disminuye)”. Siguiendo con este tipo de comparaciones vemos que la energía de ionización tiende a incrementarse al aumentar el número atómico, lo que se puede explicar con base en el incremento de la carga nuclear y la correspondiente fuerza de atracción sobre los electrones en la segunda capa. Cambios drásticos en la evolución de los valores experimentales de EI sugieren cambios en la estructura electrónica que pueden modelarse como cambios en la ocupación de las distintas capas, y también proporcionan información sobre el máximo nivel de ocupación de cada capa (tabla 2).
Para cada átomo se indican las capas existentes en el modelo y el número de electrones que tiene cada capa. Los cambios bruscos en la Energía de Ionización de la figura 2 se explican con un cambio de capa.
| Átomo | H | He | Li | Be | B | C | N | O | F | Ne | Na |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Número de capas | 1 | 1 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 3 |
| Número de electrones en cada capa | 1 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 8 | |||
| 1 |
Una vez que se construye el modelo de capas, puede utilizarse para derivar más información sobre las propiedades de los átomos.
Utilizando el modeloLos estudiantes pueden usar su modelo material icónico para hacer predicciones tentativas sobre cambios en la afinidad electrónica de los átomos como función del número atómico. También pueden generar predicciones cualitativas sobre la evolución de la energía potencial de los electrones como función de la capa en la que se localizan. En este punto es necesario tener más información experimental. Se pueden utilizar espectros de emisión cuya estructura puede explicarse con el modelo propuesto. La exploración y el análisis de esta información experimental justifican la introducción de un modelo de cuantización de la energía por capas. De hecho, la información experimental sobre la longitud de onda de las líneas de emisión del átomo de hidrógeno puede utilizarse para generar un modelo más cuantitativo sobre la distribución energética de las capas electrónicas en este sistema.
Más información sobre la interacción energía-materiaLos resultados de algunos experimentos de espectroscopia fotoelectrónica proporcionan información detallada sobre la energía de ionización y la ocupación de los electrones en cada capa. En este tipo de experimentos lo que se hace es aplicarles más energía a los átomos de tal forma que podamos desprender no solamente un electrón, sino que podamos expulsar a cualquier electrón de cualquier capa. La energía que le demos al sistema se traducirá en dos partes: en aquella necesaria para arrancar al electrón y la que sobra se convertirá en energía cinética del electrón que puede medirse experimentalmente. Matemáticamente:
La energía de arranque de los electrones en una cierta capa está entonces dada por la diferencia:
En la figura 3 se presentan representaciones esquemáticas de los espectros fotoelectrónicos para los átomos de H, He, Li, Ne y Na. En el eje de las x de estos espectros se indica el valor de la energía de arranque de los electrones en diferentes capas, mientras que en el eje de las y se representa el número de electrones arrancados de cada capa. La energía de arranque también se conoce como energía de ionización.
Identificando patronesEl análisis de la información condensada en la figura 3 muestra que el H presenta un pico que es la mitad de alto que el del He. Al pasar al Li observamos dos picos, uno mayor y otro menor, ambos separados por una cantidad de energía considerable. El primer pico tiene una altura parecida a la del He. El segundo pico tiene una altura parecida a la del H. En el Ne se observan tres picos, dos de la misma altura y otro tres veces más alto. El primer está situado en un valor de energía mucho mayor que el segundo y que el tercero. Para el Na se presentan cuatro picos, dos de la misma altura y parecidos al del He, uno seis veces más alto parecido a uno del Ne, y uno cuya altura es similar a la del H. ¿Cómo explicamos estas tendencias?
Generando modelos, es decir, modelarLo primero que tiene que hacer el estudiante es relacionar la altura del pico con el número de electrones de cada átomo, y llegar a la conclusión de que el modelo debe contemplar la idea de que la altura del pico indica el número de electrones. El pico del He es el doble de alto que el del H porque el He tiene dos electrones y el H solamente uno. El primer pico del Li tiene una altura parecida a la del He porque corresponde a dos electrones. El segundo pico tiene una altura parecida a la del H y corresponde a un electrón. Los dos picos están separados por una cantidad de energía considerable, porque están en distinta capa. En el Li, los dos primeros electrones están en una primera capa y el tercero en una segunda capa. Para remover los electrones que están situados en la primera capa se necesita más energía porque están más cerca del núcleo que los que están en la segunda capa. Hasta aquí aparece una sola señal para cada capa. Pasemos al Ne. Los dos picos de la misma altura se parecen al del He, por lo que se puede decir que cada uno corresponde a dos electrones. El otro que es tres veces más alto corresponde a tres veces más electrones, es decir, seis. El primer pico está situado en un valor de energía mucho mayor que el segundo y el tercero. Podemos decir que corresponde a la primera capa. Los siguientes corresponden a la segunda capa. Lo que no se puede entender con este modelo es que aparezcan dos picos para la segunda capa. Esto significa que los electrones en esa segunda capa tienen dos valores de energía distintos. Los estudiantes tendrán que incluirle al modelo algo más para poder explicar esta información.
Para poder explicar esto el modelo tiene que incluir a las subcapas. En la segunda capa, hay dos electrones en una subcapa (por eso este primer pico tiene la misma altura que el pico del He) y seis (lo que explica que este pico sea tres veces más alto) en la otra. Cada subcapa tiene un valor de energía distinto, y la diferencia de energía entre cada capa es mucho mayor que la diferencia de energía entre cada subcapa.
Igual que le pusimos nombre a las capas (n) podemos bautizar a las subcapas. Así, a la primera subcapa la llamaremos “s” y a la segunda “p”. En la subcapa “s” caben solamente dos electrones. En la subcapa “p” caben como máximo seis porque recordemos que al pasar al siguiente átomo en la tabla periódica nos cambiamos de capa.
Una vez que se introduce la idea de subcapa en el modelo se tiene que usar para todos los átomos, aunque aparentemente no sea necesario como es el caso del H, el He y el Li. El electrón del H está en la capa 1, en la subcapa “s”. Para escribirlo decimos 1s1. En el He están en la misma capa y subcapa pero como son dos escribimos 1s2. El Li tiene tres electrones, dos en la primera capa y otro en la segunda. Así decimos 1s22 s1. Así lo hacemos con todos y llegamos a que la configuración electrónica a partir del espectro fotoelectrónico que podemos obtener para el Ne es 1s22s22p6.
Utilizando el modeloLos estudiantes pueden usar su modelo material icónico de capas y subcapas para explicar las propiedades periódicas experimentales, y algunas de las reacciones que se pueden dar entre los elementos. El modelo también puede aplicarse para comprender cómo se utiliza la espectroscopia atómica en el análisis de la composición de sistemas tan diversos como estrellas y nuestra propia sangre. Adicionalmente, el mismo enfoque podría utilizarse para analizar la estructura electrónica de sistemas moleculares. Considérense, como ejemplo, las representaciones esquemáticas de los espectros fotoelectrónicos de las moléculas diatómicas de hidrógeno (H2) y litio (Li2) que se muestran en la figura 4. Aquí, la única capa de la molécula de hidrógeno, que ahora representaría una capa “molecular”, tiene dos electrones (uno de cada átomo de H), mientras que la molécula de litio tiene una primera capa con cuatro electrones y una segunda con dos electrones (seis electrones en total en esta molécula). Si se desea, la discusión podría extenderse al análisis de cómo construir configuraciones electrónicas de diversas moléculas e introducir la idea de orbitales moleculares.
Entre las ventajas más notables de este enfoque para enseñar conceptos e ideas centrales sobre estructura de la materia es que el alumno puede reconocer las maneras de pensar que nos llevan a generar modelos a partir de resultados experimentales. Adicionalmente, los estudiantes tienen la oportunidad de analizar cómo los modelos generados nos permiten resolver problemas relevantes para la ciencia, la tecnología, y las sociedades modernas.
Algunas conclusionesLas ideas presentadas en las secciones anteriores ilustran cómo podemos involucrar a los estudiantes en el análisis de información experimental para construir modelos materiales icónicos sobre estructura atómica y molecular en el salón de clases. Una vez elaborados, estos modelos pueden ser utilizados para explicar diversas propiedades de la materia y para resolver preguntas de interés en sistemas relevantes. En este proceso es posible que los modelos desarrollados resulten insuficientes para explicar algunos resultados, lo que puede servir de base para reiniciar la discusión sobre cómo modificar los modelos para darle sentido a las nuevas observaciones, (como se muestra en la figura 1). Siguiendo esta estrategia en el salón de clase, los modelos y teorías científicas se presentan como conocimiento dinámico en constante re-elaboración y no como ideas estáticas generadas por mentes privilegiadas.
La estrategia educativa propuesta tiene varias ventajas sobre formas más tradicionales de enseñar estructura de la materia. Por un lado, los estudiantes tienen la oportunidad de construir su propio conocimiento con base en el análisis y la discusión de resultados experimentales y la generación de modelos tentativos para explicarlos. En este proceso, los modelos juegan el papel de herramientas intelectuales útiles para resolver problemas y hacer predicciones. Adicionalmente, los estudiantes se involucran en formas de argumentación científica más auténticas, lo que no sólo los ayuda a desarrollar habilidades del pensamiento sino también a adquirir una visión más realista sobre la naturaleza de la ciencia (AAAS, 1993; Lederman, 2007).
Cuando nuestros esfuerzos educativos se centran en enseñar “lo que sabemos” sobre estructura atómica y molecular, en lugar de en ayudar a los estudiantes a “utilizar pensamiento químico” para explicar, predecir, o controlar las propiedades de la materia, los conceptos e ideas que presentamos normalmente aparecen divorciados de su utilidad práctica. Así, los estudiantes aprenden a construir configuraciones electrónicas sin entender muy bien qué significan o para qué sirven. O son capaces de memorizar la ecuación de Schrödinger, y quizá hasta puedan aplicarla de manera algorítmica para resolver problemas, pero no tienen una idea clara de las implicaciones físicas de este modelo matemático. En este proceso, el conocimiento químico queda reducido a un montón de fórmulas y algoritmos para memorizar, en lugar de ser concebido como una herramienta poderosa para analizar fenómenos tan importantes como el calentamiento global o la contaminación atmosférica en nuestro planeta.
Debe ser claro que la propuesta educativa que hemos descrito no tiene como objetivo reducir la demanda intelectual de los cursos de estructura de la materia. Al contrario, nuestra propuesta implica involucrar a los estudiantes en actividades con alta demanda cognitiva: analizar datos, generar hipótesis, construir argumentos con base en evidencia sólida y confiable, desarrollar modelos, y hacer predicciones. No se trata, por ejemplo, de eliminar la discusión de la ecuación de Schrödinger simplemente porque es muy difícil o de presentarla de manera inapropiada. Lo que se busca es transformar la enseñanza de temas centrales en la disciplina de manera que los estudiantes comprendan de mejor manera los alcances y limitaciones de las ideas discutidas. El objetivo es que los estudiantes se apropien del conocimiento y lo apliquen de manera significativa, en lugar de tan sólo memorizarlo con el fin de pasar exámenes.