Mathematics, Physics and Computation are disciplines that require a written language appropriate for communication of knowledge. In organic chemistry such language is essential to understand and handle knowledge, mainly structure and transformations of organic compounds. In the present study, was designed and applied a reactive to four groups of students in the course of organic chemistry III in order to assess the knowledge and use of bond - line formulas of organic compounds should be taught in the initial organic chemistry courses to identify and correct any deficiencies that contribute to raising achievement in learning organic chemistry. A significant correlation was found between average of correct answers and final course grades, in particular to higher scores. These data show that in the reactive applied there were more correct answers in the number of carbons and heteroatoms that in the number of hydrogen atoms and order of the atoms.
La identidad y la comunicación son dos aspectos esenciales en los procesos de enseñanza-aprendizaje. En la sociedad, cada persona tiene uno o varios códigos de identidad, los cuales son “representaciones” del individuo, vinculados de forma biunívoca. El nombre (Registro Civil), el registro federal de contribuyentes (RFC, Trámites Fiscales), la matrícula (Universidades y Colegios), el CURP (Cédula de identidad del Gobierno), y el número de pasaporte, son ejemplos de códigos de identidad o representaciones de un individuo ante diferentes instancias, los cuales se emplean para facilitar la comunicación escrita y electrónica, al referirse a un miembro de una comunidad.
En Química Orgánica se utiliza un lenguaje escrito para identificar las moléculas llamado representaciones químicas (Mc Murry 2008; Solomons, 2002) o “fórmulas” (Solomons, 2002; Carey, 1999; Streitwieser y Heathcock, 1989), con las cuales se interpretan las estructuras moleculares en los libros, revistas tanto de educación química (García de la Mora, 2006; Haro-Castellanos, 2004; Nava Carrillo y col. 2008) como de investigación (Haro-Castellanos, 2002) y otros documentos. Esta forma de comunicación escrita es acordada y avalada por la IUPAC (International Union of Pure and Applied Chemistry).
Las representaciones moleculares de los compuestos orgánicos contemplan tres niveles básicos de la estructura molecular:
- 1.
Composición (Eliel, 1970): Se refiere a los elementos presentes en la molécula y el número de átomos de cada elemento. Se expresa por la fórmula molecular, constituida por los símbolos de los elementos presentes en el compuesto, ordenados alfabéticamente con excepción del carbono e hidrógeno que se colocan al principio (en el orden mencionado), y con un subíndice en cada símbolo que indica el número de átomos de cada elemento presentes en la molécula.
- 2.
Constitución (Solomons, 2002; Carey, 1999; Eliel, 1970): Determina el tipo y número de enlaces presentes en la molécula y se representa por las fórmulas semidesarrolladas, desarrolladas o las de enlace-línea. En los tres casos, además de la información que expresa la fórmula molecular (punto anterior), se explícita cuales átomos están unidos entre sí.
- 3.
Configuración (Eliel, 1970): Representa el arreglo en el espacio, de los átomos o grupos unidos a un átomo es-tereogénico (normalmente carbono). Para expresarse se utilizan las representaciones estereoquímicas como las de Newman, Fischer, etc.
El uso de la fórmula molecular tiene limitaciones, ya que para describir la gran mayoría de las reacciones químicas de los compuestos orgánicos se requieren expresar los tipos de enlaces y los grupos funcionales para comprender los cambios de las moléculas en las transformaciones que sufren, información que sí se describe en las fórmulas semi-desarrolladas, las desarrolladas y las representaciones de enlace-línea también llamadas de esqueleto (Mc Murry 2008; Solomons, 2002). Sin embargo, de las tres representaciones moleculares, la tendencia actual es usar las de enlace-línea debido a que proporcionan la información necesaria de las estructuras moleculares, con la menor cantidad de trazos gráficos para hacer su escritura más fácil y rápida.
Dada la importancia de las representaciones moleculares de enlace línea, en el presente trabajo se evaluó el nivel de comprensión y manejo de estas representaciones, mediante un reactivo (ver ANEXO 1) que contiene moléculas de las veinte familias que se consideran las más importantes de la Química Orgánica, aplicado a grupos de alumnos en un periodo de cuatro trimestres en los años 2009 y 2010, en la División de Ciencias Biológicas y de la Salud de la Universidad Autónoma Metropolitana, Unidad Iztapalapa (UAM-Iztapalapa). Por lo tanto, el objetivo de este estudio fue evaluar el nivel de conocimiento y el aprendizaje de las representaciones enlace-línea, correspondientes a las estructuras moleculares de los compuestos orgánicos mediante la aplicación de un cuestionario a una muestra de alumnos que ya cursaron y aprobaron un curso previo de Química Orgánica
MetodologíaEl reactivo se basa en la correlación existente en que para cada representación de enlace-línea corresponde solamente una fórmula molecular. Con esta premisa se puede conocer que el alumno comprende las representaciones moleculares enlace-línea de los compuestos orgánicos, únicamente si es capaz de escribir su correspondiente fórmula molecular.
Con base en el anterior precepto, se elaboró un reactivo para valorar la comprensión y manejo de las representaciones de enlace-línea de los compuestos orgánicos con el propósito de aplicarlo a alumnos que ya cursaron y aprobaron un curso previo de química orgánica.
1Características del reactivo (ver ANEXO 1)- 1.1
El encabezado contiene: (a) el nombre del alumno; (b) el trimestre en curso; (c) la UEA (asignatura); (d) el grupo; (e) la fecha.
- 1.2
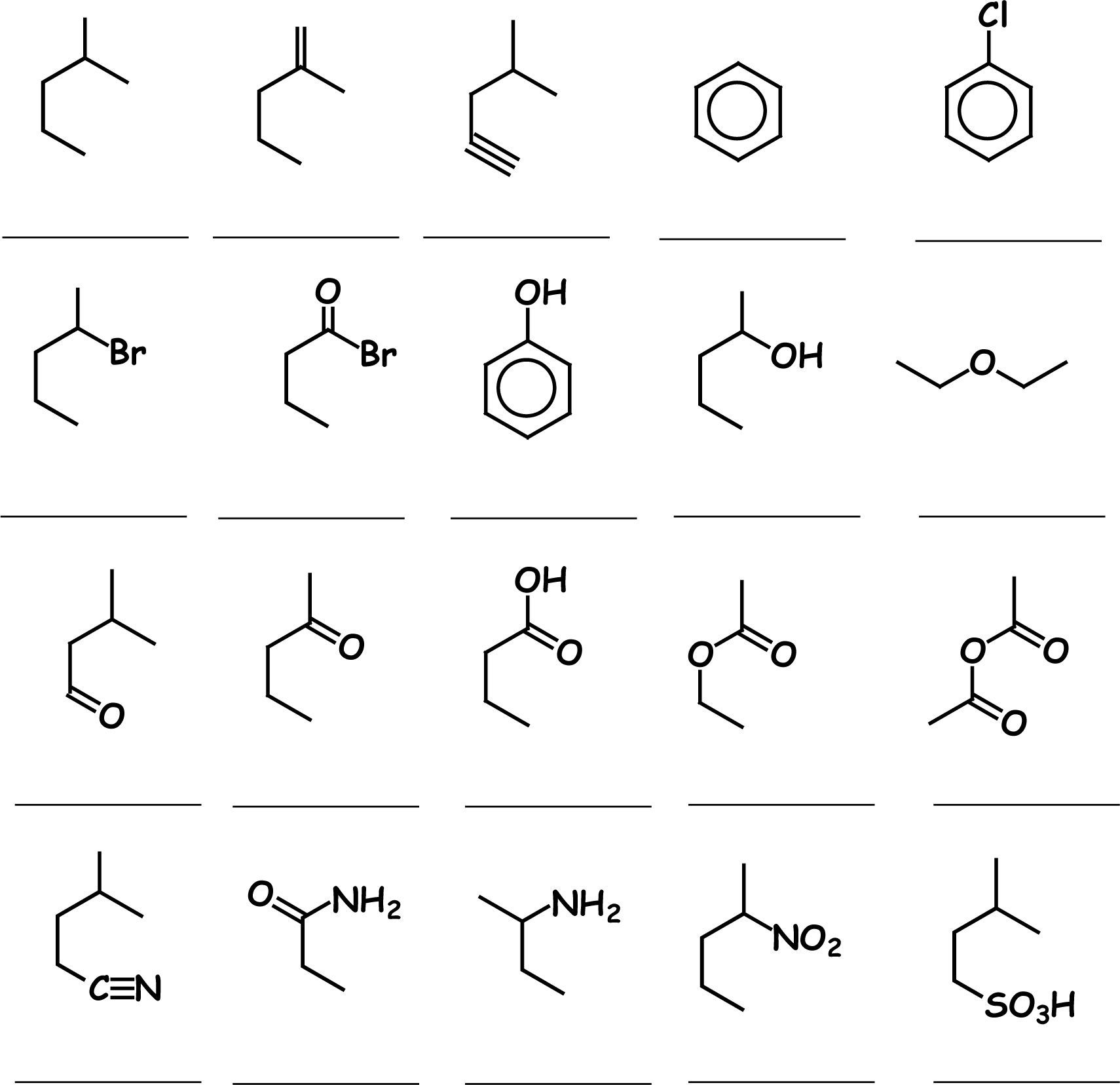
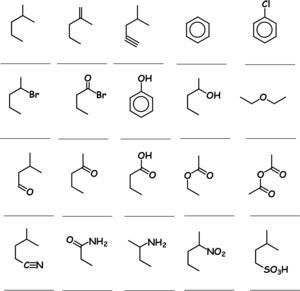
El cuerpo consiste en (a) las instrucciones para su resolución: “Debajo de cada una de las 20 representaciones moleculares enlace-línea, escribe su fórmula molecular la cual se expresa por los símbolos de los elementos presentes (en el orden: carbono, hidrógeno y el resto en orden alfabético), con un subíndice que indica el número de átomos presentes de cada elemento”; (b) las representaciones enlace-línea de las estructuras moleculares, correspondientes a ejemplos de compuestos orgánicos de las 20 familias más importantes en las ciencias biológicas y de la salud. Las familias fueron escogidas con el criterio de representatividad de los compuestos orgánicos manejados en los planes de estudio de Biología y Biotecnología, en tanto que los ejemplos fueron seleccionados de compuestos orgánicos que siendo materias primas o intermediarios sufren tipos importantes de reacciones representativas en la Química Orgánica.
- 1.3
El pie de página contiene los nombres de las 20 familias mencionadas anteriormente y colocados en orden alfabético.
- 2.1
Se explica previamente el objetivo del reactivo que se va a aplicar mostrando el formato utilizado.
- 2.2
Se les indica a los alumnos que para la resolución del reactivo solo tiene que escribir la fórmula molecular debajo de cada estructura como se indica en las instrucciones y debe resolverse en forma individual.
- 2.3
Se entrega el reactivo a los alumnos indicándoles que debe mantenerse con el anverso tapado (hacia abajo).
- 2.4
Se les indica que a la señal que dé el profesor, volteen la hoja lean las instrucciones y aclaren dudas.
- 2.5
A partir de que se tiene clara la forma de resolver el reactivo, el profesor da la segunda señal para que inicien la resolución del mismo.
- 2.6
Al término de 10 minutos (tiempo determinado previamente como suficiente) de iniciada la resolución, se da la señal para suspender el trabajo y recoger los reactivos.
- 3.1
Los factores considerados para valorar los resultados, se encuentran en la fórmula molecular y son los siguientes: (a) número de carbonos; (b) número de hidrógenos; (c) heteroátomos y número de átomos de cada uno de ellos; (d) ordenamiento de los elementos: primero carbono, en seguida hidrógeno y luego los heteroátomos (éstos últimos en orden alfabético).
- 3.2
Valoración semi-cuantitativa: para cada una de las 20 estructuras se considera acertada la respuesta si los cuatro factores (ver punto anterior) fueron correctos. Esto determina el nivel de comprensión y manejo de las representaciones poligonales:
- a)
Capacitado: Se considera que son los alumnos que tienen el conocimiento y manejo adecuado de las representaciones poligonales, por lo que no tendrán dificultad en comprender sus transformaciones químicas expresadas en las ecuaciones.
- b)
Aceptable: Son los alumnos que tienen algunas dificultades con el conocimiento y manejo de las representaciones moleculares, pero con ejercicios podrán habilitarse.
- c)
Suficiente: Son alumnos que con los resultados obtenidos en el reactivo, alcanzaron a acreditar el curso de química orgánica III con la mínima calificación.
- d)
Deficiente: Son los alumnos que tienen pocas posibilidades de habilitarse si no dedican tiempo extra a reforzar este tema y bajo asesoría adecuada.
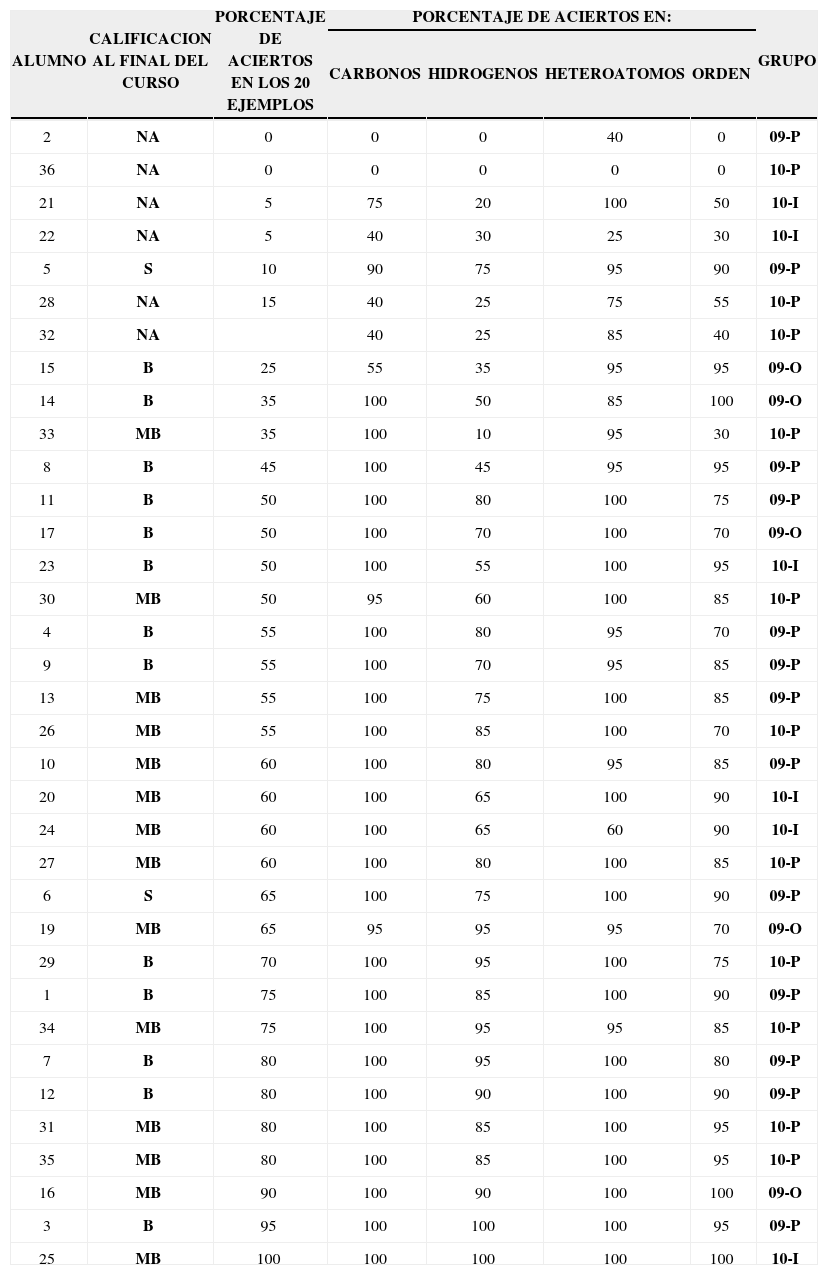
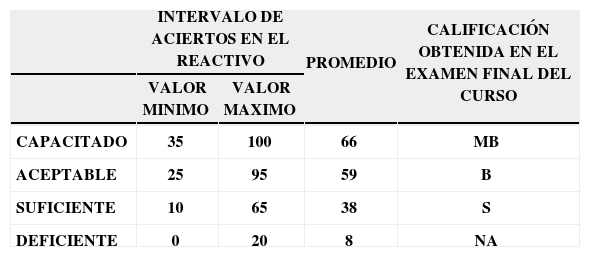
Los intervalos y promedios de cada uno de los niveles anteriormente citados, se determinan por los resultados mostrados en la tabla 1.
Tabla 1.Resultados del cuestionario para los alumnos de los grupos de Química Orgánica III.
ALUMNO CALIFICACION AL FINAL DEL CURSO PORCENTAJE DE ACIERTOS EN LOS 20 EJEMPLOS PORCENTAJE DE ACIERTOS EN: GRUPO CARBONOS HIDROGENOS HETEROATOMOS ORDEN 2 NA 0 0 0 40 0 09-P 36 NA 0 0 0 0 0 10-P 21 NA 5 75 20 100 50 10-I 22 NA 5 40 30 25 30 10-I 5 S 10 90 75 95 90 09-P 28 NA 15 40 25 75 55 10-P 32 NA 40 25 85 40 10-P 15 B 25 55 35 95 95 09-O 14 B 35 100 50 85 100 09-O 33 MB 35 100 10 95 30 10-P 8 B 45 100 45 95 95 09-P 11 B 50 100 80 100 75 09-P 17 B 50 100 70 100 70 09-O 23 B 50 100 55 100 95 10-I 30 MB 50 95 60 100 85 10-P 4 B 55 100 80 95 70 09-P 9 B 55 100 70 95 85 09-P 13 MB 55 100 75 100 85 09-P 26 MB 55 100 85 100 70 10-P 10 MB 60 100 80 95 85 09-P 20 MB 60 100 65 100 90 10-I 24 MB 60 100 65 60 90 10-I 27 MB 60 100 80 100 85 10-P 6 S 65 100 75 100 90 09-P 19 MB 65 95 95 95 70 09-O 29 B 70 100 95 100 75 10-P 1 B 75 100 85 100 90 09-P 34 MB 75 100 95 95 85 10-P 7 B 80 100 95 100 80 09-P 12 B 80 100 90 100 90 09-P 31 MB 80 100 85 100 95 10-P 35 MB 80 100 85 100 95 10-P 16 MB 90 100 90 100 100 09-O 3 B 95 100 100 100 95 09-P 25 MB 100 100 100 100 100 10-I - a)
- 3.3
Valoración cualitativa: en la fórmula molecular de cada uno de los 20 ejercicios, se marcan los cuatro tipos de errores (número de carbonos, número de hidrógenos, número de heteroátomos y ordenamiento de los elementos) usando diferentes colores. Esto permite ubicar las deficiencias de los alumnos en este tema para poder asesorarlos.
- 3.4
Tabulación de resultados: Los resultados que se obtienen al calificar los cuestionarios se tabulan conforme a la tabla 1 y se grafican de acuerdo con las figuras 1-6.
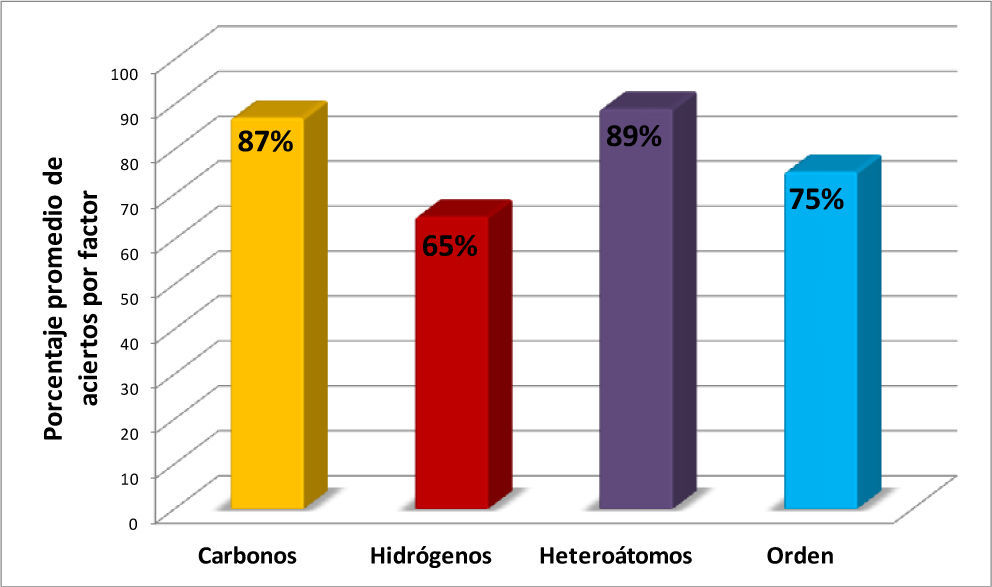
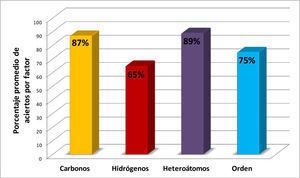
Figura 6.Promedios de los porcentajes de aciertos correspondientes a cada uno de los cuatro factores (columnas 4-7 de la tabla 1) considerados en la fórmula molecular para valorar los resultados.
(0.07MB).
De acuerdo con el punto 2 de la metodología, se aplicó el reactivo (anexo 1) a los alumnos de cuatro trimestres (once semanas de clases) de los años 2009 y 2010, en los cursos de la Química Orgánica III para las licenciaturas de Ingeniería de los Alimentos e Ingeniería Bioquímica Industrial (División de Ciencias Biológicas y de la Salud Universidad Autónoma Metropolitana, Unidad Iztapalapa). Se descartaron los resultados de los alumnos en cuatro casos: a) alumnos repetidores del curso, b) alumnos que copiaron para contestar el reactivo, c) alumnos que no escribieron su nombre y d) alumnos que no presentaron el examen final, quedando solo para fines estadísticos los alumnos que aparecen en la tabla 1. En esta tabla se colocaron los alumnos en orden de menor a mayor calificación en el porcentaje de aciertos (columna 3). En la primera columna aparece el número de lista del alumno y en la última columna, el grupo al cual estaba asignado.
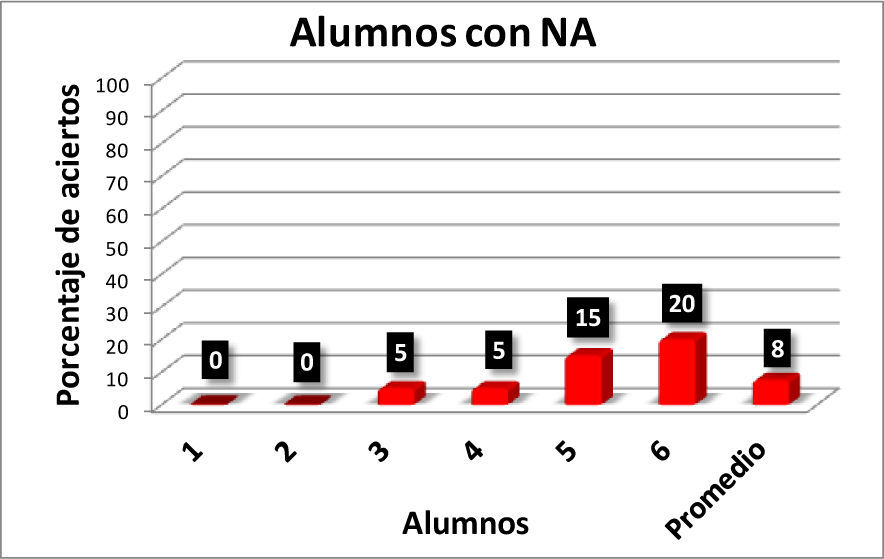
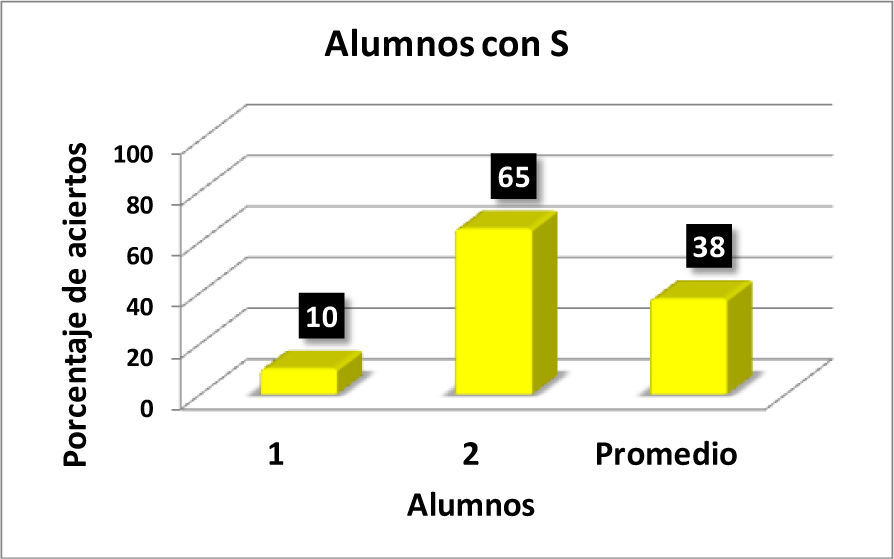
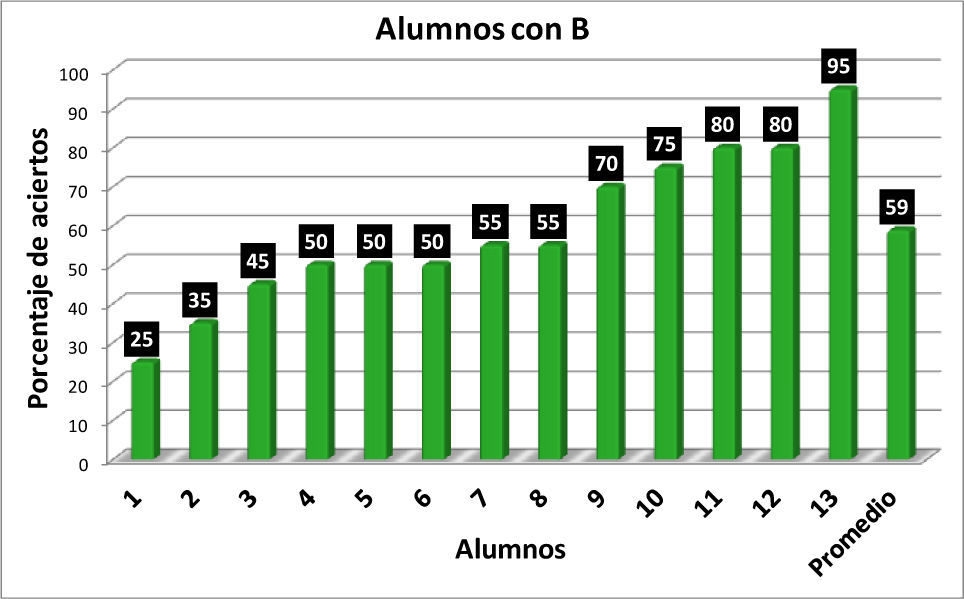
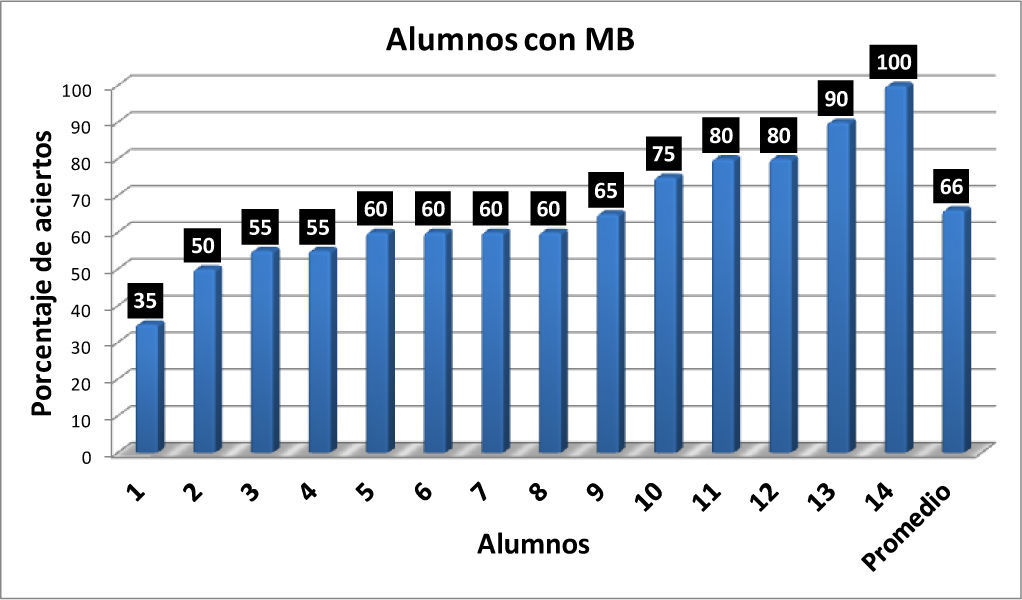
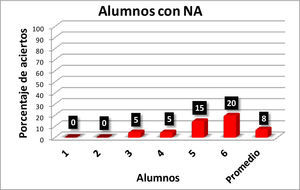
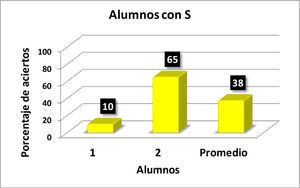
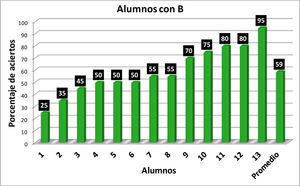
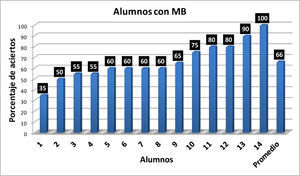
Con los resultados de la tabla 1 se elaboraron las gráficas de las figuras 1-6. Las figuras 1, 2, 3 y 4 corresponden a los alumnos que en el examen final obtuvieron respectivamente calificaciones de NA (No Acreditado), S (Suficiente), B (Bien) y MB (Muy Bien). La barra final muestra el promedio en cada caso.
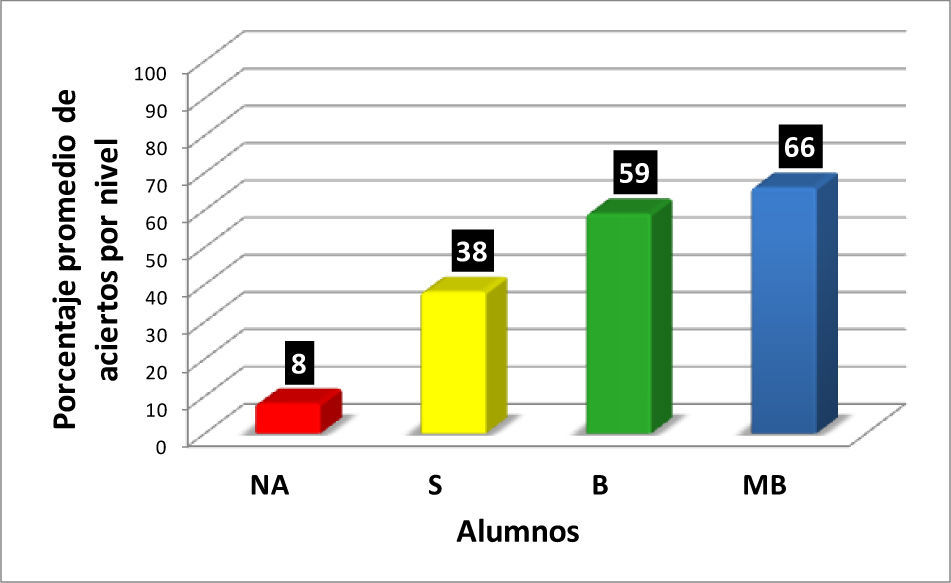
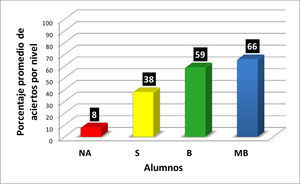
En la figura 5, se muestran los valores de los promedios de aciertos correspondientes a los 20 ejercicios del reactivo, para los alumnos de cada nivel (NA, S, B y MB) de aprovechamiento en el curso de Química Orgánica III, extraídos de las cuatro gráficas precedentes. En la figura 5 se muestra la correlación entre el nivel de aprendizaje de las representaciones enlace-línea y la eficiencia en el aprovechamiento de los conocimientos del curso de Química Orgánica III.
En la figura 6 y en la tabla 2 se muestra, mediante el promedio general de los aciertos, el nivel de conocimiento gru-pal en cada uno de los cuatro factores mencionados en el punto 3.1 de la metodología (número de átomos de carbono, de hidrógeno y heteroátomos, así como el orden de acomodo), con los cuales se califica cada uno de los 20 ejercicios del reactivo. En la figura 6, el valor más bajo de aciertos corresponde a la determinación del número de hidrógenos indicando que este es el factor clave en la baja eficiencia de los resultados, seguido por el orden de colocación de los elementos en la fórmula molecular, lo cual señala que éstos son los puntos que hay que mejorar en el aprendizaje del alumnado. Para definir el número de carbonos y de heteroátomos, la eficiencia promedio fue de 83% y 85% respectivamente.
Correlación entre los intervalos y promedios de aciertos con los resultados de aprovechamiento en el curso, para los cuatro niveles de habilitación en el reconocimiento y manejo de las representaciones enlace-línea de los compuestos orgánicos.
| INTERVALO DE ACIERTOS EN EL REACTIVO | PROMEDIO | CALIFICACIÓN OBTENIDA EN EL EXAMEN FINAL DEL CURSO | ||
|---|---|---|---|---|
| VALOR MINIMO | VALOR MAXIMO | |||
| CAPACITADO | 35 | 100 | 66 | MB |
| ACEPTABLE | 25 | 95 | 59 | B |
| SUFICIENTE | 10 | 65 | 38 | S |
| DEFICIENTE | 0 | 20 | 8 | NA |
En la figura 5 se observa que hay una correlación significativa entre las calificaciones finales de los alumnos en los cursos de Química Orgánica III y los resultados obtenidos por los alumnos en el reactivo aplicado para valorar la comprensión y manejo de las representaciones moleculares de enlace-línea de los compuestos orgánicos. Los seis alumnos que no acreditaron el curso (NA), son quienes tienen los más bajos porcentajes de aciertos (0-20%) en la resolución completa del reactivo aplicado, en comparación con los 14 alumnos que acreditaron con calificación de MB con porcentajes de 35-100 (tabla 1).
ConclusionesLa eficiencia en el aprovechamiento de los cursos de química orgánica, depende en gran parte del conocimiento y manejo de las representaciones poligonales de los compuestos orgánicos, como se demuestra por la correlación que hay entre los resultados de la aplicación del reactivo y los resultados finales del curso de Química Orgánica III (figura 5).
El nivel de dificultad (de mayor a menor) en el manejo de los factores (punto 3.1 de la metodología) de las representaciones de enlace-línea, que se manifiestan al escribir su correspondiente fórmula molecular, es mayor para el número de hidrógenos, seguido por el orden de acomodo de los símbolos de los elementos y menor para el número de átomos de carbono y de los heteroátomos presentes.
NOMBRE DEL ALUMNO:_________________________________________________________
TRIMESTRE:_________________________ UEA:________________________
GRUPO:____________________________ FECHA:_____________________________
Debajo de cada una de las 20 representaciones moleculares enlace-línea, escribe su fórmula molecular la cual se expresa por los símbolos de los elementos presentes (en el orden: carbono hidrógeno y el resto en orden alfabético), con un subíndice que indica el número de átomos presentes de cada elemento.
Ácidos carboxílicos, ácidos sulfónicos, alcanos, alcoholes, aldehidos, alquenos, alquinos, amidas, aminas, anhídridos de ácido, cetonas, ésteres, éteres, fenoles, halogenuros de acilo, halogenuros de alquilo, halogenuros de arilo, hidrocarburos aromáticos, nitrilos, nitrocompuestos.